Наличие иммунной патологии у детей. Результаты проведенного исследования.
Моллаева Н.О., Насруллаева Г.М., Гулиев Н.Д.
Азербайджанский медицинский университет, Баку
Несмотpя на успехи и достижения медицины в области лечения и пpофилактики инфекционных заболеваний, детская смертность до сих пор является наиболее уязвимым звеном практической медицины, число детей со сниженным уровнем иммунной защиты неуклонно увеличивается. Наличие иммунной патологии существенно нарушает состояние здоровья детей: снижаются адаптационные возможности организма к воздействию повреждающих факторов, увеличивается частота и длительность инфекционных заболеваний, становится сложным проведение полноценной и эффективной вакцинопрофилактики [1, 8]. Проблема иммунодефицитных состояний (ИДС) среди детей первого года жизни чрезвычайно актуальна. Необходимость решения этой проблемы определяется целым набором причин, среди которых выделяется высокий уровень летальности детей первого года жизни с иммунодефицитными состояниями, так как на фоне иммунной патологии усугубляется течение практически любого заболевания [4].
Во время беременности плод развивается практически в стерильных условиях. После рождения патогенные микроорганизмы, с которыми ребенок до сих пор не встречался, вызывают развитие соответствующей инфекционной болезни. Каждый новый контакт с патогеном приводит к расширению иммунологиче-ской памяти ребенка и формирует продолжительный иммунитет [15].
Многие инфекционно-воспалительные заболевания во время беременности имеют общие черты: обычно инфицирование плода и новорожденного может быть вызвано как острой инфекцией матери, так и активацией хронической инфекции во время беременности. Такая активация хронической инфекции возникает при любом нарушении гомеостаза в организме беременной, что часто наблюдается при анемии, ревматизме, диабете, бронхиальной астме и др. [9]. При инфекционном заболевании матери во время беременности на эмбрион и плод воздействуют возбудители и токсичные продукты, образующиеся при нарушении метаболизма у матери, бактериальные токсины при остром воспалительном процессе [3, 12].
Ведущая роль в реализации инфекционного процесса принадлежит иммунной системе новорожденного. Формирование системы иммунитета в онтогенезе определяется взаимоотношениями между матерью и плодом, а также периодом ранней адаптации ребенка к условиям внеутробной жизни.
Наличие внутриутробных инфекций (ВУИ) в антенатальном периоде сказывается на анатомическом формировании, а также на функциональной активности различных органов и систем плода [6, 14]. Иммунный статус детей в периоде новорожденности и в первые годы жизни в значительной степени связан с особенностями течения беременности у их матерей. Функциональная незрелость лейкоцитов, неполноценность клеточной кооперации в формировании иммунного ответа обуславливают высокую предрасположенность новорожденного к инфекции [7]. После рождения ребенок лишается материнских антител, которые защищали плод, ослабляя вирулентность возбудителя. В то же время собственный противовирусный иммунитет новорожденного не всегда является эффективным вследствие дефицита зрелых иммунологических механизмов противовирусной защиты.
Наименее изученными иммунологическими механизмами, обеспечивающими взаимосвязь отдельных клеточных популяций и формирование нормального иммунного ответа, являются цитокины. Это вещества, регулирующие ответную реакцию организма на инфекцию, которые участвуют в неспецифической защите организма от бактериальных и вирусных инфекций. Некоторые цитокины ухудшают течение заболевания (провоспалительные – IFN-альфа, бета, IL-1 и IL-6, TNF-альфа, хемокины – IL-8, MCP-1, RANTES и др.), тогда как другие способны уменьшить местное воспаление и обеспечить его разрешение (противовоспалительные цитокины) [5, 13].
Цитокины синтезируются в процессе реализации механизмов естественного или специфического иммунитета, проявляют свою активность при очень низких концентрациях (порядка 10–11 моль/л), служат медиаторами иммунной и воспалительной реакций, действуют как факторы роста и факторы дифференцировки клеток [2]. Их основными мишенями являются фагоцитарные клетки – макрофаги и гранулоциты. Изучение уровней цитокинов позволяет получить информацию о функциональной активности различных типов иммунокомпетентных клеток, о степени тяжести воспалительного процесса, о соотношении процессов активации Th1 и Th2 лимфоцитов, что очень важно при дифференциальной диагностике ряда инфекционных и иммунопатологических процессов [11]. Кроме того, определение уровней цитокинов используется при применении новых иммуномодулирующих препаратов на основе рекомбинантных цитокинов и их антагонистов для изучения фармакокинетики этих препаратов, а также их споcобности индуцировать синтез других цитокинов [10]. С учетом вышесказанного нами были исследованы уровни провоспалительных цитокинов IL-1бета, IL-6 и TNF-альфа в сыворотке крови больных и здоровых новорожденных, способствующие развитию иммунных нарушений у детей первого года жизни с ВУИ.
Цель исследования – оценка анамнестических и клинических данных, а также состояния цитокинового статуса у младенцев с внутриутробной инфекцией и выявление взаимосвязи ВУИ и иммунодефицитных состояний.
Материал и методы
Были обследованы 89 новорожденных и детей грудного возраста, родившихся с различными видами ВУИ. Дети обследовались на первой неделе жизни, на 30-й день, а также в возрасте 3 и 6 месяцев.
При оценке клинических данных у детей с внутриутробной инфекцией учитывались степени доношенности и зрелость новорожденного, наличие инфекционно-воспалительных изменений со стороны органов и систем. Анализ здоровья младенцев проводился по данным физического и нервнопсихического развития, по частоте и характеру сопутствующих заболеваний, наличию хронической патологии. Патология нервной системы оценивалась наличием судорожного, гипертензионногидроцефального, вегето-висцерального синдромов, синдромов двигательных нарушений.
Лабораторным подтверждением внутриутробных инфекций новорожденных послужило обнаружение специфических IgM, IgG в сыворотке крови методом иммуноферментного анализа. Кроме того нами изучались показатели клеточного иммунитета, а именно популяции лимфоцитов (CD3+, CD4+, CD8+, CD19+) и количество натуральных киллеров (CD16/56+) методом проточной цитометрии. Содержание цитокинов IL-1бета, IL-6 и TNF-альфа определяли методом иммуноферментного анализа наборами BIOSOURCE.
Результаты и обсуждение
Изучение анамнестических данных позволило установить, что у основной части матерей больных детей имел место отягощенный акушерскогинекологический анамнез. По поводу бесплодия свыше двух лет лечилось 10% матерей, терапия внутриутробных инфекций во время беременности проводилась 44% матерей, но зачастую повторного обследования они не проходили и к моменту родов титр специфических антител у них был все еще высоким. Мертворождаемость и выкидыши имели место у 26,2% матерей больных, два ребенка (4%,) родились при наличии Rhконфликта между матерью и плодом, от близкородственного брака родителей родились 8% новорожденных.
Наибольшее число больных детей родились от матерей с сочетанной инфекцией: герпес + цитомегаловирус (ЦМВ) выявлялись в 11,6% случаев, токсоплазмоз + ЦМВ – в 38,3% Отдельные инфекции у матери встречались реже: ЦМВ – 16,6%, токсоплазмоз – 20,3%, герпес – 6,6%, краснуха – 3,3%, хламидийная инфекция – 3,3%. Дети родились в тяжелом состоянии, ухудшение состояния часто наступало с первых суток жизни. Тяжесть определялась выраженным токсикозом, появлением симптомов угнетения ЦНС и дыхательных расстройств.
Как известно, уровни провоспалительных цитокинов IL-1бета, IL-6 и TNF-альфа ?напрямую связаны с количеством и активностью Th1 и Th2 лимфоцитов. Нами установлено, что независимо от типа инфекции у всех детей с ВУИ отмечалось достоверное повышение TNF-альфа и IL-6 и менее выраженное повышение IL-1бета. Следует отметить, что усиление синтеза провоспалительных цитокинов у обследованных детей происходило с различной интенсивностью. Так, у младенцев с ЦМВ уровень TNF-альфа ?возрастал в среднем до 29,3 пг/мл, а IL-6 – до 19,17 ± 2,8 пг/мл при нормальных показателях в контрольной группе детей от 0 до 5 пг/мл (см. таблицу). Наименее выраженное повышение отмечалось в содержании провоспалительного цитокина IL-1бета, уровен которого обычно не превышал нормальных показателей. Из 89 обследуемых только у 15 больных мы выявили рост IL-1бета в 3 и более раз по сравнению с контрольным уровнем (см. таблицу).
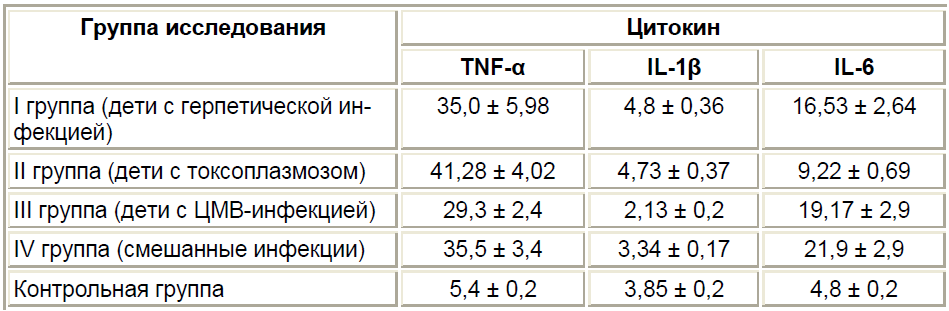
Именно уровень TNF-альфа явился наиболее чувствительным индексом воспалительной реакции, так как синтез его увеличивался как при герпетической инфекции (35,0 ± 5,98 пг/мл), так и при ЦМВ (29,3 ± 2,4 пг/мл), и при токсоплазменной инфекции (41,28 ± 4,02 пг/мл). Именно при наличии смешанной ВУИ также были выявлены высокие показатели провоспалительных цитокинов, что, по-видимому, связано с одновременным воздействием нескольких антигенов на иммунную систему.
Таким образом, полученные результаты свидетельствуют о непосредственной связи цитокинового статуса с серьезными ВУИ у больных детей и необходимости изучения важных цитокинов для определения функциональной активности клеточного иммуннитета. Показатели уровней цитокинов в сыворотке крови позволяет анализировать цитокиновый профиль при внутриутробных инфекциях, а также использовать эти данные для прогноза заболевания и эффективности проводимой терапии.
ЛИТЕРАТУРА
- Андреева Е.А. // Эпидемиология и инфекцион. болезни. – 2006. – № 1. – С. 49–52.
- Володин Н.Н., Дегтярева М.В., Симбирцев А.С. и др. // Int. J. on Immunorehabilitation. – 2000. – Vol. 2, N 1. – P. 75.
- Крюкова А.Г., Мансурова Э.Ф., Красникова Р.М. // Материалы междисциплин. науч.-практ. конф. стран СНГ, посвященной памяти Э.К. Цыбульника (Санкт-Петербург, 25–26 июня 2004 г.).
- Иммунодефицитные состояния / Под ред.B.C. Смирнова, И.С. Фрейдлин.– СПб., 2000.–С. 95.
- Полетаев А.Б., Будыкина Т.С, Морозов С.Г., Абросимова А.А. // Аллергология и иммунология. – 2001. – Т. – C. 110–116.
- Резник И.Б. // Рус. мед. журн.– 1998.– Т. 6, № 9.– C. 364–367.
- Сидорчук А.В., Трегубова Е.С. // Материалы междунар. конф. «Региональные проблемы профилактической медицины».– В. Новгород, 1999.– C. 115.
- Лаптева О.В. Клинико-иммунологическая характеристика детей с врожденной цитомегаловирусной инфекцией в периоде резидуальных явлений: Автореф. дис. … канд. мед. наук. – Ставрополь, 2001. – С. 14.
- Хаитов Р.М. Иммунология. – М., 2006.– 311 с.
- Аутеншлюс А.И., Шкунов А.Н., Иванова Г.Г. и др. // Цитокины и воспаление. – 2005. – Т. 4, № 3.– С. 11–15.
- Buck D., Malivert L., Chasseval R. et al. // Cell. – 2006. – Vol. 124. – P. 287–299.
- Gastigli E., Wilson S., Garibyan E. et al. // Nature Genetr. – 2007. – Vol. 39. – P. 430–431.
- Gunningham- Rundles G. // Blood Rev. – 2002. – Vol. l6. – P. 61–64.
- Segal A.W. // Clin. Exp. – 2010. – Vol. 160 (suppl. 1). – P. 1–2.
- Horn J., Manguat A., Berglund L. // J. Clin. Exp.Immunology. – 2009. – Vol. 2. – P. 1–2.
Данная статья взята из журнала «Медицинские новости», № 2, 2011.








Комментировать