Оценка изменения липидного спектра и иммунных маркеров воспаления при лечении заболеваний печени с использованием эссенциальных фосфолипидов и метионина у лиц молодого возраста. Данные исследования 46 пациентов, страдающих неалкогольной жировой болезнью печени.
Вялов Сергей Сергеевич – канд. мед. наук, кафедра общей врачебной практики ГОУ ВПО Российский университет дружбы народов.
Резюме. Для оценки изменения липидного спектра и иммунных маркеров воспаления при лечении заболеваний печени с использованием эссенциальных фосфолипидов и метионина у лиц молодого возраста проведено исследование 46 пациентов, страдающих неалкогольной жировой болезнью печени. На фоне терапии у всех пациентов отмечено снижение выраженности мезенхимальновоспалительного, цитолического и холестатического синдромов поражения печени по сравнению с начальным уровнем. Отмечены также выраженное гиполипидемическое действие и снижение признаков воспаления. На фоне лечения отмечено уменьшение выраженности признаков стеатоза печени. Исследование продемонстрировало высокую эффективность лечения метионином и эссенциальными фосфолипидами заболеваний печени у лиц молодого возраста.
Ключевые слова : НАЖБП, фиброз печени, метионин, эссенциальные фосфолипиды, комбинированная терапия, гепатопротекторы, липидный спектр, иммунные маркеры, воспаление.
Введение
Распространенность неалкогольной жировой болезни печени (НАЖБП) в различных странах Европы очень высока и составляет, по данным разных авторов, 10–24% в общей популяции населения, 57–74% среди тучных людей и приблизительно 11% – у пациентов, которым проводят биопсию печени в связи с повышенным уровнем трансаминаз сыворотки крови при подозрении на наличие фиброза или цирроза печени[1–5]. В действительности распространенность НАЖБП может быть еще выше среди больных без клинической симптоматики (табл. 1).
Современные представления о патогенезе НАЖБП позволяют выделить два этапа ее развития (теория «двух ударов» – «two-hits model») (Day, 1995). Резистентность к инсулину приводит к чрезмерному поглощению гепатоцитами высвобождающихся свободных жирных кислот и блокированию βокисления. На начальном этапе происходит накопление липидов (триглицеридов) в гепатоцитах, т.е. формирование собственно стеатоза печени [1, 6–10].
Второй этап – развитие воспаления и формирование собственно стеатогепатита. Считается, что второй этап заболевания является наиболее важным, поскольку факт воспаления, его интенсивность и степень фиброза ткани печени в большей степени определяют характер течения болезни и ее прогноз.Компенсаторное увеличение инсулина уменьшает синтез аполипопротеина В-100 – «первый удар». В ответ на это увеличивается чувствительность печени к агрессивным факторам «второго удара», который вызван активными формами кислорода и провоспалительными цитокинами (фактор некроза опухоли α – ФНО-α, трансформирующий фактор роста β – ТФР-β, интерлейкины –ИЛ-6 и ИЛ-8) [1, 6, 8, 9, 11].
Также в настоящее время важную роль в развитии стеатогепатита отводят нарушениям состава микрофлоры кишечника, рассматриваемым в качестве индуктора воспалительной реакции, стимулированной ФНО-α. Микрофлора кишечника является фактором, в некоторой мере определяющим чувствительность организма к инсулину, что связано со снижением в крови концентраций липополисахарида и продуцируемого кишечником провоспалительного цитокина ФНО-α [12–14]. Присутствие отдельных бактерий в кишечнике может обусловливать слабовыраженное хроническое системное воспаление, которое в свою очередь приводит к формированию инсулинорези-стентности. Развитие НАЖБП можно рассматривать как общебиологическую реакцию на хроническое системное воспаление, индуцированное и поддерживаемое дисбиотическими нарушениями [10, 12, 14].
На этом этапе происходит трансформация стеатоза в стеатогепатит с последующим развитием соединительной ткани и фиброза печени. Свободные радикалы возникают в электронно-транспортной цепи митохондрий, в цитоплазме за счет взаимодействий с участием цитохромов – CYP2E1 и CYP4A (гидроксилирование длинноцепочечных жирных кислот). Регулирование максимального уровня CYP2E1 зависит от употребления алкоголя, голодания, наличия сахарного диабета, ожирения и инсулинорезистентности. Поэтому система цитохрома Р-450 играет ключевую роль в развитии стеатогепатита [1, 6, 10, 13, 16, 17].
Согласно теории оксидативного стресса как важнейшего универсального патогенетического механизма развития НАЖБП, рассматриваются эффекты перекисного окисления липидов, что объясняет основную часть наблюдаемых при неалкогольном стеатогепатите (НАСГ) гистологических изменений. Процессы перекисного окисления липидов приводят к повреждению мембран гепатоцитов, к формированию гигантских митохондрий и некрозу клеток. Это активирует звездчатые клетки, которые служат основными продуцентами коллагена, а также вызывать перекрестное связывание цитокератинов с формированием телец Мэллори [1, 6, 15, 16].
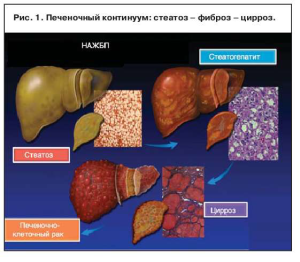
Таким образом, в развитии НАЖБП выделяется несколько этапов: гепатоз или стеатоз, стеатогепатит, фиброз печени и цирроз печени. Стеатоз печени характеризуется накоплением жира в гепатоцитах и звездчатых клетках, которое в дальнейшем приводит к повреждениям гепатоцитов. Формирование стеатогепатита сопровождается воспалительно-некротическими изменениями в печени, в основе которых лежат универсальные механизмы, не зависящие от этиологии стеатоза. При НАСГ происходит усиление ПОЛ и образование свободных радикалов. Образование свободных радикалов приводит к повреждению гепатоцитов, нарушению целостности мембран, накоплению токсинов, стимулирующих синтез коллагена. В результате несоответствия синтеза и секреции триглицеридов, стимулирующих воспалительные реакции, усиления синтеза коллагена развивается фиброз. Дальнейшее развитие изменений и отсутствие медикаментозной коррекции приводит к прогрессированию заболевания по пути печеночного континуума (рис. 1). Усиление фибротических изменений печени переходит в цирроз печени и при самом неблагоприятном прогнозе – развитию осложнений или гепатоцеллюлярной карциномы [3, 5–7, 10].
Возвращаясь к первому патогенетическому фактору развития НАЖБП, следует помнить о пациентах с избыточной массой тела, ожирением, атеросклерозом. В современном обществе проблема ожирения приобрела высокое медико-социальное значение. У тучных пациентов практикующие врачи диагностируют сразу несколько серьезных заболеваний, среди которых сочетание НАЖБП и атерогенной дислипидемии встречается довольно часто [5, 7, 17].
Первичный НАСГ, как правило, ассоциирован с эндогенными нарушениями липидного и углеводного обмена. Наиболее высок риск развития стеатоза печени у лиц с ожирением, инсулинонезависимым сахарным диабетом, гипертриглицеридемией.
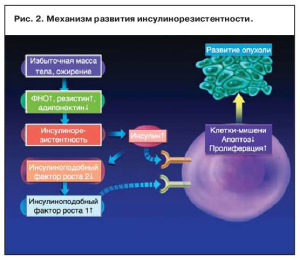
При рассмотрении механизмов формирования синдрома инсулинорезистентности (рис. 2) большое значение придается печени как главному органу глюконеогенеза. При этом печень является не только местом начала метаболических нарушений, но и мишенью этих нарушений. Так, одним из основных морфологических проявлений является избыточное отложение жира в гепатоцитах. В последующем происходят изменение функциональной активности клеток печени и перестройка регуляции гомеостаза, способствующая развитию патоморфологических изменений вначале по типу дистрофии и крупнокапельного ожирения, а в дальнейшем – воспаления и фиброза [7, 11].
Основная цель лечения заболеваний печени состоит в том, чтобы предотвратить развитие цирроза печени и его осложнений. Стандартом терапии на сегодня являются эссенциальные фосфолипиды (ЭФЛ) – незаменимые средства для развития и функционирования клеток печени. Основная фракция ЭФЛ обычно представлена фосфатидилхолином, который является основным компонентом биологических мембран. Попадая в организм, фосфатидилхолин восстанавливает целостность мембран пораженных клеток печени и активирует расположенные в мембране фосфолипидзависимые ферменты, нормализуя тем самым проницаемость и усиливая дезинтоксикационный и экскреторный потенциал клеток печени [1, 11, 15, 18, 19].
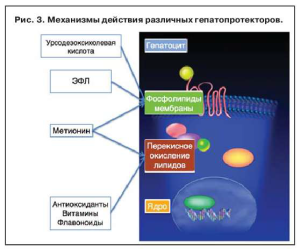
При лечении данной патологии лекарственные средства должны не только улучшать функциональное состояние печени и предотвращать развитие фиброза печени у больных с НАЖБП, но и параллельно устранять высокий атерогенный потенциал липидного спектра для профилактики развития сердечно-сосудистых катастроф. В настоящее время разрабатывается множество новых препаратов для лечения НАЖБП. Однако для их широкого внедрения в практику требуется длительное время. При этом роль некоторых препаратов, уже имеющихся в арсенале практикующего врача, принижается, а также недооцененной остается возможность проведения комбинированной терапии (рис. 3). Так, весьма важен данный аспект при лечении заболеваний печени, в тех ситуациях, когда возможна комбинация нескольких действующих веществ с разными механизмами действия, что оказывает более быстрый и выраженный эффект по сравнению с монотерапией. Одним из таких примеров может служить комбинация ЭФЛ с метионином.
Метионин – незаменимая аминокислота, которая является источником метильных групп. Особая роль этой аминокислоты в обмене веществ связана с тем, что метильная группа подвижна и может передаваться на другие соединения. Таким образом, метионин участвует в весьма важных для жизнедеятельности организма процессах переметилирования, дезаминирования, декарбоксилирования.
С процессом переметилирования связан биологический синтез холина, являющегося важнейшим липотропным фактором организма. Увеличение содержания холина способствует увеличению синтеза эндогенных фосфолипидов и, соответственно, уменьшению отложения в печени нейтрального жира. Развитие нарушений в жировом обмене печени при белковой недостаточности организма также имеет в своей основе недостаточное поступление содержащегося в белках метионина. Введение метионина вызывает снижение содержания в крови холестерина и повышение уровня фосфолипидов.
При лечении заболеваний печени большее значение приобретают такие функции метионина, как участие в следующих важных метаболических реакциях: трансметилирования, биосинтезе фосфолипидов [1, 15, 18, 19]. Это является важным фактором, влияющим на связанные с мембраной ферментативные процессы, в регуляции выработки желчи, предотвращении внутрипеченочного холестаза (Chawla и соавт., 1990). Важным аспектом действия метионина является участие в обмене глутатиона, защищающего гепатоциты от токсического повреждения свободными радикалами. Участвуя в реакциях сульфатирования, метионин играет важную роль в детоксикации метаболитов, токсичных желчных кислот.
При одновременном приеме метионин и ЭФЛ усиливают действие друг друга, являясь источником эндогенных и экзогенных фосфолипидов соответственно, улучшают функциональное состояние клеток печени и оказывают гепатопротекторный, гиполипидемический и противовоспалительный эффекты. В связи с этим представляется важным изучение влияния комбинированной терапии метионином и ЭФЛ на течение заболеваний, приводящих к фиброзу и циррозу печени.
Целью исследования явилась комплексная оценка лечения НАЖБП с использованием ЭФЛ и метионина, оценка гепатопротективных свойств монотерапии по сравнению с комбинированной терапией, оценка изменений лабораторных данных, в том числе маркеров цитолиза, липидного спектра, иммунных индексов и признаков фиброза.
Материалы и методы
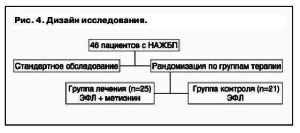
В исследование были включены 46 пациентов, страдающих НАЖБП. Длительность наблюдения и лечения составила 3 мес (рис. 4). В ходе исследования оценивалась динамика клинических проявлений и показатели биохимического исследования крови. Контролировались ультразвуковые показатели состояния печени.
Группа контроля включала 21 пациента с НАЖБП, средний возраст пациентов составил 32,3 года. Все пациенты контрольной группы проходили стандартное обследование, которое включало общий анализ крови, мочи, биохимический анализ крови с определением маркеров цитолиза, липидного спектра, показателей свертывающей системы крови, иммунной системы, а также маркеры воспаления. Всем пациентам проводилось ультразвуковое исследование (УЗИ) гепатобилиарной зоны для определения состояния печени и стадии НАЖБП, также проводилась непрямая эластометрия. В группе контроля проводилось лечение ЭФЛ в стандартной дозировке 1800 мг/сут.
Группа лечения включала 25 пациентов с НАЖБП. Группы пациентов были сопоставимы по полу, возрасту и исходному состоянию печени. Пациентам в этой группе также проводилось стандартное обследование на момент включения в исследование и на момент его окончания. Для оценки динамики и темпов изменения трансаминаз их определение проводилось несколько раз в ходе исследования. В качестве терапии пациенты получали ЭФЛ и метионин в стандартной дозировке 600 мг/сут.
Результаты
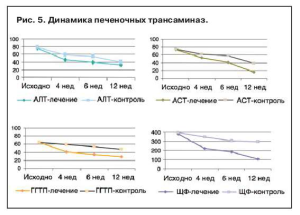
Уровень печеночных трансаминаз является одним из основных показателей, позволяющих оценить течение и прогноз заболевания. Уровни аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) в группе лечения снизились с 76,8 до 32,4 Ед/л и с 73,7 до 16,4 Ед/л соответственно. Уровень АЛТ снизился на 58,0%. Уровень АСТ снизился на 78,0%. При этом начальные уровни ферментов не различались между группами.
У всех пациентов на фоне приема фосфолипидов и метионина соотношение АСТ/АЛТ нормализовалось. При анализе темпов снижения показателей АСТ и АЛТ отмечается большая положительная динамика в группе лечения по сравнению с группой контроля (рис. 5). К концу периода наблюдения отмечается нормализация показателей печеночных трансаминаз в группе лечения.
Анализ динамики одного из ключевых показателей оценки состояния печени – γглутамилтранспептидаза (ГГТП) – обнаруживает следующую тенденцию. На момент начала исследования уровень показателя составлял 64,4 Ед/л в группе лечения и 63,9 Ед/л – в группе контроля. Причем, в контрольной группе происходила более быстрая нормализация показателя по сравнению с группой лечения, однако после 1 мес приема темпы снижения ГГТП замедляются и к моменту окончания исследования достигают нормальных значений, составляя 47,1 Ед/л. Группа пациентов, получающих комбинированное лечение, отмечает более медленную динамику, но тем не менее достигает целевых уровней. К моменту окончания исследования значение уровня ГГТП составило 29,1 Ед/л (p<0,05). Уровень ГГТП снизился на 54,8% по сравнению с начальным уровнем. При оценке уровней щелочной фосфатазы (ЩФ) картина в целом не отличается от трансаминаз. Так же происходит снижение при более выраженной динамике в группе лечения.
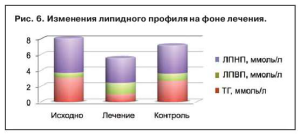
Анализ динамики показателей липидного спектра показал более интенсивную динамику в группе пациентов, получающих комбинированное лечение, по сравнению с контролем. Более интенсивное снижение реализуется в большей степени за счет атероген-ных липопротеидов низкой плотности (ЛПНП) и триглицеридов (ТГ) в группе лечения. В группе контроля снижение уровней липидов сыворотки происходило в большей степени за счет ТГ (рис. 6).
Исходно повышенный в 2 группах уровень общего холестерина, составивший в группе контроля 8,1 ммоль/л и в группе лечения 8,0 ммоль/л, снизился к моменту окончания исследования по-разному в 2 группах. Различия между группами статистически достоверны: в группе контроля уровень общего холестерина – 7,2 ммоль/л, снижение составило 11%, а в группе лечения – 5,6 ммоль/л, т.е. снижение составило 28,7% по сравнению с исходным. Причем снижение происходило в основном за счет ЛПНП, уровень которых снизился на 25,4%,что свидетельствует о взаимном потенцировании действия при совместном назначении фосфолипидов и метионина.
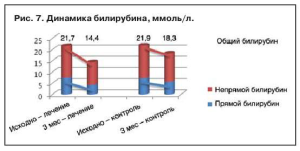
Снижение содержания билирубина отмечалось в обеих группах (рис. 7). На момент включения в исследование средний уровень общего билирубина составил 21,7 ммоль/л, уровень прямого билирубина – 7,4 ммоль/л. После проведенного курса терапии положительная динамика отмечается в обеих группах. В группе лечения уровень билирубина снизился на 33,3%, в контрольной группе отмечалось менее интенсивное снижение – на 16,4%. При этом различия между группами были статистически достоверны (p<0,05). Подобные тенденции обнаруживаются при исследовании прямого билирубина. Уровень содержания глюкозы не выявил значимых изменений. Общий белок сыворотки, сниженный изначально, к окончанию наблюдения восстановился до референтных значений в обеих группах.
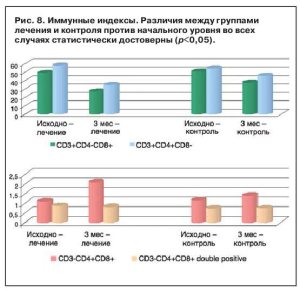
В исследуемой группе было отмечено повышение активных Т-лимфоцитов и индекса Т-хелперы/Тсупрессоры (рис.8). Показатели CD3+CD4+CD8-, CD3+CD8+CD4-, CD4+CD8+CD3- single, doublepositive также имеют благоприятное значение при прогностической оценке дальнейшего течения заболевания в группе лечения. Все приведенные индексы свидетельствуют о положительном влиянии на иммунный статус, в особенности на клеточное звено иммунитета. Отмечается более быстрое снижение CD3+CD4+CD8в контрольной группе в течение 1-го месяца наблюдения, однако в последующем снижения значения показателя не отмечается. К моменту окончания наблюдения более выраженным оказывается снижение CD3+CD4+CD8в группе лечения. Подобная динамика отмечается при анализе CD3+CD8+CD4с более выраженным снижением индекса в группе лечения. CD4+CD8+CD3single отмечает повышение в обеих группах на фоне проводимой терапии. При этом комбинированная терапия приводит к более выраженной динамике индекса и большему его росту. Изменения индекса CD4+CD8+CD3doublepositive отмечают определенную динамику, однако диапазон изменений не имеет большого клинического значения.
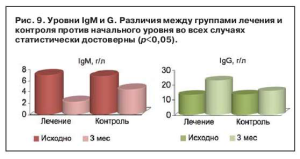
Уровни иммуноглобулинов (Ig) в ходе проведения исследования нормализовались. Более быстрая динамика нормализации показателей отмечалась в группе лечения. К моменту окончания исследования уровни IgM и G в группе пациентов, получающих комбинированную терапию, соответствовали референтным значениям. Причем, более быстрые темпы нормализации показателей IgG были характерны для контрольной группы пациентов, а IgМ – для группы лечения (рис. 9). Данное различие вероятно связано с механизмом действия препаратов и обусловлено влиянием на клеточное и гуморальное звенья иммунной системы, что подтверждается изменениями иммунных индексов.
При проведении исследования у пациентов обеих групп не обнаруживались антинуклеарные антитела (ANA), антитела к митохондриям (AMA), антитела к фосфолипидам (Anti-PhLA), антитела к микросомам почек 1-го типа (Anti-LKM1).
Уровень фибротических изменений печени оценивался нами с использованием нескольких методик. Проводилась оценка состояния печени с помощью УЗИ, при этом определялись также размеры печени, эхогенность, наличие жидкости в брюшной полости. Учитывая сложную воспроизводимость и неоднозначность интерпретации полученных с помощью УЗИ данных, а также сложностей фиксации результатов для оценки динамики изменений, необходимо было использование ряда других методик [2, 3, 20, 21].
«Золотым стандартом» диагностики фиброза печени является проведение биопсии с гистологическим исследованием. Гистологическая оценка проводится по шкалам Desmet (1984 г.) в модификации Серова; шкале JSHAK или METAVIR. В связи с инвазивностью, с большой погрешностью гистологического исследования, связанной с «ошибками попадания» иглы при пункционной биопсии печени, различием в интерпретации результатов для ранней диагностики патологических процессов в настоящее время уделяют большое внимание неинвазивным методам диагностики фиброза. К ним относят биопрогностические лабораторные тесты; эластометрию печени; УЗИ, компьютерную и магнитно-резонансную томографию печени, ультразвуковую допплерографию сосудов печени и селезенки с расчетом индексов фиброза и портальной гипертензии[2, 3, 5, 12, 14, 21].
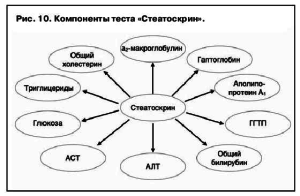
С учетом сложностей использования инвазивных методов и наличия множества новых современных методов для определения степени фиброза использовался «Стеатоскрин» (рис. 10), а также непрямая ультразвуковая эластометрия. Оба метода на данный момент хорошо изучены, для них исследована корреляция со степенями фиброза печени и подтверждена результатами множества исследований [2–4, 19, 20].
Для оценки выраженности фиброза печени используют также системы ФиброТест и АктиТест, рассматривая их в качестве альтернативы биопсии. ФиброТест включает 5 биохимических показателей: α2-макроглобулин (активирует клетки Ито), гаптоглобин (отражает стимуляцию клеток печени ИЛ), аполипопротеин А1, ГГТП, общий билирубин. АктиТест оценивает вирусную некровоспалительную активность и в дополнение к перечисленным компонентам включает аланиновую аминотрансферазу – АЛТ.
ФиброМакс является сочетанием пяти неинвазивных тестов: ФиброТест и АктиТест, СтеатоТест (диагностирует стеатоз печени), НешТест (диагностирует НАСГ), АшТест (диагностирует тяжелый алкогольный стеатогепатит). В ФиброМаксе определяется α2-макроглобулин, гаптоглобин, аполипопротеин А1, ГГТП, общий билирубин, АЛТ, АСТ, глюкоза, ТГ, холестерин. По полученным данным, с учетом возраста и пола пациента рассчитывается стадия фиброза и уровень активности гепатита. Лимитируют использование тестов признаки холестаза, отрицательно влияющие на диагностическую значимость тестов.
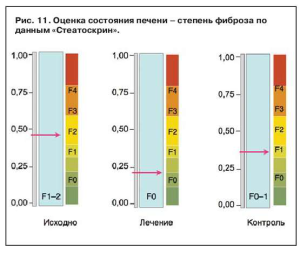
Исходная степень стеатоза печени была сопоставима в 2 группах и составляла около 0,46 по данным теста «Стеатоскрин» (p<0,05). По окончании наблюдения по данным обследования признаки развития стеатоза печени были менее выражены у пациентов, получающих комбинированную терапию (рис. 11).
Это подтверждает большее снижение степени стеатоза печени в группе лечения (0,22) по сравнению с группой контроля (0,34).
Выводы
Результаты исследования показали клинически значимое влияние комбинированной терапии метионином и ЭФЛ у пациентов молодого возраста с хроническим поражением печени на показатели липидного спектра и иммунные индексы. Включение в схему терапии заболеваний печени метионина в комбинации с ЭФЛ приводит к более быстрой нормализации клинических показателей, отмечается нормализация липидного спектра крови, ускорение восстановления структуры печени и положительное влияние на признаки воспаления.
Включение метионина в комплексе с ЭФЛ в терапию НАЖБП совместно оказывает положительное действие на иммунные индексы, что свидетельствует об уменьшении воспалительных процессов с вовлечением иммунных механизмов. Это особенно важно у пациентов с метаболическим синдромом. Представляется целесообразным комбинирование ЭФЛ с метионином при лечении заболеваний печени.
Литература
1. Буеверов А.О., Богомолов П.О. Неалкогольная жировая болезнь печени: обоснование патогенетической терапии. Клин. перспективы гастроэнтерол. 2009; 1: 3–9.
2. Вялов С.С., Кузнецов В.И., Ходорович А.М. Новые возможности выявления скрытых заболеваний у студентов с помощью скрининговой диагностики в рамках программы «Здоровье»: внедрение и эффективность. Вестник РУДН, Серия Медицина.М.: РУДН, 2009; 4 (33): 92–8.
3. Павлов Ч.С., Глушенков Д.В., Коновалова О.Н. и др. Сфера клинического применения неинвазивных методов оценки фиброза печени: результаты собственных исследований в многопрофильном стационаре. Клин. мед. 2009; 9: 40–5.
4. Павлов Ч.С., Золотаревский В.Б., Ивашкин В.Т. и др. Структура хронических заболеваний печени по данным биопсии и морфологического исследования ее ткани. Рос. журн. гастроэнтерол., гепатол., колопроктол. 2007; 17 (1): 90.
5. Clark JM. The epidemiology of nonalcoholic fatty liver disease in adults. J Clin.Gastroenterol 2006; 40 (Suppl. 1): S5–10.
6. Гриневич В.Б., Сас Е.И., Ефимов О.И. Неалкогольный стеатогепатит как патофизиологическая адаптивная реакция на атерогенные изменения липидного спектра сыворотки крови. Медицинский альманах. 2009; 4: 54–9.
7. Карнейро де Мур М. Неалкогольный стеатогепатит. Клин. перспективы в гастроэнтерол., гепатол.2001; 2: 12–5.
8. Сторожаков Г.И., Ивкова А.Н. Патогенетические аспекты фиброгенеза при хронических заболеваниях печени. Клин. перспективы гастроэнтерологии, гепатологии 2009; 2: 3–10.
9. Donnelly KL, Smith CI, Schwarzenberg SJ et al. Sources of fatty acids stored in liver and secreted via lipoproteins in patients with NAFLD. J ClinInvest 2005; 115 (5): 1343–51.
10. Parsons CJ, Takashima M, Rippe RA. Molecular mechanisms of hepatic fibrogenesis. J Gastroenterol Hepatol 2007; 22 (1): 79–84.
11. Вялов С.С., Вялов И.С., Aleksanyan A.A. Коррекция иммунного статуса у пациентов с хронической ассоциированной вирусной инфекцией в послеоперационном периоде. Проблемы амбулаторной хирургии. Под ред. П.Н.Олейникова. Х научно-практ. конф. М: ИКАР, 2009; с. 342–7.
12. Гриневич В.Б., Сас Е.И., Ефимов О.И. и др. Коррекция дисбиоза кишечника – фактор преодоления инсулинорезистентности. Рос. журн. гастроэнтерол., гепатол., колопроктол. 2009; 19 (1, Прил.33): 90–1.
13. Possemiers S et al. Changes in gut microbiota control inflammation in obese mice through a mechanism involving GLP–2–driven improvement of gut permeability. Gut 2009; 58: 1091–103.
14. Vyalov SS. Bacterial overgrowth syndrome effect on the course of nonalcoholic steatohepatitis. GASL Annual Scientific Meeting, A24; Li-ver and inflammation, Regensburg, Germany, 2011.
15. Драпкина О.М., Корнеева О.Н., Ивашкин В.Т. Терапия неалкогольного стеатогепатита при метаболическом синдроме: фокус на эссенциальные фосфолипиды. Лечащий Врач. 2010; 2: 43–5.
16. Permana PA, Menge C, Reaven PD. Macrophage–secreted factors induce adipocyte inflammation and insulin resistance. Biochem-Biophys Res Commun 2006; 341 (2): 507–14.
17. Ивашкин В.Т., Драпкина О.М. Синдром инсулинорезистентности. Рус. мед. журн. 2009; 3 (3): 45–9.
18. Ratzui V, Zelber-Sagi S. Pharmacologic therapy of non-alcoholic steatohepatitis. Clin Liver Dis 2009;13 (4): 667–88.
19. Vyalov SS. Polyprenols effect on inflammation and liver fibrosis. GASL Annual Scientific Meeting, A25; Liver and inflammation, Regensburg, Germany, 2011.20.
20. Вялов С.С. Алгоритмы диагностики. Практическое руководство. Изд. 3-е, дополненное. М.: МЕДпресс-информ, 2010.
21. Вялов С.С., Вялов И.С. и др. Общая врачебная практика: диагностическое значение лабораторных исследований. Учебное пособие. Под ред. С.С.Вялова, С.А.Чорбинской. Изд. 4-е, дополненное. М.: МЕДпресс-информ, 2010.









Комментировать