Геморрагический шок: факторы риска возникновения и клиническая картина. Организация экстренной помощи при геморрагическом шоке.
Р.А. Ткаченко, д.м.н., доцент кафедры анестезиологии и интенсивной терапии Национального медицинского университета им. А.А. Богомольца, главный консультант ГУЗО и МЗ г. Киева по вопросам акушерской реанимации
Геморрагический шок и его осложнения в акушерской практике устойчиво занимают ведущее место среди причин материнской смертности. Как правило, причиной его развития являются массивные маточные кровотечения, которые встречаются в 8-11% случаев от всех родов [1].
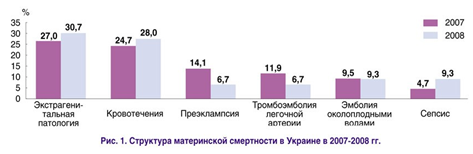
Повсеместно акушерские кровотечения– одна из основных причин материнской смертности, составляющая в чистом виде 20-25%; как конкурирующая причина – 42% и как фоновая – до 78% [8]. К сожалению, подобная статистика характерна и для Украины (рис. 1).
Одним из предрасполагающих факторов к развитию акушерских кровотечений является исходная гиповолемия. Первичная гиповолемия у беременных наблюдается при гестозах, многоводии, многоплодии, сосудистых аллергических поражениях, заболеваниях, сопровождающихся лихорадочными состояниями, диабете, заболеваниях почек, недостаточности кровообращения и др. Кроме того, возможно развитие вторичной (ятрогенной) гиповолемии под влиянием неадекватного использования диуретиков, ганглиоблокаторов и т.д. [18].
Факторы риска возникновения геморрагического шока в акушерстве [13]:
Кровотечения на ранних сроках беременности:
аборт;
внематочнаябеременность;
пузырныйзанос.
Кровотечения на поздних сроках беременности или в родах:
преждевременная отслойка плаценты;
предлежание плаценты;
разрывы матки;
эмболия околоплодными водами.
Кровотечения после родов:
гипотония или атония матки;
задержка плаценты или ее фрагментов;
разрывы родовых путей.
Печеночная недостаточность.
Патология системы гемостаза.
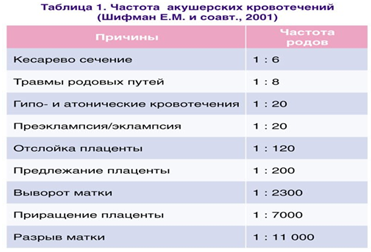
Наиболее частые причины акушерских кровотечений отражены в таблице 1.
Особенностью акушерских кровотечений являются их внезапность и массивность. Для акушерских кровотечений характерны острый дефицит объема циркулирующей крови (ОЦК), нарушения сердечной деятельности, анемическая и циркуляторные формы гипоксии. Основные причины нарушений гемодинамики – дефицит ОЦК и несоответствие между ним и емкостью сосудистого русла. Возникающая на этом фоне тканевая гипоксия сопровождается нарушением окислительно—восстановительных процессов с преимущественным поражением ЦНС, почек, печени. Кроме того, происходит нарушение водно—электролитного баланса, кислотнощелочного состояния, гормональных соотношений и ферментативных процессов. При массивных кровотечениях быстро развивается порочный круг, который может привести к терминальному состоянию и летальному исходу.
Акушерские кровотечения нередко возникают из—за нарушения гемокоагуляционных свойств крови. При сравнительно небольшой кровопотере (20% от ОЦК) зачастую можно констатировать двухфазность изменений в системе гемостаза. Кратковременная фаза гиперкоагуляции сменяется фазой гипокоагуляции. На этом фоне возникают генерализованные кровотечения при одновременном развитии синдрома диссеминированного внутрисосудистого свертывания (ДВС— синдрома). Развивающееся в начальной фазе кровотечения внутрисосудистое свертывание (коагулопатия потребления) приводит к гипофибриногенемии и вторичному фибринолизу [19].
Наилучшими способами предупреждения развития кровотечений являются тщательное наблюдение за беременными, современные методы диагностики и обследования, а также наличие квалифицированного персонала, владеющего методами интенсивной терапии и знающего специфику акушерской клиники.
Основная задача врачей при кровотечении заключается в своевременном использовании эффективных и надежных методов его остановки до возникновения симптомов геморрагического шока. Промедление приводит к тому, что приходится бороться не только с кровотечением, но и с его осложнениями, в частности с развившимся геморрагическим шоком, что влечет за собой необходимость комплексной терапии и системных реанимационных мероприятий в зависимости от акушерской ситуации.
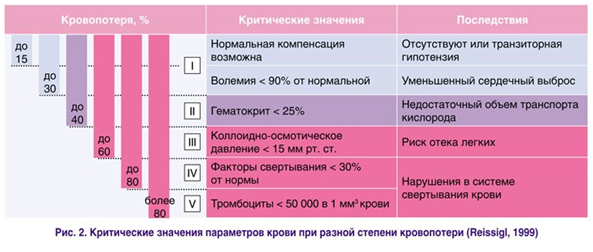
Опасность развития геморрагического шока у беременных возникает при кровопотере 15- 20% от ОЦК или 750-1000 мл. Кровопотеря, превышающая 1500 мл (25-30% от ОЦК или 1,5% от массы тела), считается массивной [7, 13, 14]. Связано это в первую очередь с теми адаптационно-приспособительными изменениями, которые возникают у женщин в процессе прогрессирования беременности. Прежде всего, это развитие физиологической гиперволемической аутогемодилюции, снижение коллоидно—осмотического давления до 22 мм рт. ст. и осмолярности до 275-280 мос моль/л [2, 9, 18]. Данные изменения способствуют развитию отека легких, особенно на фоне непродуманной инфузионно—трансфузионной терапии. Кроме того, на фоне гиперпрогестеронемии увеличивается эластичность вен и уменьшается реакция сосудов на катехоламины, что создает определенную проблематичность компенсации кровопотери более 20% от ОЦК. Снижение общего периферического сосудистого сопротивления до 750-1500 дин× см/с2предполагает более раннее присоединение относительной гиповолемии к абсолютной.
Все это делает приспособительные реакции у беременных малоэффективными при кровопотере более 30% ОЦК [2] и приводит к развитию тяжелого гиповолемического шока, сопровождающегося множеством патологических нарушений (рис. 2).
Также следует учитывать и большую скорость маточного кровотока в конце III триместра беременности, достигающего 400-700 мл/мин, что обусловливает достаточно высокий темп потери ОЦК. Особенно быстро развивается геморрагиче— ский шок у беременных на фоне исходной гипово— лемии [3].
Этиопатогенез
Основной причиной патогенетических изменений, развивающихся при геморрагическом шоке, является острая кровопотеря, приводящая к снижению ОЦК. В результате этого происходит уменьшение венозного возврата и сердечного выброса (в соответствии с законом Старлинга) и как следствие – снижение уровня артериального давления (АД). Это в свою очередь приводит к стимуляции барорецепторов в дуге аорты, что сопровождается активацией симпато—адреналовой системы и выбросом катехоламинов (концентрация адреналина может повыситься в два раза, а нора дреналина – в шесть раз). Стимуляция α1— адренорецепторов сосудов приводит к спазму ар— териол и венул, а также к выбросу крови из депо (сокращение селезенки, сосудов желудка и кишечника, подкожно—жировой клетчатки и почек). В первую очередь реагируют сосуды—емкости – венулы, которые содержат около 2/3 ОЦК. Этот ме— ханизм способствует поддержанию нормального венозного возврата крови к сердцу.
Обусловленная кровопотерей внезапная гиповолемия приводит к миграции интерстициальной жидкости в сосудистое русло за счет первоначального снижения гидростатического давления в капиллярах.В первые 5 мин после кровопотери в сосудистое русло может перейти количество жидкости, соответствующее 10-15% ОЦК, что и обусловливает достаточно хорошую компенсацию кровопотери в этом объеме (рис. 2). В дальнейшем при продолжающемся кровотечении развива ется компенсаторная централизация кровообращения, направленная на улучшение перфузии жизненно важных органов, в первую очередь головного мозга и сердца [3, 9, 15, 26]. Без симпатической компенсации быстрая потеря 25% ОЦК (20 мл/кг)привела бы к остановке кровообращения вследствие прекращения венозного возврата к сердцу [23]. Очень существенным фактором перераспределения крови при кровопотере является реакция спланхнического кровотока, которая выражается в спазме артериол, снижении венулярного сопротивления портальной системы и печени, в результате чего улучшается отток крови из этого бассейна в системный кровоток [22].
Активация β1—адренорецепторов повышает сократительную активность миокарда, что сопровождается повышением частоты сердечных сокращений и до определенного периода позволяет удерживать АД на прежнем уровне. Кроме того, это сопровождается расширением бронхиол и снижением сопротивления дыхательных путей. По мере прогрессирования кровопотери, возникающие в организме компенсаторные изменения не в состоянии противостоять все более усиливающемуся падению сердечного выброса, что приводит к снижению перфузии и ишемизации различных ор— ганов и тканей, в том числе почек, печени, кишечника, кожи и др. Ишемия почек приводит к активации ренинангиотензиновой системы, сопровождающейся повышением продукции антидиуретического гормона и дальнейшим усугублением спазма артериол, а также повышением перифери— ческого сосудистого сопротивления, что еще больше увеличивает нагрузку на миокард.
Ишемизация тканей приводит к тканевой гипоксии и перестройке клеточного метаболизма, что сопровождается накоплением недоокисленных продуктов, в частности молочной, пировиноградной и других органических кислот, и развитием метаболического ацидоза. Возникающие нарушения кислотно—основного состояния еще больше редуцируют функционирование микроциркуляторного русла и нарушают работоспособность пре— и посткапиллярных сфинктеров. Это обусловливает повышение внутрикапиллярного гидродинамического давления и последующий выход жидкости из капиллярного русла. Потеря жидкости сопровождается нарастанием вязкости крови и замедлением капиллярного кровотока, что в конечном итоге приводит к склеиванию эритроцитов, тромбоцитов и развитию сладж—феномена. Таким образом, в сосудистом русле создаются все предпосылки для дальнейшей каскадной реакции внутрисосудистой коагуляции и прогрессирования ДВС—синдрома.
Нарушение клеточного метаболизма сопровождается активацией цитокинов и комплемента, часть фракций которого образует мембраноповреждающий комплекс, что приводит к повреждению мембран форменных элементов и эндотелия сосудов, выбросу тромбопластина и усугубляет нарушенную сосудистую проницаемость. Все эти изменения происходят на фоне активизации метаболизма арахидоновой кислоты и образования эйкозаноидов (простагландинов, лейкотриенов и тромбоксанов). Под действием фосфолипазы А2 запускается каскад последующих превращений арахидоновой кислоты, которые проходят двумя путями: циклооксигеназным и липооксигеназным. В результате прохождения циклооксигеназным путем образуются короткоживущие эндоперекиси РGG2 и РGН2, которые затем метаболизируются в тромбоксан (ТХА2), простациклин (РGІ2) и простагландины (PGD2, PGE2 и PGF2α).Липоксигеназные энзимы обеспечивают конкурирующий путь окисления свободной арахидоновой кислоты, первичными продуктами которой являются эндоперекиси. Они в дальнейшем могут превращаться в лейкотриены. Метаболиты арахидоновой кислоты активно влияют на микроциркуляцию. Тромбоксан А2 вызывает спазм артериол и стимулирует агрегацию тромбоцитов. Простациклин обладает способностью расширять сосуды и является сильным ингибитором агрегации тромбоцитов. Простагландин Е2 является вазодилататором, тогда как простагландин F2α индуцирует вазоконстрикцию. Лейкотриены С4, D4 и Е4 в 1000-5000 раз превосходят гистамин по действию на сосудистую проницаемость и обусловливают спазм сосудов. Конечным результатом изменений в сосудах микроциркуля— торного русла является нарушение нормального капиллярного барьера, что приводит к пропотева— нию в интерстиций жидкости и к снижению объема плазмы [27].
Тканевая ишемия, перестройка клеточного метаболизма, активизация метаболизма арахидо— новой кислоты и другие патологические факторы способствуют дальнейшему повреждению клеточ— ных мемебран и поступлению в организм облом— ков белковых молекул, обладающих миокардиоде— прессивным эффектом, замыкая образовавшийся порочный круг [17]. Mebazaa A.и соавт. (2004) по— лагают, что миокардиальная ишемия является од— ним из основных осложнений после массивной послеродовой кровопотери. Считается, что низкий уровень диастолического АД в сочетании с выра— женной тахикардией – серьезный прогностический фактор в генезе развития ишемии миокарда у этой категории пациенток [24].
Образование вазоактивных метаболитов при длительной тканевой гипоксии приводит к расширению сосудов и резкому, нередко трудно поддающемуся коррекции, снижению АД. При снижении систолического АД ниже 50 мм рт. ст. нарушается синтез сурфактанта, вследствие чего альвеолы начинают спадаться, нарушая альвеолярную вентиляцию и диффузию газов через альвеоло-капиллярную мембрану и усугубляя имеющуюся гипоксию тканей и гипоксемию.
При снижении кровотока в периферических сосудах и артериальной гипотензии ткани активно начинают потреблять кислород из венозного отдела капилляров. В результате этого увеличивается артерио—венозная разница по кислороду и в течение некоторого времени поддерживается нормальное потребление тканями кислорода. В дальнейшем возникают снижение потребления кислорода тканями и нарастающая тканевая гипоксия вследствие открытия артерио—венозных шунтов. Основная часть кровотока устремляется через открывшиеся шунты, делая абсолютно неэффективной тканевую перфузию [26].
Таким образом, после острой кровопотери при отсутствии своевременной коррекции происходит полное поражение макро— и микроциркуляции, нарушение всех видов метаболизма, расстройство деятельности всех органов и ферментативных систем. Возникает синдром полиорганной и полисистемной недостаточности, который в конечном итоге приводит к гибели клеток и всего макроорганизма [11].
Комбинация гипотензии, гипотермии, коагулопатии и ацидоза является постоянным синдромом при шоке, который поддерживает порочный круг, и если его не разорвать – исход может быть летальным [21].
Клиническая картина
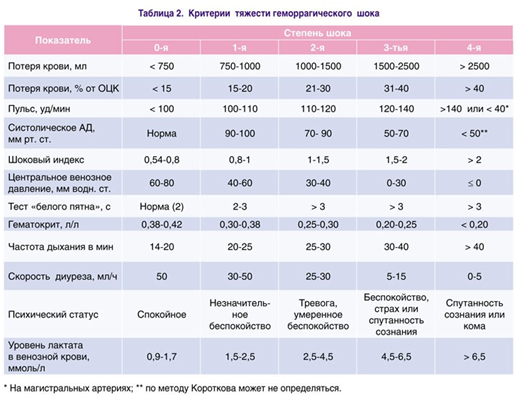
Клиника геморрагического шока в значительной мере зависит не только от объема кровопотери, но и от ее скорости и возможности организма включать компенсаторные системы. Следует также учитывать, что артериальная гипотензия считается поздним симптомом акушерского геморрагического шока. Благодаря физиологической гиперволемической аутогемодилюции у беременных АД может оставаться неизменным даже при кровопотере 25-30% от ОЦК [10]. Компенсация гиповолемии у таких пациенток происходит в первую очередь за счет активации симпато—адреналовой системы, что проявляется вазоспазмом и тахикардией. Однако, как уже указывалось выше, эти механизмы неустойчивы и быстро истощаются. Рано присоединяется олигоурия [5, 6, 12]. Поэтому при постановке диагноза геморрагического шока необходимо ориентироваться не только на объем кровопотери, но и на его клинические проявления. Адекватно определить объем кровопотери у беременных при развитии массивного маточного кровотечения зачастую бывает крайне сложно, так как вытекающая из влагалища кровь часто разбавлена околоплодными водами. Кроме того, не исключается задержка крови во влагалище или матке или же развитие внутреннего кровотечения при разрыве матки, что также затрудняет адекватное определение реального объема кровопотери. Уточнение диагноза необходимо проводить параллельно с интенсивной терапией. Борьба с шоком – экстренное задание, поскольку процесс стремительно прогрессирует, а терапевтические возможности организма беременной быстро исчерпываются. Поэтому для качественного проведения инфузионно—трансфузионной терапии необходимо отталкиваться не только от объема кровопотери, но и от клинических проявлений степени тяжести шока, используя шоковый индекс Алговера, симптом «бледного пятна», уровень лактата венозной крови и др. (табл. 2).
Таким образом, самая простая и главная причина ухудшения доставки кислорода к тканям – это невозможность организма обеспечить адекватный кровоток вследствие уменьшения объема внутрисосудистой жидкости. Следовательно, для поддержания и улучшения доставки кислорода к тканям необходимо восстановление внутрисосудистого объема как единственно главного критического параметра для адекватного кровотока и, следовательно, транспорта кислорода, что позволяет предупредить серьезные клинические последствия гипоксии. Гиповолемия должна корригироваться на наиболее ранних стадиях, потому что как только гипоксия вызовет значительные изменения тканей, процесс становится необратимым, и развивается полиорганная недостаточность [1, 3, 16].
Организация экстренной помощи при геморрагическом шоке
Анализ историй родов, сопровождавшихся массивной кровопотерей, показывает, что эффективность проводимого лечения в значительной степени зависит от времени начала интенсивной противошоковой терапии и организации мероприятий, направленных на окончательную остановку кровотечения. Именно упущенное время, как известно, является одним из пусковых факторов, приводящих в действие весь комплекс патофизиологических сдвигов, которые происходят в организме при продолжающейся кровопотере. По—этому во главу угла проблемы снижения материнской смертности от массивной кровопотери должны быть поставлены вопросы организации экстренной помощи этой категории женщин.
Экстренная помощь должна базироваться на следующих принципах:
Каждому члену дежурной бригады родильного блока и операционной, начиная от акушерки приемного покоя и заканчивая врачебной бригадой, следует четко знать порядок своих действий при оказании помощи женщине с кровотечением в зависимости от его причины, объема, скорости и исходной тяжести состояния больной.
Медперсонал лечебного учреждения должен находиться в постоянной готовности к оказанию помощи пациенткам с любым объемом кровопотери.
В лечебном учреждении надлежит организовать запас препаратов крови всех групп, средств для инфузионной терапии, в том числе коллоидных и белковых препаратов. Должны быть в наличии и постоянной готовности наборы для катетеризации центральных вен и венесекции, системы для переливания крови и ее забора.
В постоянной готовности необходимо содержать операционный инструментарий и анестезиологическое оборудование, включая наборы для проведения сердечно—легочной реанимации женщине и новорожденному.
Круглосуточно должна функционировать экспресс лаборатория для диагностики состояния жизненно важных органов и систем [6, 14].
Интенсивная терапия геморрагического шока включает следующие мероприятия:
немедленную остановку кровотечения консервативными или хирургическими методами, в зависимости от причины кровопотери;
восполнение ОЦК;
обеспечение адекватного газообмена;
лечение органной дисфункции и профилактики полиорганной недостаточности;
коррекцию метаболических нарушений. Остановка кровотечения является основным компонентом интенсивной терапии. Методы для этого выбирают в зависимости от причины, объема, скорости кровопотери и тяжести состояния больной, соблюдая главное условие – остановка кровотечения должна быть надежной и своевременной (тяжесть состояния не является противопоказанием к операционному гемостазу).
Восполнение ОЦК и проведение инфузионной терапии базируется на старом и хорошо зарекомендовавшем себя принципе: чем раньше – тем лучше. От скорости восстановления ОЦК и эффективной перфузии органов и тканей в основном зависит исход и вероятность выживания пациентки. Как правило, лечение геморрагического шока более эффективно, если инфузионная терапия начинается как можно раньше, не позднее чем за 30 мин от начала развития первых проявлений шока [20].
Скорость инфузионной терапии определяется степенью тяжести состояния больной (в терминальных случаях до 500 мл/мин, но не менее 100 мл/мин) [15].
В зависимости от объема кровопотери и тяжести шокового состояния проводят катетеризацию одной—двух периферических вен катетерами большого диаметра (№ 14-16 G). При существующей возможности доступа к нескольким периферическим венам не следует спешить с катетеризацией центральных вен, так как существует вероятность возникновения тяжелых пост катетеризационных осложнений. При развитии шока 3-4-й степени тяжести необходима катетеризация трех или даже четырех вен, при этом одна из них должна быть центральной. Преимущество при катетеризации вен следует отдавать венесекции v. braсhialis или пункции v. jugularis interna с последующим по стоянным контролем центрального венозного давления (как одного из показателей эффективности проводимой терапии). При шоке 2-3-й степени темп инфузии должен составлять 200-300 мл/мин [13]. При прогрессировании сердечной недостаточности, о чем свидетельствует повышение центрального венозного давления на фоне проведения инфузионной терапии, при остающемся низком уровне АД необходимо проведение симпатомиметической поддержки (дофамином 5-20 мкг/кг/мин или добутамином 5-40 мкг/кг/мин) [11].
Показателем эффективности проводимой терапии геморрагического шока является нормализация центрального венозного давления и АД, уменьшение тахикардии, сердечный индекс > 3 л/мин, потребление кислорода (VO2) > 100 мл/мин × м2, повышение темпа мочеотделения > 30 мл/ч, снижение уровня венозного лактата < 3,5 ммоль/л. При своевременном начале и адекватном проведении интенсивной терапии исход геморрагического шока, как правило, благоприятный [15].









Комментировать