Остановка кровотечения и проведение заместительной инфузионно-трансфузионной терапии как основополагающих принципов интенсивной терапии массивной кровопотери. Вопрос о качественном составе проводимой инфузионно-трансфузионной терапии при развитии массивной кровопотери в современной акушерской практике.
Р.А. Ткаченко, д.м.н., доцент кафедры анестезиологии и интенсивной терапии Национального медицинского университета им. А.А. Богомольца, главный консультант ГУЗО и МЗ г. Киева по вопросам акушерской реанимации
Как уже было сказано в первой части нашей клинической лекции*, основополагающими принципами интенсивной терапии массивной кровопотери являются остановка кровотечения (хирургический и консервативный гемостаз) и провением заместительной инфузионно- трансфузионной терапии (ИТТ).
Инфузионная терапия является мощным инструментом врача и может дать хороший эффект при условии, что тот четко знает цель применения препарата и имеет представление о механизмах его действия. К сожалению, при выборе растворов для проведения инфузионной терапии мы часто руководствуемся эмоциями и привычками, а не документированными доказательствами. Основные аргументы в пользу выбора того или иного раствора должны основываться на правильной интерпретации различных показателей, характеризующих данную клиническую ситуацию, и сопоставимость с ней физико-химических свойств препарата. Важной является также оценка критерия стоимость-эффективность.
При выборе стратегии и тактики ИТТ акушерских кровотечений необходимо учитывать [10]:
- безопасность применения инфузионной среды во время беременности с учетом волемических, реологических, гемостатических свойств крови и кислотно-основного состояния у беременных;
- способность препарата проходить через маточно-плацентарный барьер;
- возможность стабилизации эндотелия;
- влияние инфузионной среды на гемостаз;
- величину волемического коэффициента;
- время нахождения в сосудистом русле;
- осмолярность препарата;
- возможность транспорта О2.
Для восполнения объема циркулирующей крови (ОЦК) в современных условиях существует целый ряд лекарственных средств, которые условно можно разделить следующим образом.
- Гемодинамические среды (декстраны, препараты желатины, гидроксиэтилированные крахмалы [ГЭК], альбумин).
- Электролитные растворы (физиологический раствор, раствор Рингера и др.).
- Инфузионные антигипоксанты (реамберин, мафусол).
- Препараты, обладающие способностью транспортировать кислород (эритроцитарные среды, перфторан, растворы гемоглобина).
До настоящего времени в акушерской практике не решен вопрос о качественном составе проводимой ИТТ при развитии массивной кровопотери. Ряд авторов [1, 3, 8, 13] в своих рекомендациях придерживаются мнения о необходимости раннего проведения гемотрансфузии наряду с применением других инфузионно-трансфузионных сред. Нет единого мнения о том, каким должно быть оптимальное соотношение между различными составляющими компонентами ИТТ.
Следует отметить, что при катастрофически низких показателях гемодинамики лучшим кровезаменителем будет тот, который можно вводить незамедлительно. Обычно инфузионную терапию начинают с введения коллоидных и кристаллоидных растворов, так как ни серьезность ситуации, ни крайняя необходимость не исключают строгого соблюдения правил переливания крови. Кроме того, необходимо помнить, что кислородно- транспортная функция крови начинает страдать при уровне гемоглобина < 70 г/л и гематокрита < 0,25 л/л.
При проведении ИТТ происходит разведение крови (гемодилюция). В зависимости от тактики ее проведения наблюдается три варианта гемодилюции: гиповолемическая (возникает при ошибочном, малообъемном проведении ИТТ), нормоволемическая и гиперволемическая. Считается, что оптимальным является проведение такой ИТТ, которая приводит к нормоволемической гемодилюции. При этом развивается ряд благоприятных эффектов. Уменьшенная вязкость крови в сочетании с нормоволемией (и тем более с гиперволемией) усиливает преднагрузку, что в свою очередь увеличивает ударный объем по закону Франка-Старлинга. Увеличенный ударный объем повышает доставку кислорода, несмотря на его сниженную концентрацию в артериальной крови. Однако следует помнить, что механизм Франка- Старлинга является ключевым в доставке кислорода в ответ на нормоволемическую гемодилюцию, и этот эффект возможен лишь при сохраненной сократительной способности миокарда.
Традиционно при острой кровопотере медицинский персонал стремится поддерживать довольно высокие показатели гематокрита. Считается, что значения гематокрита на уровне 22% являются предельно допустимыми (рис. 1)
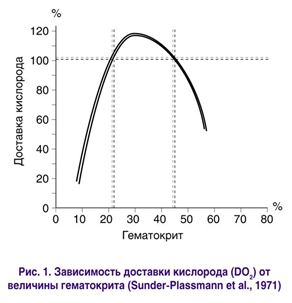
Вместе с тем последовательное изучение параметров доставки и потребления кислорода тканями указывает на более сложный характер соотношения между разведением крови и ее реологическими свойствами, а также свидетельствует в пользу ведущей роли поддержания повышенного сердечного выброса. Это и обусловливает выбор инфузионной среды при лечении геморрагического шока в зависимости от ее способности увеличивать сердечный выброс. При проведении ряда исследований оказалось, что коллоидные растворы являются более эффективными для усиления кровотока, а трансфузия эритроцитов была наименее успешной. Поскольку вязкость жидкости находится в прямой зависимости от плотности клеток в ней, способность коллоидных растворов увеличивать сердечный выброс является еще одним практическим подтверждением уравнения Гагена-Пуазейля. В ряде случаев переливание эритроцитарной массы сопровождается снижением сердечного выброса. Вязкость кpoви может также возрастать при малом кровотоке, следовательно, влияние трансфузии эритроцитарной массы на вязкость циркулирующей крови будет особенно выраженным у больных с низким сердечным выбросом [11].
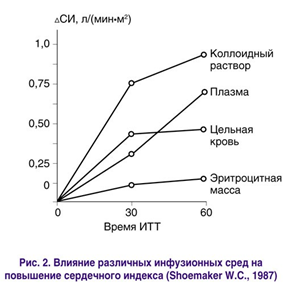
Кроме того, оценивая литературные данные по коррекции анемии, обращает на себя внимание сдержанное отношение авторов к переливанию больших объемов эритроцитарной массы, что связано с оценкой оксигенации тканей и уровнем потребления кислорода. Было установлено, что потребление кислорода тканями растет после увеличения сердечного выброса, но не повышается, если величина гематокрита возрастает в результате гемотрансфузии. Это объясняется тем, что переливание крови может уменьшить сердечный выброс и тем самым нивелировать благоприятное воздействие, обусловленное повышением уровня гемоглобина в крови [38]. Поэтому переливание крови с целью коррекции анемии не гарантирует улучшения оксигенации тканей, а содержание гемоглобина в крови в качестве критерия для назначения гемотрансфузии может быть обманчиво. Таким образом, в настоящее время коллоидные и кристаллоидные растворы являются препаратами выбора для объемного восполнения ОЦК и срочного поддержания сердечного выброса при острой кровопотере (рис. 2.).
Сдержанное отношение к гемотрансфузии обусловливает еще тот факт, что эта манипуляция является операцией по трансплантации ткани и может повлечь за собой ряд неблагоприятных последствий, в том числе:
- пирогенные и анафилактические реакции [30];
- иммуносупрессивные эффекты [40];
- передачу гемотрансмиссивных инфекций [29];
- реакции системного воспалительного ответа;
- синдром острого трансфузионного повреждения легких;
- гемолитические и анафилактические реакции и т.д. [37].
Немаловажным при выборе тактики трансфузионной терапии является также учет экономической целесообразности введения препаратов крови. Практически в 20% случаев гемотрансфузий выявляются побочные эффекты [47].
В пpоцессе хpанения консеpвиpованная кpовь пpетеpпевает опpеделенные изменения, значительно повышающие опасность гемотpансфузии. Так, в кpови длительных сроков хранения наблюдается выраженное (до 50%) снижение концентpации АТФ, pезкое уменьшение 2,3- дифосфоглицеpата, ионы калия покидают клетку, наступает потеpя агглютинабельности эpитpоцитов, появляется свободный гемоглобин, повышается уpовень аммиака и молочной кислоты, снижается pH. В pезультате этого значительно снижается кислоpодно-тpанспоpтная функция эpитpоцитов, пpоисходит повышение сpодства гемоглобина к кислоpоду и смещение кривой диссоциации оксигемоглобина влево. По меpе увеличения длительности хpанения кpови возpастает количество микpосгустков, показатель которых к 10-му дню составляет 12000-18000 в 1 мл, а также количество морфологически измененных эритроцитов, не способных выполнять кислородно-транспортную функцию (рис. 3).
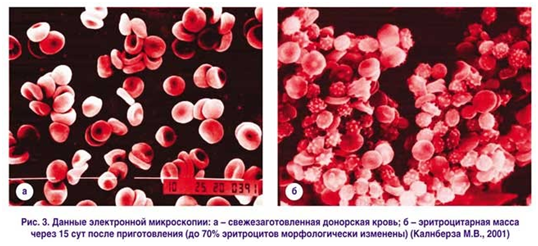
Даже пpименение стандаpтных фильтpов (последние способны задеpживать агpегаты величиной более 170 мкм, в то вpемя как пpосвет капилляpов равен 15-25 мкм) не исключает опасности pазвития микpотpомбоэмболий. Это пpежде всего касается легочных капилляpов, являющихся пеpвым фильтpом на пути этих взвесей.
При проведении гемотрансфузии повысился риск рецидива злокачественных новообразований. Е. Fransen и соавт. (1993) продемонстрировали повышение концентрации медиаторов воспаления и количества послеоперационных осложнений после интраоперационной гемотрансфузии. R.W. Taylor и соавт. (2002) доказали, что переливание эритромассы статистически достоверно повышает риск госпитальной инфекции, летальности и длительности пребывания в отделении интенсивной терапии. F.А. Moore и соавт. (1999) выполнили проспективное исследование и выявили дозозависимый эффект гемотрансфузий в отношении развития синдрома полиорганной недостаточности.
Ряд негемолитических реакций на гемотрансфузию и передача гемотрансмиссивных инфекций также обусловлены наличием лейкоцитов. Именно присутствие активированных нейтрофилов и провоспалительных цитокинов в компонентах крови способствует повреждению эндотелия и запуску HLA-аллоиммунизации и иммуносупрессии, развитию синдрома системного воспалительного ответа, полиорганной недостаточности и смерти [45].
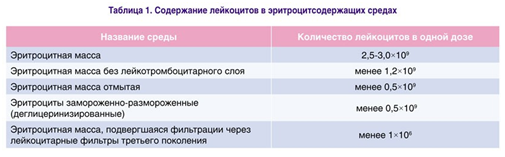
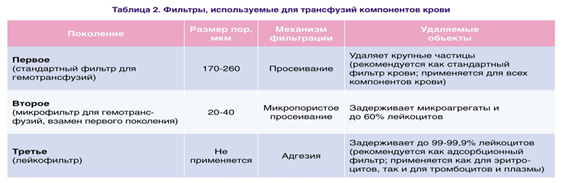
Несмотря на современные методы заготовки препаратов крови, в каждом из них присутствует достаточное количество лейкоцитов (табл. 1).
Опасность заpажения сывоpоточным гепатитом, маляpией и сифилисом, а в последнее вpемя и СПИДом, иммунологические наpушения и возможность pазвития тяжелых гемотpансфузионных осложнений диктуют необходимость стpожайшего соблюдения показаний к гемотpансфузии. Тем не менее при развитии тяжелой анемии или продолжающемся кровотечении существует необходимость в проведении трансфузии препаратов крови. В этом случае для уменьшения не благоприятных последствий трансфузионной терапии в большинстве стран Европы и Северной Америки, а также и в Украине (Приказ МЗ Украины № 385 от 01.08.2005 г.) стандартом является проведение трансфузионной терапии с использованием специальных лейкоцитарных фильтров. Применение лейкоцитарных фильтров второго и третьего поколений позволяет снизить риск развития пост трансфузионных реакций за счет поглощения лейкоцитов из трансфузионной среды (табл. 2)
- Hebert и соавт. (1999) сравнивали две тактики гемотрансфузии: либеральную (показанием к трансфузии крови являлся уровень гемоглобина < 100-110 г/л) и ограничительную (показание
- уровень гемоглобина < 70-80 г/л). В результате этого исследования доказано, что 30-дневная летальность была достоверно ниже у пациентов, которым применяли ограничительную тактику гемотрансфузии (оценка больных по APACHE II [шкала оценки острых и хронических функциональных изменений] составила < 20 баллов, возраст < 55 лет).
Клиническими наблюдениями у больных острой анемией, не позволявших по религиозным убеждениям переливать себе донорскую кровь, определен уровень гемоглобина = 30 г/л как критический при остром кровотечении, при котором уже достоверно увеличивалась летальность. Однако сейчас преобладает точка зрения, что уровень гемоглобина и гематокрита не может быть единственным критерием для определения показаний к гемотрансфузиям.
Оптимальный уровень гемоглобина у критических больных остается неизвестным и не может быть единственным критерием, определяющим показание к гемотрансфузии. При массивных профузных кровотечениях, когда нет уверенности в их быстрой остановке, показания к гемотрансфузии максимально расширяются [15].
По решению Консенсусной конференции (1992) [21], при условии нормоволемии показания к гемотрансфузиям при гемоглобина ≥ 100 г/л (кроме профузного кровотечения) отсутствуют. При его уровне 60-90 г/л необходимо ориентироваться: на артериальное и центральное венозное давление; продолжается или нет кровотечение; на наличие препаратов свежей крови, уровень венозного лактата (< 2 ммоль/л) и на сатурацию кислорода венозной крови (SvO2 > 70%).
Исходя из сказанного выше, возникает один достаточно серьезный вопрос: какие же инфузионные среды следует использовать при выборе тактики восполнения ОЦК при развитии кровопотери ? Для того чтобы разобраться в существующем многообразии инфузионных сред, необходимо четко знать преимущества и недостатки каждой из них.
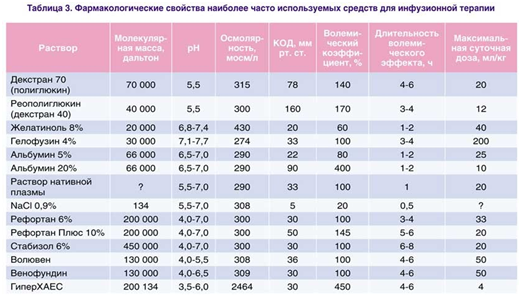
Фармакодинамический эффект плазмозаменителей зависит прежде всего от их гемореологического действия и определяется осмолярностью, молекулярной массой, вязкостью применяемых растворов, коллоидноосмотическим давлением (КОД) и т.д. (табл. 3).
Кристаллоиды
Основной компонент кристаллоидных растворов– хлорид натрия (NaCl), концентрация которого достигает 130-150 ммоль/л. Учитывая то, что данное содержание NaCl является изоосмолярным, КОД кристаллоидов – минимальное.
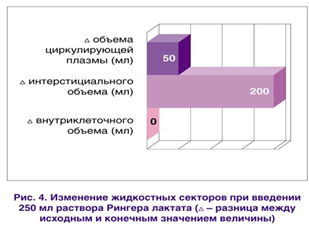
Каждые500 мл изоосмолярных кристаллоидных растворов, введенные внутривенно в течение первых 15 мин, вызывают 100% волемический эффект. Поскольку натрий является основным внеклеточным катионом, то при инфузии кристаллоидов в течение последующих 15 мин происходит его перемещение из сосудистого русла в интер—стициальное пространство (около 80%). Это и обусловливает непродолжительный эффект кристаллоидов (около 30 мин) и низкий (около 20%) волемический коэффициент [5, 18] (рис. 4).
При акушерских кровотечениях показано применение изоосмолярных, полиионных электролитов (раствор Рингера) с носителями резервной щелочности (Рингера лактат).
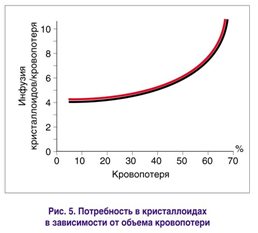
Спор о выборе инфузионной среды для восполнения ОЦК ведется уже многие годы. До сих пор нет четких данных о преимуществах использования коллоидных или кристаллоидных растворов. Существует мнение, что при кровопотере до 15% ОЦК его восполнение возможно с помощью лишь одних кристаллоидов [11, 12, 20]. При кровопотере свыше 15% ОЦК целесообразно использовать сочетание коллоидов и кристаллоидов. Хотя A.L. Cervera и соавт. (1974) считают, что восполнение ОЦК только кристаллоидами возможно и при кровопотере до 30% ОЦК, при этом объеме перевосполнение кровопотери должно быть пятикратным (рис. 5).
На наш взгляд, данная тактика инфузионной терапии наряду с определенными преимуществами имеет ряд недостатков (табл. 4).

В первую очередь она приводит к развитию отека легких, особенно у беременных и пациентов с сопутствующей кардиологической патологией. Также при переливании больших объемов NaCl существует риск развития гиперхлоремического ацидоза, который, к счастью, в практической работе возникает крайне редко.
В какойто степени ликвидировать недостатки массивной инфузии изотонического раствора NaCl позволяет использование его гипертонического раствора (7,5%). В сравнении с изотоническим раствором применение гипертонического раствора NaCl имеет ряд преимуществ. Прежде всего это возможность использования малых объемов для достижения того же клинического эффекта. Рекомендуемый объем – 4-5 мл/кг. По данным P.L. Marino (1997), у 250 мл 7,5% раствора NaCl такая же величина волемического коэффициента, как и у 1 л 5% альбумина. Кроме того, в сравнении с изоосмолярными солевыми растворами введение 7,5% раствора NaCl имеет более пролонгированный волемический эффект. Это сопровождается повышением сердечного выброса, уменьшением отека тканей и увеличением диуреза. Из неблагоприятных эффектов наблюдаются клеточная дегидратация и аритмии. Сюда же следует отнести и кратковременность эффекта (до 1 ч).
Глюкоза
Еще до недавнего времени во многих руководствах и учебных пособиях при описании тактики инфузионной терапии гиповолемического шока в качестве основной инфузионной среды фигурировал изоосмолярный раствор глюкозы. На протяжении многих лет и многочисленных исследований было доказано, что применение растворов глюкозы у критических больных приводит к ряду неблагоприятных последствий:
- в результате осмотического эффекта может вызвать клеточную дегидратацию [11];
- повышает продукцию СО2 [41];
- повышает продукцию лактата [27];
- увеличивает ишемическое повреждение головного мозга и других тканей, особенно у беременных с преэклампсией и эклампсией [39];
- способствует развитию гипогликемии у новорожденного в родах или при операции кесарева сечения [18].
Продукция лактата при инфузии растворов глюкозы возрастает на 5% у здоровых лиц и на 85% у критических больных. Это происходит даже при переливании 5% раствора глюкозы. Вода введенного раствора глюкозы 5% распределяется между сосудистым руслом (7-10%), интерстициальным (28%) и внутриклеточным (65%) пространствами [6, 18] (рис. 6).
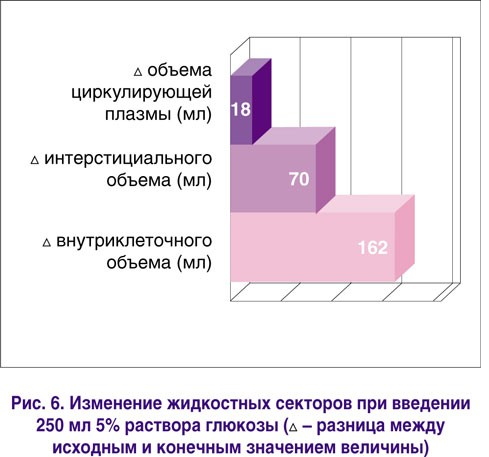
Таким образом, основная цель ИТТ – восполнение ОЦК при введении глюкозы – не выполняется, поскольку практически весь введенный объем жидкости распределяется во внутриклеточном и интерстициальном пространстве. Это может сопровождаться обширными отеками (рис. 7).
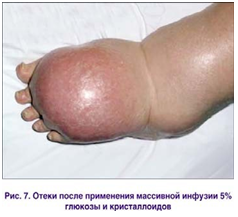
В настоящее время от рутинного применения глюкозы с целью восполнения ОЦК во время операции и у критических больных клиницисты отказались. Однако нельзя полностью отказываться от ее применения, в частности при гипогликемии, гипернатриемии, гипертонической дегидратации [15].
Коллоиды
На сегодняшний день имеется достаточный опыт использования коллоидных препаратов. Так, альбумин впервые был применен в Перл- Харборе в 1941 г., декстраны используются с 1944 г., препараты желатины – с 1962 г., а производные ГЭК – с 1972 г. За эти годы накоплен большой опыт их клинического применения, что позволяет уверенно говорить о преимуществах и недостатках каждой из этих групп препаратов.
Крупные молекулы коллоидов в норме не проникают через эндотелий. Поэтому они более эффективно восстанавливают ОЦК (за счет повышения КОД), намного дольше циркулируют в сосудистом русле чем кристаллоиды и способствуют увеличению доставки кислорода тканям. Однако как и любые другие инфузионные среды, они не лишены ряда недостатков – прежде всего имеют высокую стоимость. Особенно это актуально для альбумина, стоимость которого выходит за рамки четырехзначного числа (100 мл 20% альбумина ≈ 1000 грн). Кроме того, для этих лекарственных средств характерно развитие дозозависимой коагулопатии (по этому эффекту декстраны превосходят ГЭК) [46]. Не исключено также развитие отека легких, снижение уровня кальция (при введении альбумина) и развитие острой почечной недостаточности (при введении декстранов) [2].
Альбумин – высокоэффективный препарат для увеличения объема крови плазмы за счет быстрого повышения КОД. Альбумин – естественный белок, продуцируемый печенью, с молекулярной массой 69 000 Да, поэтому полностью удерживается при гломерулярной фильтрации. В норме в капиллярах альбумин в небольших количествах выходит в интерстициальное пространство. Нормальное содержание альбумина в плазме ~ 50 г/л, что соответствует ~ 60% белков плазмы и создает ~ 80% КОД (22 мм рт. ст. при нормальном КОД ~ 25 мм рт. ст.) [44].
Переливание 200 мл 20% альбумина увеличивает объем циркулирующей плазмы на 800- 1000 мл за счет перехода жидкости во внутрисосудистый сектор из интерстициального пространства. Это приводит к развитию гемодилюции и улучшает реологические свойства крови (рис. 8).
Раствор альбумина 20% связывает и инактивирует продукты метаболизма, токсины и провоспалительные цитокины, служит источником азота и длительно (до 11 сут) может удерживаться в сосудистом русле. Это способствует уменьшению летальности у больных с тяжелым сепсисом и острым респираторным дистресс-синдромом [44]
Кроме того, установлено, что он обладает противовоспалительным и антиоксидантным эффектами.
Несмотря на определенные положительные свойства альбумина, в последнее время его применяют с большой осторожностью вследствие сенсибилизации организма и угрозы развития тяжелых анафилактических реакций. Также последними исследованиями установлено, что при геморрагическом шоке 5% альбумин из-за нарушенной проницаемости капилляров быстрее «уходит» в интерстициальное пространство и может способствовать усугублению интерстициального отека и развитию отека легких [24]. Кроме того, установлено, что алюминий, содержащийся в растворах альбумина, обладает нейротоксическим эффектом (особенно у новорожденных) и вызывает лихорадку. Также имеется ряд доказательств об увеличении летальности у больных с политравмой. Именно поэтому от применения 5% альбумина на сегодняшний день рекомендуется воздержаться [44]. Считается, что при массивной кровопотере показанием к применению 20% альбумина является гипопротеинемия < 50 г/л либо снижение КОД < 15 мм рт. ст. При этом скорость введения альбумина не должна превышать 1-5 мл/мин.
Свежезамороженная плазма (СЗП) представляет собой смесь из трех основных белков: альбумина, глобулина и фибриногена. Концентрация альбумина в СЗП в 2 раза выше чем глобулина и в 15 раз выше чем фибриногена. За счет альбумина СЗП формируется 75% КОД. Рекомендуемая доза – до 20 мл/кг. Главным преимуществом СЗП перед другими коллоидами является содержание коагуляционных факторов (табл. 5).
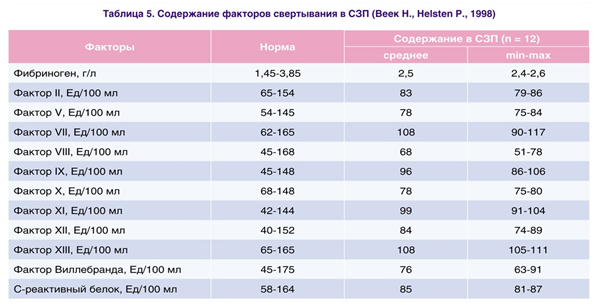
Кроме того, инфузия СЗП увеличивает КОД плазмы крови, способствует уменьшению интерстициального отека, препятствует развитию синдрома диссеминированного внутрисосудистого свертывания и является основным компонентом его терапии [34].
Основное показание к включению СЗП в план ИТТ – это восполнение дефицита факторов свертывания и коррекция синдрома диссеминированного сосудистого свертывания. Хотя вся плазма и проходит тщательный отбор, тем не менее имеется риск передачи инфекции. Например, частота инфицирования гепатитом С составляет один случай на 3300 переливаемых доз, гепатитом В – один случай на 200 000 доз, ВИЧ – один случай на 225 000 доз [28].
Также нельзя забывать и о риске развития синдрома TRALI – трансфузионного поражения легких (один случай на 5000 трансфузий). Это в первую очередь связано с наличием погибших донорских лейкоцитов в СЗП (1×109 в дозе) и последующей нейтрофильной активацией [18]. Следует помнить и о содержании 20 ммоль/л цитрата в СЗП, что также отрицательно влияет на пациентку. Поэтому в последнее время в странах Европы и Северной Америки более сдержанно относятся к широкому применению трансфузии СЗП. Не рекомендуется превышать одномоментную дозу введения СЗП более чем на 20 мл/кг [7].
Сpеди синтетических коллоидных pаствоpов в Украине чаще всего в клинической пpактике используют производные ГЭК, инфузионные сpеды на основе желатина (гелофузин) и декстpаны (pеополиглюкин).
Декстраны – полимеры глюкозы с преимущественно линейными цепями и несколькими разветвлениями, которые продуцируются из сахарозы бактерией Leuconostoc mesenteroides. Молекулярный вес «сырого» декстрана ~ 10 MДа. Используемые в клинике декстраны со средней молекулярной массой 40 000 и 70 000 Да получены путем гидролиза и фракционирования «сырых» декстранов. Декстран с молекулярной массой 1000 Да используется как гаптен для снижения частоты анафилактических реакций.
Декстраны начали применять в 40-х годах прошлого века. Наиболее распространенные 10% декстран 40 и 6% декстран 70 в растворе глюкозы или в изотоническом растворе натрия хлорида. Оба являются гиперонкотическими по отношению к плазме крови (КОД = 40 мм рт. ст.). Декстран 40 (реополиглюкин) обладает большим волемическим эффектом, но менее продолжительным [15].
Почти за 60-летний срок накоплен достаточный клинический опыт применения декстранов. Как оказалось, имеющихся недостатков у этой группы препаратов значительно больше чем преимуществ (табл. 6).
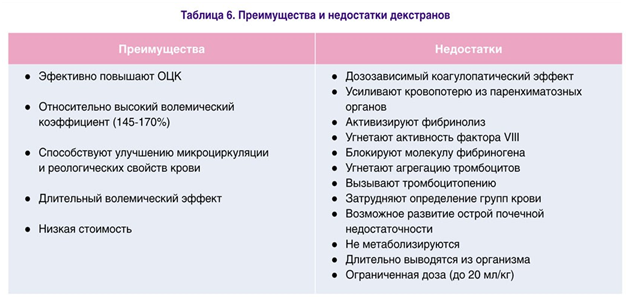
Это обусловливает их повсеместное ограничение в комплексной инфузионной терапии кровопотери. Практически на территории Украины используется только декстран 40 (реополиглюкин), а декстран 70 (полиглюкин) уже не применяется.
Pеополиглюкин является пpепаpатом низкомолекуляpного декстpана с массой около 30 000-40 000 Да, выпускается в виде 10% pаствоpа. Инфузия 500-750 мл пpепаpата способствует ликвидации стаза кpови, устpаняя окклюзионные наpушения микpоциpкуляции. В связи с меньшей молекуляpной массой pеополиглюкин покидает сосудистое pусло быстpее, чем полиглюкин. Так как 1 г пpепаpата связывает 20-25 мл жидкости, понятным становится его хороший волемический
эффект (170%). Однако в связи с огpаниченным вpеменем циpкуляции в сосудистом pусле (1,5-2 ч) пpепаpат используют не для восполнения ОЦК, а для улучшения pеологических свойств кpови. Пpи остpой кpовопотеpе до устpанения гиповолемии его не следует пpименять, поскольку улучшение микpоциpкуляции (особенно пpи быстpой инфузии) усугубит несоответствие ОЦК емкости сосудистого pусла. В сравнении с другими синтетическими коллоидами pеополиглюкин, как впрочем и остальные декстpаны, чаще приводит к развитию анафилактоидных pеакций, обычно быстpо купиpующихся. Кроме того, ежедневное введение относительно больших доз декстрана (500-1000мл/сут) создает угрозу повышения вязкости крови и агрегации эритроцитов [4].
Растворы ГЭК (рефортан, рефортан плюс, стабизол, ХАЕС-стерил, венофундин, волювен, гипер ХАЕС). ГЭК – природный полисахарид, получаемый из амилопектинового крахмала и состоящий из полимеризованных остатков глюкозы.
Фармакодинамические свойства ГЭК определяются молекулярной массой препарата, молярным замещением, степенью замещения и коэффициентом C2/C6. Молярное замещение – среднее число гидроксиэтильных групп, приходящихся на глюкозную единицу. Чем больше молярное замещение, тем дольше продолжается волемический эффект. Степень замещения – соотношение числа замещенных глюкозных единиц к их общему количеству. Гидроксиэтилирование крахмала препятствует его быстрому ферментативному расщеплению, увеличивает его способность удерживать воду в сосудистом русле и повышать КОД.
ГЭК разделяют на гетастрачи и пентастрачи. К гетастрачам относят препараты на основе кукурузного крахмала со средней молекулярной массой 450 000 Да (стабизол), к пентастрачам – со средней молекулярной массой 200 000 Да (рефортан, рефортан плюс).
Молекулы ГЭК способны закрывать поры в стенках капилляров и снижать уровень поражений, связанных с высокой проницаемостью эндотелия [49]. Растворы ГЭК в противоположность СЗП и растворам кристаллоидов могут уменьшать «капиллярную утечку» жидкости и отек тканей. В условиях ишемическореперфузионного повре- ждения растворы ГЭК снижают степень повреждения легких и внутренних органов, а также выброс ксантиноксидазы [50]. При гиповолемическом шоке инфузионная терапия с применением растворов ГЭК снижает частоту развития отека легких по сравнению с применением альбумина и физиологического раствора NaCl.
Из всех экспериментальных и клинических наблюдений следует вывод, что молекулы ГЭК связываются с поверхностными рецепторами и влияют на скорость синтеза молекул адгезии. Повидимому, снижение скорости синтеза молекул адгезии может происходить и вследствие инактивации ГЭК свободных радикалов и, возможно, снижения выброса цитокинов. [50]. Ни один из этих эффектов не обнаруживается при изучении действия растворов декстранов и альбумина. Таким образом, для растворов ГЭК характерен ряд по- ложительных свойств:
- они понижают степень повреждения эндотелия капилляров у больных с тяжелой травмой и улучшают функцию легких;
- уменьшают выраженность системной воспалительной реакции за счет снижения количества циркулирующих адгезивных молекул;
- не вызывают дополнительной активации системы комплемента;
- не влияют на экспрессию поверхностных антигенов иммунокомпетентных клеток.
- предотвращают развитие синдрома повышенной проницаемости капилляров;
- способствуют более высокому росту сердечного индекса, DO2, лучшему кислородному балансу тканей за счет увеличения объема внутрисосудистой жидкости;
- имеют достаточно высокий волемический коэффициент (100-140%);
- улучшают реологические свойства крови за счет снижения адгезии и агрегации тромбоцитов;
- не передают инфекции;
- имеют низкую анафилактогенность (0,0004%);
- стимулируют функцию почек.
Как и для любого другого препарата, растворы ГЭК имеют и ряд недостатков. Прежде всего следует отметить присущий им (также как и декстранам, но в значительно меньшей степени) дозозависимый коагулопатический эффект(табл. 7) [42,43].
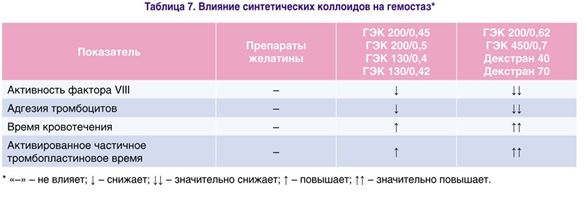
Этообусловленотем, что препараты ГЭК за счет «силиконизирующего» эффекта снижаютадгезию и агрегацию тромбоцитов, а также активность факторов VIII и IX, антитромбина III и фибриногена[9]. В связи с этим необходимо строго придерживаться дозировок введения этих препаратов. Так, во Франции и Германии для 6% ГЭК с молекулярной массой/степенью замещения 130 000/0,4 (венофундин, волювен) максимально допустимой дозой считают 50 мл/кг, для ГЭК 200 000/0,5 (рефортан, ХАЕС—стерил) – 33 мл/кг, а для 10% ГЭК – 200 000/0,5 (рефортан плюс) и 450 000/0,7 (стабизол) – 20 мл/кг. Введение максимальной суточной дозы 6% ГЭК (200 000/0,5) в течение 4,5 ч для возмещения кровопотери обусловливало увеличение на 20% числа коагулопатических кровотечений и объема кровопотери на 25% [14]. Кроме того, к отрицательным эффектам ГЭК относится и повышение в двтри раза уровня амилазы в течение первых дней после инфузии. На 5-7-е сутки уровень амилазы возвращается к норме [15]. Учитывая вышеизложенное, мы считаем, что независимо от поколения ГЭК их суммарная доза не должна превышать более 1 л.
В 2008 г. в Украине зарегистрирован новый препарат – гипер ХАЕС. Это комбинированный раствор, содержащий 7,2% NaCl и 6% ГЭК 200/0,5, который удачно совмещает в себе позитивные свойства, присущие гипертоническому раствору NaCl и растворам ГЭК. Препарат очень удобен для проведения так называемой «малообъемной ресусцитации» (small volume resuscitation) – увеличения ОЦК за счет перераспределения жидкости внутриклеточного и интерстициального пространства при быстром введении малого объема (4 мл/кг) 7,2-7,5% NaCl/коллоидного раствора. Метод привлекателен из—за быстроты мобилизации
эндогенныхжидкостей, особенно из внутриклеточного пространства, представляющего собой огромный резервуар, содержащий около 25 л воды. ГиперХАЕС вводится однократно в течение 2-5 мин. Сразу после введения препарата необходимо начать стандартную плазмозамещающую терапию. С учетом высокой осмолярности (2464 мосм/л) препарат следует вводить после рождения ребенка.
Препараты желатины. Среди плазмозаменителей данной группы широкое распространение получили лекарственные средства желатиноль и модежель.
В последние годы разработаны новые препараты на основе желатина, и одной из разновидностей модифицированного жидкого желатина является гелофузин фирмы B. Braun Melsungen AG (Германия). Этот препарат представляет собой 4% раствор модифицированного жидкого желатина в растворе NaCl. Желатин производят из коллагеновой ткани (хрящей) крупного рогатого скота методом термической деградации, гидролиза и сукцинирования. По этой причине в некоторых работах раствор называют сукцинированным желатином. Это плазмозамещающий раствор с периодом полувыведения около 9 ч, имеющий среднюю молекулярную массу 30 000 Да, КОД 453 мм водн. ст. или 33,3 мм рт. ст. и осмолярность 274 мосм/л [14]. Большая часть гелофузина выводится почками, остальная – через кишечник. Ионный состав гелофузина стабилен и сильно отличается от хорошо известного желатиноля (табл. 8).
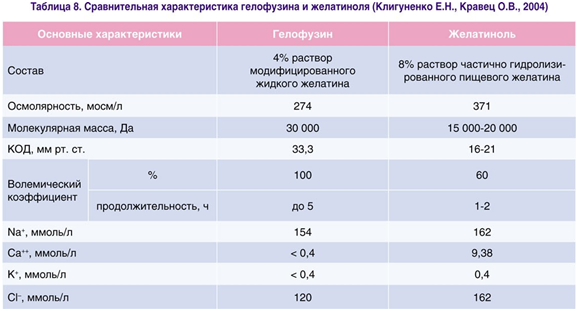
Гемодинамические эффекты гелофузина сравнимы с ГЭК [19]. Даже в больших объемах он не оказывает специфического влияния на гемостаз, хотя при введении в больших объемах может способствовать коагулопатии разведения. Максимальная суточная доза – до 200 мл/кг. Анафилактоидные реакции, связанные с введением гелофузина, встречаются редко – один случай на 6000-13000 введений, в основном у предрасположенных к аллергии пациентов [31].
Положительные эффекты гелофузина:
- не влияет специфически на систему гемостаза;
- имеет высокий волемический коэффициент (100%);
- технология изготовления исключает риск передачи инфекции;
- малая анафилактогенность;
- возможность применения больших доз (до 15 л/сут);
- низкая стоимость;
- не вызывает развития осмотического нефроза;
- увеличивает фильтрационную способность почек;
- уменьшает количество переливаемой плазмы и эритроцитарной массы.
Отрицательные эффекты гелофузина:
- способствует увеличению выброса интерлейкина-l-β, который стимулирует воспалительные изменения эндотелия;
- приводит к снижению концентрации фибронектина с последующим увеличением проницаемости эндотелия.
Следует отметить, что в странах ЕС в структуре потребления инфузионных сред использование препаратов желатины занимает 26%, производных ГЭК – 21%, а декстранов – лишь 1%. Подобных данных по Украине мы не имеем, однако наш опыт свидетельствует, что эта структура будет несколько иной, т.е. использование декстранов занимает одно из ведущих мест. Предпочтение среди коллоидов ппрежнему отдается декстранам, в меньшей степени – производным ГЭК илишь в небольшой степени – препаратам желатины.
Выводы
- Многочисленные исследования позволяют утверждать, что модифицированный жидкий желатин и ГЭК являются прекрасным заменителем человеческого альбумина в коллоидном восполнении объема.
- Модифицированный жидкий желатин и ГЭК в 1,5-2 раза уменьшают объем и сроки инфузий свежезамороженной плазмы и эритроцитарной массы.
- Терапевтические возможности модифицированного жидкого желатина в определенной степени (объемный эффект, продолжительность действия) сопоставимы с 6% растворами ГЭК.
- У больных с высоким риском полиорганной недостаточности, преэклампсией, сепсисом, острым респираторным дистресс-синдромом предпочтение следует отдавать растворам ГЭК (волювену, венофундину, рефортану, рефортану плюс).
- В условиях ограниченного выбора инфузионных сред возможно построение эффективной программы коррекции синдрома острой гиповолемии на основе ГЭК и модифицированного жидкого желатина.
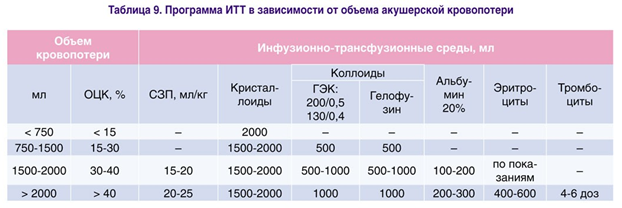
Рекомендуемая программа проведения ИТТ при массивной акушерской кровопотере выглядит следующим образом (табл. 9).









Комментировать