Инсульт головного мозга у детей: полная описательная «картина». Вопросы цереброкардиальных нарушений среди взрослого населения.
Волосовец А.П., проф.; Кривопустов С.П., проф.,
Национальный медицинский университет им. А.А. Богомольца, г. Киев
Вопросам цереброкардиальных нарушений среди взрослого населения в настоящее время уделяется самое пристальное внимание. Между тем анализ литературных и клинических данных показывает, что указанные заболевания в детском возрасте не являются редкостью и требуют тщательного изучения. Важность проблемы подчеркивается высокой социальной значимостью, недостаточной осведомленностью о ней педиатров, семейных врачей, неврологов, кардио ревматологов и врачей других педиатрических специальностей.
Инсульт головного мозга
Нарушения мозгового кровообращения (НМК) представляют собой одну из самых актуальных проблем современной медицины. Ежегодно НМК регистрируются у 6 млн человек в мире, у 700-750 тыс. — в США, свыше 450 тыс. — в России, около 175 тыс. — в Украине [1], летальность при этом в острой стадии составляет около 30-35% [15]. Показатель смертности от цереброваскулярных заболеваний в Украине является одним из самых высоких в мире, в несколько раз выше, чем в других странах Европы, и имеет тенденцию к дальнейшему повышению и «омоложению». Недостаточно учитываются ранние формы НМК, не всегда в поле зрения практического врача оказываются преходящие церебральные ишемии («немые» инсульты), а терминологическая разноречивость еще более затрудняет суждения о частоте мозговых сосудистых нарушений.
По данным В.Г. Бабина (2004), удельный вес пациентов, перенесших ишемический инсульт в возрасте 15-20 лет, составляет 0,8% [1]. В то же время установление причин острых нарушений мозгового кровообращения у подростков и детей вызывает значительные затруднения, в связи с чем мозговые инсульты в детском возрасте в 20-30% случаев проходят под разнообразными ошибочными диагнозами, а в 1/3 случаев установленного диагноза не удавалось выяснить причину возникновения инсульта [20].
В детском возрасте нередко встречаются типичные, не вызывающие сомнения НМК. Чаще они бывают преходящими, но могут и многократно повторяться. Среди органических поражений мозга их частота колеблется от 3 до 5%. По данным статистического анализа (клиника Мейо Робсона, США), с 1965 по 1974 год выявлено 2,52 случая инсульта на 100 тыс. детского населения в год. В Исландии этот показатель составляет 3,1 на 100 тыс. детей в год (G. Golden, 1985). По данным J.Kurtzke (1969), I.M. Moriyame, D.E. Krueger, G. Stamlor (1971), мозговые инсульты чаще встречаются при рождении и в течение первого года жизни, а в возрасте до 5 лет их частота больше, чем у детей 5-14 лет. Так, в США на каждый миллион детей ежегодно приходится 15 смертей от цереброваскулярных болезней в возрасте до 5 лет, а в возрасте 5-14 лет — 7.
По данным С.К. Евтушенко и соавт оров (Украина), частота инсультов у детей составляет 2,5-4,2 на 100 тыс. детского населения [9]. Однако нарушения мозгового кровообращения у детей встречаются значительно чаще, чем считается. Учитывая, что у большого количества детей чаще встречаются упорные головные боли, необъяснимые обморочные состояния и другие формы церебральной сосудистой неполноценности, проблемы детской цереброваскулярной патологии заслуживают самого пристального внимания и тщательного изучения.
Важно помнить о значении врожденных микрои макроаномалий сосудов головного мозга у недоношенных детей с преи перинатальной патологией в генезе эпилепсии, слабоумия, церебрального паралича, задержки психомоторного и речевого развития [9].
Известно, что этиология и патогенез НМК у детей и взрослых существенно отличаются друг от друга [6]. С.К. Евтушенко и соавт. (2003) акцентируют внимание на мультифакториальности инсульта у детей и приводят следующие причины инсультов у детей.
Основные цереброваскулярные заболевания и патологические состояния, приводящие к инсульту у детей(С.К. Евтушенко, О.С. Евтушенко, Ю.М. Перепечаенко, М.А. Москаленко 2003)
I. Внутричерепные кровоизлияния (внутримозговые и субарахноидальные) — геморрагический инсульт.
- Артериовенозные мальформации и аневризмы.
- Артериальная гипертензия.
- Патология крови:
— геморрагический васкулит (болезнь Шенлейна
— Геноха);
— гемофилия;
— гемоглобинопатия;
— апластическая анемия;
— лейкозы;
— осложнения антикоагулянтной терапии;
— токсические или инфекционные васкулопатии;
— ДВС-синдром и др.
3.1. Коагулопатии:
— дефицит кофактора гепарина Ш;
— дефицит протеина С;
— дефицит антитромбина Ш;
— дефицит протеина S;
— дефицит плазминогена и др.
3.2. Тромбоцитопатии.
3.2.1. Наследственные и врожденные формы:
— мембранные и внутриклеточные аномалии, дефицит тромбоксансинтетазы, афибриногенемия, аномалии коллагена и субэндотелия и др.,
— функционально-морфологические формы (нарушение агрегации тромбоцитов, дефицит гранул тромбоцитов и их хранение и др.).
3.2.2. Приобретенные тромбоцитопатии:
— гемобластоз;
— В12 — дефицитная анемия;
— уремия;
— миелопролиферативные заболевания;
— цинга;
— лекарственные тромбоцитопатии и др.
3.2.3. Тромбоцитопении:
— аллоиммунные и трансиммунные (проникновение антител от матери к ребенку);
— гетероиммунные (чаще под влиянием вируса);
— аутоиммунные (например, коагуляционные антифосфолипидные тромбоцитопении);
— болезни печени;
— мальабсорбция, вызывающая недостаток витамина К, и др.
II. Ишемический инсульт.
1. Тромботические инсульты.
1.1. Патология сосуда:
— врожденная аплазия или стенозирование;
— извитость, перегиб;
— артериосклероз (прогерия) и др.;
— системные и церебральные артерииты;
— болезнь Такаясу;
— болезнь Кавасаки;
— болезнь Бехчета;
— системная красная волчанка;
— узелковый периартериит;
— гранулематоз Вегенера;
— криоглобулинемический васкулит;
— листериозный аретриит;
— сифилитический артериит и др.
1.2. Тромбоз синусов и мозговых вен:
— внутричерепной и внутрипозвоночный флебит и тромбофлебит;
— инфекции области шеи, ушей, параназальных синусов;
— ретрофарингеальный абцесс;
— воспалительные заболевания кишечника;
— полицитемия;
— менингит;
— тромботическая тромбоцитопения;
— метастазы опухолей;
— нейрофакоматозы;
— тромбозы при применении метотрексата;
— дегидратация или гиперосмолярность.
1.3. Экстраартериальные поражения:
— краниометафизарная дисплазия;
— опухоли основания черепа;
— фибромышечная дисплазия.
1.4. Ангиоматозные дисплазии:
— синдром моя-моя идиопатический;
— синдром моя-моя симптоматический;
— нейрофиброматоз (болезнь Реклингхаузена, преимущественно тип 2);
— туберозный склероз.
1.5. Другие сосудистые заболевания:
— синдром Снеддона — антифосфолипидассоцированный церебральный васкулит (инсульт + кожное сетчатое ливедо + тромбоцитопения + антифосфолипидные антитела);
— болезнь Дегоса.
1.6. Вирусные заболевания:
— herpes zoster (альтернирующая гемоплегия);
— ветряная оспа;
— вирус Коксаки А9;
— краснуха;
— грибковые заболевания (мукоромикоз);
— нейроСПИД.
1.7. Необычные и раритетные причины тромботического инфаркта у детей:
— рентгеновское облучение;
— чрезмерное использование назальных противоотечных средств;
— ужаление осы;
— токсикомания;
— кокаинизм;
— длительное применение противозачаточных средств у девочек-подростков (тромбозы маточных и церебральных сосудов);
— непосредственное прорастание и сдавливание опухолью;
— метастазирование.
2. Эмболические инсульты.
2.1. Кардиогенные:
— аритмии (идиопатические и постмиокардитические);
— фибрилляция предсердий;
— бактериальный эндокардит (острый или подострый);
— ревмокардит;
— врожденные пороки сердца со сбросом крови справа налево;
— пролапс митрального клапана;
— слабость синусового узла;
— миксома предсердий;
— миокардит.
2.2. Плацентарные:
— инфаркты плаценты;
— неонатальная антифосфолипидная церебральная васкулопатия (вследствие антифосолипидного синдрома матери).
2.3. Септические:
— осложнения бактериальной пневмонии или абцесса легких;
— опухоли легких;
— катетеризация пупочной вены и др.
2.4. Жировые:
— осложнения переломов и жировых инфузий.
2.5. Воздушные:
— ятрогенные и неятрогенные.
3. Гемодинамические ишемические инсульты:
— выраженная кардиомиопатия (различного генеза);
— тяжелая патология сердца, сочетающаяся с врожденно-приобретенными сужениями магистральных сосудов головы;
— хронические истощающие заболевания.
4. Ишемические инсульты метаболического генеза:
— митохондриальная энцефаломиопатия, рецидивирующий лактат-ацидоз, инсультоподобные эпизоды — MELAS-синдром (Mitochondrial encephalopaty lactate acidosis stroke);
— гомоцистеинурия;
— сахарный диабет;
— болезнь Менкеса;
— болезнь Фабри;
— болезнь Лея;
— церебральная амилоидная ангиопатия;
— органическая ацидемия;
— карбогидратная недостаточность;
— глюкопротеиновая недостаточность;
— дислипопротеинемия;
— хроническая недостаточность функции поджелудочной железы (рецидивирующие ацетонемические состояния);
— метаболический ацидоз и др.
5. Заболевания, которые могут проявляться ишемическим или геморрагическим инсультом (либо их трансформацией):
— синдром Элерса — Данло (преимущественно типы 3 и 4);
— синдром Марфана;
— Pseudoxantoma elasticum;
— гипермобильный синдром как недифференцированное проявление патологии соединительной ткани: MASS-фенотип (Mitral valve, Aorta, Skeleton, Skin);
— факоматоз (Гиппеля — Линдау, Стерджа — Вебера).
Анализ литературных данных убедительно свидетельствует о том, что экстрацеребральные причины играют не меньшую роль в развитии тяжелых церебральных сосудистых нарушений, чем интрацеребральные. В частности, патология экстракраниальной части позвоночных артерий приводит к таким же тяжелым состояниям, что и тромбоз и стеноз шейной части сонных артерий, при этом имеет место исключительная ранимость внечерепной части позвоночных артерий, особенно в преи перинатальный периоды, и возможность развития хронической натально обусловленной неполноценности гемодинамики в более старшем возрасте [12, 16].
Геморрагический инсульт развивается вследствие разрыва кавернозных гемангиом, на долю которых приходится 5-13% врожденных сосудистых аномалий. Он встречается при аневризме сосудов головного мозга, дуральной артериовенозной аневризме, симптоматических гипертензиях (при заболеваниях почек, альдостероме, феохромоцитоме, гиперкортицизме, коарктации аорты). Цереброваскулярная патология является в 18% случаев осложнением первичного гиперальдостеронизма [18].
В 1/2-1/3 случаев причиной инфаркта мозга у детей и подростков оказываются тромбоэмболии в основном из левых отделов сердца, при эндокардите, пороках клапанов левых отделов сердца (порок митрального клапана, клапанов аорты) [13]. Описаны случаи ишемического инсульта (ИИ) с множественными аномально расположенными хордами (как кардиогенная причина) [1], когда причиной был ПМК (в 5-7% случаев). Описана миксома сердца, приведшая к эмболии сосудов мозга. В патогенезе мозговых эмболий могут иметь значение декомпенсация сердечной деятельности, застой крови, нарушение сердечного ритма, бактериальный эндокардит, цианотические пороки сердца, аритмии сердца [9].
В ряде случаев возможно одновременное развитие инфаркта миокарда и ИИ, что указывает общность их патогенеза [10]. Существуют данные, что у 25% пациентов с митральным стенозом отмечались «немые» инфаркты мозга. Более частое «симптомное» ишемическое поражение мозга отмечено у пациентов с митральным (45%) и сочетанным (35%) пороками сердца, что обусловливало частое возникновение мерцательной аритмии. Особая группа эмболий сосудов головного мозга — парадоксальная эмболия (в 15-30%) у лиц с открытым овальным окном. Описаны случаи парадоксальной эмболии сосудов головного мозга у лиц молодого возраста на фоне артериовенозных мальформаций сосудов легких.
Тромбоз сонных артерий может быть вызван прямой травмой: колотыми, рваными, огнестрельными ранениями шеи, попытками удушения или при переломах черепа. Повреждение сонной артерии может произойти, в частности, во время тонзиллэктомии.
Среди причин развития инсультов у детей наряду с врожденными и приобретенными поражениями сосудов подчеркивается значительная роль нарушений коагулирующих и антикоагулирующих свойств крови [9].
В 3/4 случаев ИИ — дебют первичного антифосфолипидного синдрома (ПАФС). Одним из вариантов ПАФС с ИИ являлся синдром Снеддона с положительными антифосфолипидными антителами — сочетание цереброваскулярных нарушений ишемического характера и распространенного ливедо на коже при отсутствии признаков диффузных заболеваний соединительной ткани [12].
По данным С.К. Евтушенко и соавторов, этиология привычного невынашивания, спонтанных выкидышей, а также внутриутробной гипоксии плода не только обусловлена внутриутробной инфицированностью, эндокринной недостаточностью, но в 45% случаев связана с антифосфолипидным синдромом у матери, приводящим к микрои макротромбозу сосудов плаценты и матки (синдром Снеддона). Он проявляется также изменениями на коже ( livedo reticularis — приобретенные синеватофиолетовые ветвящиеся пятна сосудистого генеза на коже в сочетании с поражением клапанов сердца), тромбоцитопенией, анемией, патологией сердца (клапанные вегетации), почечным синдромом с небольшой протеинурией, хроническими язвами ног, легочной и артериальной гипертензией, асимптомными некрозами костей, различными неврологическими проявлениями (эпилептический синдром, хорея, мигренеподобные головные боли и др.) и наличием антифосфолипидных антител.
В литературе описываются «метаболические» инсульты у детей [9,18,19] с тяжелой формой диабета, хроническими заболеваниями поджелудочной железы, печени, после перенесенного тяжелого алкалоза или ацидоза, после тяжелых оперативных вмешательств на кишечнике, после наркоза, после контакта с токсическими веществами.
Известна семейная гемиплегическая мигрень (CADASIL ) с семейным анамнезом мигрени, с инфарктом мозга, прогрессирующим неврологическим дефицитом, развитием деменции (возможны семейные и спорадические случаи). Синдром MELAS (синдром митохондриальной энцефалопатии с лактат-ацидозом) [18] характеризуется головными болями, инсультами (у 99% пациентов с этой патологией), низкорослостью, эпилептическими приступами, деменцией, в крови отмечается повышенное содержание лактата, биопсия мышц выявляет «неистово красные» мышечные волокна с точковой мутацией митохондриальной ДНК [12].
В группе мезодермальных дисплазий (MASSфенотип) ведущими являются гипермобильный синдром и крайние его проявления — синдром Элерса — Данло (12 типов) и синдром Марфана. Сочетание повышенной эластичности и растяжимости тканей, гипермобильности, дизэмбриогенетической стигматизации (пролапс митрального клапана, слабость синусового узла и др.), хрупкость и дилатированность сосудов, тромбоцитопении, аномалии коллагена и субэндотелия могут привести к ишемическому, а в ряде случаев и к геморрагическому инсульту [9]. У этих же больных, как отмечают авторы, реален и эмболический инсульт, источник которого — пролапс митрального клапана.
Общей особенностью проявления инсульта в старшей возрастной группе детей является остро развившаяся гемиплегия, которая нередко сопровождается нарушением полей зрения и расстройствами речи [9]. Во время ИИ повышается артериальное давление, усиливается головная боль. У детей младшего возраста болезнь чаще проявляется общемозговыми симптомами (рвотой, судорогами, комой и выходом из этого состояния в виде гемиплегии и афазии) [9,16]. У детей с кровоизлияниями в головной мозг в остром периоде заболевания отмечается лейкоцитоз, ускоренная СОЭ. На ЭЭГ отмечаются межполушарная асимметрия, низкоамплитудный a-ритм. На РЭГ определяется сосудистая дистония с тенденцией к гипертонусу и венозному застою в бассейне нарушения мозгового кровообращения.
В диагностике инсульта в детском возрасте имеют значение также ультразвуковая допплерография, электроэнцефалографическое картирование с видеомониторингом ЭЭГ, магнитно-резонансная томография в сосудистом режиме в случае осложненного инсульта и судорог, артериография с магневистом, компьютерная томография [9].
В лечении применяют гипотензивную терапию (при повышенном АД), сосудорасширяющие средства, дегидратацию, антикоагулирующие средства (при ИИ) и др. [11].
Инфаркт миокарда
В настоящее время большинство педиатров и кардиологов традиционно считают инфаркт миокарда (ИМ) в детском возрасте явлением редким. Однако литературные данные говорят о том, что это заболевание у детей не является казуистикой и последние годы диагностируется все чаще [2,14].
Проявления острой сердечной недостаточности вследствие ИМ, нередко приводящие к смерти, истолковываются в пользу других, более изученных сердечных заболеваний.
Далеко не всегда при патоморфологическом исследовании тщательно исследуются признаки острой либо давней ишемии миокарда и состояние коронарного русла. Еще в 1960 году W. Blanc показал, что при аутопсии детей, умерших от ВПС, в 75% случаев присутствовали признаки перенесенного ИМ, при этом половина из них, по ретроспективному анализу ЭКГ, могла быть диагностирована клинически.
В настоящее время в США Национальная медицинская библиотека специально регистрирует каждый случай ИМ у детей, описанный в мировой литературе [14]. В целом частота ИМ у детей в популяции неизвестна. В отличие от взрослых, у которых причиной развития инфаркта миокарда (ИМ), внезапной смерти (ВС) в 91,7% случаев является атеросклеротическое поражение коронарных артерий (КА) (Е.И. Чазов, 1992), у детей и подростков, несмотря на большую распространенность факторов риска атеросклероза, атеросклеротическое поражение КА встречается казуистически редко, за исключением случаев семейной гиперлипидемии.
ИМ в детском возрасте имеет мультифакториальную этиологию. Может быть, поэтому у педиатров в настоящее время отсутствует настороженность при постановке этого диагноза. Анализируя литературный материал, можно выделить несколько вариантов поражения КА, обусловливающих ИМ в детском возрасте [2, 4]:
— врожденные аномалии КА;
— воспалительные и дистрофические заболевания, функциональные нарушения кровотока, тромбоэмболия КА, травма сердца, поражение КА при других заболеваниях;
— функциональные нарушения коронарного кровотока.
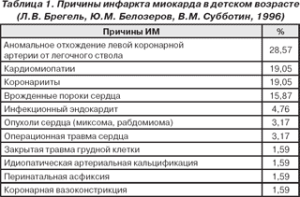
Наиболее частая причина ИМ у детей — врожденные аномалии КА. Их частота составляет 0,3% общего числа невыборочных аутопсий и 1,1 на 1000 случаев ВПС [4]. Истинная частота встречаемости врожденных коронарных аномалий неизвестна. Приблизительно для взрослой популяции она оценивается в 2% [5], и, следовательно, у детей частота их должна быть еще выше. Многие коронарные аномалии могут протекать у детей бессимптомно, вплоть до момента смерти, которая у 45% из них бывает внезапной [5].
Рабочая классификация врожденных коронарных аномалій (Л.В. Брегель, Ю.М. Белозеров, В.М. Субботин 1996)
1. Аномалии устья:
а) гипоплазия устья;
б) фиброзная эндопролиферация устья (фиброзные «гребни» устья);
в) атрезия устья;
г) тангенциальное отхождение коронарной артерии.
2. Эктопическое отхождение коронарной артерии:
а) аномальное отхождение коронарной артерии от легочного ствола (аномалия отхождения КА от легочной артерии (синдром Бланда — Уайта — Гарленда); аномальное отхождение правой коронарной артерии от легочной артерии, аномальное отхождение единой коронарной артерии от легочной артерии);
б) аномальное отхождение коронарной артерии от аорты:
— отхождение коронарной артерии от некоронарного синуса;
— отхождение коронарной артерии выше уровня синуса;
— аномальное отхождение коронарной артерии от противоположного коронарного синуса (аномальное отхождение левой коронарной артерии от правого коронарного синуса; аномальное отхождение правой коронарной артерии от левого коронарного синуса);
в) аномальное отхождение коронарной артерии от других коронарных артерий;
г) аномальное отхождение коронарной артерии от экстракардиальных сосудов (подключичной, бронхиальной и др.); д) аномальное отхождение коронарной артерии от желудочковой камеры.
3. Интрамуральный ход коронарной артерии («ныряющие» коронарные артерии).
4. Аномалии дистального соединения коронарных артерий (коронарные фистулы):
а) фистула коронарной артерии в правые сердечные камеры (артериовенозные);
б) фистула коронарной артерии в левые сердечные камеры (артерио-артериальные);
в) фистула коронарной артерии в экстракардиальные сосуды (коронарно-бронхиальная, коронарноперикардиальная и другие).
5. Аномалии числа коронарных артерий:
а) единственная правая коронарная артерия;
б) единственная левая коронарная артерия.
6. Гипоплазия коронарных артерий.
Из наиболее частых причин развития ИМ вследствие врожденных аномалий КА, которые составляют 25% от всех случаев ИМ [2] и 0,25-0,5% от всех ВПС [4] следует отметить аномальное отхождение левой коронарной артерии от легочной (АОЛКА от ЛА) — синдром Бланда — Уайта — Гарленда.
В большинстве случаев аномалия наблюдается изолировано, реже сочетается с ВПС (дефектом межжелудочковой перегородки, атриовентрикулярной коммуникацией, общим артериальным стволом) [5]. Выделяют два типа синдрома Бланда — Уайта — Гарленда («детский» — с малым количеством анастомозов и плохим прогнозом, и «взрослый», при котором имеется большое количество анастомозов, обеспечивающих длительное выживание), а также, согласно функциональному подходу, три стадии течения (декомпенсация, субкомпенсация и компенсация) [4, 5, 14].
Чаще АОЛКА от Л манифестируется в первые 3 месяца жизни ребенка и проявляется задержкой физического развития, признаками левожелудочковой недостаточности, часто в сочетании с митральной регургитацией [5], эластофиброзом эндокарда.
ЭКГ-паттерн данного порока: выраженное (патологическое) отклонение электрической оси сердца влево из-за блокады передней левой ветви пучка Гиса (в 50% случаев); характерный глубокий уширенный зубец Qв отведениях I, aVL, V56, максимально в aVL. В стадии декомпенсации такие изменения часто сочетаются с подъемом сегмента STвыше изолинии на 3-6 см и уменьшением амплитуды зубца R, что соответствует картине острого ИМ. Часто у детей с застывшими глубокими зубцами Q, но без подъема сегмента ST, на аутопсии отмечаются следы ранее перенесенного ИМ, распространенный кардиосклероз и гипертрофия межжелудочковой перегородки [4]. Имеет место также инверсия зубца Tв отведениях I, aVLи левых грудных. Диагностическую значимость при АОЛКА от ЛА имеет «провал» зубцов R(морфология комплекса становится типа rS, QS, Qr) в отведениях V34 при нормальных зубцах Rв отведениях V1, а также в отведениях V5-7. В стадии субкомпенсации сохраняются признаки гипертрофии миокарда ЛЖ с субэндокардиальной ишемией (смещение на 2-4 см ниже изолинии сегмента ST,aVL, V56, наличие отрицательного зубца T), зубец Qостается глубоким в отведении I , V56.
Почти 2/3 больных без лечения умирают на первом году жизни, 12-15% доживают до старшего возраста, из них в дальнейшем половина погибает внезапно после физической нагрузки или психической травмы [4]. Продолжительность жизни зависит от выраженности межкоронарных анастомозов, « steal»-синдрома, кардиосклероза и фиброэластоза, гемодинамически значимой митральной недостаточности.
У подростков аномалия протекает по «взрослому» типу и выявляется случайно. Описаны случаи, когда этот тип синдрома Бланда — Уайта — Гарленда «случайно» выявлялся в процессе обследования у детей с идиопатической кардиомегалией или по поводу систолического шума недостаточности митрального клапана [2,5].
Ко второй группе причин ИМ у детей относят приобретенные заболевания и травмы коронарных артерий.
В литературе описываются случаи ИМ у детей при инфекционном эндокардите (локализация поражения — на эндокарде аортального клапана) вследствие эмболии одной из ветвей КА оторвавшейся вегетацией. Реже ИМ возникает вследствие инфекционного коронарита (вирусного и бактериального) или прикрытия устья коронарной артерии вегетацией со створки аортального клапана. Описаны также случаи ИМ при скарлатине, тифе, сальмонеллезе [14]. Существуют работы, где приводятся данные о персистенции хламидийной инфекции у пациентов с ИМ [17].
ИМ может возникнуть на фоне ревматических и неревматических кардитов, геморрагического васкулита, тромбоцитопенической пурпуры, а также может встречаться при идиопатической артериальной кальцификации, инсулинозависимом диабете (замедление кровотока на фоне микроангиопатий приводит к диффузному кардиосклерозу и аневризме). Ангинозный статус с выраженными ишемическими нарушениями встречается в 19% случаев при эластичной псевдоксантоме (синдроме Гренблата — Страндберга) — наследственном заболевании с диффузным поражением соединительной ткани сосудов многих органов и систем. Причинами подострых и хронических коронаритов может быть узелковый периартериит, системная красная волчанка, неспецифический аортоартериит, гигантоклеточный артериит, синдром Такаясу, болезни Кавасаки [2, 3, 5, 7, 14].
Болезнь Кавасаки (слизисто-кожно-лимфонодулярный синдром) — первичный системный васкулит неизвестной этиологии з преимущественным поражением коронарных артерий. Встречается в основном в раннем детском возрасте: от 2 месяцев до 8 лет (пик заболеваемости — до 2летнего возраста). Соотношение мальчики : девочки = 1,4 : 1. Основными критериями в постановке диагноза являются лихорадка неизвестной этиологии, резистентная к антибиотикам длительностью минимум 5 дней, и наличие следующих 4 из 5 признаков: двусторонняя инъекция сосудов конъюктивы, острое воспаление слизистых полости рта (гиперемия, диффузная эритема, «малиновый» язык, сухость и трещины губ, катаральная ангина), цервикальная лимфаденопатия > 1,5 см в диаметре, изменения в периферических отделах конечностей (гиперемия и отечность ладоней и стоп, шелушение). Может встречаться неполный синдром Кавасаки — при менее 4 признаков. Кардиоваскулярные симптомы чаще диагностируются на 2-й неделе от начала заболевания. Поражение сердца может быть по типу миокардита (в острой стадии), коронарита с развитием множественных, иногда гигантских аневризм (на 6-8-й неделе), стенозов и окклюзий КА, что в последующем может привести к развитию ИМ, и даже в отдаленные сроки (6 лет от начала заболевания и более). В постановке диагноза значительно помогает проведение эхокардиографии.
Причиной ИМ в детском возрасте могут быть закрытые травмы грудной клетки, сопровождающиеся субинтимальными кровоизлияниями и формированием хронических полных или частичных аневризм ЛЖ; операционные травмы сердца, при которых ранение коронарных артерий может привести к их эмболизации [5]. В литературе описан случай развития ИМ у 13-летнего мальчика во время интенсивной физической нагрузки через 3 года после закрытой травмы грудной клетки (субинтимальное кровоизлияние с умеренной окклюзией левой коронарной артерии). Поэтому дети, перенесшие закрытые травмы (даже нетяжелые), нуждаются в динамическом наблюдении и обследовании (в течение 3-6 лет после травмы). Трансмуральный ИМ описан при семейной тромбофилии [14], атеросклерозе КА на фоне наследственно обусловленной гиперхолестеринемии [2, 14].
Эмболия в КА — редкая причина ИМ в детском возрасте, однако и она возможна во время хирургического вмешательства при иссечении кальцифицированного митрального клапана. Она развивается у 9% больных с протезированным клапаном сердца при нерегулярном приеме антикоагулянтов. Возможно развитие эмболии при катетеризации пупочной вены у новорожденных [4].
Хочется заметить, что в последнее время проблема развития атеросклероза в раннем возрасте попрежнему остается дискутабельной и оставляет за собой право на существование среди причин развития коронарной болезни (КБ) в частности. Так, например, появились новые данные о доказаной роли цитомегаловируса в формировании асептического дистрофического поражения стенок сосудов (Е.И.Чазов, 1992). Существуют работы, где показано, что структурные и функциональные изменения артерий появляются уже в раннем возрасте у лиц, чьи родители перенесли ранний инфаркт миокарда. Риск ишемии, по данным ЭхоКГ, на 40% выше, а риск смерти от сердечных приступов в 2,57 раз выше у лиц, чьи родители страдали ранней КБ по сравнению с лицами с неотягощенным по этому фактору анамнезом [8].
Функциональные нарушения коронарного кровотока имеют спастический генез и чаще развиваются при заболеваниях, которые сопровождаются выраженной гипертрофией сердечных камер (ВПС, чаще — стеноз аорты, гипертрофические кардиомиопатии, опухоли сердца) и которые вызывают несоответствие коронарного кровотока массе функционирующего миокарда (нормального или гипертрофированного) при структурно неизмененных коронарных артериях [2, 5]. Возникающая коронарная гипоперфузия является причиной острой гипоксии миокарда с развитием ИМ или без него. Такое состояние может наблюдаться у детей с родовой травмой, повышенным внутричерепным давлением, воспалительными заболеваниями ЦНС, респираторном дистресс-синдроме. Кроме того, в результате энцефалогенных влияний на сердечно-сосудистую систему (при так называемом цереброкардиальном синдроме) обнаруживаются катехоламиновые некрозы как вблизи КА, так и вдали от них [4], что фиксируется на ЭКГ в виде локальных нарушений метаболизма и угрожающих жизни аритмий, а также ИМ.
Утолщение стенки КА может возникать при феохромоцитоме, при выраженной артериальной гипертензии почечного генеза (гломерулонефрит, стеноз почечных сосудов). Высокая артериальная гипертензия и спазм коронарных сосудов, приведший к ИМ, был описан в литературе у мальчика 13 лет на фоне симпатоадреналового криза при симпатоганглиоме [5].
Рубцовые изменения в миокарде наблюдались в одном из случаев ИМ у подростка 15 лет, в генезе которых лежала коронарная вазоконстрикция (стенокардия напряжения). Об этом свидетельствовали ишемические изменения в миокарде при физической нагрузке (сцинтиграфия миокарда с таллием) и дисбаланс симпатоадреналовой регуляции при нормальной проходимости КА по данным ангиокардиографии [3, 5].
В структуре причин ИМ в возрастном аспекте являются врожденные аномалии КА, асфиксия, кардит с коронаритом, ВПС в периоде новорожденности и у детей первого года жизни, от 1 до 10 лет — инфекционные коронариты вирусного или бактериального происхождения, нередко в сочетании с кардитом, болезнь Кавасаки, а у детей старше 10 лет — кардиомиопатии и миокардиты с явлениями коронарита [5].
По морфологическому типу ИМ у детей чаще бывает субэндокардиальным (75%), трансмуральным (19-25%) [5].
Клинически проявления коронарной недостаточности любой этиологии сходны и в основном неспецифичны. У маленьких детей это приступы внезапного беспокойства и бледности с акроцианозом, вялость, повышенная потливость (после или во время кормления), вновь появившийся либо усилившийся грубый систолический шум митральной регургитации, диспепсические расстройства, умеренный лейкоцитоз, симптомы острой сердечной недостаточности.
Ошибочная тактика лечения в связи с гиподиагностикой ИМ у младенцев значительно утяжеляет прогноз. Клиническая картина в старшей возрастной группе приближается к таковой у взрослых. Нередко возникает кардиогенный шок у, казалось бы, здорового ребенка.
Ведущим ЭКГ-признаком ИМ служит подъем выше изолинии сегмента ST и его слияние с зубцом Т. ЭКГ-картина ИМ не отличается от таковой у взрослых и представляет собой «золотой» стандарт в диагностике.
Нарушение сократимости миокарда подтверждается данными ЭхоКГ. Критериями диагностики ИМ [14] является наличие зон акинезии, гипокинезии, асинхронности сокращений отдельных сегментов ЛЖ в области ишемического повреждения. В 16% случаев, по данным И.В. Леонтьевой (2001), выявлялась аневризма ЛЖ.
Наличие ИМ подтверждается лабораторно: повышение уровня креатинфосфокиназы, лактатдегидрогиназы, аминотрансфераз, лейкоцитоз, ускоренная СОЭ [4].
Широко используется в диагностике ИМ в детском возрасте коронарография и вентрикулография, а в последнее время рекомендуется применять сцинтиграфию и позитронно-эмиссионную томографию миокарда [14].
Для выявления скрытых врожденных аномалий КА рекомендуется проводить тест с дозированной физической нагрузкой, которая позволяет определить ишемию миокарда во время пробы (смещение сегмента ST вниз от изолинии в отведениях V2-б)[5].
Течение ИМ обычно осложняется аритмиями (мерцательная аритмия, фибрилляция желудочков, желудочковая тахикардия). Описан случай ИМ у 13-летней девочки, который сочетался с ишемическим инсультом [14].
Лечение детей с ИМ и коронарной недостаточностью в настоящее время аналогично таковому у взрослых.
Таким образом, приведенный анализ иллюстрирует, что цереброкардиальные заболевания в детском возрасте встречаются нередко, имеют мультифакториальную природу и многообразие проявлений в клинической картине, требуют конкретизации причин и обусловливают необходимость широкого внедрения в педиатрическую практику новых высокоинформативных методов исследования.
Своевременная диагностика цереброкардиальных нарушений необходима для определения дифференцированного подхода к их лечению с целью снижения смертности и инвалидизации как в детском возрасте, так и в дальнейшие периоды жизни. Инсульт головного мозга и инфаркт миокарда у детей: современный взгляд на проблему
А.П. Волосовец, проф.; С.П. Кривопустов, проф., Национальный медицинский университет им. А.А. Богомольца, г. Киев
Журнал «Здоровье ребенка» 2(2) 2006 / Клинические лекции
Литература
- Бабин В.Г., Атаманчук И.Н., Давиденко Г.М. и соавт. Множественные аномально расположенные хорды на верхушке левого желудочка — этиологический и патогенетический факторы ишемического инсульта у лиц молодого возраста // Лікарська справа.—2004.—№5-6. — С. 62-64.
- Белозеров Ю.М. Инфаркт миокарда у детей // Росс. вестник перинатол. и педиатр.—1996.— №3. — С. 36-40.
- Белозеров Ю.М. Болезнь Кавасаки //Росс. вестник перинатол. и педиатр.—1995.—№3.— С. 41-47.
- Белоконь Н.А., Кубергер М.Б. Болезни сердца и сосудов у детей: Руководство для врачей: в 2 т. — М., 1987. —Т. 2. С. 223-259.
- Брегель Л.В., Белозеров Ю.М., Субботин В.М. о проблеме инфаркта миокарда у детей // Пробл. здоровья женщин и детей Сибири.—1997. — №4. — С. 12-14.
- Бурцев Е.М. // Журнал неврологии и психиатрии. — 1994. — №6. — С. 83-86.
- Волосовець О.П., Крамарєв С.О., Кривопустов С.П. та співавт. Хвороба Кавасакі: сучасні підходи до діагностики та лікування // Інфекційні хвороби.—2004.—№2.—С. 76-81.
- Дж.Гаста, Марио де Микеле, Серджио Куомо и соавт. Изменение артерий у детей пациентов с ранним инфарктом миокарда (Университет штата Нью Йорк, США) // Международный медицинский журнал (IMJ).—2000.—№6. — С. 509-515.
- Евтушенко С.К., Евтушенко О.С., Перепечаенко Ю.М., Москаленко М.А. Инсульты у детей и их причины // Журнал неврологии и психиатрии.—2003—Т. 103.—Приложение №8 «Инсульт».—С. 30-35.
- Заваденко Н.Н. Причины ишемического инсульта у больных молодого возраста (обзор) // Журнал неврологии и психиатрии.—1986.—Т. 86, №6. — С. 931-941.
- Иванникова З.А., Соловьева Э.И., Кириченко В.М. Диагностика и лечение церебрального инсульта у детей // IV обл. научно-практ. конференция (тезисы докладов). — Днепропетровск, 1988.
- Калашникова Л.А. Ишемический инсульт в молодом возрасте: роль антифосфолипидных антител // Ангиология и сосудистая хирургия. — 2004. — Т. 10. — №4. — С. 8-12.
- Ким А.В., Джебуладзе Д.Н., Семеновская М.Л. Клапанная патология сердца и ишемический инсульт // Неврологический журнал.—2004.— Т. 9. — №6. — С. 11-15.
- Леонтьева И.В. Царегородцева Л.В., Белозеров Ю.М. и соавт. Инфаркт миокарда у детей: возможные причины, современные подходы к диагностике // Педиатрия.—2001.—№1. — С. 32-37.
- Назаренко В.Л., Джоджуа А.Г., Грищенко С.В. и соавт. Эпидемиология мозгового инсульта в популяции экокризисного региона Украины // Архив клинической и экспериментальной медицины. —2003. — Т. 12, №1. — С. 28-31.
- Ратнер А.Ю. Нарушение мозгового кровообращения у детей.—Казань, 1988.
- Чинов Г.П., Притупило О.А., Пасулько Н.П. Хламидийная патология у больных с инфарктом миокарда // Иммунология и аллергология. — 2001. — №3. — С. 62.
- Чухловина М.Л., Гузеева В.М., Мацукатова Е.М. Особенности патогенеза и диагностики геморрагического инсульта у лиц молодого возраста // Клиническая медицина.—2004.—№3. — С. 11-15.
- Чучин М.Ю., Ширеторова Д.И. Метаболический инсульт в детском возрасте // Педиатрия. — 2002. — №4. — С. 19-23.
- Чучин М., Бондаренко Е. Мигренозный инсульт в детском возрасте // Врач. — 2000. — №1. — С. 28-29.








Комментировать