Гиперандрогения. Этиология функциональной гиперандрогении. Принципы гормональной фармакотерапии. Стероидные и нестероидные антиандрогены.
А.Г. Резников, член-корреспондент НАН и АМН Украины, Институт эндокринологии и обмена веществ им. В.П. Комиссаренко АМН Украины, г. Киев
Наличие в организме женщины определенного количества мужских половых гормонов андрогенов (тестостерона, андростендиона) является биологической необходимостью, поскольку они служат незаменимым субстратом для синтеза в яичниках, жировой и нервной тканях женских половых гормонов эстрогенов. Андрогены стимулируют эритропоэз, анаболизм белков, секрецию кожного жира, рост волос на определенных участках поверхности тела, активируют либидо. В то же время абсолютный или относительный избыток андрогенов, а также повышенная чувствительность к ним органовмишеней могут приводить к разнообразным патологическим изменениям, которые квалифицируются как гиперандрогения. Следует подчеркнуть, что гиперандрогенная патология может наблюдаться на фоне как нормального, так и повышенного уровня андрогенов в крови.
Гиперандрогения наблюдается у 10-15% женщин и играет ведущую роль в патогенезе синдрома склерополикистозных яичников (СПКЯ), стромального текоза яичников, гирсутизма, акне, себореи, андрогенной алопеции. Она является причиной нарушений овариально-менструального цикла (аменорея и др.), ановуляторного бесплодия и сопряжена с повышенным риском метаболических расстройств (ожирение, сахарный диабет 2 типа, рак яичников и матки, сердечно-сосудистая патология).
Гормонально-активные злокачественные опухоли эндокринных органов, вырабатывающих андрогены, яичников и коры надпочечных желез, встречаются довольно редко и подлежат безотлагательному хирургическому лечению. В повседневной клинической практике врач чаще всего сталкивается с гиперандрогенией неопухолевого генеза, то есть так называемой функциональной гиперандрогенией. Несвоевременное выявление гиперандрогении как причины заболевания приводит к тому, что больные не получают своевременного лечения.
Этиология функциональной гиперандрогении недостаточно изучена, однако роль наследственных факторов у большинства больных не вызывает сомнения. В ряде случаев прослеживается отчетливая причинно-следственная связь между длительным приемом кортикостероидов, гипотиреозом, акромегалией, гиперпролактинемией, нарушением функций печени и возникновением гиперандрогенной патологии. В патогенезе функциональной гиперандрогении ведущую роль играют следующие механизмы, которые могут сочетаться друг с другом:
- увеличение синтеза и секреции андрогенных стероидов в яичниках и/или коре надпочечных желез (имеет место при СПКЯ, стромальном текозе яичников, врожденной гиперплазии коры надпочечных желез);
- низкая концентрация в крови глобулина, связывающего половые стероиды (ГСПС), вследствие чего уровень в крови свободного, то есть физиологически активного, тестостерона или андростендиона повышается в 2-3 раза с 1 до 2-3% (наблюдается при вышеперечисленных заболеваниях, а также гипотиреозе, патологии печени и др.);
- нарушение гипоталамо-гипофизарной регуляции функции яичников (например, при СПКЯ соотношение лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов в крови сдвигается в сторону ЛГ);
- нарушение метаболизма андрогенов в придатках кожи, обычно в результате повышения активности фермента 5-редуктазы, превращающего тестостерон в высокоактивный 5дигидротестостерон (ДГТ) (чаще всего это ведет к гирсутизму распределению и росту волос на теле по мужскому типу и андрогенной алопеции);
- увеличение количества клеточных рецепторов андрогенов в сальных железах и волосяных фолликулах, что проявляется в виде угрей (акне) и себореи.
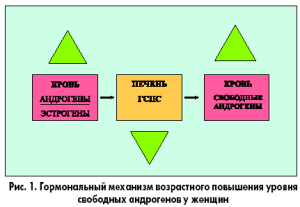
Особую группу гиперандрогенных состояний, которые можно назвать естественной, или возрастной, гиперандрогенией, составляют постменопаузальные осложнения: огрубение голоса, себорея, изменения липидного обмена, андроидное ожирение, инсулинорезистентность, появление волос на щеках, подбородке и т.д. Известно, что эстрогены стимулируют синтез ГСПС в печени. В условиях возрастного эстрогенного дефицита и относительного преобладания андрогенов в крови повышается уровень свободных андрогенов (рис. 1). В связи с этим гормональная диагностика должна базироваться, прежде всего, на определении уровня эстрогенов и биологически активной фракции андрогенов, а не только их общего содержания, которое может оставаться нормальным. Например, у 2030% пациенток с гирсутизмом в крови определяется нормальный уровень общего тестостерона.
Принципы гормональной фармакотерапии
При надпочечниковой гиперандрогении, чаще всего обусловленной врожденным дефицитом 21гидроксилазы стероидов в корковом слое надпочечных желез, снижена продукция кортизола. Вследствие этого растормаживается секреция гипофизарного кортикотропина и усиливается синтез адренокортикальных андрогенов. При данной патологии (адреногенитальный синдром, врожденная гиперплазия коры надпочечных желез) хорошие результаты дает заместительная терапия препаратами глюкокортикоидных гормонов, позволяющая добиться полной или частичной нормализации андрогенного фона благодаря уменьшению секреции кортикотропина.
В качестве терапии второй линии с целью нормализации менструального цикла и лечения гиперандрогенной патологии применяют комбинированные оральные контрацептивы, содержащие прогестины с антиандрогенной активностью.
С целью коррекции гормонального профиля и менструального цикла при функциональной яичниковой гиперандрогении (СПКЯ, стромальный текоз) у женщин репродуктивного возраста применяют комбинированные оральные контрацептивы. Входящие в их состав гормональные препараты синтетический прогестин и этинилэстрадиол уменьшают секрецию ЛГ, благодаря чему снижается синтез тестостерона и андростендиона в интерстициальных клетках яичников и внутренней оболочке фолликулов. Эстрогенный ингредиент контрацептива усиливает продукцию ГСПС в печени и повышает его уровень в крови, а также изменяет в благоприятную сторону соотношение андрогенов и эстрогенов в организме.
Эффективным методом борьбы с андрогенизацией организма после наступления менопаузы является заместительная гормональная терапия, которая включает применение натуральных эстрогенов, особенно в сочетании с синтетическими прогестинами, обладающими антиандрогенной активностью. При этом механизмы профилактического и лечебного действия эстрогенов и гормональных контрацептивов аналогичны.
Ослабить биологические эффекты тестостерона можно при помощи финастерида и других ингибиторов его трансформации в ДГТ. Положительный эффект финастерида отмечен при легком и умеренном гирсутизме, но широкого распространения этот метод не получил.
Принципиально иной подход состоит в фармакологической блокаде рецепторов андрогенов в тканяхмишенях, который, в отличие от других методов, универсален, поскольку эффект не зависит от причины гиперандрогении, будь-то повышенная секреция андрогенов или нарушение их тканевой рецепции и метаболизма. С этой целью широко применяют антиандрогены (стероидные и нестероидные) антагонисты рецепторов андрогенов. Стероидные антиандрогены, которые используют в клинической практике, обладают выраженной гестагенной активностью и могут проявлять другие гормональные свойства. Напротив, нестероидные антиандрогены обнаруживают высокую селективность антиандрогенного действия без сопутствующей гормональной активности, вследствие чего их называют «чистыми» антиандрогенами.
Стероидные антиандрогены
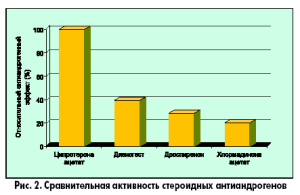
Вещества с антиандрогенными свойствами выявлены среди синтетических прогестинов, к которым относятся некоторые химические дериваты прогестерона (ципротерона ацетат ЦПА, хлормадинона ацетат), 19-нортестостерона (диеногест) и спиронолактона (дроспиренон). Самым активным антиандрогеном оказался ЦПА (рис. 2), на основе которого созданы препарат Андрокур, комбинированный оральный контрацептив Диане-35 и препарат для менопаузальной гормонотерапии Климен.
Обладая высоким химическим сродством к тканевым белкам цитоплазматическим и ядерным рецепторам андрогенов ЦПА препятствует взаимодействию с ними тестостерона, андростендиона и ДГТ. Вследствие этого оказывается невозможной гормональная активация соответствующих участков ядерной ДНК и экспрессия специфических генов, ингибируется синтез белков и нуклеиновых кислот. Более того, под влиянием длительного (1-5 лет) лечения с применением ЦПА в коже женщин с гирсутным синдромом снижается содержание рецепторов андрогенов и активность 5-редуктазы. Кроме периферического действия, ЦПА проявляет антигонадотропный эффект, выражающийся в уменьшении секреции гипофизарного ЛГ и, соответственно, яичниковых андрогенов. В связи с этим ЦПА называют антиандрогеном двойного действия.
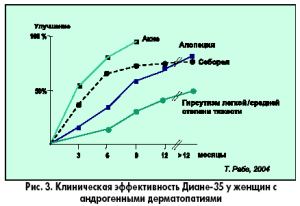
Диане-35 признан как препарат выбора для лечения гирсутизма и других кожных проявлений гиперандрогении у женщин репродуктивного возраста. Он замедляет рост волос на лице и других участках тела, препятствует облысению, снижает гиперпродукцию кожного жира, улучшает его эвакуацию из сальных желез благодаря уменьшению ороговения их протоков. Антиандрогенный эффект ЦПА усиливается наличием в составе данного контрацептива этинилэстрадиола, который повышает уровень ГСПС и снижает содержание биологически активного тестостерона в крови. Лечение проводится длительно: при гирсутизме не менее 9-12 месяцев, при акне и себорее не менее 6-9 месяцев (рис. 3).
Диане-35 положительно влияет на морфофункциональное состояние яичников у женщин с СПКЯ и адреногенитальным синдромом. После длительного его приема (один год и более) уменьшаются или нормализуются размеры яичников, снижаются количество и размеры больших фолликулов и кист, в яичниках уменьшается степень разрастания соединительной ткани. Однако возможность восстановления фертильности в более короткие сроки ограничена контрацептивным эффектом препарата.
Комбинация эстрадиола валерата с ЦПА используется для циклической менопаузальной гормональной терапии у женщин с выраженными симптомами гиперандрогении. В частности, снижается риск развития метаболического синдрома, в том числе нарушений углеводного обмена.
В последние годы на фармацевтическом рынке Украины появились комбинированные оральные контрацептивы и препараты менопаузальной гормонотерапии, в состав которых входят недавно созданные инновационные прогестины с антиандрогенной активностью диеногест и дроспиренон. Антиандрогенное действие диеногеста обусловлено преимущественно торможением синтеза андрогенов в яичниках, тогда как дроспиренон действует на рецепторном уровне. Кроме того, дроспиренон проявляет антиминералокортикоидную активность и препятствует задержке воды в организме, благодаря чему соответствующий контрацептив (Ярина) рекомендуется женщинам с предменструальным синдромом. Оба прогестина соединили в себе лучшие групповые качества дериватов прогестерона и 19-норстероидов. Им присуща высокая биодоступность, отсутствие кумуляции в организме, метаболическая нейтральность (хорошая переносимость), умеренная антиандрогенная активность. Этим объясняется положительный эффект контрацептивов Жанин, в состав которого входит диеногест, и Ярина при так называемой проблемной коже лица с наличием легких и умеренной тяжести форм акне, себореи (повышенная сальность, пористость кожи). По данным клинических исследований, после 8 месяцев приема Ярины выделение кожного жира и выраженность себореи уменьшаются на 25%, количество угрей на лице на 60%. Интересно, что по силе терапевтического эффекта при акне Ярина не уступает Диане-35. Следует также упомянуть о том, что диеногест входит в состав Климодиена, а дроспиренон (препарат Анжелик) в состав средств менопаузальной гормональной терапии в непрерывном монофазном режиме.
Нестероидные антиандрогены
Первые нестероидные антиандрогены были открыты около 35 лет тому назад в группе замещенных карбоксанилидов. Синтез и фармакологическое изучение этих препаратов в Украине шло параллельно с зарубежными фирмами и независимо от них, что подтверждено рядом свидетельств на изобретение и патентов, выданных Институту эндокринологии и обмена веществ им. В.П. Комиссаренко АМН Украины, Институту урологии АМН Украины, Киевскому институту усовершенствования врачей и Институту органической химии НАН Украины. Наиболее широкое распространение в медицине получили флутамид (Флуцином, Флутафарм, Флутамид и др.) и бикалутамид (Касодекс), которые преимущественно используются для лечения рака предстательной железы. Применение препаратов нестероидных антиандрогенов у женщин является приоритетом украинской науки.
В конце 1980-х гг. для лечения гирсутизма нами была предложена мазь нифтолида (флутамида, синтезированного в Украине по оригинальной методике), которая после клинических испытаний в клиниках Харькова, Киева, Москвы и Ленинграда была разрешена для медицинского применения. К сожалению, после распада СССР ее выпуск на Нижегородском химико-фармацевтическом заводе (Россия) был прекращен. В зарубежной литературе 1990-х гг. появились единичные сообщения о применении таблеток флутамида для лечения гирсутизма. Исходя из результатов многолетних экспериментальных исследований, нами был предложен способ лечения нарушений овариальноменструального цикла у женщин с эндокринным бесплодием гиперандрогенного генеза при помощи таблеток нифтолида. В дальнейшем экспериментальные и клинические исследования продолжались с применением более совершенного препарата флутамида Флутафарма, разработанного совместно с ОАО «Фармак». Эти исследования выполнялись в рамках национальных программ «Планирование семьи 1996-2000» и «Репродуктивное здоровье 2001-2005» в соответствии с нормативными документами Государственного фармакологического центра МЗ Украины.
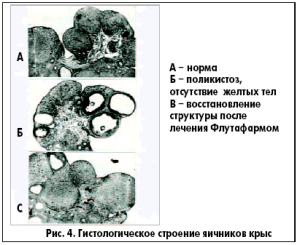
В ходе экспериментов у самок крыс воспроизводили модель поликистоза яичников подсадкой под кожу силастиковых капсул с тестостероном. У большинства из них в крови повышался уровень тестостерона, прекращались эстральные циклы и наступало состояние ановуляторного бесплодия с типичными морфологическими изменениями яичников. Однако пероральное введение флутамида на протяжении 3-5 условных эстральных циклов перед спариванием с самцами восстанавливало половую цикличность и фертильный потенциал подопытных самок, которые приносили нормальное потомство. При этом восстанавливалась структура яичников, в них появлялись желтые тела, что однозначно указывало на возобновление овуляций (рис. 4). Применение антиандрогена до спаривания не вызывало эмбриотоксического или тератогенного эффектов.
Клинические исследования, проведенные под руководством профессоров В.Я. Голоты (Национальный медицинский университет им. А.А. Богомольца) и Т.Ф. Татарчук (Институт педиатрии акушерства и гинекологии АМН Украины), продемонстрировали эффективность и безопасность Флутафарма при лечении нарушений менструальной функции, гирсутизма и других нарушений у больных со СПКЯ. Приказом Минздрава Украины (№ 654 от 04.10.2006 г.) медицинская инструкция по применению Флутафарма дополнена показаниями в новой терапевтической области.
Перспективы дальнейших исследований в данном направлении связаны с изучением возможности восстановления плодовитости, в том числе путем повышения эффективности индукторов овуляции в схемах комбинированного лечения бесплодия.
Источинк: health-ua.com














Комментировать