Нейрогуморальная активность и прогрессирование сердечной недостаточности. Ингибиторы АПФ при лечении сердечной недостаточности. Диастолическая сердечная недостаточность. Бессимптомное снижение сократительной функции левого желудочка. Ингибиторы АПФ и сердечная недостаточность у больных инфарктом миокарда.
Шевченко О.П., Шевченко А.О.
Сердечная недостаточность – важнейший клинический синдром, характеризующийся неуклонным прогрессированием, что приводит к потере трудоспособности и значительно ухудшает качество жизни всё большего количества больных. Увеличение заболеваемости сердечной недостаточностью происходит на фоне все более заметных достижений в лечении больных с болезнями сердца и, в первую очередь, ишемической болезни сердца [1]. В будущем, вероятно, такая тенденция не только не исчезнет, но, скорее, приобретет ещё большую актуальность. Успехи в лечении острого инфаркта миокарда и уменьшение случаев внезапной смерти неизбежно приводит к увеличению количества больных, имеющих дефекты сердечной мышцы, у которых в последующем развивается сердечная недостаточность. В настоящее время количество больных сердечной недостаточностью, обусловленной ишемической болезнью сердца, намного превышает число случаев с иной причиной её развития. Смертность больных с выраженной степенью сердечной недостаточности достигает 40% в год, при этом средняя продолжительность жизни при появлении клинических признаков недостаточности кровообращения составляет около 5 лет [2].
Нейрогуморальная активность и прогрессирование сердечной недостаточности
Симпатическая нервная система и ренинангиотензиновая активность являются наиболее важными факторами, влияющими на кровообращение при развитии сердечной недостаточности. Уже на ранних стадиях нарушения гемодинамики активация нейрогуморальных систем позволяет компенсировать снижение кровотока. Усиленная активность симпатической нервной системы приводит к повышению сократимости кардиомиоцитов и увеличению сил натяжения, действующих на стенку левого желудочка как в систолу, так и в диастолу, что приводит к развитию гипертрофии кардиомиоцитов [3].
Если величина повреждения сердечной мышцы небольшая, степень гипертрофии миокарда и расширения полостей сердца может быть умеренно выраженной. На фоне значительной потери массы функционирующего миокарда гипертрофии кардиомиоцитов уже недостаточно, и полость левого желудочка начинает расширяться, что приводит к повышению силы натяжения, действующей на стенку левого желудочка, и дальнейшему увеличению размеров его полости, способствуя прогрессированию патологического процесса.
Повышение активности ренинангиотензин-альдостероновой системы (РААС) также способствует развитию гипертрофии и фиброза кардиомиоцитов. Если на краткосрочном этапе активация нейрогуморальной системы позволяет повысить перфузию органов и компенсировать недостаточность кровообращения, то спустя определённый период времени «энергозатратный» механизм, интенсифицирующий работу сердечной мышцы, становится наиболее важным механизмом прогрессирования сердечной недостаточности.
С конца 80-х годов истекшего века прогрессирование сердечной недостаточности и сопровождающую её нейрогуморальную активность стали рассматривать как наиболее важную проблему в кардиологии. Использование в медикаментозной терапии больных недостаточностью кровообращения двух групп лекарственных препаратов – ингибиторов АПФ (ИАПФ) и бетаадреноблокаторов существенно изменило концепцию патогенеза прогрессирования сердечной недостаточности [4].
В крупных исследованиях с многолетним наблюдением, включавших более 200 000 больных, было доказано, что ИАПФ снижают риск смерти от инфаркта миокарда, мозгового инсульта и прогрессирования сердечной недостаточности у больных с синдромом сердечной недостаточности, сниженной фракцией выброса левого желудочка, атеросклерозом коронарных или периферических артерий или сахарным диабетом. Анализы результатов исследований, выполненные различными авторами в разное время, свидетельствуют о том, что прием ингибиторов АПФ снижает смертность на 25%, а частоту госпитализаций – на 35% [5, 6].
Ингибиторы АПФ при лечении сердечной недостаточности
Ингибиторы АПФ представляют собой лекарственные средства, которые одновременно подавляют прессорные системы регуляции АД и активируют вазодепрессорные процессы. Обладая свойствами нейрогуморальных модуляторов, эти препараты подавляют образование таких вазоконстрикторных веществ, как ангиотензин II, альдостерон, а также норадреналин, аргининвазопрессин, эндотелин-1. При этом повышается уровень вазодилататоров брадикинина, оксида азота, эндотелиального фактора гиперполяризации, простагландинов Е2 и I2.
Помимо блокирования превращения малоактивного ангиотензина-I в высокоактивный ангиотензин II, ингибиторы АПФ тормозят секрецию альдостерона и вазопрессина. Другой эффект ингибиторов АПФ, также непосредственно связанный с инактивацией этого фермента, связан с предупреждением деградации брадикинина, вызывающего релаксацию гладких мышц сосудов и способствующего высвобождению эндотелиального фактора релаксации – оксида азота NO. Кроме того, под влиянием ингибиторов АПФ снижется синтез других вазоконстрикторных и антинатрийуретических соединений (норадреналина, аргинина-вазопрессина, эндотелина-1), участвующих в патогенезе прогрессирования сердечной недостаточности.
Адренэргическая (симпатическая) и ренинангиотензиновая системы тесно связаны. Например, выброс ренина регулируется бета-1 адренорецепторами, а ангиотензин II способствует выбросу норадреналина в синаптическую щель. Таким образом, воздействие на одну из этих систем у больных сердечной недостаточностью позволяет оказывать воздействие и на другую. Вазодилататоры, оказывающие симптоматическое действие и улучшающие гемодинамику у больных сердечной недостаточностью, такие как гидролазин, повышают уровни норадреналина в крови. В отличие от них, ингибиторы АПФ снижают уровни норадреналина в крови, что свидетельствует о подавлении симпатической активности. Снижение уровней норадреналина в плазме крови на фоне приема ИАПФ может быть следствием ослабления ангиотензин II-зависимого выброса норадреналина.
Gilbert E.M et al. в контролируемом двойном слепом перекрестном исследовании назначали больным сердечной недостаточностью лизиноприл в дозе 5–20 мг в течение 12 недель. Как показали результаты исследования, лизиноприл достоверно снижал активность симпатической нервной системы. На фоне терапии лизиноприлом уровни норадреналина в правом предсердии снижались с 695±300 до 287±72 пг/мл, a средняя частота сердечных сокращений снижалась с 83±5 до 75±3 уд/мин [7].
Результатом действия ингибиторов АПФ является выраженное снижение общего периферического сосудистого сопротивления при незначительном повышении ударного и минутного объема сердца без существенного изменения частоты сердечных сокращений. Ингибиторы АПФ повышают сердечный выброс и ударный объем [8, 9].
Положительные гемодинамические эффекты ИАПФ способствуют улучшению сократительной функции миокарда левого желудочка и уменьшению клинических проявлений сердечной недостаточности. При сравнении с другими вазодилататорами, ИАПФ вызывают равномерную (сбалансированную) системную артериальную и венозную вазодилатацию, уменьшают задержку соли и воды в организме, снижая синтез альдостерона [10].
Ингибиторы АПФ показаны как средства первой линии у больных со сниженной сократительной функцией левого желудочка (фракция выброса левого желудочка <40–45%) у больных как с наличием, так и отсутствием симптомов сердечной недостаточности, в отсутствие противопоказаний [11].
У больных сердечной недостаточностью ИАПФ снижают смертность, частоту госпитализаций и уменьшают прогрессирование сердечной недостаточности. Эффективность ИАПФ при сердечной недостаточности не зависит от наличия сахарного диабета, расовых и половых различий [12, 13]. Так, в исследовании CONSENSUS I (первое из исследований, проведенное для оценки влияния ИАПФ на смертность больных ХСН) на фоне приема эналаприла отмечалось снижение смертности у больных ХСН IV функционального класса на 40% [14]. В исследовании SOLVD было показано, что ИАПФ эффективны не только у больных с тяжелой сердечной недостаточностью, но и у больных с бессимптомным снижением сократительной функции миокарда левого желудочка (NYHA 0). В исследовании SOLVD больные ХСН II-III ФК наблюдались, в среднем, в течение 3,5 лет. Смертность в группе плацебо составила 39,7%, в группе больных, получавших ИАПФ – 35,2% [15].
Анализ результатов исследований показал, что из тысячи пролеченных больных назначение ИАПФ позволяет предотвратить 45 смертных случаев, или для того, чтобы спасти одну жизнь, ИАПФ надо назначать 22 больным на протяжении 3,5 лет. Результаты крупных исследований с многолетним наблюдением показали, что на фоне приема ИАПФ снижается частота госпитализаций больных по поводу ХСН. Так, согласно результатам исследования SOLVD, ИАПФ в течение 3,5 лет должны получать 4,5 больных для предупреждения одной госпитализации по поводу прогрессирования сердечной недостаточности и 3 больных для предотвращения одной госпитализации независимо от причины.
В исследовании VHeFT II (Vasodilator Heart Failure Trial II) эффективность ИАПФ эналаприла сравнивалась с эффективностью комбинированной терапии гидралазином и изосорбидом динитрата у больных ХСН мужского пола. На фоне ИАПФ отмечалось достоверное снижение смертности через 2 года наблюдения (18% против 25%). Снижение смертности достигалось за счет снижения частоты внезапной смерти, особенно у больных с менее выраженными симптомами ХСН (I-II ФК) [16].
Таким образом, результаты клинических исследований свидетельствуют о том, что ИАПФ у больных ХСН увеличивают продолжительность жизни, замедляют прогрессирование сердечной недостаточности и улучшают качество жизни.
Основное действие ИАПФ связано с их способностью подавлять активность ангиотензинпревращающего фермента (киназы II) и оказывать, таким образом, влияние на активность РААС. Результатом ингибирования АПФ является подавление эффектов ангиотензина II.
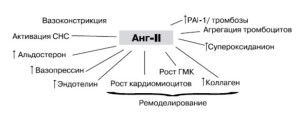
Рис. Нежелательные эффекты, оказываемые ангиотензином II [17, 18].
Диастолическая сердечная недостаточность
Положительный эффект ИАПФ также продемонстрирован у больных сердечной недостаточностью с диастолической дисфункцией левого желудочка. Благоприятное действие ИАПФ у этих больных может быть связано с воздействием на ремоделирование миокарда и уменьшение массы миокарда, обратное развитие фиброза и повышение эластичности стенки левого желудочка.
Положительный эффект этой группы лекарственных средств может быть обусловлен также снижением нейроэндокринной активации и регрессии гипертрофии миокарда на фоне длительного приема ИАПФ [19–22].
Метаанализ исследований, в которых изучалось влияние медикаментозных средств на гипертрофию левого желудочка, показал, что наибольшей эффективностью обладают ИАПФ [23].
Таким образом, ИАПФ показаны больным с клиническими признаками сердечной недостаточности и сохранной сократительной функцией миокарда левого желудочка.
Бессимптомное снижение сократительной функции левого желудочка
Больным с бессимптомным снижением сократительной функции левого желудочка (ФВЛЖ <40–45%) показано назначение ИАПФ при отсутствии противопоказаний.
Cleland J. Et al. провели исследование, в котором больным со сниженной фракцией выброса левого желудочка, но без клинических признаков сердечной недостаточности, в течение месяца назначали лизиноприл (10 мг/сут) или плацебо [24]. На фоне приема лизиноприла отмечалось достоверное повышение пикового потребления кислорода на фоне физической нагрузки, а также снижение уровней ангиотензина II, альдостерона и предсердного натрийуретического пептида. На основании полученных результатов авторами был сделан вывод о том, что у больных со сниженной систолической функцией миокарда левого желудочка без симптомов сердечной недостаточности лизиноприл улучшает переносимость физической нагрузки.
В исследование SOLVD-P были включены больные с низкой фракцией выброса левого желудочка (<35%), но без клинических признаков сердечной недостаточности. После рандомизации больным назначались эналаприл или плацебо. У большинства больных, включенных в исследование, в анамнезе был перенесенный инфаркт миокарда или ИБС. Больные наблюдались в среднем 3,1 года. На фоне приема ИАПФ риск смерти или госпитализации в связи с декомпенсацией сердечной недостаточности снизился с 24,5% (в группе плацебо) до 20,6% (в группе больных, принимавших эналаприл). По сравнению с плацебо ИАПФ снизил риск развития синдрома сердечной недостаточности с 38,6% до 29,8%. Средний период времени до развития клинических признаков сердечной недостаточности в группе плацебо составил 8,3 месяца, в группе активного лечения – 22, 3 месяца. Через 11,3 года наблюдения смертность в группе больных, получавших ИАПФ, была достоверно ниже, чем в группе больных, получавших плацебо (50,9% и 56,4% соответственно) [25].
Ингибиторы АПФ и сердечная недостаточность у больных инфарктом миокарда
Причинами развития сердечной недостаточности у больных, перенесших инфаркт миокарда, являются развившееся вследствие повреждения нарушение сократительной функции миокарда, изменения размеров, формы и структуры миокарда левого желудочка. Будучи проявлением адаптивных и компенсаторных процессов, с течением времени ремоделирование миокарда становится патологическим, нежелательным процессом, приводящим к прогрессивному развитию нарушения сократительной функции миокарда левого желудочка [26–28].
В течение нескольких дней после развития острой окклюзии коронарной артерии и развития инфаркта миокарда происходит ремоделирование левого желудочка в виде расширения зоны инфаркта и компенсаторной гипертрофии жизнеспособного миокарда. Это сопровождается дилатацией левого желудочка, происходящей в течение последующих месяцев и вовлекающей как участки поврежденного вследствие инфаркта, так и неповрежденного миокарда. Ремоделирование и другие патологические изменения в сердечной мышце, приводящие к развитию и прогрессированию сердечной недостаточности, происходят на фоне активации РААС и симпатической нервной системы. Вазоконстрикция, увеличение объема наполнения левого желудочка и расширение его полости повышают силу, действующую на стенку левого желудочка, что является основным стимулом прогрессирующего ремоделирования миокарда левого желудочка [29–31].
Степень ремоделирования миокарда левого желудочка может быть определена путем оценки размеров левого желудочка сердца и сократительной функции миокарда. Показатели объемов левого желудочка и, в особенности, конечный систолический объем левого желудочка имеют важное прогностическое значение – даже большее, чем фракция выброса левого желудочка или размер зоны инфаркта. Наиболее благоприятный прогноз отмечается у больных без дилатации левого желудочка и, в связи с этим, предотвращение ремоделирования миокарда у больных инфарктом является важной задачей лечения, направленного на улучшение отдаленного прогноза. Своевременное и адекватное восстановление кровотока в инфаркт связанной артерии с помощью ангиопластики, шунтирования или тромболизиса, или медикаментозная терапия, направленная на снижение перегрузки левого желудочка, позволяют уменьшить степень выраженности ремоделирования миокарда левого желудочка в раннем и отделенном периоде после перенесенного инфаркта миокарда [32–34].
Наибольшая эффективность ИАПФ при остром инфаркте отмечается у больных с более высоким риском дилатации левого желудочка, а именно – у больных с большой зоной инфаркта, с инфарктом передней локализации, с инфарктом, формирующим патологический зубец Q на ЭКГ и у больных с полной окклюзией коронарной артерии.
Первый опыт применения ИАПФ при остром инфаркте миокарда оказался неудачным. В исследовании CONSENSUS II, назначение эналаприла больным острым инфарктом миокарда не только не снизило смертность, но и способствовало повышению частоты ишемических эпизодов [35].
Исследование GISSI-3 оказалось принципиально значимым, поскольку его результаты позволили вновь вернуться к обсуждению проблемы применения ингибиторов АПФ в острой стадии инфаркта миокарда. Во-первых, организаторы исследования учли возможность нежелательного эффекта артериальной гипотензии у больных инфарктом миокарда, и в качестве препарата был выбран ингибитор АПФ, обладающий наиболее подходящими для этого характеристиками – лизиноприл. Выбор лизиноприла в качестве исследуемого препарата был обусловлен целым рядом особенностей, отличающим его от других представителей класса ингибиторов АПФ. Лизиноприл обладает гидрофильными свойствами, практически не связывается с белками крови, является исходно активной лекарственной формой с длительным периодом действия (терапевтические концентрации достигаются при пероральном приеме 1 раз в сутки). Отсутствие биотрансформации в печени позволяет эффективно и безопасно применять его у больных с различными нарушениями функции печени. Лизиноприл не взаимодействует с многими лекарственными средствами, включая сердечные гликозиды, антикоагулянты, антиаритмические средства и др. Кроме того, использование лизиноприла позволяет титровать дозу препарата в зависимости от уровня артериального давления [36].
Лизиноприл, лизиновое производное эналаприлата, является длительно действующим ингибитором АПФ. Пероральное назначение лизиноприла приводит к снижению активности АПФ в плазме крови и тканях организма, а также уровней ангиотензина II и альдостерона. Назначение лизиноприла больным сердечной недостаточностью приводит к повышению ударного объема и сердечного выброса, снижает системное сосудистое сопротивление и давление заклинивания легочной артерии, способствуя уменьшению симптомов сердечной недостаточности и повышению переносимости физической нагрузки. У больных сердечной недостаточностью максимальное фармакодинамическое действие лизиноприла отмечается спустя 6–8 часов после приема и длится в течение 24 часов.
В крупных многоцентровых исследованиях показано, что лизиноприл значительно эффективнее плацебо и не менее эффективно, чем другие ИАПФ (каптоприл, эналаприл), улучшает клиническое состояние и отдаленный прогноз у больных сердечной недостаточностью. Терапия лизиноприлом хорошо переносится. Побочные эффекты на фоне приема лизиноприла отмечаются редко. Некоторые побочные действия лизиноприла, отмечавшиеся в клинических исследованиях, включающие слабость, головные боли, артериальную гипотонию и диарею, носили преходящий характер, в большинстве случаев не приводили к отмене препарата и исчезали на фоне уменьшения дозы препарата или коррекции сопутствующей лекарственной терапии. Назначение лизиноприла больным сердечной недостаточностью, принимающим диуретики или дигоксин, позволяет добиться дополнительного положительного клинического эффекта [37–38].
В исследовании GISSI-3 лизиноприл назначался больным острым инфарктом миокарда в первые сутки. Начальная доза составляла 5 мг затем, если позволял уровень АД, она постепенно ступенчато-образно увеличивалась до 20 м.г Помимо сравнения эффектов препарата с эффектом плацебо ставилась задача оценить влияние лечения ИАПФ на эффективность лечения такими препаратами как аспирин, бета-адреноблокаторы и тромболитики. Результаты этого исследования оказали огромное влияние на использование ИАПФ в остром периоде инфаркта миокарда, поскольку впервые была продемонстрирована безопасность применения ИАПФ – лизиноприла – в остром периоде инфаркта миокарда, положительное влияние на смертность больных и отсутствие влияния на эффекты других лекарственных средств, используемых в остром периоде инфаркта миокарда. Опыт применения лизиноприла у больных инфарктом миокарда при использовании его в первые часы от начала развития ангинозного приступа показал, что такое лечение оказывает положительное влияние на миокард в зоне повреждения, вызывая уменьшение размеров инфаркта и предупреждая расширение зоны повреждения.
Анализ результатов 6-недельного наблюдения за больными, принимавшими участие в исследовании GISSI-3, показал, что снижение смертности на фоне приема лизиноприла отмечалось в течение первых 4-х суток госпитализации и, в основном, происходило за счет уменьшения случаев разрывов миокарда (снижение риска составило 51%), электромеханической диссоциации и левожелудочковой недостаточности [39].
Результаты метаанализа, включавшего более 100 000 больных, показали, что ИАПФ, при сравнении с плацебо, достоверно снижают смертность в течение 30 дней после острого инфаркта миокарда (7,1% против 7,6%). Наибольший эффект ИАПФ отмечался в подгруппах больных с высоким риском нежелательных событий – больных с сердечной недостаточностью или инфарктом миокарда передней локализации. Назначение ИАПФ также снижало риск развития сердечной недостаточности (14,6% против 15,2%), но не снижало риск повторного инфаркта миокарда или мозгового инсульта. При этом, на фоне приема ИАПФ чаще отмечалась артериальная гипотония (17,6% против 9,3%) и нарушения функции почек (1,3% против 0,6%). Анализ также показал, что наибольшая польза лечения ИАПФ отмечалась в течение первой недели после развития острого инфаркта миокарда – из 239 спасенных жизней 200 смертей были предотвращены в течение первой недели [40].
Расчёты показали, что назначение ИАПФ в ранние сроки инфаркта миокарда позволяет спасти не менее 5 жизней из 1000 пролеченных больных. При более позднем назначении эффект лечения оказывается менее выраженным. Максимально положительный эффект лечения наблюдается у больных с нарушением сократительной функции левого желудочка, но при отсутствии тяжёлой степени сердечной недостаточности. В то же время, при назначении ИАПФ больным инфарктом миокарда необходимо исключать возможность развития артериальной гипотензии, поскольку это ухудшает кровоснабжение миокарда и повышает риск смерти [41].
Профилактика внезапной смерти
Внезапная смерть является самой частой причиной смерти у больных сердечной недостаточностью и у больных в течение первого года после перенесенного инфаркта миокарда. Во многих исследованиях показано, что ИАПФ снижают риск внезапной смерти [42–45], однако механизмы этого эффекта до конца не выяснены. Внезапная смерть развивается вследствие остро развившейся ишемии миокарда или нарушения ритма. ИАПФ снижают риск развития внезапной вазоконстрикции и ремоделирования миокарда левого желудочка. На молекулярном уровне, блокируя синтез ангиотензина II и повышая уровни брадикинина в крови, ИАПФ способствуют повышению уровней вазодилататоров – таких, как простагландины и NO [46,47].
Ингибиторы АПФ могут также снижать выброс катехоламинов, уменьшать перегрузку кардиомиоцитов кальцием и подавлять синтез эндотелина [48–50].
Показано, что у больных с гомозиготным носительством аллели DD в гене АПФ и наличием аллели 1С в гене ангиотензина II повышен риск развития жизненно опасных желудочковых аритмий [51].
Профилактика развития нежелательных ишемических событий
Снижение сократительной функции миокарда, приводящее к развитию недостаточности кровообращения, нередко является следствием хронической ишемии миокарда. Ангиотензин II обладает проишемическим действием, вызывая вазоконстрикцию и стимулируя миграцию и пролиферацию гладкомышечных клеток сосудистой стенки. Ангиотензин II стимулирует выброс гладкомышечными клетками сосудов фермента, стимулирующего образование активных соединений кислорода (свободных радикалов), что, в свою очередь, стимулирует окисление липопротеинов низкой плотности и способствует прогресированию атеросклероза [52].
Помимо влияния на ремоделирование миокарда левого желудочка, ИАПФ улучшают прогноз у больных атеросклерозом с высоким риском нежелательных событий и сохранной сократительной функцией миокарда левого желудочка. Так, в исследовании HOPE (The Heart Outcomes Prevention Evaluation Study), включавшем больных с признаками атеросклероза коронарных или периферических артерий или сахарным диабетом и любым дополнительным фактором сердечнососудистого риска с сохранной сократительной функцией миокарда левого желудочка, 651 больному назначался ИАПФ рамиприл в дозе 10 мг в сутки, 826 больных получали плацебо на протяжении 5 лет. На фоне приема ИАПФ отмечалось снижение частоты сердечно-сосудистой смертности на 26%, инфаркта миокарда – на 20%, мозгового инсульта – на 32%, общей смертности – на 16%, процедур реваскуляризации – на 15%, остановки сердца – на 37%, развития сердечной недостаточности – на 33% и осложнений сахарного диабета – на 16%. Особенно эффективны ИАПФ были у больных с сопутствующим сахарным диабетом.
ИАПФ и сахарный диабет
Абдоминальное ожирение, инсулиновая резистентность и сахарный диабет являются доказанными факторами риска развития ХСН [53]. Более того, развитие сердечной недостаточности у больных сахарным диабетом значительно ухудшает прогноз. Так, в исследовании DIABHYCAR, в котором участвовали больные сахарным диабетом 2-го типа, ХСН развилась у 4% больных, из которых к концу периода исследования 36% умерли [54].
Как показали клинические исследования, у больных сахарным диабетом ИАПФ оказались самыми эффективными средствами профилактики развития ХСН [55, 56].
ИАПФ снижают риск развития СД и прогрессирования осложнений (нефропатии). В многоцентровом рандомизированном двойном слепом исследовании TROPHY 232 больных ожирением и артериальной гипертонией в течение 12 недель получали лизиноприл (10- 40 мг) или гипотиазид (12, 5–50 мг).
Оба препарата – лизиноприл и гипотиазид– одинаково эффективно снижали систолическое и диастолическое артериальное давление. Однако на фоне приема лизиноприла отмечалось снижение уровней глюкозы в крови, а на фоне приема гипотиазида – повышение последней (-0,21 против +0,31 ммоль/л; р<0,001) [57].
Как показали результаты многоцентрового рандомизированного двойного слепого исследования ALLHAT (The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial), в котором приняло участие 33 357 больных, наблюдавшихся в среднем 4,9 лет, лизиноприл, по сравнению с тиазидовым диуретиком хлорталидоном, снижал частоту новых случаев сахарного диабета на 43%, антагонист кальция амлодипин – на 17% [58].
Целесообразность применения ИАПФ у больных с инсулинорезистентностью объясняется активацией РАС на фоне гиперинсулинемии и гипергликемии, а также общими молекулярными путями передачи сигналов, используемыми инсулиновой и ренинангиотензиновой системами. Ингибиторы АПФ улучшают чувствительность тканей к инсулину отчасти за счет увеличения захвата глюкозы скелетными мышцами путем усиления синтеза и увеличения функциональной активности белка-переносчика глюкозы-4 (glucose transporter 4 protein) в результате активации тирозинзависимого фосфорилирования субстрата инсулинового рецептора IRS-1 и повышения уровней брадикинина и биодоступности оксида азота NO.
Особенности назначения ИАПФ у больных ХСН
Ингибиторы АПФ у больных сердечной недостаточностью назначаются с целью профилактики преждевременной смерти и снижения риска госпитализаций. Препараты этой группы показаны всем больным с сердечной недостаточностью или бессимптомным снижением сократительной функции миокарда левого желудочка. Противопоказаниями к назначению ИАПФ являются беременность, ангионевротические отеки в анамнезе и двусторонний стеноз почечной артерии.
Назначение ИАПФ должно начинаться как можно раньше при выявлении симптомов сердечной недостаточности или бессимптомного снижения сократительной функции миокарда левого желудочка. Вначале рекомендуется использовать малые дозы препаратов (например, лизиноприл 2,5–5 мг/сут однократно). При хорошей переносимости и отсутствии побочных действий доза повышается. Рекомендуется удваивать дозу через две недели (быстрее повышать дозу можно у больных с бессимптомной дисфункцией левого желудочка, I-II ФК ХСН, у больных артериальной гипертонией или больных, находящихся в стационаре). У больных ХСН при титровании дозы ИАПФ следует стремиться к достижению адекватных доз, эффективность которых была доказана в крупных клинических исследованиях (например, максимальная доза лизиноприла не должна превышать 35- 40 мг/сут). Считается, что все препараты из группы ИАПФ обладают схожей клинической эффективностью, однако не все они были изучены у больных ХСН.
Результаты исследований свидетельствуют о том, что при длительном назначении ИАПФ может наблюдаться так называемый «феномен ускользания», при котором отмечается некоторое повышение биодоступности ангиотензинпревращающего фермента. Анализ результатов клинических исследований показывает, что реактивация АПФ на фоне длительного приема ИАПФ способствует некоторому повышению частоты госпитализаций, но не смертности среди больных ХСН. Вероятность развития «феномена ускользания» также обуславливает возможную необходимость повышения дозы ИАПФ на фоне их длительного приема.
Farquharson et al. изучали конверсию ангиотензина I в ангиотензин II в сосудистой стенке на фоне приема лизиноприла, вводя внутриартериально растворы ангиотензина I и ангиотензина II 28 больным хронической сердечной недостаточностью [59]. Результаты показали, что скорость конверсии AI в AII у больных с более выраженной сердечной недостаточностью (III ФК) выше по сравнению с больными с легкой степенью сердечной недостаточностью (I-II ФК).
На фоне длительного приема лизиноприла в дозе 10 мг/сут его эффект, выражающийся в способности ингибировать активность ангиотензинпревращающего фермента, снижался, но при повышении дозы препарата вдвое, до 20 мг/сут, его эффективность восстанавливалась полностью. Авторами был сделан вывод о том, что с течением времени на фоне приема ИАПФ отмечается постепенная реактивация тканевого АПФ, но повышение дозы препарата в два раза (до 20 мг/сут) эффективно ингибирует тканевую АПФ.
Действительно, как показали результаты исследования ATLAS [60], более высокие дозы лизиноприда в большей степени снижают риск нежелательных событий у больных хронической сердечной недостаточностью. В это двойное слепое исследование было включено 3164 больных ХСН II-IV ФК с ФВЛЖ < 30%, которым после рандомизации назначали лизиноприл в низких или высоких дозах на протяжении 39–58 месяцев. Больные уже принимали диуретики на протяжении не менее 2 месяцев. На фоне приема лизиноприла в высоких дозах отмечалось недостоверное снижение смертности на 8% и необходимость в госпитализации – на 12%. Головокружение и снижение почечной функции, как побочные действия ИАПФ, в группе больных, получавших высокие дозы лизиноприла, отмечались чаще, но количество больных, у которых пришлось отменить прием лизиноприла, в обеих группах было одинаковым.
Обращал на себя внимание тот факт, что достоверных различий в симптомах у больных, получавших высокие и низкие дозы ИАПФ, не было. Отсюда был сделан вывод о том, что при подборе дозы ИАПФ жалобы больных, связанные с синдромом сердечной недостаточности, не являются решающим фактором, поскольку основной эффект ИАПФ выражается в снижении частоты повторных госпитализаций и риска смерти.
Следует отметить, что различия в смертности у больных, получавших высокие и низкие дозы ИАПФ, были недостоверными и составили 8%. То есть, повышение дозы ИАПФ позволяет достичь дополнительного снижения частоты повторных госпитализаций, но не смертности. Таким образом, результаты исследования показали, что больные сердечной недостаточностью нуждаются в повышении дозы ИАПФ с учетом переносимости и побочных действий.
Побочные действия на фоне приема ИАПФ развиваются достаточно редко и включают артериальную гипотонию, непродуктивный сухой кашель, гиперкалиемию, ангионевротический отёк верхних дыхательных путей, явления холестаза, нарушение функции почек. Для уменьшения риска развития побочных действий у больных ХСН на фоне ИАПФ рекомендуется контроль самочувствия, регулярное измерение уровней артериального давления, особенно в период титрования дозы, периодическое измерение уровней креатинина и калия в крови.
Следует иметь в виду , что риск развития артериальной гипотонии после приема первой дозы ингибитора АПФ повышен у больных реноваскулярной артериальной гипертонией. При развитии артериальной гипотонии рекомендуется снизить дозу ИАПФ, а также оценить необходимость приема других препаратов, обладающих гипотензивным действием – нитратов, антагонистов кальция или других вазодилататоров. При отсутствии признаков задержки жидкости можно отменить диуретики.
Риск развития почечных осложнений наиболее высок на фоне гиповолемии и гипонатриемии (в том числе и на фоне приема мочегонных средств), а также у лиц, получающих НПВС. В целях профилактики нарушений функции почек перед назначением ингибиторов АПФ необходимо отменить мочегонные средства и НПВС, определить содержание белка в моче, уровень креатинина в крови, а также исключить вероятность стеноза почечных артерий. Следует помнить, что в начале приема ИАПФ возможно некоторое транзиторное повышение уровней креатинина и калия в крови [61].
У больных с гиперкалиемией следует решить вопрос о прекращении приема лекарственных средств, оказывающих нефротоксичное действие, снизить дозу ИАПФ вдвое и повторно оценить уровни калия и креатинина в крови. Кроме того, НПВС, наряду с препаратами калия и калийсберегающими диуретиками (амилорид, спиронолактон, триамтерен), повышают риск развития гиперкалиемии у больных, получающих ингибиторы АПФ. В то же время комбинация ингибиторов АПФ с тиазидными и петлевыми диуретиками уменьшает вероятность развития гиперкалиемии.
При появлении сухого кашля на фоне приема ИАПФ после исключения других причин (заболевания легких и бронхов, отек легких), вместо ИАПФ можно назначить препараты из группы блокаторов ангиотензиновых рецепторов.
Частота развития сухого кашля на фоне приема ИАПФ составляет, по разным данным, 0,7–25%. Интересно, что многие эксперты отмечают тенденцию к некоторому завышению частоты развития сухого кашля на фоне приема ИАПФ в публикуемых материалах, посвященных блокаторам ангиотензиновых рецепторов. Обычно сухой кашель на фоне приема ИАПФ появляется в течение первого месяца лечения и чаще отмечается у женщин и курящих. Характерно усиление кашля ночью и в положении лежа. Механизмы развития сухого кашля на фоне терапии ИАПФ до конца не изучены. В той или иной степени предполагается участие генетических факторов повышенной бронхиальной реактивности и кашлевого рефлекса, увеличение уровней брадикинина в легких, а также повышение концентрации местных медиаторов воспаления (простагландинов и субстанции Р). В случаях появления сухого кашля у лиц, принимающих ИАПФ, эффективными мерами могут быть замена одного ИАПФ на другой либо уменьшение дозы принимаемого ИАПФ. Ослаблению кашля также способствуют ингаляции кромогликата натрия и сочетанное назначение с антагонистами кальция.
Литература
v
- Schuster EH, Bulkley BH. Expansion of transmural MI: a pathophysiologic factor in cardiac rupture// Circulation. 1979;60:1532–1538.
- Jong P, Yusuf S, Rousseau MF et al. Effect of enalapril on 12 year survival and life expectancy in patients with left ventricular systolic dysfunction: a follow-up study// Lancet 2003;361:1843–8.
- Cleland J. et al. Effects of lisinopril on cardiorespiratory, neuroendocrine, and renal function in patients with asymptomatic left ventricular dysfunction// Br Heart J. 1993;69:512–515.
- Schmieder et al. //JAMA 1996; 275: 1507–1513.
- Yusuf S, Pfeffer MA, Swedberg K, Granger KB, Held P, McMurray JJV et al. for the CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and preserved leftventricular ejection fraction: the CHARM Preserved Trial// Lancet 2003;362:777–781.
- Beltman F, Heesen W, Smit A et al. Two-year follow-up study to evaluate the reduction of left ventricular mass and diastolic function in mild to moderate diastolic hypertensive patients// J Hyper-tens Suppl 1998;16: S15–9.
- Devereux RB, Palmieri V, Sharpe N et al. Effects of oncedaily angiotensin-converting enzyme inhibition and calcium channel blockade- based antihypertensive treatment regimens on left ventricular hypertrophy and diastolic filling in hypertension: the prospective randomized enalapril study evaluating regression of ventricular enlargement (preserve) trial// Circulation 2001;104:1248–54.
- Effects of cardiac versus circulatory angiotensin-converting enzyme inhibition on left ventricular diastolic function and coronary blood flow in hypertrophic obstructive cardiomyopathy// Circulation 1998;97:1342–47.
- Brown NJ, Vaughn DE.// Adv Intern Med. 2000;45:419–29.
- Burnier M, Brunner HR. //Lancet. 2000;355:637–45.
- Cohn JN, Johnson G, Ziesche S et al. A comparison of enalapril with hydralazine-isosorbide dinitrate in the treatment of chronic congestive heart failure// N Engl J Med. 1991;325:303–10.
- The SOLVD Investigators. Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure// N Engl J Med. 1991;325:293–302.
- CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure: results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS)// N Engl J Med. 1987;316:1429–1435.
- Pilote L, Abrahamowicz M, Eisenberg M. et al. Effect of different angiotensin-convertingenzyme inhibitors on mortality among elderly patients with congestive heart failure// CMAJ 2008;178:1303–
- Garg R, Yusuf S. Overview of randomized trials of angiotensinconverting enzyme inhibitors on mortality and morbidity in patients with heart failure. Collaborative Group on ACE Inhibitor Trials//JAMA 1995; 273:1450–6.
- Сидоренко Б.А. Современные подходы к лечению хронической сердечной недостаточности. В кн. Избранные лекции для практикующих врачей. Москва. 2002, стр.26–36.
- Беленков Ю. Н. Хроническая сердечная недостаточность. В кн. «Болезни органов кровообращения». Москва, Медицина -1997, стр.663–685.
- Douglas D. Schocken et al. Prevention of Heart Failure. A Scientific Statement From the American Heart Association Councils on Epidemiology and Prevention, Clinical Cardiology, Cardiovascular Nursing, and High Blood Pressure Research; Quality of Care and Outcomes Research Interdisciplinary Working Group; and Functional Genomics and Translational Biology Interdisciplinary Working Group// Circulation. 2008;117:2544–2565.
- Гуревич М.А. В кн. Хроническая сердечная недостаточность. Москва.1997. стр. 4–27.
- 7. Gilbert E.M. et al. Lisinopril lowers cardiac adrenergic drive and increases beta-receptor density in the failing human heart//Circulation 1993;88; 472–480.
- 8. Uretsky BF, Shaver JA, Liang CS et al. Modulation of hemodynamic effects with a converting enzyme inhibitor: acute hemodynamic dose-response relationship of a new angiotensin-converting enzyme inhibitor, lisinopril, with observations on long-term clinical, functional and biochemical responses// Am Heart J. 1988;116:480–488.
- 9. Stone CK, Uretsky BF, Linnemeier TJ et al. Hemodynamic effects of lisinopril after long-term administration in congestive heart failure//Am J Cardiol. 1989;63:567–570.
- 10. Tarazi RC, Fouad FM, Ceimo JK et al. Renin, aldosterone and cardiac decompensation: studies with an oral converting enzyme inhibitor in heart failure// Am J Cardiol. 1979;44:1013–1018.
- 11. Lopez-Sendon J. et al. Expert consensus document on angiotensin converting enzyme inhibitors in cardiovascular disease// Eur.Heart J. 2004- 25, 1454–1470.
- 12. Shekelle PG, Rich MW, Morton SC et al. Efficacy of angiotensin converting enzyme inhibitors and beta-blockers in the management of left ventricular systolic dysfunction according to race, gender, and diabetic status. A meta-analysis of major clinical trials// J Am Coll Cardiol. 2003;41:1529–38.
- 13. Flather M, Yusuf S, Kшber L, Pfeffer M, Hall A, Murria G et al. for the ACE-Inhibitor Myocardial Infarction Collaborative Group. Long-term ACE-inhibitor therapy in patients with heart failure or left-ventricular dysfunction: a systematic overview of data from individual patients// Lancet 2000;355:1575–781.
- Carstensen S. et al. Effects of early enalapril treatment on global and regional wall motion in acute MI. Am Heart J. 1995;129:1101–1108.
- Edner M. et al. Effect of enalapril initiated early after acute MI on heart failure parameters, with reference to clinical class and echocardiographic determinants// Clin Cardiol. 1996;19:543–548.
- Bonarjee VV, et al. Benefit of converting enzyme inhibition on left ventricular volumes and ejection fraction in patients receiving betablockade after MI: CONSENSUS II Multi-Echo study group// Am Heart J. 1996;132:71–77.
- Jugdutt BI et al. Effect of long-term captopril therapy on left ventricular remodeling and function during healing of canine MI//J Am Coll Cardiol. 1992;19:713–721.
- Brown EJ Jr, Swinford RD, Gadde P, Lillis O. Acute affects of delayed reperfusion on infarct shape and left ventricular volume: a potential mechanism of additional benefits from thrombolytic therapy// J Am Coll Cardiol. 1991;17:1641–1650.
- Hacker M, et al. Comparative effects of low and high doses of the ACE inhibitor, lisinopril, on morbidity and mortality in CHF//Circulation. 1999;100:2312–2318.
- Shotan A, Widerhorn J, Hurst A. et al. Risks of ACE inhibition during pregnancy: experimental and clinical evidence, potential mechanisms and recommendations for use// Am J Med. 1994;96:451–456.
- David D. et al. A comparison of the cough profile of fosinopril and enalapril in hypertensive patients with a history of ACE inhibitorassociated cough// Am J Ther. 1995;2:806–813.
- CONSENSUS trial group. Effects of enalapril on long-term mortality in severe congestive heart failure// Am J Cardiol. 1992;69:103–110.









Комментировать