Нозокомиальные инфекции. Общая характеристика. Результаты проведенных исследований.
Горбич Ю.Л., Карпов И.А., Кречикова О.И.
Белорусский государственный медицинский университет, Республика Беларусь.
НИИ антимикробной химиотерапии Смоленской государственной медицинской академии, Российская Фе-дерация.
Нозокомиальные инфекции (лат. nosocomium – больница, греч. nosocmeo – больница, ухаживать за больным) – это инфекции, развившиеся у пациента не менее чем через 48 ч после госпитализации, при условии что при поступлении в стационар инфек-ция не существовала и не находилась в инкубаци-онном периоде; инфекции, явившееся следствием предыдущей госпитализации, а также инфекцион-ные заболевания медицинских работников, связан-ные с их профессиональной деятельностью.
По данным различных авторов, число пациентов, у которых развиваются нозокомиальные инфекции, колеблется от 3 до 15% [1–3]. Из них 90% имеют бактериальное происхождение; вирусные, грибко-вые возбудители и простейшие встречаются значи-тельно реже [2].
С начала эры антибиотиков и до 60-х годов ХХ в. примерно 65% внутрибольничных инфекций (ВБИ) имели стафилококковую природу. С появлением в арсенале врачей пенициллиназостабильных анти-бактериальных препаратов они отступили на вто-рой план, уступив лидерство инфекциям, вызван-ным грамотрицательными бактериями [4].
В настоящее время, несмотря на несколько воз-росшую этиологическую роль грамположительных микроорганизмов и грибов как возбудителей нозо-комиальных инфекций, штаммы грамотрицатель-ных микроорганизмов со множественной рези-стентностью к антибактериальным препаратам представляют серьезную проблему в стационарах различных стран мира [1, 2]. По данным ряда авто-ров, их частота варьируется от 62 до 72% всех но-зокомиальных инфекций [5–7]. Наиболее актуаль-ными возбудителями всех ВБИ (кроме ангиогенных) и сепсиса являются микроорганизмы семейства Enterobacteriaceae и неферментирующие бактерии, к которым относятся Pseudomonasaeruginosa и Acinetobacterspp. [4].
Наиболее клинически значимым видом рода Acinetobacter является Acinetobacter baumannii (ге-номовид 2) [8], который вызывает 2–10% грамотри-цательных инфекций в Европе и США [9], до 1% всех нозокомиальных инфекций [10].
Факторы риска
В качестве общих факторов риска инфекций, вы-званных A. baumannii, выделяют:
—
—
- мужской пол;
—
- пожилой возраст;
—
- наличие сопутствующих заболеваний (злокаче-ственные заболевания крови, сердечно-сосудистая или дыхательная недостаточность, диссеминированное внутрисосудистое сверты-вание крови);
—
- длительность использования инвазивных ме-тодов лечения и мониторинга (ИВЛ более 3 дней; ингаляционное введение лекарственных препаратов; введение назогастрального зонда; трахео-стомия; катетеризация мочевого пузы-ря, центральной вены, артерии, оперативное вмешательство);
—
- длительное нахождения в стационаре или от-делении реанимации и интенсивной терапии (ОРИТ);
—
- предшествующая антибактериальная терапия с использованием цефалоспоринов, фторхино-лонов или карбапенемов [11, 12–20].
Предшествующее госпитализации в ОРИТ хирурги-ческое вмешательство повышает риск инфициро-вания примерно в 5 раз [15].
В качестве факторов риска инфицирования кар-бапенемрезистентным штаммом A. baumannii для взрослых к настоящему моменту описаны: большой размер стационара (более 500 ко-ек); госпитализация в ОРИТ или госпитализация по экстренным показаниям; длительное пребывание в
стационаре; высокая плотность пациентов с CRAB в палате; мужской пол; иммуносупрессия; ИВЛ, ка-тетеризация мочевыводящих путей или артерии, проведение гемодиализа; недавнее оперативное вмешательство; пульс-лаваж ран; предшествую-щее использование меропенема, имипенема или цефтазидима [16, 18, 21, 22–27].
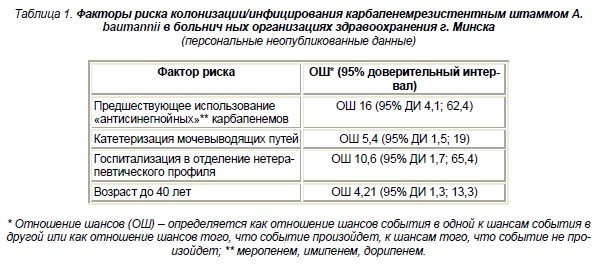
В Республике Беларусь в качестве факторов риска колонизации/инфицирования нозокомиальным изо-лятом Acinetobacter baumannii, устойчивым к кар-бапенемным антибиотикам, были выделены пред-шествующее использование «антисинегнойных» карбапенемов, катетеризация мочевыводящих пу-тей, госпитализация в отделение нетерапевтиче-ского профиля и возраст до 40 лет (табл. 1).
Ацинетобактерассоциированные инфекции
A. baumannii в большинстве случаев вызывает за-болевания у тяжелобольных иммуноскомпромети-рованных пациентов[4, 10, 11, 14, 16, 23, 28, 29]. Данный микроорганизм может являться причиной инфекций дыхательных путей (синусит, трахео-бронхит, пневмония), кровотока (сепсис, эндокар-дит естественных и искусственных клапанов), мо-чевыводящих путей, раневой и хирургической ин-фекций, инфекций кожи и мягких тканей (включая некротизирующий фасциит), нервной системы (ме-нингит, вентрикулит, абсцесс мозга), интраабдоми-нальных (абсцессы различной локализации, пери-тонит), опорно-двигательного аппарата (остеомие-лит, артрит) [11, 21, 28–30].
По данным собственных исследований, проведен-ных в 15 больничных организациях здравоохране-ния г. Минска, в структуре A. baumannii-ассоциированных инфекций превалируют инфек-ции кровотока, составляя 39,4% от всех инфекций, вызванных данным возбудителем. Второе место занимают инфекции дыхательных путей (35,4%), третье (19,7%) – инфекции кожи и мягких тканей (включая инфекции хирургической раны). Остеоми-елиты наблюдались в 4,7% случаев, инфекции мо-чевыводящих путей – 0,8% случаев.
Инфекции кровотока. Клинические проявления инфекций кровотока, вызванных A. baumannii, ва-рьируются от транзиторной бактериемии до крайне тяжелого заболевания с высоким уровнем смерт-ности [31]. Воротами инфекции чаще всего являют-ся дыхательные пути, однако при первичном разви-тии септического процесса основную роль играют внутрисосудистые катетеры [31–33]. Реже входны-ми воротами служат мочевыводящие пути, кожа и мягкие ткани, ожоговые раны, органы брюшной по-лости и центральная нервная система [31]. Внутри-больничный сепсис, вызванный A. baumannii, в 73% случаев развивается после 15-го дня госпитализа-ции [34]. Септический шок развивается примерно у 30% пациентов с ацинетобактерассоциированным сепсисом [35]. В то же время, больные с бактерие-мией, связанной с внутрисосудистыми катетерами,
характеризуются лучшим прогнозом, предположи-тельно потому, что источник инфекции может быть элиминирован из организма при удалении катетера [7, 36].
Факторами риска развития инфекций кровотока, вызванных A. baumannii, являются экстренная гос-питализация, длительное пребывание в стациона-ре, предшествующая колонизация ацинетобактери-ями, высокий коэффициент инвазивных процедур, проведение ИВЛ, пожилой возраст или возраст ме-нее 7 дней, вес менее 1500 г (для новорожденных), иммуносупрессия, злокачественные заболевания, сердечно-сосудистая недостаточность, почечная недостаточность, дыхательная недостаточность во время поступления в ОРИТ, наличие в анамнезе эпизода сепсиса, развившегося в ОРИТ, предше-ствующая антибактериальная терапия (особенно цефтазидим или имипенем) [7, 19, 24, 33, 34].
Инфекции дыхательных путей. A. baumannii, наряду с Pseudomonas aeruginosa, Stenotrophomonasmaltophilia и MRSA, является воз-будителем поздних (развивающихся позже 5 дней с момента госпитализации) эпизодов нозокомиаль-ной пневмонии. Кроме времени манифестации ин-фекции имеют значение также предшествующая антибактериальная терапия и госпитализация в те-чение последних 60 дней [37].
Нозокомиальные ацинетобактерассоциированные пневмонии чаще всего полисегментарные. Может наблюдаться формирование полостей в легких, плевральный выпот, образование бронхоплевраль-ной фистулы [35].
Независимыми факторами риска развития ВАП, вызванной A. baumannii, являются предшествую-щая антибактериальная терапия и наличие острого респираторного дистресс-синдрома [12, 16, 37, 38]. Предшествующий эпизод сепсиса, использование антибактериальных препаратов до развития ин-фекции (особенно имипенема, фторхинолонов и цефалоспоринов III поколения, пиперацилли-на/тазобактама), продолжительность ИВЛ более 7 дней, реинтубация, длительность пребывания в стационаре определены в качестве факторов риска развития ВАП, вызванной мультирезистентным штаммом A. baumannii [12, 16, 21, 38, 39].
A. baumannii является третьей по частоте причиной нозокомиального трахеобронхита (НТБ) у пациен-тов на ИВЛ, обуславливая 13,6 и 26,5% случаев НТБ у пациентов с хирургической и терапевтиче-ской патологией соответственно. Развитие НТБ до-стоверно приводило к увеличению срока пребыва-ния в ОРИТ и продолжительности проведения ИВЛ даже в случаях, если у пациентов впо-следствии не развивалась нозокомиальная пневмония[40].
Инфекции кожи и мягких тканей. A. baumannii яв-ляется значимым патогеном при травматических повреждениях, ожогах, а также в отношении ин-фекционных осложнений послеоперационных ран [35, 41, 42]. Инфекции кожи и мягких тканей, вы-званные A. baumannii, в большинстве случаев осложняются бактериемией [43].
Ацинетобактерии способны вызывать инфекции подкожной жировой клетчатки в месте постановки внутривенного катетера, разрешения которых мож-но достичь только после его удаления [35].
Инфекции нервной системы. Acinetobacter baumannii способен вызывать внутрибольничные менингиты, абсцессы головного мозга [44–46]. Ме-нингит может развиться остро или иметь по-степенное начало. На кожных покровах может наблюдаться петехиальная сыпь (до 30% случаев) [35]. Изменения спинномозговой жидкости при ме-нингите, вызванном A. baumannii, не отличаются от соответствующих изменений при менингитах дру-гой этиологии и представлены: плейоцитозом с преобладанием нейтрофилов, увеличением уровня белка и молочной кислоты, снижением уровня глю-козы [46].
Факторы риска развития ацинетобактерного менин-гита включают: экстренное нейрохирургическое вмешательство, наружную вентрикулостомию (осо-бенно проводимую ³5 дней), наличие цереброспи-нальной фистулы, нерациональное использование антибактериальных препаратов в нейрохирургиче-ских ОРИТ [46, 47].
Инфекции мочевыводящих путей (ИМП). Не-смотря на частую колонизацию нижних отделов мо-чевыводящих путей ацинетобактерии редко явля-ются этиологическим агентом ИМП [35]. Acinetobacter spp. выделяются в 1–4,6% случаев нозокомиальных ИМП [47, 48].
Факторами риска ацинетобактерассоциированных ИМП являются наличие катетера в мочевом пузыре и нефролитиаз [35].
Другие инфекции. Ацинетобактерии вызывают пе-ритонит у пациентов, находящихся на длительном амбулаторном перитонеальном диализе; а также холангит на фоне чреспеченочной холангиографии или дренирования желчевыводящих путей [12, 47]. Остеомиелиты и артриты, вызванные A. baumannii, связаны с внедрением искусственных имплантатов или травмой [12]. Описаны также ацинетобактерас-социированные поражения глаз, связанные с кон-таминацией мягких контактных линз (изъязвление и прободение роговицы). Возможно развитие других поражений органа зрения от конъюнктивита до эн-дофтальмита [35].
Диагностика и определение чувствительности к антимикробным препаратам
В клинической практике инфекции, вызванной A. baumannii, предшествует колонизация кожных покровов, дыхательных и мочевыводящих путей, желудочно-кишечного тракта пациентов [16, 18, 29, 46, 49]. Значительное распространение A. baumannii как колонизирующего микроорганизма требует объективной оценки ситуации при выделе-нии из биологического материала пациента [12]. В то же время, следует отметить, что выделение Acinetobacterspp. в качестве колонизирующего мик-роорганизма является прогностически значимым для определения этиологии последующей нозоко-миальной инфекции (положитель-ная/отрицательная предиктивная ценность – 94/73% для ВАП, 43/100% для инфекций кровотока соответственно) [49].
Диагностика нозокомиальной инфекции, в т.ч. A. baumannii-ассоциированной, с клинических пози-ций условно подразделяется на 4 этапа:
—
—
- 1. Забор и транспортировка клинического мате-риала.
—
- 2. Идентификация возбудителя.
—
- 3. Определение этиологической значимости вы-деленного микроорганизма.
—
- 4. Определение чувствительности к антимикроб-ным препаратам и интерпретация полученных результатов.
Правильный сбор и транспортировка клинического материала позволяют свести к минимуму вероят-ность недостоверных результатов лабораторных исследований, а следовательно, и уменьшить «не-адекватное» назначение антимикробных препара-тов.
Общие правила забора клинического материала на микробиологическое исследование ([50] с измене-ниями):
—
—
- 1. Забор, по возможности, необходимо проводить до начала антибактериальной терапии. Если больной уже получает антибактериальную те-рапию, то клинический материал следует брать непосредственно перед очередным введением препарата.
—
- 2. Материал для бактериологического исследова-ния необходимо забирать непосредственно из очага инфекции. При невозможности – исполь-зовать другой клинически значимый биологиче-ский материал.
—
- 3. Строго соблюдать правила асептики, не допус-кая контаминации материала посторонней мик-рофлорой.
—
- 4. Для взятия отделяемого из раны, мазков со слизистых оболочек, из глаза, уха, носа, зева, цервикального канала, влагалища, анального отверстия следует использовать стерильные ватные тампоны. Для крови, гноя, ликвора и экссудатов – стерильные шприцы и специали-зированные транспортные среды; для мокроты, мочи, кала – стерильные плотно закрывающие-ся контейнеры.
—
- 5. Количество материала должно быть достаточ-ным для проведения исследования.
—
- 6. Нативный материал доставляют в лаборато-рию в максимально короткие сроки (не позднее 1,5–2 ч после их получения). Допускается хра-нение материала в холодильнике при 4 оС (кроме биологического материала, полученного из стерильных в норме локусов: ликвора, крови, внутрисуставной и плевральной жидкости). При использовании транспортных сред клинический материал можно хранить в течение 24–48 ч.
—
- 7. Жидкий биологический материал можно транс-портировать непосредственно в шприце, на кончик которого надет стерильный колпачок или загнутая под углом игла.
Идентификация возбудителя. Род Acinetobacter (семейство Moraxellaceae) состоит из строгих аэробных, неподвижных грамотрицательных лакто-занеферментирующих оксидазаотрицательных, ка-талазаположительных коккобактерий размером 1–1,5 х 1,5–2,5 мкм, окисляющих глюкозу до кислоты только в присутствии кислорода и способных расти на обычных питательных средах [11, 21, 28, 32, 47, 51–53]. На плотных питательных средах колонии
гладкие, непрозрачные, несколько меньшие по размерам, чем представители энтеробактерий.
Типичные морфологические формы эти микроорга-низмы имеют в мазках, сделанных из клинического материала или из жидких питательных сред. При росте на плотных средах в присутствии антибиоти-ков в мазках бактерии имеют форму палочек [54, 55]. Некоторые изоляты ацинетобактерий могут за-держивать кристаллический виолет, плохо обес-цвечиваясь при окраске по Граму, что приводит к их ошибочной интерпретации как грамположительных бактерий [52].
Трактовка результатов([50] с изменениями и до-полнениями). По глубокому убеждению авторов, достоверным критерием инфекции, связанной с условно-патогенной внутрибольничной микрофло-рой, в том числе и Acinetobacter baumannii, являет-ся выделение культуры из стерильного источника.
Кровь. Материал для исследования необходимо брать как минимум из двух периферических вен в разные флаконы. Не допускается взятие крови из венозного катетера за исключением случаев, когда имеется подозрение на катетерассоциированную инфекцию. При сравнении посевов двух порций крови, взятых из катетера и периферической вены и засеянных количественным методом, получение роста колоний из катетера, превышающего в 5–10 раз число идентичных колоний при посеве веноз-ной крови, свидетельствует о наличии инфекции, связанной с катетером.
Ликвор. Выделение A. baumannii в низких концен-трациях затрудняет интерпретацию результатов, особенно в отделениях, где этот микроорганизм часто колонизирует кожные покровы пациентов. Вероятность его этиологической значимости значи-тельно повышается в случае выделения ацинето-бактерий из ликвора у пациентов с уже имеющейся инфекцией, вызванной A. baumannii, вне централь-ной нервной системы (так называемый вторичный менингит), после проведения нейрохирургических вмешательств, у пациентов с проникающими по-вреждениями черепа, особенно на фоне имеющих-ся факторов риска ацинетобактерассоциированных инфекций.
Интерпретация клинического значения ацинетобак-терий, выделенных из нестерильных локусов, – многофакторный процесс, зависящий от квалифи-кации клинициста, микробиолога, специалиста за-биравшего материал, состояния пациента. Ниже-приведенные критерии в определенной мере явля-ются условными, но в то же время позволяют по-высить вероятность адекватной трактовки выде-ленного микроорганизма, как колонизирующего агента или возбудителя инфекции.
Мокрота. Выделение ацинетобактерий в количе-стве ³106 КОЕ/мл (из бронхиальных смывов ³104 КОЕ/мл) является диагностически значимым при условии соблюдения правил забора мокроты. Од-нако эти значения не являются абсолютными, так как на фоне антибактериальной терапии количе-ство причинно значимых бактерий в мокроте сни-жается и, наоборот, возрастает концентрация ко-лонизирующей микрофлоры.
При исследовании мокроты ее бактериоскопия яв-ляется обязательной, так как позволяет судить о качестве взятого материала. Наличие в одном поле зрения при малом увеличении более 10 эпители-альных клеток и/или менее 25 полиморфно-ядерных лейкоцитов указывает на контаминацию образца слюной, поэтому дальнейшее исследова-ние этого материала нецелесообразно. В таком случае мокроту следует взять повторно с соблюде-нием всех правил забора.
Материал при раневой инфекции. Следует ис-ключить возможную контаминацию исследуемого материала изолятами A. baumannii с поверхности кожи, особенно при использовании тампонов. При выделении смешанных культур, предпочтение сле-дует отдавать микроорганизмам, выделенным в большей концентрации.
Моча. Диагностически значимым является выделе-ние бактерий в концентрации ³105 КОЕ/мл при наличии симптомов заболевания. При взятии мочи из непосредственно мочевого пузыря без катетери-зации мочевыводящих путей выделение ацинето-бактерий в любом титре считается значимым. Наличие трех и более видов микроорганизмов в больших концентрациях указывает на контамина-цию во время сбора мочи или на ее неправильное хранение.
Дополнительным маркером этиологической значи-мости Acinetobacter baumannii является положи-тельная динамика общего состояния пациента на фоне противоацинетобактерной терапии [37].
Интерпретация антибиотикограммы ([56, 57] с изменениями и дополнениями). После получения
результатов тестирования возбудителя на чувстви-тельность к антибактериальным препаратам, не следует назначать этиотропную терапию формали-зованно, опираясь лишь на показания антибиотико-граммы. Чувствительнось организма к тому или иному антимикробному препарату in vitro не всегда коррелирует с его активностью in vivo. Это может быть связано как с индивидуальными особенностя-ми фармакокинетики и/или фармакодинамики пре-парата у данного конкретного пациента, так и с по-грешностями в методике исследования, качеством используемых материалов и т.д.
При анализе антибиотикограммы следует обра-щать внимание не на какой-либо конкретный пре-парат(ы), к которому(ым) возбудитель чувствите-лен/резистентен, а на всю картину в целом. Это позволяет, сопоставив вероятный фенотип рези-стент-ности ацинетобактерий с фактическими дан-ными, скорректировать последние, избежав тем самым назначения малоэффективных препаратов.
В частности, для выявления штаммов, продуциру-ющих бета-лактамазы расширенного спектра дей-ствия (БЛРС) следует обращать внимание на чув-ствительность возбудителя к цефокситину и азт-реонаму. Если изолят продуцирует БЛРС цефокси-тин сохраняет активность, а азтреонам нет. В этом случае изолят необходимо расценивать, как рези-стентный ко всем цефалоспоринам I–IV поколения и азтреонаму вне зависимости от фактических ре-зультатов антибиотикограммы. Если штамм устой-чив к цефокситину, но чувствителен к азтреонаму, он является продуцентом хромосомных бета-лактамаз. В этом случае цефалоспорины IV поко-ления могут сохранять свою активность.
В случае определения чувствительности только к одному из «антисинегнойных» карбапенемов, не следует оценивать чувствительность остальных по аналогии с ним. Различные представители кар-бапенемов в неодинаковой степени подвержены действию того или иного механизма резистентно-сти. A. baumannii, резистентный, например, к меро-пенему, может сохранять чувствительность к ими-пенему и/или дорипенему и наоборот.
При обнаружении штамма, резистентного к коли-стину, необходимо с осторожностью относиться к такому результату и повторно определить чувстви-тельность с параллельным тестированием кон-трольных штаммов.
В отношении аминогликозидов интерпретационная оценка антибиотико-граммы крайне затруднительна ввиду большого количества аминогликозидмоди-фицирующих ферментов и вариабельности их суб-стратного профиля. Поэтому для аминогликозидов допустимы самые различные сочетания чувстви-тельности/резистентности внутри класса.
Большинство клинических изолятов A. baumannii резистентно к фторхинолонам и хлорамфениколу, поэтому необходимо с осторожностью подходить к выбору данных препаратов в качестве этиотропных для лечения ацинетобактерассоциированных ин-фекций, несмотря на результаты определения чув-ствительности к антибиотикам. Кроме того, оцени-вая чувствительность Acinetobacter baumannii к хи-нолонам, следует учитывать, тот факт, что для формирования резистентности к нефторированным хинолонам достаточно одной мутации в гене либо ДНК-гиразы (gyrA) либо топоизомеразы IV (parC). Для развития резистентности к фторхинолонам необходимы мутации в обоих генах. Поэтому при получении результатов антибиотикограммы, указы-вающих на чувствительность штамма к налидиксо-вой или пипемидовой кислоте при одновременной резистентности к фторированным хинолонам, сле-дует крайне скептически подходить к данной анти-биотикограмме в целом.
При интерпретации антибиотико-грамм также необ-ходимо учитывать, что Acinetobacterspp. в целом обладают природной резистентностью к цефалос-поринам I и II поколения, природным и аминопени-циллинам, триметоприму, фосфамицину.
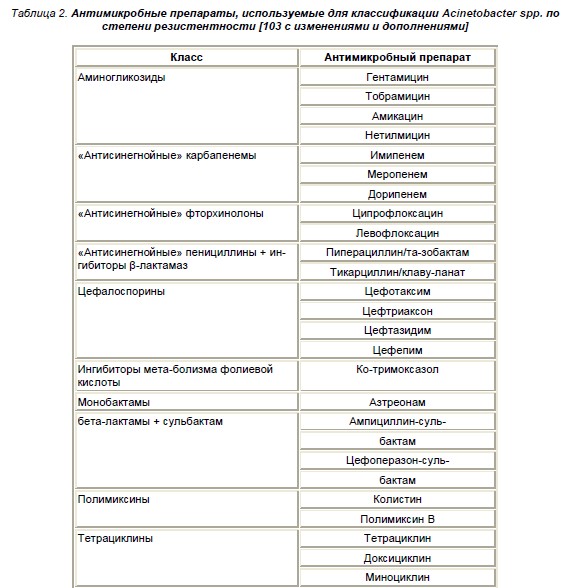
Для характеристики резистентности Acinetobacter baumannii рекомендуется использовать следующие понятия [58]:
—
—
- резистентный (resistant) Acinetobacterbaumannii – нечувствительный к одному антимикробному препарату;
—
- мультирезистентный (multidrug-resistant – MDR) Acinetobacterbaumannii – нечувствительный к ³1 препарату в ³3 классах, перечисленных в табл. 2;
—
- экстенсивно резистентный (extensivelydrug-resistant – XDR) Acinetobacterbaumannii – не-чувствительный к ³1 препарату в ³8 классах, перечисленных в табл. 2;
—
- панрезистентный (pandrug-resistant – PDR) Aci-netobacterbaumannii – нечув-ствительный ко
—
—
- всем перечисленным в табл. 2 антимикробным
—
- препаратам.
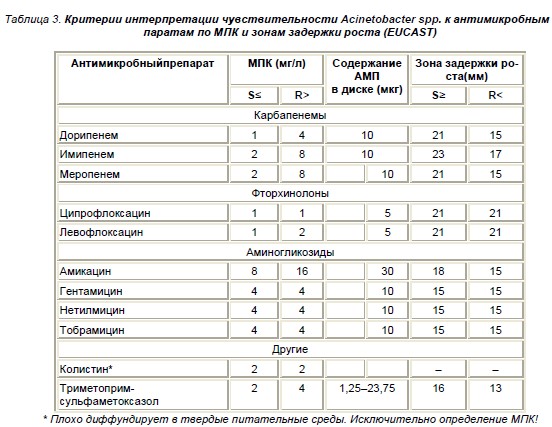
При анализе антибиотикограммы не менее важное значение, чем интерпретация качественных харак-теристик резистентности, имеет оценка минималь-ной подавляющей концентрации (МПК). В ряде случаев, особенно если микроорганизм является промежуточно-резистентным (т.е. значение МПК превышает порог чувствительности, но не достига-ет порогового значения резистентности), исходя из фармакокинетических особенностей препарата, возможно достижение концентрации препарата, превышающей МПК в очаге инфекции, при назна-чении максимальной дозы и/или использовании пролонгированного режима введения. В частности, по данным рандомизированных контролируемых исследований постоянная концентрация препарата, достигаемая в сыворотке при непрерывном введе-нии, в 5,8 раза превосходит минимальную концен-трацию, которая достигается при интермиттирую-щем режиме [59]. А в исследовании D. Wang при сравнении использования меропенема в дозе 1 г каждые 8 часов внутривенно в течение одночасо-вой инфузии и в дозе 0,5 г каждые 6 часов в тече-нии трехчасовой инфузии при лечении вентилято-рассоциированной пневмонии, вызванной мульти-резистентными штаммами A. baumannii, было уста-новлено, что концентрация препарата в сыворотке крови превышала МПК в течение 54 и 75,3% вре-мени между введениями соответственно; стои-мость антибактериальной терапии достоверно бы-ла в 1,5 раза ниже во второй группе [60]. В табл. 3 приведены критерии интерпретации чувствитель-ности по МПК и соответ-ствующие зоны задержки роста микроорганизмов на твердой питательной среде в соответствии с рекомендациями Европей-ской комиссии по определению чувствительности к антимикробным препаратам (The European Committee on Antimicrobial Susceptibility Testing – EUCAST) [61].
Лечение
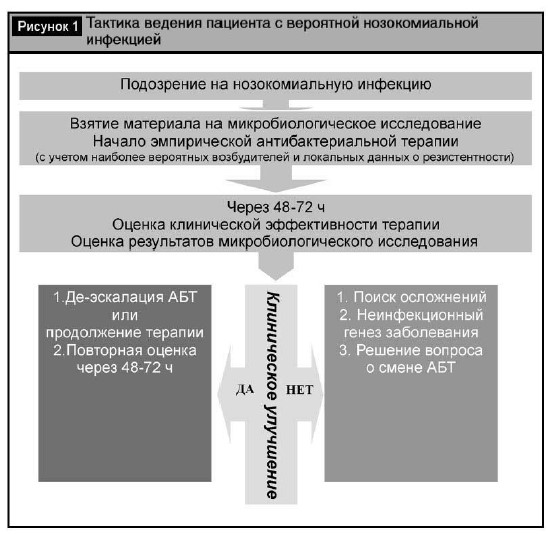
Терапия нозокомиальных инфекций, вызванных Acinetobacter baumannii, проводится в соответствии с общими правилами ведения инфекций, ассоции-рованных с оказанием медицинской помощи (рис. 1). Эмпирическое назначение антиацинетобактер-ной терапии при подозрении на развитие нозоко-миальной инфекции оправдано в тех организациях здравоохранения или их структурных подразделе-ниях, где A. baumannii является одним из ведущих возбудителей данных инфекций, с учетом факторов риска.
Оценка эффективности проводимой терапии долж-на проводиться через 48–72 ч после ее начала вне зависимости от того, назначена была терапия эм-
пирически или после выделения возбудителя. Она должна базироваться на динамике клинической картины и результатах микробиологических иссле-дований (в том числе повторных), причем превали-рующим фактором для оценки должна служить клиническая картина.
Несмотря на ряд исследований, указывающих на возможность уменьшения длительности антибиоти-котерапии, не следует сокращать продолжитель-ность антимикробной терапии при инфекциях, вы-званных A. baumannii. Так в мультицентровом ран-домизированном исследовании было выявлено, что сокращение сроков антибактериальной терапии ВАП, вызванной неферментирующими грамотрица-тельными микроорганизмами, с 15 до 8 дней связа-но с возрастанием частоты рецидивов [53].
При выборе терапии следует учитывать, что во всем мире наиболее активными антибактериаль-ными препаратами в отношении A. baumannii яв-ляются сульбактам, карбапенемы, аминогликозиды, полимиксины, тайгециклин и миноциклин [3, 11, 21]. Однако выбор конкретного антимикробного препа-рата, который может быть использован для эмпи-рической терапии A. baumannii-ассоциированных инфекций, должен основываться на локальных данных отделения или организации здравоохране-ния, где развилась нозокомиальная инфекция.
В том случае, если антимикробная терапия назна-чается после выделения ацинетобактерий из пато-логического материала, выбор антибиотика должен базироваться на антибиотикограмме, с учетом ин-терпретационного анализа ее результатов (раздел «Диагностика и определение чувствительности к антимикробным препаратам»).
Сульбактам. Сульбактам в настоящее время яв-ляется препаратом выбора для лечения ацинето-бактерассоциированных инфекций [11, 28, 62]. В Республике Беларусь к данному антимикробному препарату чувствительны 84,8% госпитальных изо-лятов A. baumannii.
Сульбактам обладает внутренней антимикробной активностью против A. baumannii, которая не зави-сит от находящегося с ним в комбинации бета-лактамного препарата [31, 32, 62].
В экспериментальных исследованиях на животных эффективность сульбактама была сравнима с эф-фективностью карбапенемов в отношении карбапе-немчувствительных ацинетобактерий. В клиниче-ских исследованиях комбинация сульбактам/бета-лактам показала аналогичную эффективность в сравнении с карбапенемами при ВАП и сепсисе, вызванными мультирезистентными изолятами A. baumannii. Исходы лечения сепсиса, обусловленно-го мультирезистентным штаммом A. baumannii, с использованием сульбактама не отличались от ис-ходов, наблюдаемых при лечении другими анти-бактериальными препаратами сепсиса, вызванного нерезистентными A. baumannii [28].
При парентеральном введении концентрация суль-бактама в сыворотке крови 20–60 мг/л, в тканях – 2–16 мг/л [62, 63]. Оптимальным режимом дозиро-вания сульбактама является 2 г в виде 30-минутной инфузии через 6 ч или 1 г в виде 3-часовой инфу-зии через 6–8 ч. При использовании высоких доз сульбактама (3 г на одно введение) возможно раз-витие нежелательных лекарственных реакций в ви-де диареи, сыпи, поражения почек [64].
В результате ряда исследований установлено си-нергичное действие сульбактама с меропенемом, имипенемом, рифампицином, цефпиромом, амика-цином [21, 28, 32, 65].
Карбапенемы. Для лечения тяжелых инфекций, вызываемых A. baumannii, могут использоваться имипенем, меропенем и дорипенем [21, 28, 37, 59, 66]. Эртапенем не обладает активностью против Acinetobacterspp. в целом [67, 68].
В связи с возрастанием числа карбапенемрези-стентных штаммов A. bauma-nnii, в том числе и в Республике Беларусь, использование карбапенем-ных антибиотиков для лечения ацинетобактерассо-циированных инфекций в режиме монотерапии в настоящее время является нецелесообразным. Ис-ключение составляют больничные организации здравоохранения, где по данным локального мони-торинга антибиотикорезистентности госпитальных патогенов абсолютное большинство последних со-храняет чув-ствительность к карбапенемам.
В исследованиях in vitro установлено синергичное или аддитивное действие комбинаций имипенем + амикацин + колистин, дорипенем + амикацин, до-рипенем + колистин, меропенем + сульбактам, ме-ропенем + колистин [69–71]; in vivo – имипенем + тобрамицин [28].
Применение комбинации карбапенем + бета-лактам/сульбактам для лечения инфекций кровото-ка, вызванных мультирезистентным A. baumannii, ассоциируется с лучшими результатами лечения, чем использование монотерапии карбапенемом или сочетания карбапенем + амикацин [31]. Однако сочетание имипенема с сульбактамом было ассо-циировано с более низкой частотой выживаемости на модели пневмонии у мышей по сравнению с комбинацией имипенем + рифампицин [28].
При выборе препарата из данного класса для ле-чения ацинетобактерассоциированных инфекций необходимо учитывать, что в Республике Беларусь имипенем обладает несколько большей активно-стью в отношении нозокомиальных изолятов A. baumannii в сравнении с меропенемом (44,1 и 38,6% чувствительных штаммов, соответственно). Активность дорипенема превышает активность имипенема и меропенема только лишь в отноше-нии изолятов A. baumannii, имеющих ген OXA-58, активность имипенема – в отношении OXA-23-продуцирующих штаммов A. baumannii [72, 73]. Од-нако в Республике Беларусь превалируют OXA-40-продуцирующие штаммы ацинетобактерий, что не позволяет говорить о преимуществах данного пре-парата перед другими представителями класса в лечении инфекций, вызываемых A. baumannii.
Аминогликозиды. Аминогликозиды часто исполь-зуются в лечении инфекций, вызываемых грамот-рицательными микроорганизмами, однако госпи-тальные изоляты A. baumannii имеют высокий уро-вень устойчивости к данному классу антибактери-альных препаратов [28]. В Республике Беларусь к гентамицину резистентны 64,4%, к амикацину – 89% исследованных штаммов A. baumannii. Отно-сительно низкий уровень резистентности к гента-мицину вероятнее всего связан со снижением ис-пользования этого антимикробного препарата в ор-ганизациях здравоохранения на протяжении ряда последних лет.
Назначение данного класса препаратов возможно только в комбинациях с более активными в отно-шении ацинетобактерий антибиотиками на основа-нии локальных данных о чувствительности возбу-дителя.
Рифампицин. Учитывая наличие чув-ствительности у госпитальных штаммов ацинето-бактерий к рифампицину, данный препарат может добавляться к терапии инфекций, вызванных муль-тирезистентными штаммами [65]. Ряд авторов по-казали эффективность рифампицина в режиме мо-нотерапии, а также в комбинации с имипенемом или сульбактамом [65, 74, 75]. Синергизм характе-рен также для комбинации рифампицина с коли-стином [74]. Показана эффективность рифампици-на и комбинации рифампицина с колистином при менингите, вызванном имипенемрезистентным изолятом A. baumannii [75].
По данным ряда исследований в процессе лечения развивается резистентность к рифампицину как при применении его в режиме монотерапии, так и в со-четании с имипенемом, однако при использовании комбинации рифампицин + колистин было показано отсутствие изменений в МПК рифампицина [74, 76].
Тетрациклины. Тетрациклины (миноциклин, док-сициклин, тетрациклин) в исследованиях invitro об-ладают активностью против A. baumannii [28, 59, 71, 73]. Наибольшую активность проявляет мино-циклин (не зарегистрирован в Республике Бела-русь), который также активен в отношении изоля-тов, резистентных к другим тетрациклинам. В це-лом экспериментальные и клинические данные, ха-рактеризующие использование тетрациклинов при инфекциях, вызванных A. baumannii, крайне мало-численны [28]. Поэтому назначение препаратов данного класса обоснованно только на основании данных антибиотикограммы при отсутствии другой альтернативы.
Полимиксины. Из пяти известных препаратов данного класса (полимиксины А-Е) для клиническо-го использования в настоящее время доступны только полимиксин В и полимиксин Е (колистин). Колистин используется в двух формах: колистин сульфат (для деконтаминации кишечника и для местного применения при инфекциях мягких тка-ней; редко для внутривенного введения) и колисти-метат натрия (для парентерального и ингаляцион-ного введения). Колистиметат натрия (неактивный предшественник колистина) обладает меньшей токсичностью и антибактериальной активностью по сравнению с колистина сульфатом [21, 28].
Полимиксины обладают высокой активностью про-тив штаммов A. baumannii, включая мультирези-стентные и карбапенемрезистентные изоляты [18, 28, 31, 74]. По данным различных исследований уровень клинической эффективности колистина со-ставляет 20–83%, микробиологической 50–92% [21, 65, 77–79]. По данным фармакокинетических ис-
следований концентрация колистина в плазме кро-ви после внутривенного введения находится в пре-делах 1–6 мг/л [80, 81], в ликворе – 25% от сыворо-точной концентрации [77].
Вследствие плохого проникновения через гистоге-матические барьеры у пациентов с инфекциями нижних дыхательных путей полимиксины более предпочтительно назначать ингаляционно, а при лечении инфекций центральной нервной системы – интравентрикулярно или интратекально, в сочета-нии с их парентеральным введением или систем-ным использованием других антимикробных препа-ратов [28, 30, 45, 77].
Частота развития нефротоксичности при примене-нии полимиксинов, по данным современных иссле-дований, сравнима с другими классами антибакте-риальных препаратов и составляет 0–37% [11, 21, 23, 28, 76, 77, 79]. Риск развития нефротоксичности при применении полимиксинов является дозозави-сим [78]. При этом наибольшая частота развития побочных эффектов со стороны почек наблюдалась у пациентов с предшествующим нарушением их функции, однако развивающаяся почечная недо-статочность обычно являлась обратимой [11, 28, 65].
По данным исследований in vitro отмечается синер-гизм колистина с рифампицином, имипенемом, ми-ноциклином и цефтазидимом; полимиксина В с имипенемом, меропенемом и рифампицином [21, 28, 65, 69, 78, 82–84].
В настоящее время парентеральные формы поли-миксинов не зарегистрированы для применения в Республике Беларусь.
Тайгециклин. Тайгециклин оказывает бактериоста-тическое или бактерицидное действие на A. baumannii, не подвержен механизмам резистент-ности, характерным для тетрациклинов [28, 63, 85].
По результатам ряда исследований тайгециклин может сохранять активность в отношении миноцик-линрезистентных, имипенемрезистентных, коли-стинрезистентных, мультирезистентных штаммов A. baumannii [21, 28, 59, 63, 65, 74].
Тайгециклин имеет большой объем распределения и создает высокие концентрации в тканях организ-ма, включая легочную, однако, по мнению ряда ав-торов, концентрация препарата в крови и спинно-мозговой жидкости при рекомендуемом режиме введения является субоптимальной и не обеспечи-вает достаточной антибактериальной активности [21, 28, 59, 85]. Вследствие низких концентраций препарата в моче, не рекомендуется использовать тайгециклин при ИМП [85].
По мнению экспертов Food and Drug Administration (США), доказана эффективность тайгециклина для лечения тяжелых интраабдоминальных инфекций, вызванных MSSA и VSE, тяжелых инфекций кожи и мягких тканей, вызванных MSSA и MRSA, внеболь-ничной пневмонии [21, 29, 59, 63]. В то же время, использование тайгециклина для лечения нозоко-миальной пневмонии (особенно ВАП) сопряжено с повышенным риском летального исхода у тяжелых пациентов[86]. В Республике Беларусь препарат в настоящее время не зарегистрирован.
Таблица 4. Дозы антибактериальных препаратов и кратность их введенияпри лечении A. baumannii-ассоциированных инфекций [87] 
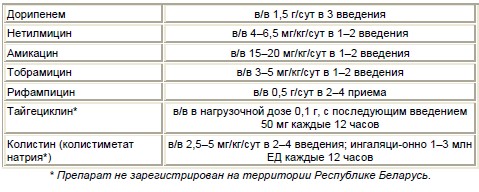
Перспективы терапии инфекций, вызываемых A. baumannii. В исследованиях in vitro описана эффек-тивность нового цефалоспорина – цефтобипрола ? против Acinetobacterspp., однако данные клиниче-ских исследований отсутствуют [59, 88]. Активность цефтобипрола превосходит активность цефтази-дима и цефепима при отсутствии или низкой экс-прессии генов, ответственных за синтез ADC-бета-лактамаз [88]. Британские авторы в исследовании invitro показали активность нового монобактама BAL30072 в отношении 73% CRAB при концентра-ции 1 мг/л и 89% при 8 мг/л [89].
В исследовании invivoс моделированием ожоговых поражений на мышах показана эффективность фо-тодинамиче-ской терапии для лечения локализо-ванных инфекций, вызванных мультирезистентны-ми A. baumannii [90].
Среди принципиально новых разрабатываемых препаратов потенциальной активностью против A. baumannii обладают ингибиторы эффлюксного насоса, ингибиторы ферментов биосинтеза бакте-риальных жирных кислот (FabI- и FabK-ингибиторы), ингибиторы пептидной деформилазы металлоэнзимов, антимикробные пептиды (буфо-рин II, A3-APO), ингибиторы бета-лактамаз класса D на основе бороновой кислоты [65, 91–95]. В ис-следовании invitro продемонстрирована способ-ность экспериментального препарата NAB741, со-держащего циклический полипептидный фрагмент идентичный аналогичному участку полимиксина В, повышать чувствительность Acinetobacterbaumannii к препаратам, для которых неповрежденная наруж-ная мембрана является эффективным барьером [96]. В другом invitro исследовании была показана эффективность ванкомицина в отношении A. baumannii при использовании технологии фузоген-ных липосом для его доставки в периплазматиче-ское пространство [97]. Описана способность ве-ществ, разрушающих биопленку (в частности, на основе 2-аминоимидазола), восстанавливать чув-ствительность мультирезистентных изолятов ацинетобактерий к антибиотикам [98]. Обсуждается возможность разработки так называемых «антиге-нов», направленных на ингибирование генов, отве-чающих за формирование механизмов резистент-ности; активной и пассивной иммунизации [99–101]. В ряде работ показана активность вытяжек и экс-трактов из растений, секретов животных в отноше-нии мультирезистентных ацинетобактерий [91, 102, 103]. В частности, масло Helichrysumitalicum, ду-бильная и эллаговая кислоты значительно снижает уровень резистентности A. baumannii к антибакте-риальным препаратам за счет ингибирования эф-флюкса [91, 103].
В ряде исследований были показаны лизис ацине-тобактерий invitro, а также эффективность приме-нения бактериофагов в лечении эксперименталь-ных инфекций, вызванных Acinetobacter spp., у жи-вотных [65, 104].
Профилактика
Учитывая высокую резистентность Acinetobacter baumannii к антимикробным препаратам, а также способность этого микроорганизма быстро выраба-тывать механизмы устойчивости, большое значе-ние приобретает профилактика A. baumannii-ассоциированных инфекций в организации здраво-охранения, в основе которой лежат принципы и нормы инфекционного контроля.
A. baumannii способны колонизировать обычно сте-рильные объекты, выживать как в сухих, так и во влажных условиях госпитальной среды [21, 28]. Ко-лонизации обычно подвергаются предметы, окру-жающие больного (перья в подушках, матрацы, по-стельное белье, занавески, кровати, прикроватные столики и тумбочки, кислородные и водопроводные краны, вода, использующаяся в аппаратах ИВЛ или для назогастрального введения), а также исполь-зующиеся для ухода за ним, контроля его состоя-ния, осуществления лечебных манипуляций. Среди предметов, использующихся для ухода и осу-ществления лечебных манипуляций A. baumannii выделяется из аппаратов искусственной вентиля-ции легких и механических отсосов, также могут колонизироваться объекты, связанные с внутрисо-судистым доступом (инфузоматы, измерители дав-ления, системы для длительной гемофильтрации, сосудистые катетеры). Среди остального оборудо-вания колонизации могут подвергаться каталки для транспортировки больных, медицинские перчатки, халаты, манжетки тонометров, пикфлоуометры, пульсоксиметры, клинки ларингоскопов, система вентиляции и кондиционирования воздуха [21, 28, 95, 105–109]. Благодаря способности существовать во влажной среде A. baumannii контаминируют са-мые разнообразные растворы, в том числе и неко-торые дезинфектанты (фурацилин, риванол) [28]. Предметы госпитальной среды часто контактирую-щие с руками персонала (дверные ручки, клавиату-ры компьютеров, истории болезни, столы на меди-цинских постах, раковины и даже уборочный инвен-тарь), покрытие пола также служат дополнитель-ным резервуаром A. baumannii [28, 105, 106, 109, 110].
Во время внутрибольничных вспышек инфекций, вызванных A. baumannii, медицинские манипуляции также могут быть связаны с распространением воз-будителя в основном за счет контаминации исполь-зуемых материалов. Такими манипуляциями могут быть гидротерапия или пульс-лаваж ран, хирурги-ческие вмешательства, катетеризация, трахеосто-мия, спинальная пункция [21, 28, 46].
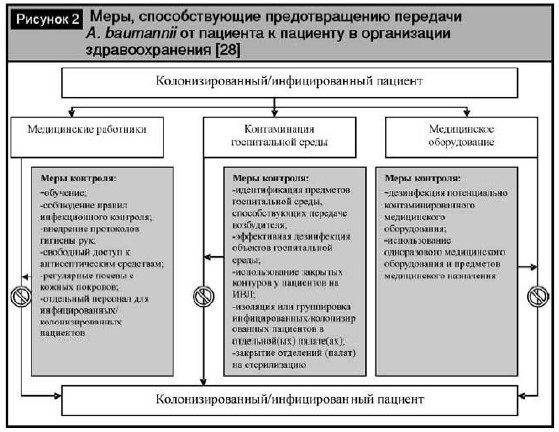
Для адекватного осуществления инфекционного контроля нозокомиальных A. baumannii-ассоции-рованных инфекций необходимо постоянно под-держивать меры, направленные на предотвраще-ние передачи возбудителя от пациента к пациенту (рис. 2), так как основным резервуаром A. baumannii в стационаре являются колонизирован-ные/инфицированные пациенты [15, 105].
За исключением вышеуказанных мероприятий, немаловажное значение имеет введение жестких показаний для назначения антимикробных препара-тов не входящих в первую линию антимикробной те-рапии (например, карбапенемов, цефалоспоринов и фторхинолонов IV поколения и др.), что снижает ча-стоту неадекватного назначения антибиотиков в больничной организации здравоохранения в целом и, как следствие, уровни резистентности госпиталь-ных изолятов в том числе и A. baumannii.
В целом, следует сказать, что Acinetobacter baumannii, является в настоящее время «проблем-ным» возбудителем нозокомиальных инфекций, по-ражающим преимущественно пациентов находящих-ся в тяжелом клиническом состоянии, хорошо адап-тированный к обитанию в госпитальной среде и об-ладающим высокой резистентностью к большинству антисептических и антимикробных препаратов. При назначении антибактериальной терапии, направлен-ной на A. baumannii, следует обязательно учитывать локальные данные о его чувствительности в кон-кретной организации здравоохранения, а более предпочтительно в каждом конкретном отделении.
Данная статья взята из журнала «Медицинские новости», № 5, 2011.










Комментировать