Источник: R. Berner Infektionen durch Gruppe-B-Streptokokken In der Neonatalperiode/ Monatsschr Kinder-heild 2003. 151 : 373-383
Перевод с немецкого – Ю.М.Богданов
Streptococcus agalactae (группа В-стрептококков, GBS) остается наиболее частым возбудителем неонатального сепсиса, даже в индустриально развитых странах. Частота перинатальных GBS инфекций резко увеличилась к началу 70-х годов. Из трех независимых работ в апрельском выпуске Journal of Pediatrics 1973 следовало, что GBS стал наиболее частым возбудителем неонатального сепсиса в США. В это время умирала почти половина пораженных GBS инфекцией новорожденных. Даже сегодня неонатальный сепсис, несмотря на весь достигнутый прогресс в перинатальной медицине, ассоциирует с весьма значительной морбидностью и летальностью.
Внезапное возникновение возбудителей в 70-е годы, а также некоторые другие феномены, сопровождающие неонтальный сепсис, пока еще остаются невыясненными, но медики уделяют этому вопросу пристальное внимание.
GBS дает почти половину изолятов культур крови, выделяемых в течение первых дней жизни у новорожденных с сепсисом.
Возбудитель вполне очевидно происходит из родовых путей матери. Почему же именно GBS с такой частотой переходит на новорожденных до сих пор остается непонятным. Материнский генитальный тракт заселен разнообразными другими схожими или более патогенными бактериями, без того чтобы они могли играть такую эпидемиологическую или подобную роль. Интересно наблюдение того, что инвазивная инфекция развивается только у той части новорожденных, которая постнатально колонизируется GBS.
По меньшей мере, 10% беременных в Германии колонизированы GBS. Почти половина детей от этих матерей также будет колонизирована, однако фактически заболеет только небольшая часть. При величине колонизации матерей GBS в почти 10% , и уровне передачи почти 50% , риск заболевания новорожденного составляет около 0,2% . При этом свою роль играют такие факторы риска, как недоношенность, преждевременный разрыв плодных оболочек, плотность заселения микроорганизмами и др. Особое значение кроме того должна иметь величина специфических материнских антител.
Другим, только в последние годы несколько лучше изученным феноменом, является чрезвычайно сильная активация иммунной системы в рамках GBS инфекции. Клиническая фудроянтность (молниеность) GBS-сепсиса коррелирует с чрезмерно повышенными концентрациями провоспалительного цитокина в крови пупочного канатика. Иммунологические основания для этого в последние годы интенсивно изучаются. Ниже мы представим некоторые из этих новых знаний, а также актуальные аспекты касающиеся клиники, эпидемиологии, терапии и профилактики.
Клиническая картина
Клинический спектр системных GBS инфекций в перинатальном периоде довольно широк и распространяется от септического аборта до транзиторной бактериемии со слабовыраженным клиническим течением. Не всегда можно выявить какие-либо особенности в анамнезе беременности и родов. Даже у доношенных новорожденных, без какихлибо указаний на материнскую лихорадку или синдром инфекции амниона, может в течение нескольких часов жизни развиться тяжелая септическася картина за-болевания.
Традиционно различается две формы сепсиса новорожденных:
- Ранний сепсис (early onset) и
- Поздний сепсис (late onset)
Обычно говорят о ранней форме, если сепсис развился в течение первой недели жизни. К поздней форме относят септикемии, начавшиеся со 2 недели жизни до конца 3 месяца жизни. Более 80% всех случаев раннего сепсиса, вызванного GBS, проявляется в первые 24 часа жизни.
Как и при других возбудителях к ранним признакам сепсиса относятся нарушения дыхания (апное, постанывания, тахи- и диспное) и нарушенная перфузия кожи (сероватая бледность, мраморность), а также тахикардия и артериальная гипотония. Эти клинические признаки сепсиса однако неспецифичны, классические реакции острой фазы в крови запаздывают, так что диагноз часто устанавливается довольно поздно. Респираторная недостаточность (синдром одышки (Atemnotsyndrome) и септический шок часто заставляют проводить интубацию, искусственное дыхание и терапию кровообращения. Иногда течение молниеносно вплоть до полиорганной недостаточности (отказа множественных органов).
Чем больше незрелость новорожденного, тем чаще инфекция GBS протекает как тяжелый сепсис. У доношенных новорожденных чаще отмечается пневмония с иногда тяжелой дыхательной недостаточностью вплоть до персистирующей пульмональной гипертонии новорожденного (PPHN).
Поздняя форма GBS инфекций чаще протекает в виде
менингита . Часто короткий период лихорадки, жажды, беспокойства и чувствительности при касании трактуется неправильно. Позднее развивается полная картина менингита с напржением родничков, лихорадкой, летаргией вплоть до комы и тоническиклоническими судорогами. Течение чаще всего менее фудроянтно, чем при раннем сепсисе, однако нейрологические остаточные повреждения чрезвычайно часты.
Эпидемиология
Хорошо известно, что у 10-30% беременных желудочно-кишечный тракт и генитальный тракт заселены GBS. Однако, до сих пор неясно когда в каком периоде детства и отрочества начинается заселение желудочно-кишечного тракта и имеет ли колонизация полоспецифическую динамику. Недавно было доказано, что уровень заселения у здоровых мужского пола коллег студентов в США был почти таким же, как и у здоровых не беременных студентов женского пола (31% vs. 34%). После вагинальных родов почти у половины детей колонизированных матерей также происходит заселение кожи и слизистых GBS, риск заболевания у доношенных детей составляет около 0,2%. Исходя из когорты 800.000 детей в год в Германии, установленного уровня колонзации беременных в 10%, и риска колонизации детей в 0,2%, а также с другой стороны, из установленной частоты кровопозитивных случаев сепсиса 0,5/1000 можно ожидать развития от 400 до 800 случаев сепсиса в Германии.
ESPED-исследование
1.4.2001 в Германии было начато двухлетнее исследование ESPED (Выявление редких педиатрических заболеваний в Германии) с федеральным охватом инвазивных инфекций, вызванных GBS. Цель исследования состояла в получение данных о частоте инвазивных GBS в Германии, инфекций новорожденных и грудных детей до 3 месяцев жизни, выявлении факторов риска, клинического течения, а также фенотипических и генотипических характеристик изолятов. В центральном офисе ESPED ежемесячно регистрировались позитивные результаты выделений на культурах из крови и ликвора случаев забоелваний GBS. Параллельно с сообщением в ESPED данные микробиологических лабораторий Германии о выделении GBS в культурах крови и ликвора ежемесячно направлялись в Koch-Institut.
За первый год наблюдения с 1.4.2001 по 31.3.2002 имелись только результаты ESPED-выявления, так что точного расчета частоты по Capturerecapture-методу получить не было возможности. Фактическая частота могла бы быть почти в два раза больше, чем число сделанных сообщений в адрес ESPED, которое за 1 год наблюдения составило 231. После исключения 70 уведомлений (65 заявлений о GBS только на основании мазков и 1 сообщение без данных о материале и 1 сообщение без выделения GBS, 4 сообщения с неправильным указанием даты) общее количество составило 161. Выявление GBS имело место в 122 случаях на культуре крови, в 10 случаях в ликворе и в 2 случаях из пунктатов. В 30 других случаях микроорганизм был выделен как из культуры крови, так и культуры ликвора, 2/3 заявленных случаев составляли новорожденные с ранним началом сепсиса, 34% детей заболели в возрасте от 7 дней до 3 месяев постнатально (позднее начало), в 62% случаев речь шла о доношенных новорожденных, 30% составляли недоношенные, в остальных случаях (8%) не было никаких данных о гестационном возрасте. В 73% случаев произошло полное излечение, и около 6% умерло.
С помощью эпидемиологического метода «capture-recapture» после получения всех данных от ESPED и RKI за двухлетний промежуток будет возможно сделать надежные заключения о частоте инвазвиных GBS инфекций в Германии.
На основании единственно основанной культурах крови учете эпизодов, количество случаев GBS ассоциированного сепсиса в значительной степени недооценивается.
Оно должно быть многократно выше при учете большого количества кровьнегативных, так называемых клинических случаев сепсиса. Число этих клинических случаев сепсиса должно поэтому учитываться дополнительно в некоторых меньших Standorten (Strepss-Net), чтобы при этом сделать возможным перерасчет фактической частоты в Германии.
Бактериология
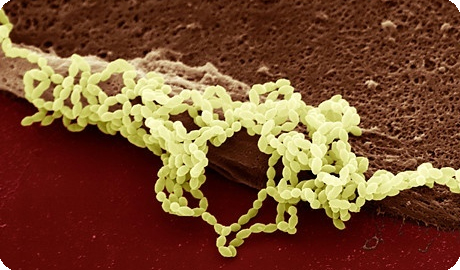
Точное бактериологическое название вида Streptococcus agalactiae ; в клинической речи вошло понятие группа В стрептококков. Речь идет о факультативных грамположительных кокках, располагающихся цепочкой. На бараннем кровяном агаре они дают характерный рост в форме плоских серых колоний, окруженных узким b-гемолитическим двориком с несколько нечетким краем. Очень редко встречаются стрептококки серологической группы В, у которых отсутствует характерное b-гемолитическое проявление, но без того, чтобы это оказывало бы какое влияние на вирулентность.
Streptococcus agalactiae обладает — как и другие гемолизирующие стрептококки — четко установленным углеводным антигеном, прочно связанным с клеточной стенкой и определяющим групповую принадлежность (группу В). Кроме этого, имеется капсула из типоспецифических углеводов, которые кавалентно связаны с пептидогликаном клеточной стенки и определяют принадлежность к определенным серотипам. Наиболее часто встречаемыми серотипами являются Ia, Ib, II, III, IV, V, VI и VIII. Вместе с тем, имеется целый ряд не типированных штаммов. В исследовании ESPEDRKI почти 2/3 изолятов относятся к III серотипу. На втором месте по частоте встречаемости Ia и V серотипы, при чем последний в США уже превзошел по частоте III серотип. В Германии серотип V до недавнего времени вообще не играл никакой роли, но приобретает все возрастающее значение.
Тогда как полисахаридные антигены однозначно идентифицируются как факторы вирулентности, патогенетическое значение протеиновых антигенов GBS остается менее изученным. К протеинам, которым приписывается патогенетическое значение, относится протеиновый комплекс, так называемого, С-протеина, которые участвуют в резистентности против опсонизации и интрацеллюлярной гибели. В частности, b-антиген С-протеина, обладающий способностью связываться с Fcчастью человеческого IgA (как и IgA1 так и IgA2), позволяет предполагать особую ассоциацию с патогенностью.
Благодаря связыванию человеческого IgA с поверхностью бактериальной клетки GBS оказывается способным связывать опсонизирующие антитела или скрывать другие антигены на клеточной поверхности и ингибировать фагоцитоз. Наряду с капсульными полисахарилами и С-протеином с патогнезом GBS-инфекций ассоциируют и другие факторы вирулентности. К ним относятся CAMP-фактор, гемолизин и, недавно идентифицированный протеин (laminin binding protein, Imb), опосредующий связывание GBS с ламинином, главной составляющей частью базальной мембраны. Предполагается, что повреждение, наносимое b-гемолизином эпителию легких, приводит к обнажению базальной мембраны и через опосредуемую Imp прикрепление делает возможным инвазию бактерий в кровообращение.
Патогенез
Условия инфекции
К важнейшим признакам патогенности возбудителя относится полисахаридная капсула, которая определяет серотип и защищает от фагоцитоза и нападения комплемента. Специфические антитела матери, направленные против полисахаридного антигена капсулы, действуют опсонирующе. Можно показать, что пик уровня материнских антител прочно коррелирует с защитой новорожденного от инвазивной инфекции.
Это означает, что отсутствие трансплацентраной передачи серотипспецифических антител матери, является решающим предусловием возникновения инфекции у новорожденного.
Значительный трансферт иммуноглобулинов через плаценту отмечается только на 3 триместре беременности, так что чрезвычайно недоношенные a priori трансплацентарно получают весьма незначительное количество специфических антител.
Кроме того, определенно, что не все беременные вырабатывают достаточное количество специфических антител против капсульных антигенов возбудителя, несмотря на имеющееся массивное ректовагинальное заселение. Возможно, что в основе этого лежит частичный материнский дефицит, образовывать Т-клеточнонезависмые полисахарид-специфические антитела. При отсутствии соответственно высоких титров анттел непосредственная опсонизация возбудителя после инвазии невозможна. Пул нейтрофильных гранулоцитов соответственно не в состоянии быстро и полностью элиминировать возбудителей.
Рекрутирование и быстрое потребление гранулоцитов без элиминации возбудителя в конце концов приводит к истощению запасов гранулоцитов и, вме-сте с тем, как следствию часто наблюдаемой в рамках GBS инфекции
нейтропении . Моноцитарно-макрофагальная система, чья иммунологическая компетенция сохраняется в достаточном объеме, приводит даже к максимальной активации воспалительной реакции, что клинически проявляется синдромом сепсиса, достаточной же элиминации возбудителя, однако, достичь этого не удается без быстрого проведения адекватной терапии.
Иммуноактивация, вызываемая GBS
Выработка провоспалительного цитокина, как TNF-a, после стимуляции мононуклеарных клеток из крови пупочного канатика (CBMNC) GBS, чрезвычайно выражена, объективно сильнее, чем после стимуляции другими возбудителями или LPS. GBS индуцируют сильную транслокацию нуклеарного фактора транскрипции NF-kB, усиленную секрецию TNF-a, а также выработку оксида азота (NO). GBS активируют макрофаги, как составную часть врожденной иммунной системы (innate immunity), через так называемые «pattern recognition receptors (PRR)». К этим рецепторам относятся Toll-like-рецепторы (TLR), играющие ключевую роль в индуцировании иммунных и воспалительных реакций. Внутриклеточная адаптер молекула MyD88 выполняет наряду с другими элементами, решающую функцию в TLR-опосредуемом интрацеллюлярном проведении сигнала, который снова в свою очередь входит в провоспалительную реакцию цитокина.
На соответствующих knockout-моделях удалось продемонстрировать, что иммунная активация, инактивированным нагреванием препаратом целых клеток GBS, однозначно зависит от MyD88 и, вместе с тем от TLR (рис. 7). Ответственный TLR, однако, до сих пор не может быть идентифицирован. В качестве активирующего начала GBS предполагаются составная часть грампозитивной бактериальной клеточной стенки, к которой принадлежат полисахариды, пептидгликан и липотейхоновые кислоты.
Однако, ни один из этих компонентов не обладает сравнимым с LPS иммуноактивирующим потенциалом. Чрезвычайно сильная иммуноактивация — измеряемая выработкой TNF-a — в отличие от этого индуцируется GBS сецернируемым растворимым фактором (GBS-F). Это дополнительное активирование GBS-F, очевидно, также опосредуется через различные PRR. Считается, что CD14, TLR2 и TLR6 действуют как корецепторы для GBS-F. GBS-F представ-ляется мощным проинфламатрным токсином.
Другая гипотеза, объясняющая выраженную иммуностимулирующую потенцию GBS, касается TLR-независимого пути активации. В модели на животных, а также на клеточных культурах после стимуляции сецернируемыми GBS протеинами, проявляется олигоклональная экспансия определенных семей Т-клеток, выражение чего весьма напоминает состоянию иммуноактивации суперантигеном.
Суперантигены характеризуются сильным активированием CD4+ , или CD8+ — T-клеток, без того, чтобы они распознавались, как специфический антиген Т-клеточными рецепторами. У новорожденных с GBS-сепсисом предварительные результаты указывают на то, что и при нем происходит селективная экспансия отдельных семей Т-клеточных рецепторов. Отсюда клинически проявляющийся toxic-shock-like-syndrome очень бы хорошо соответствовал часто наблюдаемой молниености неонатального раннего сепсиса. Подтвержденный многими исследованиями «цитокиновый штурм» мог бы указывать на массивную активацию иммунной ситемы суперантигеном.
Иммуноактивация различными клиническими изолятами
Как было показано, одной из характеристик GBS является способность in vivo и в экспериментальных условиях индуцировать высокую экспрессию цитоки-на в CBMNC. Непонятым клиническим феноменом представляет тот факт, что у многих новорожденных после рождения оказываются заселенными вся кожа и слизистые GBS, но при этом они остаются здоровыми, тогда как у других развивается сверхострая септическая картина. Независимо от факторов риска сопряженных с чрезвычайной недоношеннстью или тяжелым синдромом инфицирования амниона с системным гематогенным поражением, а также высоты уровня специфических материнских антител, со стороны возбудителя имеется мало моментов, которые бы достаточно убедительно могли бы объяснить различные течения.
Если сравнивать клинически и микроскопически довольно характерные GBS изоляты от здорового колонизированного и септического новорожденных в отношении их потенциалов индуцировать экспрессии различных провоспалительных цитокинов, то после стимуляции септическими изолятами вызывается более сильная экспрессия цитокинов, чем изолятами с обычных мазков. Это позволяет интерпретировать в том направлении, что величина иммуноактивации — особенно неонатальных моноцитов или макрофагов — представляет штаммаспецифическую характеристику. Изоляты, вызывающие системную инфекцию и in vivo обуславливающие высокую секрецию цитокинов, также характеризуются in vitro более высоким иммунактивирующим потенциалом. Другие экспериментальные исследования необходимы для выявления тех признаков возбудителя, которые обуславливают это различие.
Цель будущих стратегий вакцинации могла бы состоять в том, чтобы вызывать защитный иммунитет в отношении только тех штаммов GBS, которые проявляют факторы вирулентности, которые приводят к развитию септической картины. Возможно что этими кандидатами для вакцины могли бы стать растворимые протеины возбудителя, естественно создавая более высокую иммуногеннсть, чем таковую производят полисахарижные антигены бактериальной капсулы.
Диагностика
Доказательным для постановки GBS инфекции оказывается выделение возбудителя в культуре крови или ликвора или из других первично стерильных жидкостей организма. Тот факт, что у новорожденных с клинической картиной сепсиса выделение возбудителя через культуру крови не удается осуществить, представляет повседневную клиническую проблему. Причины небольшого числа изолятов из культур крови или ликвора при неонатальном GBS сепсисе многообразны. Они состоят среди прочего и в том, что бактериемия не постоянна и в крови новорожденного плотность возбудителя мала; кроме того, в этой группе пациентов можно получить однократный небольшой объем крови и использовать его для диагностики на культуре.
Не в последнюю очередь, препятствует росту возбудителей из крови ребенка и лечение антибиотиками матери до и во время родов. Иногда удается вырастить бактерии из мекония, секрета желудка или мазков из уха и пупочного канатика. Однако, это доказывает только наличие заселения (колонизации). Из чего следует, что исключительное показание к лечению новорожденого возникает только тогда, когда дополнительно к этому инфекция будет подтверждена клиническими симптомами и лабораторными показателями.
Многие новорожденные оказываются заселенными GBS без клинического того проявления.
В качестве суррогатного параметра за последние годы в педиатрической практике, наряду с дифференциальнйо картиной крови и CRP, которые однако обладают весьма ограниченной чувствительностью, оправдало себя определение провоспалительных цитокинов, из которых широко и рутинно уже определяются интерлейкин (IL)-6 и/или IL-8.
Весьма рационально и желательно проводить скрининг всех беременных в последнем трименоне на заселение (колонизацию) GBS (см. ниже), так как это открывает возможность целенаправленной антибактериальной профилактики во время родов. В качестве материала для исследования может служить комбинированный мазок из Introitus vaginae и Anorectum.Стандартным методом сейчас, как и ранее, является выявление GBS на культуре, при чем на специальных средах, которые в положительном случае будут изменять окраску, что будет значительно сокращать время на проведение теста. Энзиматический скоростной тест и метод PCR не раскрыли себя достаточно хорошо на практике.
Терапия
GBS как и прежде, обладает хорошей чувствительностью к b-лактам антибиотикам, включая пенициллин. Чувствительность к пенициллину in vitro оказывается почти на фактор 10 ниже, чем таковая стрептококков группы А. Хотя GBS in vitro проявляют резистентность к аминогликозидам, однако как in vitro, так и in vivo оказывается, что между b-лактам антибиотиками и аминогликозидами существует синергизм. Вероятно, что действие b-лактама на бактериальную клетчную стенку осуществляет проникновение и, вместе с тем внутриклеточную действенность аминогликозидов. Поэтому появилась рекомендация лечения GBS-инфекций пенициллином (300.000 IE/kg KG день) или ампициллином (200 mg/kg KG день), по меньшей мере в течение 5 дней, в комбинации с аминогликозидом.
Комбинированное лечение, кроме того, имеет своей целью уничтожение толерантных бактерий. При менингите доза b-лактам антибиотиков естественно увеличивается, для пенициллина до 500.000 IE/kg KG день, для ампициллина до 300 mg/kg KG день.
Необходимая общая продолжительность антибактериальной терапии GBS сепсиса точно не установлена. Рекомендуемая продолжительность терапии 7-10 дней при позитивной культуре крови; при так называемом, клиническом сепсисе без выделения возбудителя из крови, вероятно достаточно 5-7 дней, в зависимости от клинической картины и тяжести течения. Лечение менингита должно продолжаться в течение 14 дней после времени установления стерильности ликвора. Цефалоспорины могут применяться в обоснованных отдельных случаях, однако, они не обладают никаким преимуществом в отношении пенициллина или ампициллина. Представляется не рациональной комбинация цефалоспорина и пенициллина или ампициллина в лечении GBS сепсиса.
Рецидивы GBS инфекции могут проявляться даже после завершенного лечения инвазивной GBS инфекции, частота их оценивается в пределах 1% .
Следует исходить из того, что колонизация тем же самым возбудителем сохраняется несмотря на проведение парентаральной терапии. Молекулярно-биологическое типизирование пары изолятов, как правило, это подтверждает. Попытка осуществления эрадикационного лечения рифампицином с подключением к завершающемуся парентеральному лечению действенными антибиотиками — аналогично при инфекциях менингококком и Haemophilus influenzae — не приводит, несмотря на подтвержденную чувствительность возбудителя, к устранению рецидивов заболевания.
Это означает, что антибиотико терапия асимптоматических колонизированных новорожденных с целью предотвращения последующей инвазивной инфек-ции не рациональна и, поэтому не показана.
Антибиотикорезистентность
За последние годы у GBS — как и у других штаммов стрептококков — произошло быстрое развитие резистентности к макролидам и близко родственному классу линкосамидам (клиндамицин). Хотя обе группы субстанций не применяются в лечении неонатального сепсиса, тем не менее, это наблюдение имеет не только чисто академическое значение. Макролиды и клиндамицин рекомендуются в качестве альтернативных препаратов при непероносимости пенициллина при перипартальной профилактике. В полном соответствие с публикациями из других стран, в которых уровень резистентности указывается более 30% , можно также продемонстрировать на основании локальной эпидемиологии в Фрайбурге с 1997 по 1999 года удвоение уровня резистентности к макролилам и клиндамицину.
Подъем резистентности был связан с возрастанием серотипа V, который до сих пор в Германии — в отличие от США и Японии — выделялся довольно редко. С помощью генетического анализа fingerprint можно доказать, что резистентные изоляты идентичны серотипу V, и вместе продемонстрировать увеличение резистентности в связи с распространением отдельных резистентных клонов.
В отношении увеличивающейся резистентности пневмококков и А-стрептококков, а также возрастающего давления селекции из-за проведения амбулаторной антибиотикотерапии и профилактики матерей, следует опасаться дальнейшего возрастания резистентности также и GBS.
Предупреждение и профилактика
В США частота неонатального early-onset-сепсиса и -менигита, вызываемых GBS со времени введения национальных правил по интрапартальной хемопрофилактики CDC в 1996 году, снизилась на 67% — с 1,7 до 0,6/1000 живых родов. В основном применяется 2 альтернативных стратегии интрапартальной профилактики, которые также были рекомендованы обществами специалистов и для Германии (AWMF) : одна из которых «основанная на рисках» и другая «основанная на скрининге» стратегии профилактики.
1. Стратегия основанная на рисках
При стратегии «основанной на рисках» матери в родах получают антибиотики, когда присутствует один или несколько из нижеследующих факторов :
- Предидущий ребенок с инвазивной GBS инфекцией,
- Бактериурия при беременности,
- Угроза преждевременных родов до завершения 37 недель,
- Высокая плотность бактерий GBS в урогенитальном тракте матери ко времени родоразрешения,
- Промежуток времени от разрыва плодных оболочек и родоразрешением превышает равен 18 часам.
- Перипартальная лихорадка >38oC
2. Стратегия основанная на проведении скрининга
В основе стратегии основанной на проведении скрининга лежит бактериальная культура ректовагинального мазка беременной, взятого в промежутке 35 и 37 недель беременности. При выделении GBS рекомендуется проведение антибиотико профилактики. Независимо от результат скрининга антибиотики назначаются, если имеется один из 3 основных факторов риска:
- Предыдущий ребенок с инвазивной GBS инфекцией,
- Бактериурия или
- Угроза преждевременных родов до 37 недели беременности.
В последнем случае в профилактике нет необходимости, если негативная на GBS культура получена в промежутке с 35 по 37 неделю беременности.
Антибиотико профилактика проводится пенициллином (в начале 5 Mega IE i.v. с последующим 2,5 Mega IE каждые 4 часа вплоть до родов) или ампициллин (в начале 2 г i.v. с последующим 1g до родов), при непереносимости пенициллина можно рассматривать клиндацмицин (проходящий через плаценту) или эритромицин (плохо проходящий через плаценту). Профилактическое назначение антибиотиков еще до начала потужной деятельности и/или вскрытия плодных оболочек у беременных с колонизацией GBS не показало себя эффективным, так как у 70% пролеченных женщин ко времени родов вновь происходит колонизация GBS.
Несмотря на успехи материнской антибиотико профилактики, как и прежде продолжается бурная дискуссия о лучшем профилактическом методе и средних и отдаленных рисках относительно широко распространенного применения антибиотиков. В актуальном, но ретроспективном исследовании проведенном в США удалось показать, что «базирующий на скрининге» метод профилактики, как представляется, имеет явные преимущества по сравнению со стратегией «базирующей на рисках» (относительный риск 0,46, 95% -конфиденциальный интервал 0,36-0,6).
В отношении основания дискуссии об интрапартальной профилактике имеющими значение представляются следующие вопросы : До сих пор однозначно не доказано, приводит ли профилактика действительно к снижению частоты неонатального GBS-сепсиса, что a priori вполне вероятно, или же больше исключительно снижает величину случаев подтверждаемых положительными культурами крови.
Это известная проблема, так как имеется большое количество клинических случаев сепсиса, при которых культура крови остается стерильной. Другой открытый вопрос касается предупреждения GBS индуцируемых преждевременных родов. В анализе крупной когорты из 13.646 беременных женщин удалось показать, что высокая плотность заселения GBS на 23-26 неделях беременности ассоциирует с высоким риском преждевременных родов. Проблема преждевременных родов также как и частоты late-onset сепсиса даваемыми рекомендацями по профилактике не затрагивается.. Кроме того были высказаны опасения, что широко распространенное применение антибиотиков повышает вероятность развития аллергических реакций, антибиотико-индуцированного псевдомемранозного колита, а также проблема развития резистентности. Во многих исследованиях, как представляется, препаратальная антибиотико профилактика вызывает увеличение частоты развития случаев неонатального сепсиса, особенно у недоношенных, вызываемого резистентной Escherichia coli.
Эти ограничения, в прочем в общем успешной профилактики GBS, объективно показывают, что было бы разумным подумать об альтернативных стратегиях профилактики.
Развитие вакцин
Уже несколько лет в связи с высокой морбидностью GBS-сепсиса разработка вакцин продвигается вперед. Исследования уже 70-х годов, также как и современные исследования показывают, что отсутствие материнских антител против серотипспецифических полисахаридных капсульных антигенов GBS коррелирует с повышенной восприимчивостью новорожденных к инвазивным инфекциям. Чтобы привести к снижению риска заболевания до 90% , содержание серотипспецифических антител в сыворотке должно быть >5 mg/ml (vs. <0,5 mg/ml). На основании этих исследований можно сделать вывод, что специфическое содержание антител в сыворотке может применяться как суррогатный маркер потенциального защитного действия вакцины.
Так как антитела матери оказывают основное действие, то прививка должна в основном осуществляться во время или до беременности, со всей связанной с этим проблематикой.
В целом ряде клинических и преклинических исследований уже изучены многих из вакцинальных кандидатов. Так Baker et al. показывают, что конъюгатные вакцины, в которых капсульный полисахарид серотипов Ia и Ib связаны с токсоидом тетануса, индуцируют у молодых женщин высокий титр антител с хорошей активностью опсофагоцитоза. Проблематичным представляется, что вакцины и с ними претективный эффект оказываются серотипспецифическими. Из почти 8 серотипов GBS только отдельные немногие обуславливают большую часть инвазивных инфекций у новорожденных, при том, что отмечаются существенные региональные и национальные различия в распределениях серотипов.
Хотя потенциальные вакцины в будущем предполагаются поливалентными, тем не менее, не следует ожидать, что можно охватить все имеющиеся серотипы. Это заставляет еще больше обратить внимание на знание национальных и региональных распространений серотипов GBS инфекций.
Резюме для практики
Группа В стрептококков сегодня, как и раньше, является наиболее частым возбудителем неонатального сепсиса и менингита. Частота в Германии оценивается в почти 0,5/1000 новорожденных, при чем число негатинвых по культуре крови клинических случаев сепсиса может оказаться в несколько раз больше.
Вероятность встречи с неонатальным GBS-сепсисом для клинического и практического педиатров весьма велика. Фульминантность early-onset сепсиса, а также незаметное постепенное начало late-onset сепсиса делают жизненно необходимым умение быстрой постановки диагноза и диагнозаподозрения, а также проведения адекватной терапии. Именно для диагностики early-onset сепсиса в клинической практики оказывает большую помощь определение цитокина IL-6 или IL-8, например, в крови пупочного канатика.
Несмотря на возрастающую антибиотикорезистентность, в терапии пенициллином и аминогликозидами за последние 30 лет ничего не изменилось. Особое значение сегодня приобретает профилактика.
Национальные и международные общества специалистов рекомендуют интрапартальную антибиотикопрофилактику у матери на основании скрининговых исследований на поздних сроках беременности, а также при наличии факторов риска. Так как эти стратегии профилактики хотя и эффективны, но не лишены своей проблематики, то возможно, что в будущем иммунопрофилактика будет осуществляться вакцинацией матери. Хотя уже и достигнуты многообещающие результаты, при этом на сегодня еще остается много нерешенных как практических, так и этических вопросов.
Статья опубликована на сайте
http://www.medafarm.ru







Комментировать