Послеродовые эндометриты. Инфекционные осложнения эпизиотомии. Инфекционные осложнения при эпизиотомии. Мионекроз. Синдром токсического шока. Пудендальные инфекции. Послеродовые маститы. Этиология, патогенез, клиническая картина, диагностика и лечение. Диагностические критерии и тактика ведения.
В. К. Чайка, Т. И. Слюсарь, Т. В. Банникова, Ю.М. Халецкий, С.А. Ласочко, Е.Ф. Неретина, О.Н. Роговая, Н.А. Морозова, И.М. Левченко
1. Послеродовые эндометриты
Одной из наиболее распространенных форм гнойно-воспалительных заболеваний в послеродовом периоде является эндометрит, частота которого после самопроизвольных родов составляет 2-5%, после кесарева сечения 10-20%. Из 100 послеродовых эндометритов 80 сопряжены с операцией кесарева сечения. Частота тяжелых осложнений эндометрита, к числу которых относятся перитонит, тазовые абсцессы, сепсис, составляет менее 2%, но именно на их долю приходится значительное количество случаев материнской смертности.
Эндометрит является начальным локализованным проявлением динамически развивающегося септического процесса. Запоздалая его диагностика и нерациональное лечение могут привести к дальнейшему распространению инфекции.
Послеродовый эндометрит часто развивается у пациенток с сахарным диабетом, артериальной гипертензией, ожирением, коллагеновыми и сосудистыми заболеваниями, при наличии хронических очагов инфекции — в частности, хронического аднексита, тонзиллита, пиелонефрита.
В последние годы появились сведения о высокой частоте хронического эндометрита, при этом в эндометрии выделяются микроорганизмы, которые могут быть потенциальными возбудителями как внутриутробной, так и послеродовой инфекции. Персистенция микроорганизмов в эндометрии в 70% наблюдений сочетается с различными степенями влагалищного дисбиоза, в том числе у 57% женщин с эндометритом выявляется бактериальный вагиноз.
Важное место среди факторов развития послеродового эндометрита занимают осложнения, возникшие в родах: преждевременное излитие околоплодных вод, длительный безводный период, хориоамнионит, частые влагалищные исследования в родах, кесарево сечение, акушерские щипцы, нарушение сократительной способности матки, значительная кровопотеря, обширные разрывы, невыявленная задержка плаценты или плодных оболочек в полости матки, грипп, ОРВИ во время беременности и накануне родов.
При операции кесарева сечения следует учесть, что слишком частое наложение швов на матку в значительной степени ухудшает кровоснабжение и способствует развитию указанного осложнения.
Этиология
Эндометрит — полимикробное заболевание, которое может быть вызвано условно-патогенными бактериями, микоплазмами, хламидиями, вирусами ит. д. В подавляющем большинстве случаев (8090%) это ассоциации аэробных и анаэробных микроорганизмов: стрептококки группы В, Staphylococcus spp., E. coli, Proteus spp., Klebsiella spp., Enterobacter spp., Bacteroides spp., Peptostrep-tococcus spp., G. vaginalis, C. trachomatis. При кесаревом сечении менее 10% составляют аэробы, при родах через естественные родовые пути более 90% — анаэробы.
Среди аэробных возбудителей эндометрита наиболее часто встречаются кишечная палочка (33%) и протей (33%). Также отмечается высокая частота обнаружения золотистого стафилококка (31%), однако данный микроорганизм обычно выявляется в ассоциации с другими аэробами (чаще всего кишечной палочкой, энтерококком) и анаэробами. Основными представителями анаэробной флоры при эндометрите являются бактероиды (43%). Несколько реже встречаются представители анаэробных грамположительных кокков — пептококки (36%), пептострептококки (25%).
Анализ количественной обсемененности микрофлорой полости матки показывает, что при эндометрите она достоверно выше, чем у здоровых родильниц. При этом прослеживается прямая зависимость между степенью микробной обсемененности и тяжестью клинического течения заболевания. При неосложненном течении послеродового периода показатель 10-Ю3 КОЕ/мл соответствует низкой степени обсемененности, показатели в пределах 103—109 КОЕ/мл являются прогностическими между нормой и инфекционным процессом.
Содержание микробов 104-106 КОЕ/мл соответствует средней степени обсемененности и свидетельствует о развитии инфекционного процесса. При тяжелом течении эндометрита чаще отмечается показатель обсемененности полости матки в пределах 107-109 КОЕ/мл. Имеется зависимость между клинической тяжестью эндометрита и частотой обнаружения микробных ассоциаций с изменением вида микробов-ассоциантов. Так, параллельно с нарастанием тяжести заболевания кроме типичных представителей аэробов-энтерококков и энтеробактерий чаще выделяется вирулентный стрептококк группы В, в несколько раз возрастает частота обнаружения пептострептококков, чаще выделяется более патогенный штамм бактероидов (В. Fragilis).
На характер микрофлоры, выделяемой из полости матки у женщин с эндометритом, оказывает влияние проводимая антибиотикотерапия. Невероятный рост энтерококков связан, в основном, с проведением антибактериальной терапии, а именно — с широким применением аминогликозидов и цефалоспоринов, к которым энтерококки нечувствительны.
Таким образом, в этиологии гнойновоспалительных осложнений преобладают ассоциации грамположительных условнопатогенных аэробных и анаэробных микроорганизмов, в том числе входящих в состав нормальной эндогенной флоры нижнего отдела генитального тракта.
Патогенез
Основными путями распространения инфекции при эндометрите являются:
- восходящий, что связано с повышающейся ролью в этиологии гнойно-воспалительных заболеваний условно-патогенных микроорганизмов, обитающих во влагалище беременной женщины (особенно это свойственно неспецифическим микробам
- стафилококкам, стрептококкам);
- гематогенный;
- лимфогенный;
- интраамниалъный, связанный с внедрением в акушерскую практику инвазивных методов исследования (амниоскопии, ам-ниоцентеза, кордоцентеза, редукции эмбрионов при многоплодной беременности и др.). Воспалительный процесс может развиваться и в результате активизации нормальной эндогенной флоры влагалища (например, при ослаблении защитных сил организма или местного иммунитета), изменений эндокринной системы вследствие внешнего воздействия (роды, аборт).
Возникновение и течение инфекционного заболевания у родильниц в значительной мере определяется состоянием клеточного и гуморального иммунитета. Установлено, что даже у здоровых женщин во время беременности и в ранние сроки послеродового периода наблюдается транзиторный частичный иммунодефицит. Отмечается угнетение Т-клеточного (Т-лимфоцитопения, снижение пролиферативной активности лимфоцитов, повышение активности Т-супрессоров) и гуморальных звеньев иммунитета.
У беременных с инфекционными осложнениями в послеродовом периоде имеются нарушения клеточного иммунитета, которые выражаются в снижении общего числа Т-иВ-лимфоцитов, угнетении функциональной активности Т-клеток, активации Т-супрессоров. Одновремено наблюдаются изменения гуморального иммунитета с изменением концентрации IgG иМ. В целом характер обнаруживаемых у родильниц с эндометритом изменений свидетельствует о наличии у них вторичного иммунодефицита.
По своей сути эндометрит — это проявление раневой инфекции. Внутренняя поверхность матки после отделения последа представляет собой обширную рану, заживление которой протекает согласно общебиологическим законам заживления любой раны. При этом на первом этапе происходит очищение внутренней поверхности матки через воспаление (I фаза раневого процесса) с последующей эпителизацией и регенерацией эндометрия (II фаза раневого процесса).
Одним из основных механизмов патогенеза развития хронического воспалительного заболевания половых органов является состояние эндогенной интоксикации. Первичной причиной возникновения синдрома эндогенной интоксикации у больных с хроническим воспалительным процессом внутренних гениталий являются патогенные микроорганизмы. Их эндо-и экзотоксины, а также другие продукты жизнедеятельности угнетают функцию ретикулоэндотелиальной системы, снижают активность фагоцитов, титр комплемента и других факторов неспецифической резистентности организма, нарушают микроциркуляцию в органах и тканях. Нерациональная, часто необоснованная антибактериальная терапия и возвратная инфекция поддерживают этот процесс.
Важную роль в патогенезе хронического воспалительного процесса играет иммунная система. Некоторые исследователи установили, что вялотекущие рецидивирующие заболевания матки и придатков сопровождаются развитием у таких больных состояния вторичного иммунодефицита, снижающего сопротивление организма к инфекциям. Уровень снижения функциональной активности иммунной системы зависит от длительности патологического процесса.
Клиническая картина
Различают три клинические формы эндометрита — легкую, средней тяжести и тяжелую, отличающиеся друг от друга выраженностью отдельных симптомов (лихорадка, интоксикация, локальные проявления), изменениями лабораторных показателей, продолжительностью заболевания.
Эндометрит чаще протекает в легкой форме и заканчивается выздоровлением. Лишь у каждой четвертой родильницы он имеет тяжелое течение с явлениями интоксикации.
Для эндометрита средней тяжести заболевания характерны относительно позднее начало (на 5-12 сутки послеродового периода), повышение температуры тела до 37-38 С, отсутствие озноба, умеренное увеличение СОЭ (30-40 мм/ч), лейкоцитоз в пределах 9-12х109/л, незначительный нейтрофильный сдвиг белой крови. Общее самочувствие родильниц существенно не изменяется, сон, аппетит остаются хорошими, головной боли нет.
Матка несколько увеличена, лохии длительное время остаются кровянистыми.
Эндометрит с тяжелым течением начинается на 2-3 сутки послеродового периода. Характерно повышение температуры до 39,6 °С и выше, нередко с ознобом. Больные отмечают слабость, недомогание, головную боль, нарушение сна, аппетита, боль внизу живота.
Местные проявления характеризуются болезненностью при пальпации матки, замедлением процессов формирования шейки матки, обильными кровянистыми лохиями, которые постепенно переходят в гнойные.
Критерии диагностики послеродового эндометрита (со вторых суток после родов):
- неоднократный подъем температуры от 37,5 °С, бледность кожных покровов;
- язык сухой, обложен налетом;
- тахикардия, некоторое снижение АД;
- лейкоцитоз — от 12 000 и выше;
- выраженное ускорение СОЭ — 50 мм/чи выше;
- палочкоядерный нейтрофильный сдвиг от 10% и более;
- анемия;
- болезненность и пастозность матки;
- гноевидные лохии;
- бактериологическое определение этиологической картины микрофлоры в количестве более или равном 104-105 КОЕ/мл.
Следует помнить, что в первые сутки после родов эти критерии неинформативны.
При осложненном течении эндометрита, отсутствии эффекта от лечения важная информация может быть получена при культуральном исследовании крови пациентки. У 10-30% родильниц с эндометритом возбудитель выявляется уже на ранних этапах заболевания. Получение роста микроорганизмов в посеве крови уточняет диагноз и степень распространения инфекционного процесса. Следует уточнить, что если посевы из матки у родильниц с эндометритом обычно дают рост нескольких микроорганизмов, то для посева крови более характерно выделение одного-двух ведущих микроорганизмов.
Следующим методом, играющим важную роль в диагностике эндометрита и ведении родильниц с этим осложнением, является ультразвуковое исследование. Данный метод исследования позволяет произвести точные измерения размеров матки и объективно оценить динамику послеродовой инволюции, определить наличие патологических включений в полости матки, на фоне которых развивается эндометрит.
Гистологическое исследование соскоба эндометрия остается до настоящего времени наиболее достоверным способом диагностики эндометрита.
По данным ВОЗ, примерно в половине случаев диагноз послеродового эндометрита ставится неправильно. Но если диагноз поставлен правильно, то в основе терапии должны быть антибиотики. Надежды на то, что можно добиться хорошего результата с помощью изолированного применения иммунокорригирующих препаратов или физиотерапевтических методов, с позиций доказательной медицины не оправдались.
Лечение
Основными компонентами лечения эндометрита являются антибактериальная, инфузионная, десенсибилизирующая, утеротони-ческая терапия, местная; при необходимости — антикоагулянты, иммуностимулирующие препараты, а также немедикаментозные методы лечения.
Принципы рациональной антибиотикотерапии послеродового эндометрита:
- Если известны возбудитель и его чувствительность к антибактериальным препаратам — назначение соответствующего антибиотика.
- Если возбудитель неизвестен или бакпосев выделений не готов, то рекомендуется назначать:
—сочетание аминогликозидов (гентамицина, канамицина) с пе-нициллинами (ампициллин, оксациллин);
—сочетание цефалоспоринов П-Ш поколения (зинацеф, цефтриаксон, фортум) с метронидазолом;
— защищенные аминопенициллины (аугментин, амоксиклав, флемоклав).
Основным недостатком первых двух комбинаций является то, что они не действуют на энтерококки. В результате появилась третья стратегическая программа, которая сегодня официально рекомендуется Североамериканским центром по контролю за заболеваниями и программами ВОЗ. В ней предусматривается применение аминопенициллинов с добавлением ингибиторов (3-лактамаз (защищенных аминопенициллинов). Кроме антибактериальных препаратов пенициллинового ряда, цефалоспоринов и аминогликозидов, в комплексной терапии инфекционно-воспалительного процесса применяют фторхинолоны (офлоксацин, ципрофлоксацин, таваник), макролиды (азитромицин, кларитромицин или спирамицин). Продолжительность курса антибактериальной терапии определяется индивидуально. При достижении нормального уровня температуры тела и редукции значительной части других клинических и лабораторных проявлений эндометрита антибактериальная терапия продолжается 4-5 дней, после чего введение антибактериальных препаратов прекращается.
Важным аспектом, влияющим на продолжительность курса лечения и, следовательно, на дозы антимикробных препаратов при эндометрите, является проникновение антибиотиков в грудное молоко с развитием у новорожденного токсических, аллергических реакций, нарушения биоценоза кишечника.
При среднетерапевтических дозах полусинтетических пенициллинов (ампициллин, оксациллин) и цефалоспоринов (цефуроксим, цефотаксим, цефтриаксон) в молоко попадают незначительные дозы антибиотиков. Концентрация линкомицина и клиндамицина в грудном молоке женщин, получавших эти препараты, незначительна.
С целью профилактики дисбактериоза всем женщинам и новорожденным целесообразно назначение эубиотиков (бифидумбактерин, лактобактерин, йогурт, линекс, бифиформ, лактовит).
Таким образом, антибактериальная терапия является важным компонентом общего лечения эндометрита.
При наличии факторов риска развития послеродового эндометрита необходимо проводить пациенткам антибиотикопрофилакти-ку. При этом достаточно однократное интраоперационное или в третьем периоде родов введение одной суточной терапевтической дозы антибиотика широкого спектра действия после пережатия пуповины.
Долгое время существовали трехдневные курсы антибиотико-профилактики или трехразовое введение в течение первых суток. Но результаты длительных исследований показали, что однократная терапевтическая доза является вполне достаточной и не имеет недостатков по сравнению с более длительным введением антибиотиков, а преимущества ее значительны, так как при этом предупреждается появление антибиотикорезистентных штаммов.
Помимо антибактериальных препаратов, терапия эндометрита включает комплекс других лечебных мероприятий: инфузионные среды, антикоагулянты, утеротонические и десенсибилизирующие средства, иммунокорригирующие препараты.
Для инфузионной терапии используются следующие жидкости: плазмозаменители (реополиглюкин и др.); солевые растворы (дисоль, хлосоль, трисоль, физиологический раствор и др.). Целесообразно использовать озонированные инфузионные среды (физиологический раствор). Для улучшения сократительной активности матки показано применение утеротонических средств — окситоцин по 5 ЕД 2 раза в сутки после предварительного введения 2 мл ношпы. Это способствует улучшению оттока лохий, сокращению площади раневой поверхности и уменьшению всасывания продуктов распада при воспалительном процессе в полости матки. Кроме медикаментозных средств для улучшения сократительной активности матки в послеродовом периоде могут быть использованы физиотерапевтические методы.
Из иммунокорригирующих препаратов при смешанной вирусно-бактериальной инфекции целесообразно применять интерфероновые препараты — кипферон или виферон, а также инфузии нормального человеческого иммуноглобулина — по 25 мл внутривенно капельно через день 3 раза. Всем родильницам со смешанной вирусно-бактериальной инфекцией показана терапия, направленная на коррекцию энергетического обмена, путем проведения курсов метаболической терапии на протяжении стационарного лечения и в течение трех последующих месяцев. При обострении сопутствующей вирусной инфекции показана противовирусная терапия.
В комплексной терапии эндометрита одно из ведущих мест принадлежит местной терапии. По показаниям, необходимо производить вакуумаспирацию содержимого полости матки для удаления некротических тканей. Эту манипуляцию проводят и в тех случаях, когда, по данным ультразвукового исследования, отсутствуют патологические включения в полости матки, но содержание продуктов деструкции тканей в лохиях превышает верхнюю границу доверительного интервала нормы. Местная терапия эндометрита значительно снижает уровень бактериальной обсемененности внутренней поверхности матки. Вследствие удаления нежизнеспособных тканей достоверно снижается уровень продуктов деструкции тканей в лохиях и крови. При цитологическом исследовании метроаспирата через 2-3 дня от начала лечения отмечается уменьшение количества нейтрофилов, увеличение числа лимфоцитов, фибробластов и макрофагов, что свидетельствует о значительном ускорении процесса очищения внутренней поверхности матки.
В последнее время предлагается новое местное лечение послеродовых эндометритов — «ферментативный кюретаж» стенок матки пролонгированными иммобилизированными ферментами — в частности, препаратом профезим. Препарат способствует активному лизису омертвевших тканей и фибрина, уменьшает отек слизистой, оказывает противовоспалительный эффект, ускоряет рост и созревание грануляционной ткани. Действуя как «химический нож», профезим путем некролиза способен вскрывать микроабсцессы и микрофлегмоны, рассеянные в зоне воспаления, и прокладывать путь антибиотику, что, несомненно, способствует увеличению эффективности последнего. Применение предложенного метода лечения предупреждает генерализацию инфекции, что исключает из лечения хирургическое удаление послеродовой матки.
При тяжелых формах эндометрита рекомендуется применение эфферентных методов лечения: плазмаферез, ультрафиолетовое облучение аутокрови (АУФОК). Плазмаферез (непрерывный фильтрационный или дискретный центрифужный) целесообразно проводить в 1-2 сутки от начала заболевания, а АУФОК назначают с 3-4-х суток — не менее 5 процедур. С помощью этих методов достигаются детоксикация и иммунокоррекция. При этом происходит экстракорпоральная элиминация токсических субстанций, антигенов, снижение вязкости крови, улучшение микроциркуляции, нормализация измененного тканевого метаболизма. Дополнительные эффекты обусловлены искусственной управляемой гемодилюцией путем введения инфузионных медикаментозных средств направленного действия.
Профилактика послеродового эндометрита должна начинаться в период беременности и включать лечение гинекологических (вульвит, вагинит и др.) и экстрагенитальных (хронический тонзиллит, гайморит, пиелонефрит, бронхит и др.) заболеваний. Большое значение имеет ведение родов и послеродового периода: предотвращение длительного безводного периода; в зависимости от акушерской ситуации — своевременное назначение стимуляции родовой деятельности; адекватное обезболивание родов, предупреждение и правильное лечение разрывов мягких тканей родовых путей, профилактика кровотечения в третьем периоде родов и раннем послеродовом периоде. Необходимо соблюдать правила асептики и антисептики при выполнении внутриматочных манипуляций при уходе за родильницей.
Своевременное проведение профилактики и комплексного лечения послеродового эндометрита способствует значительному уменьшению частоты тяжелых форм послеродовой инфекции, а следовательно, ведет к снижению материнской заболеваемости и смертности.
Выводы
- Эндометрит — распространенная форма гнойно-воспалительных заболеваний в послеродовом периоде с частотой после самопроизвольных родов 2-5% , после кесарева сечения — 10-20%.
- Факторы развития послеродового эндометрита: преждевременное излитие околоплодных вод, длительный безводный период, хориоамнионит, частые влагалищные исследования в родах, кесарево сечение, акушерские щипцы, нарушение сократительной способности матки, значительная кровопотеря, обширные разрывы, невыявленная задержка плаценты или плодных оболочек в полости матки, грипп, ОРВИ во время беременности и накануне родов.
- Эндометрит — полимикробное заболевание, которое может быть вызвано условнопатогенными бактериями, микоплазмами, хламидиями, вирусами и т. д. В подавляющем большинстве случаев (80-90%) это ассоциации аэробных и анаэробных микроорганизмов.
- Основными путями распространения инфекции при эндометрите являются: восходящий, гематогенный, лимфогенный, интра-амниальный.
- Течение эндометрита у родильниц в значительной мере определяется состоянием клеточного и гуморального иммунитета.
- Различают три клинические формы эндометрита — легкую, средней тяжести и тяжелую, которые отличаются друг от друга выраженностью отдельных симптомов (лихорадка, интоксикация, локальные проявления), изменениями лабораторных показателей, продолжительностью заболевания.
- Основными компонентами лечения эндометрита являются антибактериальная, инфузионная, десенсибилизирующая, утеротоническая терапия, местная; при необходимости назначают анти коагулянты, иммуностимулирующие препараты, а также проводят немедикаментозные методы лечения.
2. ИНФЕКЦИОННЫЕ ОСЛОЖНЕНИЯ ЭПИЗИОТОМИИ
Эпизиотомия продолжает оставаться наиболее часто используемой операцией при родовспоможении (30-100%), применение которой без показаний часто критиковалось. Однако сторонники рутинного применения эпизиотомии доказывают преимущества чистого разреза ткани промежности с последующим восстановлением Бульварного кольца перед разрывом, который может произойти самопроизвольно.
Fielding Ould первый рекомендовал в 1742 году эпизиотомию, как разрез от влагалищного выхода к заднему проходу для облегчения затянувшихся родов. Применение эпизиотомии было введено Taliaferro в 1851 году в США. В течение последующих 50-75 лет применение эпизиотомии поддерживалось ведущими акушерами Соединенных Штатов. Расширение влагалищного отверстия, необходимое при затянувшихся родах, рекомендовалось путем сочетания перпендикулярных влагалищу разрезов с билатеральными разрезами, идущими к анусу.
Показаниями для эпизиотомии являются: 1) защита головки плода при травматическом ее сдавлении вульварным кольцом и промежностью; 2) сокращение II периода родов; 3) защита тазового дна и промежности.
Плановое применение эпизиотомии, по данным многих авторов, помогает избежать в послеродовом периоде мионеврологического повреждения промежности, приводящего к опущению половых органов или недержанию мочи. Однако до сих пор целесообразность ее проведения остается недостаточно научно обоснованной и подтвержденной проспективными исследованиями. Противники рутинной эпизиотомии говорят об увеличении кровопотери, болевом синдроме, последующей диспареунии, а также о повышении инфекционной и хирургической заболеваемости, что бывает связано с этой процедурой. До тех пор, пока научное подтверждение одних или других позиций не приобретет убедительные доказательства, значение эпизиотомии останется философской дискуссией между сторонниками и противниками. Акушерская тактика в течение последнего столетия изменилась незначительно, и эпизиотомия продолжает выполняться с относительной регулярностью. Частота этой операции в разных европейских странах колеблется от 30% до 100%.
В целях сохранения здоровья рожениц эпизиотомия стала неотъемлемой частью акушерской практики. До настоящего времени ее считают наиболее распространенной хирургической операцией. Усовершенствованная и более безопасная анестезия, надлежащее освещение, использование правил асептики при применении стандартной эпизиотомии позволили снизить частоту осложнений при этой операции.
Инфекционные осложнения при эпизиотомии
Инфекционные осложнения при эпизиотомии возникают довольно редко — согласно статистическим данным отечественных и зарубежных авторов, от 0,2 до 4,0%. Однако, принимая во внимание частоту выполнения этой процедуры, инфекции при этой операции занимают важное место в общем уровне материнской заболеваемости и смертности, при этом их уровень значительно не изменился с течением времени. Факторы, влияющие на показатели инфекции при эпизиотомии, зависят в большей степени от состояния пациентов, чем от врачебной тактики. Возникновению осложнений могут способствовать высокий бактериальный индекс влагалища и промежности, повреждение и сдавление тканей промежности головкой плода, а также ряд патологических процессов, иммунодефицитных состояний (сахарный диабет и др.).
Классификация инфекционных осложнений при эпизиотомии:
1) поверхностные или простые:
— поверхностные фасциальные инфекции;
2) некротический фасциит;
3) мионекроз;
4) перинеальные абсцессы;
5) прямокишечно-влагалищные и прямокишечно-промежностные свищи;
6) синдром токсического шока;
7) пудендальные инфекции.
Этиология
Бактериологические исследования родильниц с инфекционными осложнениями эпизиотомии выявляют довольно широкий спектр (около 15 возбудителей) условно-патогенной микрофлоры: аэробы (72%) — Staphylococcus aureus, Staphylococcus epidermidis, Streptococcus pyogenes, Pseudomonas aeruginosae, E. coli, Klebsiella, Proteus mirabilis, Proteus vulgaris, Acinetobacter, Enterobacter; анаэробы (21%) — Bacteroides, Peptococcus, Peptostreptococcus, a также Candida albicans (7%). В 60% случаев инфицирование связано с Staphilococcus epidermidis. Частота выделения грамотрицательной флоры составляет 43%. В 30% воспалительные процессы в тканях возникают под воздействием симбиотической связи аэробных и анаэробных микроорганизмов (аэробные ассоциации — 33%, аэробноанаэробные — 35%).
Поверхностные инфекционные осложнения
Большинство инфекционных осложнений, с которыми приходится сталкиваться, являются поверхностными.
Этиология
Проведенные бактериологические исследования, касающиеся заживления «чистых» эпизиотомий, показали, что микрофлора у 90% пациенток была представлена условно-патогенными штаммами. Как при любой раневой инфекции, серома или гематома в присутствии контаминирующей флоры могут быть усугубляющими факторами течения послеоперационного (послеродового) периода.
Диагностические критерии и тактика ведения
Нормально заживающая эпизиотомия обычно имеет симметричную отечность в сочетании с минимальной эритемой вдоль всей линии разреза. Ограниченный отек, особенно с асимметричной эритемой, выделения из раны должны насторожить в отношении наличия инфекции. При неинфицированной эпизиотомий боль отмечается пациенткой только лишь при сидении на жестких поверхностях либо при ходьбе. Однако при наличии инфекции женщина будет жаловаться на постоянную боль, даже в состоянии покоя либо в положении лежа на спине из-за отека и связанного с ним давления на швы. Общие жалобы и симптомы инфекционного процесса типа лейкоцитоза и лихорадки являются редкими при простых инфекциях и свидетельствуют о более серьезном инфекционном процессе.
Лечение поверхностных, или простых, инфекций при эпизиотомий проводится по общим принципам, как и при других раневых инфекциях. Линия шва должна быть открыта до подкожной клетчатки по всей его длине. Попытки открыть только часть раны лишь продлевают клиническое выздоровление. Бактериологические исследования инфицированного участка практически не влияют на исход инфекционного процесса. Частая обработка раны с изоляцией инфицированного участка, интенсивная гигиена с использованием сидячих ванн способствуют быстрому заживлению. При отсутствии нагноения в области поверхностных раневых инфекций системное введение антибиотиков оказывает незначительное влияние на ускорение заживления.
В этих случаях заживление идет вторичным натяжением. Хотя большинство пациенток получают приемлемый косметический результат и возвращаются к нормальной сексуальной жизни, у некоторых возникает «зияющий» вход во влагалище с возможной сексуальной дисфункцией и, предположительно, хроническим вагинитом, который требует последующей кольпо-и перинеопластики.
Первичное восстановление разрушенной эпизиотомии на фоне хирургической обработки и системной антибиотикотерапии позволило Monbergi и Hammen (1987) избежать дальнейших хирургических вмешательств у пациенток и уменьшить время их пребывания в больнице.
Поверхностные фасциальные инфекции
Поверхностные фасциальные инфекции, вероятнее всего, являются либо осложнением простой инфекции, либо результатом позднего начала терапии. Большинство таких инфекций реализуются спустя 4-5 дней после родов. Стремясь к сокращению сроков пребывания новорожденных в стационаре, врачи могут не заметить прогрессирование инфекции и, следовательно, своевременно не проводить необходимую терапию.
Этиология
Бактериологические исследования показывают, что микрофлора у пациенток представлена аэробными (Staphilococcus aureus, Staphilococcus epidermidis, Streptococcus pyogenes, E. coli, Klebsiella, Proteus mirabilis, Proteus vulgaris, Enterobacter) и анаэробными бактериями, включая как Bacteroides fragilis, так и другие разновидности рода Bacteroides.
Диагностика и тактика ведения
Поскольку жалобы пациентки с поверхностной фасциальной инфекцией подобны таковым при простой инфекции, необходимо проводить тщательное обследование промежности для того, чтобы дифференцировать эти два процесса и назначить адекватную терапию. Продолжительные боли отмечаются даже в состоянии покоя: в более тяжелых случаях вследствие отека, связанного с более глубокой инфекцией, пациентка может отмечать ограничение движения бедер. При осмотре отмечаются эритема и отек, которые распространяются по поверхностным фасциальным слоям бедра и низа живота. Общие признаки проявления инфекционного процесса наблюдаются редко, и если они присутствуют, то врач должен заподозрить развитие более серьезного, потенциально опасного для жизни некротического фасциита.
Лечение
Необходимо назначение внутривенной антибиотикотерапии широкого спектра действия. Антибактериальные препараты должны обладать активностью против стрептококков, стафилококков, кишечной палочки и анаэробных бактерий. Анаэробный охват должен включать как Bacteroides fragilis, так и другие разновидности рода Bacteroides. Было доказано, что ответ на антибиотикотерапию в течение 24 часов, проявляющийся в уменьшении эритемы, позволяет избежать повторного дренирования раны. При отсутствии быстрого эффекта от лечения либо при развитии общих признаков инфекционного процесса необходима хирургическая ревизия раны и ее дренирование для исключения фасциального некроза.
Хирургическая обработка и антибактериальная терапия являются обязательными в лечении фасциита, а использование моноантибиотикотерапии приводит к однозначно неблагополучному исходу. Практика доказывает необходимость раскрытия хирургической раны промежности при осмотре пациентки для гарантии адекватного исследования фасции. Местная терапия соответствует таковой при простых инфекциях. Часто удивляет скудное нагноение таких ран, но это свидетельствует о важности грамположительных кокков, как патогенной флоры. При соответствующем выборе антибиотиков происходит довольно быстрое разрешение эритемы и отека. Антибиотикотерапия должна быть продлена до тех пор, пока вся эритема и отек не уменьшатся и при пальпации будет определяться лишь мягкий валик неокрепшего рубца.
Некротический фасциит
Фасциальный некроз, или некротический фасциит, является редким, но часто неблагоприятным в прогностическом плане осложнением, обусловленным вовлечением в воспалительный процесс поверхностных фасциальных слоев; при распространении инфекции затрагивает глубокие мышечные слои, приводя в дальнейшем к развитию клостридиального мионекроза. Эта редкая патология часто становится причиной материнской смертности.
Этиология
Бактериология некротического фасциита остается неустановленной в полном объеме, поскольку большинство исследований проводятся после начала антибиотикотерапии. В «доантибиотическую» эру считалось, что бета-гемолитический стрептококк группы A (Streptococcus pyogenes) является важнейшим патогеном, вызывающим развитие некротического фасциита, что обусловило старое название заболевания — «стрептококковая гангрена». С появлением анаэробных технологий разновидности Bacteroides и других анаэробных патогенов были обозначены как важные микроорганизмы при этих инфекциях. Установлена также роль других бактерий, включая стафилококки, грамотрицательные кишечные бактерии (включая Е. coli и Klebsiella), Peptococcus и Аего-bacter. Скорость начала некротического фасциита сопоставима с таковой при других стафилококковых инфекциях. Однако наличие высоких концентраций анаэробных бактерий обусловливает более сложную роль грамположительных кокков в патологическом процессе. Так, стрептококки могут быть причиной локального некроза с последующей колонизацией анаэробами и могут действовать либо оппортунистически, колонизируя уже разрушенные анаэробами ткани, либо в синергизме с другими микроорганизмами в развитии инфекционного процесса.
Отмечается острое начало инфекции с быстрой генерализацией процесса и развитием кардиопульмонального шока. Поэтому крайне важно своевременное распознавание инфекции и адекватное лечение. Некротический фасциит чаще встречается при глубоких, двусторонних разрезах промежности, третьей или четвертой степенях «разреза» при перинеотомии, разрывах влагалища, травмах родовых путей после вакуум-экстракции плода или наложения акушерских щипцов. Однако может наблюдаться и при простых медиолатеральных или срединных эпизиотомиях. Развитию некротического фасциита способствуют, в частности, сахарный диабет или заболевания периферической сосудистой системы, составляя существенную группу факторов риска.
Диагностика
Признаки фасциита могут появиться как спустя несколько часов после родов, так и на 4-5 сутки послеродового периода с наибольшими проявлениями от 24 до 48 часов. Раннее их появление подтверждает концепцию некротического фасциита как отдельного по сути заболевания, а не как продолжение более поверхностной инфекции. Первоначально пациентки жалуются на интенсивные боли в области промежности, хотя при первичном осмотре определяются лишь локальное размягчение, умеренный отек и эритема с нечеткими краями. При прогрессировании инфекции разрушение подкожных нервов ведет к снижению чувствительности, что может ошибочно трактоваться как улучшение состояния. В изначально непораженных нижележащих тканевых слоях развивается тромбоз подкожных кровеносных сосудов, обусловливая темно-синюю окраску тканей. К 5-му дню развития процесса формируются буллы, и некроз нижележащих тканей становится явным. Эти изменения могут сопровождаться массивным отеком. При пальпации определяется отделение незначительного количества сукровичной жидкости, описываемой как «рыбные помои». Нагноение обычно не определяется, что затрудняет оценку степени и серьезности инфекционного процесса.
У некоторых пациенток с невысокой лихорадки может начинаться манифестация общих симптомов. С прогрессированием инфекционного процесса присоединяются симптомы общей интоксикации. На ранних стадиях патологического процесса значительно, непропорционально клиническим проявлениям, возрастает уровень лейкоцитов в крови до 80 Г/л, в большинстве случаев колеблясь от 20 до 30 Г/л. При прогрессировании отека отмечается сгущение крови. Накопление бактериальных токсинов ведет к высвобождению свободных жирных кислот, приводя к сапонификации и гипокальциемии. Развиваются тяжелый электролитный дисбаланс, тахикардия, аритмия, диссеминированное внутрисосудистое свертывание, а также изменения психического статуса, что предвещает неизбежный неблагоприятный исход.
Лечение
После постановки диагноза некротического фасциита назначение терапии должно быть быстрым и решительным. Проводятся общая детоксикационная терапия, коррекция электролитного баланса и других гематологических нарушений. Хотя антибиотикотерапия — важное дополнение, хирургическая обработка является первостепенной терапией некротического фасциита.
Откладывание хирургического вмешательства до стабилизации состояния пациентки или до получения эффекта от действия антибиотиков является недопустимым — эта задержка только способствует усугублению течения процесса. Применение лишь антибиотикотерапии, либо ее сочетание с простым разрезом и дренажом, в большинстве случаев является недостаточным.
Хирургическая обработка должна быть обширной. Сначала кожа и подкожная клетчатка осторожно отсепаровываются от фасции, которая имеет характерный сероватый оттенок с наличием множественных локальных тромбов. При достижении здоровой ткани может наблюдаться небольшое кровотечение. Фасция вскрывается путем разволокнения. Осмотр и хирургическая обработка нижележащей мышцы при мионекрозе обязательны. Область обработки часто может быть значительно расширена, включая низ живота, бедра и вульву. Вовлечение в процесс верхней трети влагалища и широких связок может привести к необходимости проведения интраабдоминальной ревизии и гистерэктомии. Рекомендуется использование окраски по Граму для идентификации бактериальной флоры в множественных посевах из краев хирургической раны, а также продление хирургической обработки до 1-2 см вокруг краев потенциально кровоточивых тканей. Заживление вторичным натяжением достигается отсрочкой первичного натяжения или кожным лоскутом.
Антибиотикотерапия должна включать широкий спектр грамположительных кокков, грамотрицательных кишечных бактерий и анаэробов. В настоящее время для терапии рекомендовано сочетание аминогликозидов и клиндамицина или аминогликозидов и метронидазола. Препаратами выбора в лечении раневой инфекции являются представители Р-лактамных антибиотиков и фторхинолонов. Однако массивное нарушение гомеостаза приводит к несоответствию дозировок и потенциальной нефротоксичности у септических больных. Это делает аминогликозиды менее приемлемыми, чем более новые доступные антибиотики. Вместо аминогликозидов могут использоваться III поколение цефалоспоринов или азтреонам, исключая препараты, способствующие повышению кровоточивости, которая является патогномоничной для септических пациенток. Также потенциально приемлемо использование расширенного спектра действия пенициллинов или ингибиторов бета-лактамаз.
Мионекроз
Проникновение инфекции к фасциальному слою может привести к мионекрозу. Мионекроз может являться следствием развития некротического фасциита либо быть первичным патологическим процессом, особенно при наличии обширной травматизации и омертвения прилежащих тканей, что часто происходит при небрежном и длительном ведении второго периода родов.
Этиология
Обычно микроорганизмом, являющимся причиной мионекроза, выступает Clostridium perfringens, возбудитель газовой гангрены. Однако описаны редкие случаи ассоциаций этого микроорганизма с другими видами Clostridium, газообразующими коли-бациллами и разновидностями Bacteroides.
Клиника
Хотя симптомы могут появляться в промежутке от одного часа до нескольких недель после эпизиотомии, обычно это происходит на 1-4-й день после родов. Как и при некротическом фасциите, первым признаком заболевания является выраженный болевой синдром. Однако, в отличие от некротического фасциита, изменение цвета кожных покровов от нормально белого до темно-коричневого и, в конечном счете, возникновение некроза происходит довольно быстро. Также, в отличие от некротического фасциита, глубокие общие нарушения появляются вскоре после появления болей и иктеричности, т. е. в течение нескольких часов. Несмотря на тяжелое состояние, пациентка остается ориентированной в пространстве и времени. Крепитация при пальпации в ранних стадиях процесса наблюдается редко, но газовые пузырьки с легкостью обнаруживаются при рентгенисследовании. Иногда маленькие пузырьки могут быть обнаружены при исследовании краев раны.
Тактика ведения
Терапия заключается в массивной хирургической обработке с удалением некротизированных тканей острым путем. Это должно сопровождаться открытым дренированием, исключая смыкания краев раны. Очень важна адьювантная антибиотикотерапия с использованием высоких доз пенициллина (до 20 млн ЕД/сут) в сочетании с внутривенными инфузиями; при непереносимости пенициллинов — с использованием тетрациклинов. Как продолжение терапии с внушительным положительным эффектом рекомендуется применение гипербарической оксигенации. Однако гипербарическая оксигенация не должна заменить хирургическую обработку и антибиотикотерапию. Использование поливалентной сыворотки спорно, так как указанные бактерии продуцируют множество токсинов, которые не входят в эту вакцину. Также высок риск возникновения реакций гиперчувствительности. Поэтому большинство клиник отказались от использования вакцин.
Так как Clostridium perfringens — спорообразующий микроорганизм, в целях профилактики внутрибольничной инфекции должным образом необходимо проводить стерилизацию операционных помещений и инструментария. Холодная стерилизация может оказаться недостаточной, поэтому рекомендуется тепловая или долгосрочная газовая стерилизация.
Перинеальные абсцессы
Перинеальные абсцессы являются нетипичными осложнениями эпизиотомий или разрывов, осложняющих роды. Предрасполагающими факторами могут быть инфицированные гематомы, недиагностированные раны прямой кишки и даже медиолатераль-ные эпизиотомий, проходящие через проток бартолиновой железы. Однако крайне редки случаи этого осложнения при отсутствии ранений кишки. Любая недиагностированная травма прямой кишки потенциально приводит к образованию абсцесса или свища. Поэтому каждая эпизиотомия или ушивание разрывов должны сопровождаться тщательной ревизией прямой кишки, чтобы убедиться в ее целостности. Такие абсцессы клинически проявляются достаточно поздно — на 5-10-й день послеродового периода.
Клиника
Пациентки отмечают лихорадку, незначительные боли внизу живота, вздутие, что позволяет заподозрить развитие эндометрита, но прежде всего следует исключить перинеальный абсцесс. Поверхностная пальпация живота непоказательна для исключения абсцесса, поскольку обширная инфицированная гематома и абсцесс могут распространяться ретроперитонеально в верхние отделы живота. Необходима бережная ректальная пальпация для исключения скрытого хирургического шва, локальной флюктуации или местного уплотнения.
Тактика ведения
При обнаружении абсцесс или инфицированная гематома должны быть вскрыты, эвакуированы и оставлены открытыми для заживления вторичным натяжением. Предпочтительна активная дренажная система; однако использование тампонов приемлемо при их частой (не реже, чем ежедневно) смене в целях уменьшения риска развития токсического шока. При наличии общих симптомов необходимо использование антибиотиков широкого спектра действия с учетом всех влагалищных патогенов, включая грамположительные кокки и анаэробы. Чаще всего недиагностированные перинеальные абсцессы заканчиваются формированием свищей.
Прямокишечно-влагалищные и прямокишечно-промежностные свищи
В современной акушерской практике ректовагинальные и ректоперинеальные свищи чаще являются результатом перинеальной инфекции, а не следствием затянувшихся родов и некроза при длительном сдавлении тканей промежности. Хотя сроки формирования свищей могут колебаться от 45 дней до 6 месяцев, наиболее часто это наблюдается в течение 2-6 недель после родов.
Клиника
Ранними признаками, предупреждающими о возможном формирования свища, являются продолжающиеся боли в области промежности на фоне нормального заживления, хроническое серознокровянистое или гнойное отделяемое из области эпизиотомии или наличие необъяснимой персистирующей субфебрильной лихорадки. При формировании ректовагинального свища размером до 1 см эти симптомы могут носить непостоянный характер, как при фекальном загрязнении влагалища или хронически текущем вагините, тогда как при больших размерах свища выраженность симптоматики становится более очевидной.
Ректоперинеальные свищи более трудны для диагностики. Часто в промежности будет присутствовать небольшой свищевой ход. Хотя обычно он идет по средней линии при срединной эпизиотомии или в ягодичную область после медиолатеральной эпизиотомии. Некоторые свищевые ходы заканчиваются в областях, удаленных от места первичного разреза. Классические проявления включают периодическую диспареунию, жалобы на наличие небольшой папулы или уплотнения на промежности с появлением небольшого количества грязноватого отделяемого.
Тактика ведения
Вопрос о времени восстановления ректовагинальных свищей остается спорным. Раньше хирурги предлагали отсрочку лечения не менее 6 месяцев после диагностики свища для адекватной редукции воспаления, надлежащей реваскуляризации и уменьшения возможности инфицирования. Однако сегодня точно известно, что не так важен временной фактор, как физикальные данные перед восстановлением. Так, наличие продолжающейся эритемы, уплотнения и скрытой инфекции почти всегда обрекают попытки восстановления свища на неудачу, тогда как отсутствие вышеперечисленной симптоматики обусловливает возможность раннего хирургического вмешательства, гарантируя безопасную и успешную коррекцию. После первичной диагностики маленький свищевой ход может быть обработан нитратом серебра или другими антисептиками для улучшения самостоятельного заживления.
Использование длительно рассасывающегося шовного материала, проктоскопическое удаление пенетрирующих швов способствуют заживлению свищей. Шов на слизистой прямой кишки может быть диагностирован при классической пальпации ее поверхности. Большие свищи требуют местных гигиенических процедур для обеспечения первичного заживления. Хирургическое восстановление может быть предпринято при условии полного отсутствия уплотнения и наличия адекватной грануляционной ткани. Предоперационное применение смягчителей стула и местных клизм способствует уменьшению любого напряжения, которое может возникнуть по линии шва при контакте с фекальными массами и затрудненной дефекации. Интраоперационная антибиотикотерапия, как сообщалось, позволяет предотвратить развитие инфекций в послеоперационном периоде и избежать неудачи при хирургической коррекции.
Хотя методы хирургического восстановления ректовагинальных свищей описаны в литературе в достаточном количестве, успешный исход операции обусловлен не столько выбором метода, сколько опытом хирурга и тщательностью выполнения хирургической техники. Присущая любой хорошей хирургической коррекции послойная мобилизация тканей позволяет избежать давления на линию шва. Крайне важным для гарантии адекватного заживления и для иссечения деваскуляризированной ткани, обеспечивающей должное кровоснабжение заживающей поверхности, является использование широкого разреза даже для небольшого свища. При этом рекомендуется применение ареактивного рассасывающегося шовного материала с наименьшим диаметром нити. Не рекомендуется использовать бескислородные методики, такие как «восьмерка» или изолирование шва. Независимо от расположения ректовагинального свища, необходимо избегать нарушения целостности наружного анального сфинктера.
Ректоперинеальный свищ может иметь весьма замысловатый ход в тканях промежности перед выходом на кожу. Попытки уточнить направление свищевого хода метиленовым синим или другими подобными красителями заканчивались неудачей, так как эта манипуляция может вести к визуализации ложных протоков и, в дальнейшем, к неполному иссечению свищевого хода. После идентификации ректального конца свищевого хода при помощи проктосигмоидоскопа производится широкое эллиптическое иссечение, используя циркумферентный разрез вокруг предварительно найденного ректального начала свища. Слизистая оболочка прямой кишки должна быть ушита послойно, с использованием ареактивного, с наименьшим диаметром рассасывающегося шовного материала. Ткани промежности послойно восстанавливаются — так, как это делается при перинеоррафии. При неполном иссечении свищевой ход может образоваться вновь.
Иногда перинеальные и вагинальные свищи после родов образуются у пациенток с воспалительными заболеваниями кишечника (например, с болезнью Крона). Поскольку хирургическое иссечение таких свищей обычно неэффективно и ведет к большему воспалению и множественным свищам, следует различать те, которые являются результатом воспалительных заболеваний кишечника, от тех, что являются следствием инфицирования эпизиотомии.
Большинство кишечно-влагалищных свищей образуются в верхних отделах влагалища выше места эпизиотомии. Проводится проктоскопическое исследование для исключения швов, как причины образования новых свищевых ходов. При наличии заболевания кишечника воспалительного характера, как этиологического фактора формирования свищей, проводится терапия с использованием местных гигиенических процедур, стероидов, а также лечение основного заболевания кишечника.
Синдром токсического шока
Хотя синдром токсического шока (СТШ) является заболеванием, зачастую связанным с менструальным циклом, в последнее время все чаще встречаются сообщения о случаях СТШ, причинно не связанных с mensis. СТШ ассоциируется с родами через естественные пути, кесаревым сечением и инфицированными эпизиотомиями. Развитие данного синдрома связывают с Staphylococcus aureus, хотя значительное количество людей являются носителями этого микроорганизма. Поэтому наблюдается вариабельность восприимчивости к этой инфекции. Доказано, что нарушения местного характера, обусловленные шовным материалом или особенностями хирургического ушивания, способствуют увеличению уровня токсинов и их системному распространению, а нарушение естественных иммунных барьеров (таких как кожа и слизистые), а также других иммунных механизмов облегчают системную диссеминацию токсинов.
Необходимо тщательное обследование родильниц с целью обнаружения источника инфекции. При наличии гематомы под пузырно-маточной складкой брюшины после кесарева сечения производится ее дренирование, осуществляется расширение шейки матки для свободного отхождения лохий при субинволюции матки; эпизиотомия также должна быть вскрыта. Большинство хирургических ран, инфицированных токсин-продуцирующим Staphylococcus aureus, не имеют каких-либо признаков инфекции и потому могут быть пропущены. Терапия назначается с учетом выявленного возбудителя, в том числе и токсин-продуцирующего S. aureus, из любой хирургической раны — в частности, и из эпизиотомии. Проводится широкая хирургическая обработка раны с иссечением некротизированных тканей.
У родильниц синдром токсического шока может развиться в течение от 12 часов до 8 недель после родов. Раннее развитие шока в послеродовом периоде наблюдается в первые 12 часов. В течение первых суток после начала наиболее важными симптомами являются высокая, несоответствующая каким-либо другим клиническим проявлениям лихорадка, диарея, эритематозные высыпания на коже и слизистых, включая слизистые полости рта и влагалища. Изменения лабораторных показателей включают чрезвычайно высокий лейкоцитоз с относительным увеличением незрелых форм нейтрофилов, тромбоцитопению. С прогрессированием шока в конечном итоге у пациентки развиваются тяжелая олигурия, синдром дыхательных расстройств и гипотония. Может развиться миокардит и кардиальный шок. При подозрении на синдром токсического шока поддерживающая терапия должна включать клинико-лабораторный мониторинг и респираторную поддержку.
Рекомендуется использование системных антибиотиков — в частности, с бета-лактамазной устойчивостью.
Хотя синдром токсического шока встречается редко в послеродовом периоде, серьезность этого осложнения, связанного с высоким уровнем материнской смертности, требует своевременной диагностики и интенсивной адекватной терапии. В заключение следует отметить, что поскольку возможно внутрибольничное распространение инфекций, крайне важно соблюдение правил асептики и антисептики, особенно при подозрении на синдром токсического шока.
Пудендальные инфекции
Использование анестезии перед выполнением эпизиотомии — неотъемлемая часть современной акушерской практики. При отсутствии эпидуральной анестезии блокада парацервикальных и пудендальных нервов играет важную роль в уменьшении боли при родах. Развитие инфекции после использования таких блокад наблюдается редко, хотя возможно попадание небольшого количества бактерий в свободную рыхлую соединительную ткань, окружающую пудендальные нервы. Инфекция распространяется латерально к седалищным буграм и кзади к крестцу. Бактерии распространяются по нервам пояснично-крестцового сплетения и внутренней запирательной мышце на бедро или выше под подвздошной мышцей в ретроперитонеальное пространство. Мышцы тазового дна ограничивают генерализацию инфекции, изолируя ее глубоко между мышечными слоями, затрудняя тем самым диагностику. Фактором, способствующим распространению инфекции, является присоединение влагалищной микрофлоры.
Доминирование инфекционного процесса слева наводило некоторых на мысль о правильности выполнения пункции и проколе сигмовидной кишки с обильным загрязнением этого пространства. С другой стороны, также может произойти неосторожный прокол пудендальной артерии с формированием гематомы в очаге инфицирования. Доминирующую левостороннюю локализацию процесса можно объяснить, во-первых, относительной легкостью выполнения процедуры введения иглы в правую сторону пациентки правой рукой врача и, вовторых, относительным неудобством выполнения того же слева, чем, возможно, обусловлен большой процент сосудистых повреждений слева с последующим инфицированием.
Эти инфекции могут проявляться как в течение первых часов после родов, так и в период до 11 дней после них. Наиболее постоянным симптомом являются сильные боли в бедре, ограничивающие объем движения и перемещение. Эти боли могут наблюдаться до начала лихорадки и других симптомов, заставляя врача думать о неврологическом повреждении. Поскольку на ранней стадии инфекционный процесс локализуется глубоко в мышечном слое, выявить его можно лишь при клиническом обследовании. Так, при исследовании можно обнаружить паравагинальное размягчение и флюктуацию при нормальных размерах матки и шейки. В большинстве случаев определяются эритема и крепитация в области ягодиц, флангов или бедер. На рентгеновском снимке затронутого бедра может быть видно формирование газовых пузырьков, но не всегда. Использование компьютерной томографии более эффективно в идентификации границ «жидкость-ткань» позади т. gluteus. Хотя уровень лейкоцитоза может быть чрезвычайно высоким, как при любом гнойном процессе, у некоторых пациенток не определяются какие-либо отклонения в гемограмме.
Наиболее часто встречающимся микроорганизмом при этих инфекциях является Е. coli, но анаэробы так же, как и другие бактерии, играют важную роль в развитии этого патологического процесса. Абсолютно необходимым является назначение антибиотиков широкого спектра действия при подозрении на распространение инфекции ретросиновиально по т. gluteus и т. psoas. Ранняя диагностика и терапия позволяют сократить сроки течения болезни и избежать формирования абсцесса. При поздней диагностике развитие абсцессов происходит более чем у 80% пациенток. При диагностировании абсцесса необходимо предотвратить развитие других осложнений, таких как кровоизлияние, параплегию, а также сепсис с летальным исходом.
Выводы
- Инфекционные осложнения при эпизиотомии возникают, согласно статистическим данным, от 0,2 до 4,0%
- Бактериологические исследования показывают, что микрофлора у пациенток представлена стрептококками, стафилококками, кишечной палочкой и анаэробными бактериями, включая как Bacteroides fragilis, так и другие разновидности рода Bacteroides. Установлена также роль других бактерий, включая грамотрицательные кишечные бактерии (включая Е. coli и Klebsiella), Pepto-coccus и Aerobacter. Описаны редкие случаи ассоциаций Clostridium perfringens с другими видами Clostridium, газообразующими колибациллами и разновидностями Bacteroides
- Лечение простых инфекций при эпизиотомии проводится по общим принципам, как при других раневых инфекциях.
3. ПОСЛЕРОДОВЫЕ МАСТИТЫ
Мастит — воспаление паренхимы и интерстициальной ткани молочной железы (МЖ), Мастит следует отличать от других воспалительных заболеваний кожи, подкожной клетчатки МЖ (фурункул, карбункул, абсцесс, флегмона, рожистое воспаление), объединяемых понятием парамастита.
Острые маститы в основном (82-87% случаев) встречаются в послеродовом периоде у кормящих женщин. Несмотря на значительные успехи профилактической медицины в борьбе с неспецифической хирургической инфекцией, лактационный мастит продолжает занимать видное место как в гнойной хирургии, так и в практике акушерагинеколога.
Проблема лактационных маститов в некоторой мере является «скрытой», так как данные о частоте этого заболевания значительно расходятся в различных источниках. В официальной статистике проблема практически отсутствует как таковая: в Украине за 2004-й год в акушерских стационарах зарегистрировано всего 3 случая гнойного мастита. По данным специальной хирургической литературы, лактационные маститы (ЛМ) составляют 77-99% случаев неспецифического мастита, а все формы ЛМ — от серозной до деструктивных — имеют место у 2% женщин за период беременности и кормления грудью. Чаще официально регистрируются гнойные формы маститов, требующие специального хирургического лечения. Инфильтративный и серозный маститы, которые в большинстве случаев успешно лечатся консервативно, зачастую даже не регистрируются. По данным В.И. Оскреткова (2001), острый ЛМ в 84% возникает у пациенток в возрасте 17-30 лет, причем 80% из них — первородящие.
Анатомия молочной железы. Форма, размер, положение МЖ широко варьируют в пределах физиологической нормы и зависят от возраста женщины, фазы менструального цикла, телосложения, состояния репродуктивного здоровья, кроме того, они изменяются во время беременности и лактации. МЖ имеют дольчатое строение: доли, разделенные междольковыми соединительнотканными промежутками, состоят из 20-40 долек, каждая из которых, в свою очередь, состоит из нескольких десятков альвеол — морфофункциональных единиц МЖ (рис. 10.1). Пузырек альвеолы выстлан однослойным железистым эпителием и имеет выводной проток. Выводные протоки альвеол, соединяясь в более крупные, долевые протоки, открываются на вершине соска. Приблизительно в области границы ареолы протоки имеют расширения (млечные синусы).
1 — долли железист ого тела;
2 — соссок;
3 — млеечные протооки;
4 — жирровая капсулла;
5 — реттромаммарное простраанство
Кроме того, как в подкожной жировой клетчатке, так и вокруг железистой ткани располагается жировая ткань, количество которой в МЖ индивидуально и в большой степени, наряду с развитием железистых долек, определяет размер и форму МЖ. Соединительнотканные тяжи, поддерживающие МЖ (связки Купера), являются продолжением междольковых перегородок. Они проходят от передней поверхности МЖ к поверхностной фасции, глубоким слоям кожи и ключице.
Основные регионарные группы лимфатических узлов (ЛУ): ак-силлярные, подключичные, окологрудные (по ходу внутренней грудной артерии), грудные (между большой и малой грудными мышцами), надключичные. Возможен также отток лимфы в сторону, противоположную МЖ, — к ЛУ верхнего отдела влагалища прямой мышцы живота, к диафрагмальным ЛУ, поверхностным парастернальным и поддиафрагмальным ЛУ.
Физиология лактации. Основная физиологическая функция МЖ — синтез и выделение молока для кормления ребенка. Со второго триместра беременности начинается секреция молозива, представляющего собой мутноватую жидкость, богатую белками и бедную жирами. В нем отмечается наличие клеток, называемых тельцами Донне. По своему составу молозиво больше походит на сыворотку, чем на молоко. Выработка молозива коррелирует с разрастанием железистой ткани и изменениями, вызванными пролактином (ПРЛ) и другими гормонами.
Продолжительноссть лактации у женщины в норме колеблется от 5 доо 24 месяцев, а продуцируемое количество молока колеблется от 600 до 1300 мл в сутки. Максимальнаая секреция молока достигается к 6-12 дням посллеродового периода, затем отмечается период стабиилизации, в течение которого количество выделяеммого молока может обеспечить адекватное питаниее новорожденного в первые 3-6 месяцев послеродовоого периода.
Процесс подготоввки МЖ к выработке молока называется лакто-генезоом, а процесс поддержания лактации у кормящей жеенщины называется лактопоэзом.
Лактогенез — этто комплексный морфофизиологический процесс, включающий в себя совокупность изменений как ппротоков, так и альвеол МЖ во время беременности, и находящийся под контролем эндокринной и вегетативной нервной систем.
Изучение действвия отдельных гормонов, влияющих на развитие ММЖ и лактацию, показывает, что стероидные гормонны яичников и плаценты, наряду с ПРЛ, гонадотрропинами и плацентарным лактогеном (ПЛ), играют ведущую роль, в то время как остальные гормоны — лишь второстепенную.
Изменения МЖ ппри беременности развиваются постепенно и тесно связаны с уровнем синтеза и секреции гормонов. Внначале изменения грудной железы представляютсяя следствием выраженного роста уровня гонадотроопинов, эстрогенов, ПРЛ, к которым на поздних этаапах присоединяется повышение уровня ПЛ, прогеестерона и кортикостероидов. С наступлением роддовой деятельности и непосредственно после родоов наблюдается резкое повышение роли гормонов ззадней доли гипофиза.
ПРЛ участвует в процессе индукции и поддержания молочной секрреции. Во время беременности рост уровня ПРЛ следует за ростом концентрации эстрогенов, при ээтом определение гормонов в крови и моче показалло, что повышение уровня ПРЛ отмечается спустя 1-3 дня после роста уровня эстрогенов.
Секреция ПРЛ возрастает от 10-25 нг/мл до очень высоких концентраций: рост становится заметен в 8 недель беременности, и к сроку родов концентрация ПРЛ достигает 200-400 нг/мл. После родов базальный уровень сывороточного ПРЛ очень высок у всех женщин, но спустя 48 часов концентрация гормона понижается, опускаясь до 100 нг/мл. Сосание вызывает резкое повышение уровня ПРЛ, что является очень важным механизмом инициации выработки молока. До 2-3-х месяцев после родов базальный уровень ПРЛ составляет в среднем 4050 нг/мл, повышаясь в 10-20 раз после кормления.
ПЛ — это полипептидный гормон, синтезируемый синцитиотро-фобластом, выполняющий соматотропное, лактогенное и лютеот-ропное действия. ПЛ поступает в кровь матери, начиная с 6 недель беременности, и уровень его все время возрастает, достигая пика (около 6000 нг/мл) к сроку родов. ПЛ оказывает более слабое действие на МЖ, чем ПРЛ, тем не менее лактогенное действие этого гормона также имеет важное значение.
Гормон роста — полипептидный гормон, действующий на ткань МЖ в основном в комбинации с соматомединами (инсулино-подобными факторами роста). Интегральное действие заключается в усилении морфогенетических и анаболических процессов, выражающихся в синтезе нуклеиновых кислот и делении клеток. Активация метаболических клеточных процессов осуществляется посредством аденилатциклазы, с образованием цАМФ. Эффект гормона роста осуществляется также через взаимодействие с тире-оидными гормонами и инсулином.
Эстрогены. В физиологии лактации эти гормоны играют важную роль: эстрогены индуцируют структурные изменения в эпителиальной и соединительной ткани, характеризующиеся ростом кровоснабжения стромы; изменяют проницаемость капилляров; способствуют росту млечных протоков и их ветвлению. Высокие уровни эстрогенов индуцируют развитие альвеол.
Лактопоэз — это процесс поддержания лактации после того, как лактация началась. Необходимым условием лактопоэза являются происходящие во время беременности изменения железистой ткани. С морфологической точки зрения, это проявляется изменением соотношения эпителиальных, соединительнотканных и жировых компонентов, выражающимся уменьшением доли жировой ткани, отеком и уменьшением плотности соединительной ткани, усилением васкуляризации и гипертрофией альвеол и протоков.
Процесс лактопоэза поддерживается во время кормления грудью посредством нейрогормональных рефлексов, приводимых в действие сосанием. Рефлекторная дуга начинается в чувствительных рецепторах сосков и ареол, откуда по спинномозговым путям сигнал поступает в гипоталамус. В гипоталамусе индуцируется продукция октапептидов (в основном окситоцина) и адено-и внегипофизарных гормонов, которые поддерживают лактацию.
Выделение молока — процесс, обусловленный описанным выше нейроэндокринным рефлексом, в рамках которого ведущая роль принадлежит окситоцину и вазопрессину.
Эпидемиология маститов
Исторически послеродовой мастит был разделен на эпидемиологические и спорадические формы. В более ранней литературе мастит характеризовался как острый грудной аденит, в котором первичное инфицирование происходит в лактационных протоках. В этом случае возможно получение гнойного материала из протоков. Иногда несмежные доли в той же самой груди или доли в обеих МЖ инфицируются одновременно. Этот тип инфекции является эпидемическим и связан со стафилококковыми вспышками новорожденных.
Спорадический послеродовой мастит характеризовался как острый грудной целлюлит. Эта инфекция отличается интенсивным воспалением междолевой соединительной ткани. Получение гноя из протоков обычно невозможно. Входными воротами для бактерий, как предполагалось, являются трещины сосков. Эта форма мастита — наиболее частая, с которой мы сталкиваемся сегодня.
Мастит развивается у 2-5% лактирующих женщин. Точно определить его причину трудно. Выявляемость этого заболевания различная у разных исследователей. Во-первых, некоторые авторы включают застой молока и другие неинфекционные состояния в пределах этого определения, что другие не делают. Во-вторых, частота мастита, кажется, недооценена, потому что многие случаи не сообщаются врачам: до 50% женщин с очевидной грудной инфекцией не обращаются за медицинской помощью.
Острый мастит может развиться в любое время при кормлении грудью, но в основном это происходит в течение первого месяца постнатального периода. Средний интервал между заболеванием и инфицированием — 5,5 недели, с диапазоном от 5 дней до 1 года. Большинство исследователей указывают на пик проявления инфекции во время 2-3-й недели постнатального периода.
Острый мастит — это прежде всего болезнь постнатального периода, но может развиваться и в антенатальном периоде. Это объясняется значительными анатомическими и физиологическими изменениями, происходящими в МЖ во время беременности (они описаны выше), а также началом секреции молозива уже в этот период. Основным условием развития мастита, безусловно, является инфицирование. Клинически мастит беременных отличается от лактационного не столь быстрым развитием и отсутствием зависимости от регулярного «опорожнения» МЖ.
Многие факторы рассматриваются как предрасполагающие к маститу, но только два из них, по нашему мнению, являются ведущими: застой молока и инфекция. Thomsen и др. изучили причины лактостаза и неинфекционные воспалительные заболевания МЖ и пришли к выводу о необходимости продолжения грудного вскармливания при лактостазе и начальных стадиях мастита. Неинфекционный мастит прогрессировал в инфекционный или абсцесс только в 4% случаев, если регулярное опорожнение МЖ продолжалось. Прогрессия в инфекционный мастит была замечена в 79% случаев при отказе от грудного вскармливания. Возможно, этот эффект предрасположенности к лактостазу объясняет высокую заболеваемость маститом в первые недели после родов, когда отток молока особенно затруднен.
Источником инфекции при маститах являются бациллоносители, больные со стертыми формами гнойно-воспалительных заболеваний; резервуаром инфекции служат воздух лечебных учреждений, предметы ухода, белье, верхние дыхательные пути обслуживающего персонала. Следует отметить, что прогноз при внутрибольничном заражении тяжелее, чем при внебольничном, что связано с повышенной резистентностью и вирулентностью больничных штаммов стафилококков.
Схема эпидемической цепи внутрибольничной инфекции в родильных стационарах следующая: источник инфекции — пути передачи — восприимчивый организм. Предлагаемая схема распространения внутрибольничной инфекции, инфицирования МЖ родильниц и развития мастита довольно четко и убедительно с учетом количественных характеристик демонстрирует роль госпитальной инфекции в развитии мастита.
Интересные и очень важные, с эпидемиологической точки зрения, данные привел Л.Н. Гранат еще в 1977 году. Методом фаготипирования доказано различие штаммов стафилококков, вызывающих послеродовые воспалительные заболевания и мастит. Но при сравнительном бактериологическом анализе возбудителей гнойничковых заболеваний новорожденных (пиодермия, конъюнктивит) и мастита родильниц выявлена полная идентичность штаммов стафилококков — основных возбудителей неспецифических воспалительных заболеваний среди этих пациентов. Обнаружена идентичность стафилококков, высеянных из полости рта, носа новорожденных и выделенных из сосков матери. При этом установлено увеличение степени бактериальной обсемененности сосков после кормления. Сроки внутрибольничного инфицирования новорожденных и возникновения мастита различны. Данный факт также говорит о том, что непосредственным источником инфекции при мастите является новорожденный, который может быть как бациллоносителем, так и больным с теми или иными воспалительными заболеваниями полости рта, зева, носоглотки.
Входными воротами для микроорганизмов служат чаще всего трещины сосков, возможно также интраканаликулярное проникновение инфекции при кормлении грудью или сцеживании молока; реже наблюдается распространение инфекции гематогенным и лимфогенным путями из эндогенных очагов инфекции. От 25 до 31% всех маститов развиваются при наличии трещин сосков. Число случаев обнаружения трещин сосков у кормящих составляет 23-65% , тогда как мастит у родильниц возникает в 3-6% случаев. Тем не менее профилактика трещин сосков у родильниц служит одновременно профилактикой ЛМ.
Чрезвычайно важным фактором в возникновении ЛМ, как уже говорилось, является застой молока с инфицированием его патогенными микроорганизмами. При застое увеличивается количество бактерий в молоке и молочных ходах. Свернувшееся молоко подвергается молочнокислому брожению, что приводит к разрушению эпителия, выстилающего молочные ходы и альвеолы. При повышении давления в МЖ в ней нарушается кровообращение, возникает венозный застой. С развитием отека межуточной ткани понижается ее устойчивость к патогенным микроорганизмам, что создает хорошие условия для развития инфекции.
Снижение устойчивости тканей к инфекции в силу указанных выше причин, а также снижение общей сопротивляемости организма женщины, ослабленной родами, авитаминозами, сопутствующими воспалительными заболеваниями, создают благоприятные условия для развития мастита.
Микробиология. Основной микроорганизм, вызывающий послеродовой мастит — Staphylococcus aureus. Эта бактерия может быть обнаружена приблизительно у 70% женщин с маститом. Следующий наиболее часто встречаемый инфекционный агент — Staphylococcus epidermidis, который можно высеять приблизительно в 25% случаев. Большинство этих инфекций устойчивы к пенициллину.
Менее часто встречаемые микроорганизмы: beta-hemolytic streptococci, Enterococcus faecalis, Escherichia coli, Klebsiella pneumoniae, Pseudomonas picetti, Bacteroides, mycobacteria, Actinomyces. Анаэробы определяются более часто у пациенток с гнойным процессом. Даже в этой ситуации, однако, staphylococci преобладает.
Новорожденный обсеменяется staphylococci сразу после рождения в результате близкого контакта с матерью или взаимного загрязнения в помещениях послеродового отделения. Некоторые исследователи демонстрировали факты инфицирования стафилококком новорожденных персоналом детского отделения.
Хирургическая классификация маститов:
I. По причине заболевания:
- Неспецифический.
- Специфический. И. По функциональному состоянию МЖ:
ІІ. По функциональному состоянию МЖ:
- Лактационный.
- Нелактационный.
III. По течению воспалительного процесса:
- Острый.
- Хронический,
IV. По распространенности процесса:
- Ограниченный.
- Диффузный.
V. По характеру воспаления:
- Серозный.
- Инфильтративный.
- Гнойный:а) абсцедирующий;б) инфильтративно-абсцедирующий;в) флегмонозный;г) гнойно-некротический.
- Гангренозный.
VI. По локализации и глубине поражения:
- Поверхностный:а) подкожный;б) субареолярный.
- Глубокий:
а) интрамаммарный;
б) ретромаммарный.
Клиника, диагностика
Диагноз мастита, казалось бы, не представляет затруднений. Но это касается процесса как такового, а лечебная тактика при различных фазах течения воспалительного процесса строго дифференцирована. Своевременная диагностика ранних форм мастита и своевременно начатое лечение позволяют в большинстве случаев добиться обратного развития процесса, предупреждают переход его в гнойную, деструктивную фазу.
Маститы классифицируют по патологоанатомическим и клиническим признакам. Патологоанатомическая классификация предусматривает выделение галактофорита, паренхиматозного и интерстициального мастита. Две последние формы, встречающиеся только в комбинации друг с другом, разграничить на основании клинических данных не представляется возможным (рис. 10.2).
Острый воспалительный процесс в МЖ необходимо отличать от острого застоя молока. Причинами последнего являются аномальное строение соска, неправильное прикладывание ребенка, недостаточное развитие молочных протоков у первородящих женщин. При остром застое молока опухолевидное образование соответствует контурам долек МЖ; уплотнение в МЖ достаточно подвижное, с четкими границами, бугристой поверхностью, безболезненное. При надавливании на это образование молоко выделяется свободно, сцеживание его безболезненно. Уплотнение определяется на фоне болезненности и напряженности всей железы. После сцеживания женщина ощущает облегчение.
Рис. 10.2, Локализаация
гнойникоов при абсццедирующемм мастите:
1 — суббареолярныйй;
2 — поддкожный;
3 — инттрамаммарн ый;
4 — реттромаммарн ый
Общее состояние организма женщины при остром застое молока ухудшается незначительно. Температура тела, клинические анализы крови чаще остаются нормальными, при исследовании секрета МЖ изменений не определяется. Однако в ряде случаев острый застой молока может сопровождаться лихорадкой, значительным повышением температуры. Острый лактостаз — процесс, как правило, двусторонний и развивается в период между 3-5 днями после родов, т. е. в сроки прилива молока.
Особенно трудно дифференцировать от острого застоя молока начальные формы мастита. При проникновении в ткань молочной железы гноеродной микрофлоры застой молока через 2-4 дня переходит в серозную стадию мастита. Заболевание начинается остро, с озноба, повышения температуры, потливости, слабости, ощущения разбитости, резких болей в железе. Грудь увеличивается в размере, пальпация ее становится болезненной, инфильтрат определяется нечетко. Сцеживание молока болезненно и не приносит облегчения. В крови наблюдается лейкоцитоз до 10-12 тыс., СОЭ ускорено до 20-30 мм/ч. При несвоевременно начатом лечении через 3-6 дней процесс может перейти в инфильтративную фазу, которая характеризуется большей выраженностью клинических признаков воспаления, тяжестью общего состояния больной. Пальпируемое опухолевидное образование приобретает более четкие контуры. В крови наблюдается тенденция к моноцитозу и эози-нофилии. У 80% больных температура тела повышается до 38,0-41,0 °С. Контактная термометрия выявляет повышение локальной температуры в МЖ у 78,8% больных от 35,7 до 36,9 °С (средняя температура кожи МЖ у здоровых женщин —38,3 С).
Переход начальныхх форм мастита в гнойную форму характеризуется усиилением общих и местных симптомов воспаления, прии этом выражены признаки гнойной интоксикации. Теммпература держится постоянно на высоких цифрах илли приобретает гектиче-ский характер. Инфильтрат в жеелезе увеличивается, гиперемия кожи нарастает, в оодном из участков железы появляется флюктуация, кооторая еще раньше возникает при поверхностно рассположенных гнойниках. В ряде случаев присоединяюются явления лимфангоита, регионарного лимфаденитаа. Абсцессы могут локализовываться в поверхностныых или глубоких отделах железы с распространениемм в ретромаммарное пространство при гангреенозной фо рме маститта: темпераатура тела — до 40-441 С; тахикаардия — пуульс до 1200-130 удмиин; МЖ резкко увеличенна в объемее; кожа ее оотечная, с пузырямии, наполненнными гемо ррагическимм содержжимым, с уччастками н екроза; отеечность расспространняется на оокружающиее ткани; в крови выссокий лейкооцитоз со сддвигом лейккоцитарной формулы в лево и токксической зеернистостьюю лейкоцитоов; в моче оопределяеется белок.
Крайне тяжелое сосстояние больных наблюдается при гангренозной форме мастита: температура тела — до 40-41 С; тахикаардия — пульс до 120-130 удмин; МЖ резко увеличенна в объеме; кожа ее отечная, с пузырями, наполненнными геморрагическим содержимым, с участками некроза; отечность распространяется на окружающиее ткани; в крови высокий лейкоцитоз со сдвигом лейккоцитарной формулы влево и токсической зернистостьюю лейкоцитов; в моче определяется белок.
Рис. 10..3. Картина мастита наа термограммме
Наряду с выявлением клинических симптомов диагностики начальных форм мастита используют лабораторные методы исследования секрета МЖ. Секрет МЖ в норме характеризуется слабокислой реакцией (рН 6,8). Воспалительный процесс приводит к изменению кислотности молока в сторону увеличения рН, что связано с повышением активности щелочной фосфатазы.
Также для распознавания ранних и стертых форм ЛМ применяют УЗИ, тепловидение, термографию (рис. 10.3), а в отдельных случаях (в настоящее время крайне редко) — маммографию.
Лечениее
«… Грудница стара, как человеческий род; многие миллионы женщин болеют ею, и с незапамятных времен врачи изощрялись в лечении ее, но в наше время, при блестящем рассвете хирургии, мы не можем похвалиться полным умением лечить мастит» (Войно-Ясенецкий, 1956). Эта мысль, впервые высказанная 50 лет назад, не утратила своей актуальности и в наше время. Проблема лечения мастита по-прежнему представляется сложной и не решенной до конца, несмотря на простоту лечебных мероприятий и техники оперативного вмешательства; ошибки в лечении больных встречаются довольно часто.
Как только диагноз послеродового мастита уточнен, должна быть начата терапия антибиотиками, чтобы гарантировать оптимальный результат. Задержка лечения значительно увеличивает частоту формирования абсцесса.
Какие бы лечебные методы не применялись, необходимо соблюдать основной принцип: проводить лечение мастита с учетом фазности, стадийности процесса. На начальных стадиях показана комплексная консервативная терапия, в деструктивную фазу процесса — хирургическая операция с последующим лечением гнойноой раны.
Лечение может ппроводиться или в амбулаторных условиях, или в стационаре, в зависимости от тяжести состояния пациентки. Системные признаки должны быть ограаничены лихорадкой и умеренным недомоганием. ВВ случае амбулаторного лечения повторный осмотрр и оценка состояния пациентки обязательны в теччение 24-48 часов. Если отсутствует положительнаяя динамика как ответ на терапию антибиотиками, жеенщина должна быть госпитализирована.
Удалению из МЖЖ микроорганизмов и продуктов их жизнедеятельнности, уменьшению застоя молока способствует проодолжение кормления грудью.
Лечение послерродового мастита должно быть этиотропным, компллексным, специфическим и активным. Оно должно включать антибактериальные препараты, дезинтооксикационные и десенсибилизирующие средстваа, методы повышения специфической иммунологичческой реактивности и неспецифической защиты оорганизма, при гнойном мастите — своевременнное оперативное вмешательство.
Антибиотики являяются основным компонентом в комплексной тераппии послеродового мастита. Препаратами выбора слеедует считать полусинтетические пенициллины (окксациллин, амоксицил-лин, флемоксин солютаб, флемоклав). При наличии перекрестной аллергии наазначаются макролиды, цефалоспорины (цефазолиин, це-фалексин, цефтриаксон (лендацин), цефотакксим). Цефтриаксон (лендацин), который относится к парентеральным цефалоспоринам III поколения, отличается необычными фармакокинетическими ссвойствами, в первую очередь длительным периодом полувыведения (8,5 часа), что позволяет исспользовать его в удобном режиме — 1 раз в сутки. Так же, как и другие цефалоспорины, лендацин ххорошо переносится и используется во время берременности и лактации без каких-либо ограничений. Макролиды считаются сравнительно безопасными при беременности (за исключением рокситромицина), но в связи с проникновением в грудное молоко и отсутствием данных о влиянии на новорожденного их с осторожностью следует использовать в период лактации. Препараты обладают эффектом в отношении широкого спектра грам(+) и грам(-) бактерий, проникают внутрь фагоцитов и переносятся в очаг инфекции этими клетками. Макролиды создают высокие концентрации в тканях, намного превышающие концентрации в плазме. К макролидам мало чувствительны энтеробактерии и синегнойная палочка. Интерес к макролидам возрос в связи с введением новых препаратов, таких как азитромицин (сумамед), характеризующихся улучшенной фармакокинетикой, расширенным спектром действия и повышенной безопасностью по сравнению с эритромицином.
Необходимая продолжительность терапии антибиотиками не была установлена точно. Большинство исследователей рекомендуют лечение от 5 до 10 дней. После клинического выздоровления необходимо продолжить лечение еще 48 часов. Пациентки со стафилококковой бактериемией нуждаются в более длительном лечении. Распространение staphylococci может вести к формированию абсцессов в почках, костях и другим осложнениям. Кроме того, S. aureus — один из немногих организмов, способных к инфицированию нормальных сердечных клапанов, с развитием разрушительного острого бактериального эндокардита. Ввиду особой серьезности, стафилококковая бактериемия требует курс лечения от 10 до 14 дней. Если есть любое свидетельство метастазирования абсцесса или бактериального эндокардита, необходим более длительный курс терапии.
Рекомендуется использование стафилококкового бактериофага. Широко назначаются средства, повышающие иммунореактивность организма (энгистол, траумель), витамины, местное лечение компрессами. Физиопроцедуры широко применяются при лакто-стазе (ультразвук), трещинах сосков (терапевтический лазер). Не рекомендуется применять физиолечение в остром периоде мастита.
Несмотря на соответствующее управление маститом, переход в гнойно-деструктивные формы происходит в 4-10% случаев. Это осложнение требует незамедлительного хирургического вмешательства в хирургическом стационаре. Хирургический разрез и дренирование осуществляются в операционной под наркозом. Разрезы должны быть выполнены по естественным линиям кожи, параллельным ареолярному краю. Это обусловливает адекватный дренаж и лучший косметический результат, чем достигнутый радиальными разрезами, рекомендуемыми в прошлом. Дополнительно часть стенки абсцесса должна быть отправлена на патогистологию, так как формирование абсцесса может происходить параллельно с развитием злокачественного новообразования. После дренирования абсцесса рана должна быть хорошо промыта антисептиками и оставаться открытой. Разрезы, выполненные параллельно ареолярному краю по естественной линии кожи, обычно заживают с минимальным рубцеванием, даже когда заживление происходит вторичным натяжением.
Ранняя диагностика послеродового-мастита позволяет быстро начать противовоспалительную терапию и минимизирует воздействие на мать и младенца. В послеродовом периоде должно быть тщательное наблюдение за кормящими, начинающийся мастит и лактостаз должны диагностироваться как можно раньше. Мерами и обязательными условиями профилактики являются соблюдение санитарно-гигиенического режима, своевременное выявление и санация очагов инфекции, соблюдение режима естественного грудного вскармливания, правильное прикладывание новорожденного к груди, внимательное и доброжелательное отношение медицинского персонала.
Выводы
- Острые маститы в основном (82-87% случаев) встречаются в послеродовом периоде у кормящих женщин. Несмотря на значительные успехи профилактической медицины в борьбе с неспецифической хирургической инфекцией, лактационный мастит продолжает оставаться актуальной проблемой как в гнойной хирургии, так и в практике акушера-гинеколога.
- Мастит развивается у 2-5% лактирующих женщин. Точно определить причину этого заболевания трудно. Входными воротами для бактерий чаще всего являются трещины сосков.
- Острый мастит может развиться в любое время при кормлении грудью, но в основном это происходит в течение первого месяца постнатального периода. Средний интервал между заболеванием и инфицированием — 5,5 недели. Возможно, предрасположенность к лактостазу в первые недели после родов объясняет высокую заболеваемость маститом в этот период.
- Основными причинами лактационного мастита являются: застой молока и госпитальная инфекция. Прекращать кормление грудью не рекомендуется, т. к. неинфекционный мастит прогрессирует в инфекционный или абсцесс только 4% случаев.
- Ранняя диагностика послеродового мастита позволяет быстро начать противовоспалительную терапию и минимизирует воздействие на мать и младенца. В послеродовом периоде должно проводиться тщательное наблюдение за кормящими; начинающийся мастит и лактостаз должны диагностироваться как можно раньше.
- Мерами и обязательными условиями профилактики являются соблюдение санитарно-гигиенического режима, своевременное выявление и санация очагов инфекции, соблюдение режима естественного грудного вскармливания, правильное прикладывание новорожденного к груди, внимательное и доброжелательное отношение медицинского персонала.
4. СЕПСИС И СЕПТИЧЕСКИЙ ШОК В АКУШЕРСТВЕ
В начале XXI века сепсис продолжает оставаться одной из самых актуальных проблем современной медицины в силу неуклонной тенденции к росту числа больных и стабильно высокой летальности, которую демонстрируют даже самые авторитетные отечественные и зарубежные клиники. В целом в Европе ежегодно регистрируется до полумиллиона случаев сепсиса.
При исследовании частоты сепсиса установлено, что только в США ежегодно регистрируется от 300 000 до 500 000 случаев летальных исходов, при которых погибает от 30 до 90% больных. При этом учитывается, что не все случаи заболевания своевременно и адекватно диагностируются.
В акушерстве частота гнойно-воспалительных и септических осложнений составляет от 5 до 26%.
Росту септических осложнений в акушерстве способствует увеличение удельного веса женщин с тяжелой экстрагенитальной патологией, индуцированной беременностью, гормональной и хирургической коррекцией шейки матки при невынашивании беременности, значительное увеличение процента абдоминального родоразрешения и нередко возникающая иммунодепрессия вследствие длительного приема некоторых лекарственных препаратов.
Необходимо помнить о физиологическом снижении иммунитета, характерном для беременных, на фоне которого даже незначительная родовая травма может привести к развитию септического осложнения.
До 1991 года существовало определение сепсиса, данное в 1986 году В.Г. Бочоришвили: «Сепсис — такая клинико-патологическая форма инфекционного заболевания, при котором на фоне тяжелого преморбидного состояния (рахит, диабет, травмы, патологические роды), либо из-за высокой вирулентности, большой инфекционной дозы, неестественного пути проникновения микробов, резистентность настолько сорвана, что микробные очаги воспаления из мест уничтожения микробов превращаются в места их бурного развития и источники повторных генерализаций».
Однако с развитием фундаментальных общебиологических представлений о реакции организма на повреждение, в том числе и инфекционное, изменился взгляд на природу сепсиса. Произошла постепенная трансформация понимания сути процесса: от ведущей и единственной роли инфекционного агента к признанию существенного значения реактивности макроорганизма. Согласно современным представлениям, в основе сепсиса лежит интегральное взаимодействие между микро-и макроорганизмом, определяемое индивидуальными особенностями последнего.
Можно выделить 3 ступени эволюции концепции сепсиса:
І— сепсис приравнивается к инфекции;
ІІ— сепсис не всегда отождествляется с инфекцией;
ІІІ— сепсис характеризуется как синдром системного воспали тельного ответа не только на инфекцию, но и на экстремальные воздействия и агрессию — травму, ожоги, шоки, иммунодефицит
Таблица 10.1. Основные понятия и критерии различных проявлений сепсиса (по Bone R.C., 1994)
| 1 | 2 |
| Инфекция | Воспалительный ответ, вызванный появлением микроорганизмов путем |
| Бактериемия | Присутствиеб бактерий в крови |
| 2 | |
| Синдром системного воспалительного ответа | Системный воспалительный ответ на различные повреждающие факторы, который характеризуется двумя (или более) клиническими признаками: — температура >38 °С или < 36 °С; |
— ЧСС > 90 в мин;СепсисСистемный воспалительный ответ на достоверно выявленную инфекцию, который характеризуется двумя (или более) клиническими признаками:
- температура >38 С или < 36 °С;
- ЧСС > 90 в мин;
Тяжелый сепсисСепсис, характеризующийся нарушениями функции органов, гипоперфузией и гипотензией. Гипоперфу-зия может сочетаться (но не ограничи-Септический шокСепсис с артериальной гипотензией, развивающейся несмотря на адекватную инфузионную терапию, и нарушениями тканевой перфузии, которая может сопровождаться (но неГипотензияограничиваться )артериальноелактатацидо зомдавле-
Систолическое ние менее 90 мм рт. ст. или снижение
40Синдром полиорганной более мм рт ст от среднего в от
Присутствует острое повреждение функции органов и систем, при этом
Терминология вопроса. По мере изучения патогенеза сепсиса возникла необходимость в создании новой стандартизованной терминологии, включающей определение критериев, характерных для пациентов с септическим течением болезни. В 1991 году Американская коллегия торакальных хирургов и Общество специалистов интенсивной терапии на согласительной конференции выработали терминологию по определению общих критериев при различных формах сепсиса (табл. 10.1).
Этиология
В течение последних лет наблюдается постоянная смена лидерства бактериальных возбудителей сепсиса в акушерстве и гинекологии. До использования антибиотиков широкого спектра действия чаще встречалась грам(+) бактериальная инфекция (стафилококки, стрептококки). С появлением мощных антибиотиков сепсис становится последствием грам(-) нозокомиальной инфекции (кишечная палочка, синегнойная палочка, клебсиелла, протей). В настоящее время на первом месте среди возбудителей гнойно-воспалительных осложнений в акушерстве стоят ассоциации грам(+), грам(-) и анаэробных бактерий, что является крайне неблагоприятным фактором, так как взаимно усиливается рост и вирулентность микробов.
Патогенез
В зависимости от принадлежности микроорганизма к грам(+) или грам(-) флоре развитие сепсиса имеет свои особенности.
Грам(—) сепсис. В основе этого вида сепсиса лежит каскад реакций в ответ на LPS (липополисахарид) или эндотоксин, который является фрагментом клеточной мембраны грам(—) микроорганизма. Эндотоксин стимулирует различные компоненты воспалительного ответа (систему комплемента, нейтрофилы, мононуклеарные фагоциты). Циркулирующий LPS индуцирует активацию полиморфноядерных лейкоцитов и микрофагов, которые продуцируют различные медиаторы воспаления, цитокины, токсические кислотные радикалы, оксид азота. Доказано, что введение небольших доз эндотоксина добровольцам вызывает клиническую картину сепсиса с повышением температуры тела, тахикардию, тахипноэ, колебания АД.
Грам(+) сепсис. Грам(+) бактерии не содержат в своей мембране эндотоксины, поэтому механизм септических реакций другой. У грам(+) бактерий имеется липополисахаридная капсула, которая содержит фосфолипидную мембрану, окруженную слоем пептидогликанов. Тейхоновая и тейхуроновая кислоты и полисахариды связаны с каждым слоем. Кроме того, грам(+) бактерии содержат специфические антитела: стафилококковый протеин А и стрептококковый протеин М. Пептидогликаны и тейхоновая кислота активируют альтернативные пути комплемента, они изменяют активность макрофагов и лимфоцитов, связываются с гуморальными факторами. Комплекс ответных реакций на инвазию грам(+) микрофлоры является более сложным, по сравнению с введением эндотоксина. Грам(+) флора воздействует на моноциты и вызывает выброс цитокинов, а также активирует метаболизм арахидоновой кислоты с образованием лейкотриенов и простагландинов, активирует каскад системы комплемента, тромбоциты и другие факторы коагуляции, увеличивает проницаемость клеточных мембран.
Рассматривая патогенез сепсиса, особое внимание следует уделить феномену бактериальной транслокации. Слепая кишка и терминальный отдел подвздошной кишки являются естественным резервуаром грам(-) бактерий. При определенных состояниях или заболеваниях (таких как ишемия, геморрагический шок, термические поражения, тяжелые воспалительные заболевания) нарушается барьерная функция слизистой оболочки кишечника. Это приводит к перемещению бактерий и эндотоксина в мезентериальные лимфатические сосуды и портальную систему. Если защитная система печени не срабатывает, бактерии и эндотоксины попадают в системный кровоток и вызывают системный воспалительный ответ. Таким образом, бактериальная транслокации может быть первичным или вторичным механизмом запуска системного воспалительного ответа, который является важным звеном септического процесса.
Клинические проявления сепсиса
Первые проявления сепсиса, независимо от его формы, существенно не отличаются. Начало септического процесса характеризуется повышением температуры тела, чаще до 38-39 °С и более. Иногда температурная реакция с самого начала носит гектический характер. Суточный размах составляет обычно не менее 1 С. Изредка, особенно у ослабленных больных с пониженной реактивностью, температура повышается выше 38,5 °С лишь в тяжелом или крайне тяжелом состоянии. Одновременно с подъемом температуры появляются ознобы, частота и длительность которых в определенной мере соответствуют тяжести состояния больной.
При сепсисе отмечаются выраженные симптомы раздражения ЦНС: головокружение, головная боль; нередко наблюдается повышенная возбудимость, иногда — ступорозное состояние. Больные предъявляют жалобы на чувство страха, общую слабость.
Характерное лицо (facies hippocratica) у больных сепсисом наблюдается только в предагональной стадии. Обычно же кожа у них бледная, покрыта холодным потом, имеет сероватый оттенок, слизистые синюшны. Изредка на конъюнктиве нижних век появляется петехиальная сыпь. На лице сыпь имеет форму бабочки, на коже живота, спины, груди и конечностей носит мелкоточечный характер.
В последние годы у септических больных на фоне интоксикации отмечаются уплотнения кожи по наружной поверхности бедер, от тазобедренного до коленного суставов, по внешнему виду напоминающие лимонную корочку. Нередко в подобных случаях ставится диагноз флегмоны и производятся безрезультатные пункции и разрезы. По мере улучшения состояния эти уплотнения уменьшаются и полностью исчезают.
Для сепсиса характерны выраженные изменения со стороны сердечно-сосудистой системы: тахикардия (частота пульса достигает 120 ударов в минуту и более). При отсутствии локальных поражений сердца отмечается ослабление его тонов и появление шумов, в первую очередь — систолического на верхушке сердца, а при анемизации — так называемого «хлопающего тона». У 15% больных отмечается расширение границ сердца.
При этом над легкими прослушивается жесткое дыхание, которое учащается до 20-30 дыханий в минуту.
Язык суховатый или сухой, часто обложен белым или коричневым налетом.
Живот мягкий, не вздут, при пальпации почти всегда безболезненный. На фоне выраженной и тяжело протекающей интоксикации нередко появляется профузный понос. У таких больных при глубокой пальпации кишечника определяется болезненность. У 30-40% больных отмечается увеличение печени, иу 15-20% — селезенки. Мочевыделительная система, как правило, не страдает.
Описанная выше клиническая картина обычно наблюдается при грам(+) сепсисе, вызванном кокковой флорой. При выраженной интоксикации грамнегативными бактериями на фоне описанной картины отмечается снижение артериального давления вплоть до развития септического шока.
Сепсис, вызванный анаэробной флорой, характеризуется ранним и бурным развитием заболевания. Учитывая, что при этом возбудителями становятся неклостридиальные неспорообразующие бактерии, являющиеся в большинстве случаев представителями нормальной микрофлоры половых путей женщины, характерных симптомов perfringensсепсиса (гемолиза, блокады почек вплоть до развития анурии, желтухи) не наблюдается. Течение, как правило, тяжелое. Выделение возбудителя производится в специальных бактериологических анаэробных лабораториях. Диагноз ставится, как правило, на основании клиники и отсутствия эффекта от общепринятой антибиотикотерапии.
В случае тяжелого сепсиса при генерализации инфекционного процесса наблюдается возникновение локальных гнойных очагов в легких (95%), почках (60%), сердце (20%), головном мозге (20%).
Клиническая картина складывается из проявлений общей интоксикации, характерной для сепсиса вообще, и симптомов, свойственных локальным поражениям. Например, при локализации гнойного очага в легких, кроме картины общей интоксикации, имеет место дыхательная недостаточность, выслушиваются влажные разнокалиберные хрипы, при перкуссии отмечается притупление перкуторного звука, при плевропневмонии — нарастающее скопление жидкости в плевре. Соответственно выглядит и рентгенологическая картина. При поражении миокарда, и особенно — эндокарда, появляются шумы, изменяются сердечные тоны, сглаживается талия сердца, увеличивается его объем. Тяжесть заболевания нарастает при септическом эндокардите.
При поражении почек с развитием локальных гнойных очагов, вовлечением в процесс околопочечной клетчатки появляются локальная болезненность, положительный симптом Пастернацкого, уменьшается диурез, наблюдаются пиурия, протеинурия и бактериурия.
Учитывая тяжесть течения сепсиса и нередко — летальные исходы, большое внимание следует уделять профилактике этого грозного осложнения. С этой точки зрения важны ранняя диагностика локальных проявлений инфекции и назначение адекватной терапии.
Диагностика сепсиса
Диагноз сепсиса основан на правильном сборе анамнестических данных, клинических проявлениях (температура > 38 °С или 36 °С, ЧСС > 90 в мин; частота дыхания > 20 в мин или РаСо2< 32 мм рт. ст; ознобы, цианоз), а также интерпретации полученных данных лабораторных исследований (гемограмма характеризуется увеличением СОЭ, лейкоцитозом, повышением лейкоцитарного индекса интоксикации за счет сдвига лейкоцитарной формулы влево, анемией). Диагноз сепсиса, вызванного анаэробной инфекцией, ставится на основании клиники и отсутствия эффекта от общепринятой антибиотикотерапии. По возможности, он подтверждается бактериологическими исследованиями, выполненными в анаэробных условиях.
В зависимости от срока заболевания различают ранний сепсис, который развивается в первые 14 дней после аборта или родов, и поздний — развивается после 14 дней. По длительности течения различают 3 варианта: 1) молниеносный сепсис, который возникает в первые часы или дни после родов, характеризуется тяжелым течением, часто заканчивается летальным исходом в течение суток; 2) средний по продолжительности сепсис протекает остро 2-3 недели; 3) затяжной или хронический сепсис — длится 2-3 месяца, характеризуется вялым течением, торпидностью иммунологических реакций, состоянием глубокого вторичного иммунодефицита, низкой эффективностью общепринятой схемы лечения сепсиса.
Септический шок — тяжелейший клинический синдром, развивающийся у больных на фоне сепсиса и эндотоксемии, характеризующийся нарушениями перфузионной системы микроциркуляции жизненно важных органов и проявляющийся прогрессирующей гипотензией, не поддающейся коррекции адекватным восполнением оцк.
Летальность больных при септическом шоке в акушерстве колеблется в пределах 62-88%. Среди заболеваний и клинических состояний, течение которых наиболее часто осложняется септическим шоком, следует выделить: септический аборт, хориоамнионит, перитонит после кесарева сечения, мастит, пиелонефрит, эндомиометрит, тромбофлебит тазовых вен. Фоном, благоприятствущим развитию септического шока, является осложненное течение беременности, обусловленное преэклампсией, невынашиванием беременности, экстрагенитальными заболеваниями (заболевания почек, легких, сахарный диабет, геморрагический синдром, длительное проведение реанимационных мероприятий, наличие врожденных или приобретенных иммунологических дефектов и т. д.)-Частота развития септического шока находится в тесной зависимости от возбудителя септического процесса. В последние 25 лет чаще встречается сепсис, вызванный антибиотико-устойчивыми штаммами микроорганизмов.
Наиболее часто возбудителями гнойносептических заболеваний, на фоне которых возникает септический шок, являются продуцирующие эндотоксин грамотрицательные возбудители: Е. Coli; Klebsiella; Enterobacter; Pseudomonas и Serratia, а также грамотрицательные анаэробы. Септический шок может развиться и на фоне сепсиса, вызванного грамположительной флорой: Staphylococcus epidermidis; Pneumococcus; Staphylococcus aureus; Streptococcus viridans. Активным началом в этих случаях являются компоненты оболочки грамположительных бактерий.
В экспериментальных и клинических работах подчеркивается тесная взаимосвязь и взаимообусловленность септического шока, ДВС-синдрома, участия калликреин-кининовой системы, генерализованной реакции Санорелли-Шварцмана, при которой наблюдаются универсально выраженные некротические и геморрагические повреждения органов и тканей (почек, печени, легких, слизистых оболочек, кожи, гипофиза и т. д.). ДВС-синдром возникает при взаимодействии эндотоксина с лейкоцитами, тромбоцитами, внешней и внутренней системами активации прокоагулянтного звена системы гемостаза, фибринолитической системой, системой комплемента, кининовой системой, катехоламинами и глюкокортикоидами.
Таким образом, на ранних этапах действия эндотоксина на организм преобладают два феномена: 1) имеет место нарушение правильного распределения кровотока в капиллярах за счет дистонии артериол вследствие чрезмерного выброса веществ, влияющих на сосудистый спазм артериол, их паралитическое расширение, открытие артериовенозных шунтов и сброс в них части крови; 2) образуются мельчайшие фибриновые, тромбоцитарные и смешанные микротромбы, происходит увеличение вязкости крови за счет появления мономеров фибрина в кровотоке и явлений эритроцитарного сладжа, что еще более ухудшает капиллярную перфузию. В этих условиях нарушаются доставка кислорода и питательных веществ в ткани и удаление токсических продуктов метаболизма.
Нарушение капиллярной перфузии тканей вызывает включение компенсаторноприспособительных механизмов организма: возникает рефлекторная стимуляция тучных клеток, ответственных за нормализацию кровотока в капиллярах, активизируется фибринолиз в клетках эндотелия сосудов, находящихся в контакте с тромбом, что приводит к последующему лизису тромба и восстановлению проходимости сосуда, активизируются клетки ретикулоэндотелиальной системы, выполняющие функции фагоцитоза бактерий, происходит обезвреживание токсических веществ, поглощение из кровотока мономеров фибрина и других дериватов фибриногена. При существовании длительной эндотоксемии наступает декомпенсация систем гемостаза, что приводит к дальнейшему ухудшению условий функционирования клеток и тканей организма. Блокада микроциркуляции обусловливает развитие анаэробного гликолиза, депонирование крови в выключенных из циркуляции участках тканей, рост метаболического ацидоза, резкое увеличение проницаемости клеточных мембран, спазм и микротромбоз капилляров почечных клубочков с нарушением их функции вплоть до анурии, плазматический отек, гипоксию, жировую дистрофию и некроз центральных частей печеночных клеток, массовую обструкцию фибрино-тромбоцитарными тромбами капилляров легочной артерии, отек внутриальвеолярной перегородки, открытие артериовенозных шунтов и появление геморрагического пропитывания легочной ткани. Все эти многочисленные изменения являются патофизиологической основой клинических проявлений септического шока.
Диагноз септического шока ставится на основании анализа анамнеза, клинических и лабораторных проявлений бактериемии. Первым симптомом шока у больных обычно является озноб, сопровождающийся гипертермией до 39-40 °С с последующим снижением температуры тела до субфебрильной или нормальной. С первых часов заболевания отмечаются частый, но ритмичный пульс, одышка, в легких выслушиваются влажные хрипы. Наряду с этим отмечается появление парестезии, сильных мышечных болей, которые усиливаются даже при прикосновении постельного белья. Обращает на себя внимание изменение психики больных: возникающие вначале возбуждение, чувство беспокойства через 4-6 часов сменяются безразличием к окружающему, некритическим отношением к своему состоянию, эйфорией.
В первые часы шока багрово-красный цианотичный цвет кожных покровов резко контрастирует с цианотичной окраской губ, ногтевого ложа и кончиков пальцев. К 6-12 часам заболевания на коже губ, носа и других участках появляются высыпания геморрагического характера. Артериальное давление снижается до 60/40 мм рт. ст. и менее. У отдельных больных могут наблюдаться нормальные и даже повышенные показатели артериального давления. В начальные стадии развития септического шока печень и селезенка определяются в обычных границах. С увеличением продолжительности шока у больных появляются схваткообразные боли в животе, частый обильный стул. Моча кровянистая, с большим содержанием белка. Позже она становится бурой, а в последующие дни цвет ее вновь становится обычным, но развивается острая олигоанурия, снижается относительная плотность мочи и развивается острая почечная недостаточность.
Следует отметить, что клиническая картина септического шока во многом определяется нарушениями микроциркуляции, обусловленными ДВСсиндромом. Наблюдаются бледность, акроцианоз кожных покровов, олигурия и нарушение функции печени, дыхательная недостаточность, нарушение сознания (эйфоричность, некритическое отношение к окружающему, помрачение сознания), клинически выраженный гемолиз и геморрагический диатез. Последний чаще всего проявляется желудочнокишечными кровотечениями, подкожными геморрагиями, носовыми кровотечениями, кровоизлияниями в склеры глаз и метроррагиями. Независимо от причин шока, его тяжелые клинические проявления обычно отодвигают на задний план симптомы заболевания, являющегося причиной возникновения шока.
Для уточнения диагноза септического шока и проведения целенаправленной терапии необходимо соблюдать следующие мероприятия:
- контроль артериального и центрального венозного давления, частоты дыхания — каждые 30 мин;
- измерение ректальной температуры 4 раза в сутки, особенно после озноба, для сопоставления с данными температуры тела в подмышечной области;
- посевы крови в момент госпитализации и во время ознобов, определение чувствительности выделенной микробной флоры к антибиотикам;
- почасовой контроль за диурезом, выделение микробной культуры из мочи, определение чувствительности микробов к антибиотикам;
- определение электролитов сыворотки, азота, мочевины, креатинина, мочевой кислоты, газов артериальной крови, рН;
- постоянный мониторный контроль ЭКГ, частоты сердечных сокращений;
- рентгенологическое исследование грудной клетки, брюшной полости при вертикальном положении пациентки для контроля за состоянием
легких и брюшной полости;
- проведение общего анализа крови с оценкой лейкоцитарной формулы, определением гематокрита;
- исследование показателей свертывания крови: расчетом индекса интоксикации, количества тромбоцитов, фибриногена, растворимых комплексов мономеров фибрина (РФМК), продуктов деградации фибрина и фибриногена (ПДФФ), антитромбина III, показателей тромбоэластограммы.
При септическом шоке чрезвычайно важной является оценка кровоснабжения периферических сосудов, а также психического состояния больной. Холодные, синюшные конечности и наличие коматозного состояния у любой больной с гнойносептическим процессом указывают на наличие септического шока. Наряду с этим может наблюдаться гипердинамическая стадия шока, когда, несмотря на гипотонию, кожа конечностей остается теплой, а диурез — достаточным. Одним из характерных для септического шока объективных симптомов неадекватного кровоснабжения жизненно важных органов является нарушение функции почек, проявляющееся олигурией (почасовый диурез < 30 мл/час).
В диагностике септического шока крайне важное значение имеет оценка функции легких, которая нарушается вследствие блокады легочного кровотока тромбоцитарно-фибриновыми агрегатами. Обычно нарушения функции легких проявляются в виде их отека и развития острой легочной недостаточности. Для диагностики легочной недостаточности ценными являются определение частоты дыхания (тахипноэ) и анализ газового состава крови (выявление метаболического ацидоза). Рентгенологически во всех отделах легких обнаруживают облаковидные затемнения, являющиеся проявлением интерстициального отека легочной ткани. Нередко при септическом шоке на первый план выступают явления острой сердечной недостаточности, основными клиническими признаками которой являются гипотония или коллапс, а также увеличение и болезненность печени. Это состояние обусловлено депонированием крови на периферии, уменьшением венозного кровотока, снижением сердечного выброса и уменьшением систолического выброса крови.
При исследовании периферической крови в первые часы заболевания выявляется лейкопения, сменяющаяся к концу первых суток прогрессирующим лейкоцитозом.
Наиболее объективным показателем, отражающим степень интоксикации, является лейкоцитарный индекс интоксикации (ЛИИ), который рассчитывается по формуле:
где: С — сегментоядерные нейтрофилы;
П — палочкоядерные нейтрофилы;
Ми — миелоциты;
Пл — плазматические клетки
Мо — моноциты;
Ли — лимфоциты;
Э — эозинофилы; Ю — юные.
ЛИИ =1 — норма.
ЛИИ = 2-3 — ограниченный воспалительный процесс.
ЛИИ = 4-9 — выраженный бактериальный компонент эндрогенной интоксикации.
Лейкопения с высоким ЛИИ — негативный прогностический признак, свидетельствующий об истощении иммунной системы.
При бактериологическом исследовании крови, согласно данным литературы, только у 25% больных удается высеять возбудитель из крови, у 47% — из мочи, и у 90% — из цервикального канала.
Клиническая картина септического шока неотделима от диагностики ДВС-синдрома, важным клиническим признаком которого при данной патологии являются: кровоточивость в одном или нескольких местах (в местах уколов, из матки, из поврежденных при операции тканей), наличие пурпуры, кровоподтеков. Геморрагический некроз кожи лица, синюшность кожи рук, ног, носа, щек и ушных раковин также являются признаками ДВС. Важнейшей клинической особенностью ДВС-синдрома может быть «необъяснимое» развитие тяжелой клинической картины шока без наличия, казалось бы, явной причины возникновения этого патологического состояния. Следует помнить, что шок при этом развивается в результате повреждения тромбоцитов, активации кининов, влияния ПДФФ и депонирования крови или плазмы в системе портальной вены.
Точная диагностика патологического внутрисосудистого свертывания крови возможна лишь при своевременном лабораторном исследовании системы гемостаза, при этом обычно обнаруживаются признаки либо хронической, либо подострой или острой формы ДВС-синдрома. Подострая и острая формы ДВС-синдрома у больных с септическом шоком характеризуются выраженной тромбоцитопенией (менее 50 х 109/л), гипофибриногенемией (менее 1,5 г/л), повышенным потреблением антитромбина III и плазминогена, резким повышением дериватов фибринна и фибриногена, ПДФФ, удлинением хронометриического показателя тромбоэласто-граммы (R+K), времени свертывания, уменьшением структурного показателя тромбоэластограммы (mА и ИТП-инндекс тромбодинамическго потенциала). При хрооническом течении ДВСсиндрома имеют место умеренная тромбоцитопения (менее 150 х 109/лл), гиперфибриногенемия, усиленное потребление антитромбина III, повышение концентрации РФМКК и ПДФФ, а также реальная гиперактивность системмы гемостаза (укорочение R+K и увеличение mА и ИТП на тромбоэластограмме).
При затянувшеммся шоке (более 1 суток) имеет место, как правилло, волнообразное его течение со сменой в перифеерической крови гиперкоагуляции на гипокоагуляциюю и наоборот. Эти изменения системы гемостаза ннаходятся во взаимосвязи с расстройствами микроцииркуляции (спазм артериол, уменьшение количестваа функционирующих капилляров, внутрисосудистаая агрегация эритроцитов). Адаптационная реакцияя организма в ответ на инфекцию сопровождаетсяя задержкой жидкости в организме. В первые часыы шока, несмотря на увеличение объема циркулируующей жидкости (ОЦК), содержание натрия в плаазме крови сохраняется на физиологическом уровнне, а концентрация калия снижается вплоть до рразвития острой почечной недостаточности. Оддновременно отмечается накопление в крови недооокисленных продуктов обмена, о чем свидетельсствует повышение содержания в крови молочной и ппиро-виноградной кислот.
Накопление недооокисленных продуктов обмена в первые часы шоока не приводит к развитию тяжелого ацидоза, котоорый частично компенсируется гипервентиляцией. Поэтому, как правило, обнаруживается сдвиг киссллотно-основного состояния крови в сторону дыхатеелльного алкалоза и метаболического ацидоза. К коннцу первых суток заболевания у большинства болььных для компенсации метаболических нарушениий кислотно-основного состояния гипервентиляцции не хватает, в крови накапливаются недоокиислен-ные продукты распада, снижается рН, т. е. развивается выраженный метаболический ацидоз. Непосредственной причиной летального исхода при септическом шоке являются остро развивающщаяся печеночная и легочная недостаточность, ннарушение мозгового кровообращения, а также ттромбозы внутренних органов.
Основвополагающщие принциппы лечения сепсииса и септиического шока:
- .Неммедленная госпитализация больнной в оттделение а кушерской реанимациии или интеннсивноой терапии.
- Корррекция геммодинамиче ских наруш ений пуутем проведдения инотрропной тераапии и адеккватноой инфузио нной терапиии под пост оянным монниториингом гемоддинамическиих показателлей.
- Подддержание аадекватной вентиляциии и газообмена.
- Нормализация функции кишечника и ранее энтеральное питание.
- Своевременная коррекция метаболизма под постоянным контролем.
- Антибактериальная терапия под постоянным микробиологическим контролем. До начала антибиотикотерапии необходимо, как минимум, 2 посева.
- Иммуномодулирующая и антимедиаторная терапия.
- Хирургическая санация очага инфекции.
Наиболее распространенные ошибки при оказании помощи больным с акушерским сепсисом:
—отсутствие вазопрессоров в комплексной терапии, несмотря на первичность снижения тонуса артериол;
—промедление с радикальной санацией первичного очага, к моменту появления явных признаков гнойного эндометрита уже может сформироваться полиорганная недостаточность;
—неадекватная антибиотикотерапия (непрерывный выбор стартового антибиотика, длительное применение низкоэффективного антибиотика, отсутствие контроля за проводимой антибиотикотерапией);
—позднее использование методов экстракорпоральной детоксикации.
Выводы
В последние годы отмечен рост частоты гнойно-воспалительных осложнений в акушерстве, особенно участились тяжелые их формы. Под влиянием антибиотиков, активных по отношению к стафилококку, несколько снизилась роль этого возбудителя, и значительное место заняли кишечная палочка, энтерококк, а также анаэробы и грамотрицательная флора, эшерихии, клебсиелла, ассоциации бактерий и условно-патогенной микрофлоры. Серьезную проблему послеродовых инфекций приобретает внутригоспитальная инфекция, которая при снижении общей резистентности организма женщины имеет выраженную вирулентность. Сам по себе родовой акт таит в себе определенную опасность развития пуэрперальной инфекции, а предрасполагающими факторами могут стать: продолжительность родов более 12 часов, длительный безводный промежуток, большое число влагалищных исследований, кольпиты, бактериальный вагиноз, эндометрит в родах и ручные внутриматочные вмешательства. Особая роль отводится операции кесарева сечения.
Акушерский сепсис представляется результатом недостаточного лечения гнойновоспалительных заболеваний. В борьбе с воспалительными заболеваниями большое значение имеет профилактика этих осложнений у беременных, которая должна начинаться еще задолго до родов. Заранее должны быть выделены группы повышенного риска беременных по гнойновоспалительным заболеваниям, и в этих группах врачи женской консультации должны провести профилактические мероприятия по своевременному выявлению и санации очагов инфекции, адекватному лечению хронических воспалительных заболеваний почек, желудочно-кишечного тракта, кожи и слизистых и т. д. Только благодаря совместным усилиям медперсонала и пациенток на разных уровнях оказания помощи беременным, роженицам и родильницам, возможно предупреждение и снижение материнской заболеваемости и смертности от сепсиса и его осложнений.
Литература
- Абрамченко В.В., Башмакова МЛ., Корхов В.В. Антибиотики в акушерстве и гинекологии: Руководство. — СПб.: СпецЛит., 2001. — 239 с.
- Абрамченко В.В., Костючек Д.Ф., Перфильева Г.Н. Гнойно-септическая инфекция в акушерскогинекологической практике. — СПб., 1994. — 424 с.
- Білоненко ГА. Малоінвазивні втручання під контролем сонографіі при гнійному післяпологовому маститі // Вестник неотложной и восстановительной медицины. — 2001. — Т. 2, № 2-3. — С. 144-147.
- Венцківський Б.М., Веропотвелян П.М., Лунгол В.М. Прогностична оцінка і тактика ведення ендометриту після операції кесаревого розтину // Педіатрія, акушерство та гінекологія. — 1998. — №3. — С. 78-80.
- Венцківський Б.М., Гойда Н.Г., Іркіна Т.К. Діагностика та лікування гнійно-септичних ускладнень в акушерській практиці й профілактика материнської смертності // Педіатрія, акушерство та гінекологія. — 1996. — № 1. — С 39-41.
- Зак И.Р. Латентное течение септицемии после родов (хрониосепсис) // Акушерство и гинекология. — 1988. — № 8. — С. 44-48.
- Калинина И.Ю. Лечение послеродовых гнойных ран промежности применением низкоэнергетического лазера: Дне. … канд. мед. наук: 14.00.01, 03.00.07 / Ростовский гос. мед. ун-т. — Ростов-на-Дону, 2003. — 200 с.
- Карпов O.K., Зайцев АА. Риск применения лекарственных препаратов при беременности и лактации. — СПб.: Изд-во «Диля», 2003. — 352 с.
- Куперт А.Ф., Куперт МА. Новый подход к лечению эндометритов после родов // Актуальные вопросы акушерства и гинекологии. — 2001-2002.— Т. 1, № 1. — С. 45-46.
- Крюковский СБ. Послеоперационные гнойно-септические осложнения в акушерстве (прогнозирование, профилактика, ранняя диагностика и терапия): Дис…. д-ра мед. наук: 14.00.01 / Смоленская мед. академия. — М., 2002. —266 с.
- Куликов А.В., Казаков Д.П., Егоров В.М., Кузнецов Н.Н. Анестезия и интенсивная терапия в акушерстве и перинатологии. — М.: Медицинская книга, 2001. — 258 с.
- Ласачко С А. Диагностика и лечение диффузных доброкачественных заболеваний молочной железы // Современные направления амбулаторной помощи в акушерстве и гинекологии. — Донецк: ООО «Лебедь», 2003. — С.195-203.
- Ласачко С А., Морозова НА. Деяк1 особливост1 лактацп серед породдль, як1 ратше вживали pi3Hi методи контрацепци // Вкзник проблем бюлогп i медицини. — 1999. — № 4. — С. 26-29.
- Новикова Р.И., Кабанъко Т.П., Черний В.И., Штутин С А. Анестезия, интенсивная терапия и реанимация при критических состояниях в акушерстве. — Донецк: ДМУ, 1994. — 146 с.
- Никонов А.П. Профилактика и лечение гнойных осложнений в гинекологии. Доклад на Нижегородской конференции // http:www.apteki. nnov. ru
- Оскретков В.И., Кокин Е.Ф. Хирургическое лечение больных с острым абсцедирующим и флегмонозным лактационным маститом // Вестник хирургии. — 2001. — Т. 160, № 2. — С. 70-76.
- Потапов В.О., Болитова Н.В., Колобова О.В., Гртченко Т.М. Викорие-тання антимшробного препарату бетадин у комплекешй терапи шеляпологового ендометриту // Пед1атр1я, акушерство та гшеколопя. — 2002. — №3. —С. 103-105.
- Репина МА. Место гнойно-септических заболеваний в структуре материнской смертности // Журнал акушерства и женских болезней: Спец. выпуск. — СПб., 1998. — 123 с.
- Савельева И.С. Современные аспекты этиопатогенеза, диагностики и лечения хронических воспалительных заболеваний внутренних половых органов // РМЖ. — 1999. — Т. 7, № 3. — С. 28-33.
- Стан здоров’я жшочого населения в Украш1 за 2003 р!к / МОЗ Украши, Центр медично1 статистики. — К., 2004. — 216 с.
- Стрижаков А.И., Давыдов А.И., Белоиерковцева Л Д. Избранные лекции по акушерству и гинекологии. — Ростов-н/Д, 2000. — 144 с.
- Товстановсъка В.О., Прилуцъка А.Б., Прилуцъкий 0.1. Мшробюлопчш чинники раново! шфекци в акушерськии практищ у сучасних умовах // Здоровье женщины. — 2005. — № 3 (23). — С. 52-54
- Тютюнник В.Л., Гуртовой Б.Л. Профилактика и лечение эндометрита после родов и кесарева сечения // РМЖ. — 2002. — Т. 10, № 18. — С. 41-47.
- Усов Д. В. Избранные лекции по общей хирургии. — Тюмень, 1995. — 246 с.
- Цвелев Ю.В., Кира Е.Ф., Кочеровец В.И., Баскаков В.П. Анаэробная инфекция в акушерскогинекологической практике. — СПб.: Питер, 1995.— 320 с.
- Цвелев Ю.В., Кира Е.Ф., Баскаков В.П., Кочеровец В.И. Бактериальная инфекция в акушерстве и гинекологии. Итоги и перспективы // Журнал акушерства и женских болезней: Спец. выпуск. — СПб., 1998. — С. 188-189.
- Чайка В.К., Ласачко СА, Квашенко В.П. Роль акушера-гинеколога в выявлении и профилактике заболеваний молочных желез // Новости медицины и фармации. — 2004. — № 7 (май). — С. 14-15.
- Частная хирургия / Под ред. Ю.Л. Шевченко— СПб.: СпецЛит., 2000. —Т. 1. —С. 129-142.
- Фаткуллин И.Ф., Габидуллина Р.И., Гурьев Э.Н. Зависимость гнойно-септических осложнений после кесарева сечения от шовного материала и способа перитонизации // Казанский мед. журнал.— 1999. — № 2. — С. 91-94.
- Юхтин В.И., ЧадаевА.П., Хуторянский И.Н. О хирургической классификации мастита// Мед. помощь. — 1995. — № 2. — С. 21-23.
- Amman N.N., Hasweh Y.G., Hassan AA. et al. Postpartum necrotizing fasciitis. Case report,// Br J Obstet Gynecol. — 1986. Vol. 93. — P. 82-83.
- Bone R.C. Gram-positive organisms and sepsis // Arch.Intern.Med. —1994. _ Vol. 154. — P. 26-34.
- Christman J.W. Holden E.P. Blackwell T.S. Strategies for blocking the systemic effects of cytokines in the sepsis syndrome // Crit.Care Med. —1995. — Vol. 23, № 5. — P. 955-963.
- Cunningham F.G., MacDonald P.C., Gant N.F. Williams’ Obstetrics. — 18th ed. — Norwalk, CT: Appleton & Lange, 1989. — 323 p.
- Eschenbach DA. Acute postpartum infections // Emer. Med. Clin. North. Am. — 1985. — Vol. 3. — P. 87-115.
- Duff P. Staphylococcal infections. In: Gleicher N, ed. Principles of medical therapy in pregnancy. — New York: Plenum, 1985. — P. 437-441.
- Douglas A., Milligan and Patrick Duff. Puerperal Mastitis. Obstetric and gynecologic infectious disease. Ed. Joseph G.Pastorek, II. — New York: Raven Press, Ltd., 1994.
- Golde S., Ledger W.J. Necrotizing fascitis in postpartum patients // Obstet Gynecol. — 1977. — Vol.50. — P. 670-673.
- Hankins G.D., Houth J.C., Gilstrap L.C., Hammond T.L. et al. Early repair of episiotomy dehiscence ,// Obstet. Gynecol. — 1990. —Vol. 75. — P. 48-51.
- Hibbard L.T., Snyder E.N., McVann R.M. Subgluteal and retropsoal infection in obstetric practice // Obstet. Gynecol. — 1972. — Vol. 39. — P.137-150.
- Jewett J.F. Committee on maternal welfare: fatal perineal sepsis // N. Engl. J. Med. — 1972. — Vol.286. — P. 1213-1214.
- Lowthian J J., Gillard L.J. Postpartum necrotizing fascitis: a preventable disaster // Surg. — 1982. — Vol. 92. — P. 765-770.
- MonbergJ., Hammen S. Ruptured episiotomia resutured primarily // Ada Obstet. Gynecol. Scand. — 1987. — Vol. 66. — P. 163-164.
- Obstetric and Gynecologic infectious disease / Ed. Josef G. Pastorec II. — New York: Raven Press Ltd., 1994. — 798 p.
- Ogle K.S., Davis S. Mastitis in lactating women // J. Fam. Pract. — 1988. — Vol. 26 (2). — P. 139-144.
- ThomsenA.C, Espersen Т., Maigaard S. Course and treatment of milk stasis, nonifectious inflammation of the breast, and infectious mastitis in nursing women // Am. J. Obstet. Gynecol. — 1984, — Vol. 149 (5). — P. 492-495.
- Shy K.K., Eschenbach DA. Fatal perineal cellulitis from an episiotomy site // Obstet Gynecol. — 1979.—Vol. 54. — P. 292-298.
- Riddick D.H. The nonlactating human breast. In: Sciarna J. J., Simpson J.L., Speroff L. Gynecology and obstetrics. — Rev. ed. — Philadelphia: Lippincott.—1989. — Vol. 5. — P. 1-9.



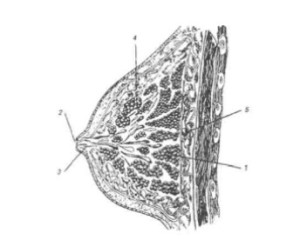

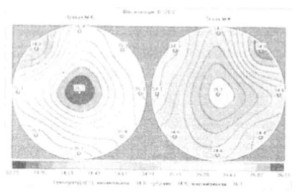






Комментировать