Физиология иммунного ответа в коже. Иммунопатология: связь нарушений в иммунной системе с дерматологическими заболеваниями. Ликопид.
И.Г. Козлов, Кафедра фармакологии и Отдел иммунологии, Российский государственный медицинский университет им. Н.И. Пирогова
Введение
Являясь одной из основных тканей, изолирующих организм от воздействия окружающей среды, кожа находится под постоянным многоэтапным контролем иммунной системы. Надзор иммунной системы за кожей направлен, с одной стороны, на создание дополнительного барьера, обеспечивающего эффективную элиминацию проникающих сквозь кожу чужеродных агентов (микроорганизмы, белки, аллергены, гаптены и др.), а с другой — на поддержание гомеостаза этой ткани посредством регуляции жизнедеятельности практически всех населяющих ее клеток.
На клеточном уровне контроль иммунной системы за кожей обеспечивается высокой концентрацией как в эпидермисе, так и в собственно дерме АПК (эпителиальные клетки Лангерганса, дермальные дендритные клетки и макрофаги), существованием популяции постоянно обновляющихся специфических интраэпителиальных Т лимфоцитов (клетки, несущие на мембране кожный лимфоцитарный Аг, CLA-позитивные лимфоциты), а также наличием в составе дермальных лимфатических фолликулов В лимфоцитов, плазматических клеток и естественных киллеров. Кроме того, далеко не последнюю роль в функционировании иммунной системы в коже играют и основные клеточные элементы этой ткани. Под действием ряда провоспалительных стимулов кератиноциты, фибробласты и эндотелиальные клетки способны экспрессировать молекулы главного комплекса гистосовместимости (ГКГС) класса II и участвовать в представлении Аг лимфоцитам. Эти же клетки являются источником растворимых регуляторных факторов (хемокинов и цитокинов), оказывающих существенное влияние на миграцию, размножение, созревание и функционирование макрофагов и дендритных клеток (ИЛ-1, ИФН), Т и В лимфоцитов (ИЛ-10, трансформирующий фактор роста-бета) и т.д.
Таким образом, имеющиеся в литературе данные указывают на тесную взаимосвязь иммунной системы и кожи, позволяющую ряду авторов рассматривать кожу в качестве «иммунокомпетентного органа».
Физиология иммунного ответа в коже.
Как и для большинства других органов и тканей типичный иммунный ответ в коже включает три этапа, начальный и конечный из которых проходят непосредственно в коже, а промежуточный — в регионарных лимфатических узлах (рисунок 1).
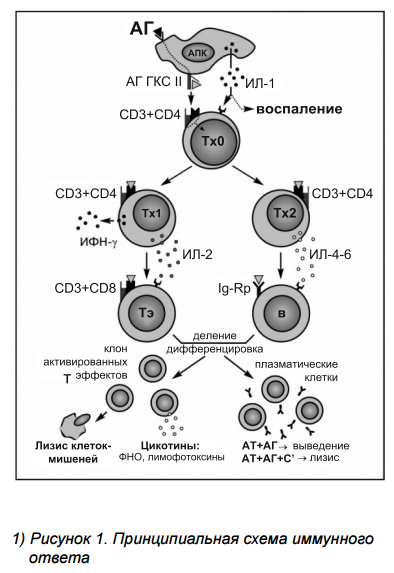
Этап I: Процессинг и презентация Аг
Как уже упоминалось выше, в норме кожа характеризуется высокой концентрацией клеток Лангерганса и других профессиональных АПК. Эти клетки постоянно «фильтруют» экстраклеточную жидкость, захватывают проникающие через эпителиальный барьер чужеродные Аг, внутри-клеточно расщепляют их до коротких пептидов (процессинг Аг) и представляют в комплексе с молекулами ГКГС класса II на своей поверхности (презентация Аг). Процессинг и презентация Аг сопровождаются активацией АПК, которая в свою очередь приводит к двум важнейшим событиям в развитии воспаления и иммунного ответа в коже.
Во-первых, АПК начинают активно секретировать целый ряд регуляторных факторов и, в частности, интерлейкин-1 (ИЛ-1). Этот цитокин играет центральную роль в патогенезе воспалительного ответа в коже. ИЛ-1 способен активировать хемотаксис нейтрофилов, индуцировать экспрессию молекул адгезии на эндотелиальных клетках, стимулировать продукцию белков острой фазы и оксида азота, вызывать активацию покоящихся лимфоцитов и т.д. Кроме того, на системном уровне ИЛ-1 является одним из основных эндогенных пирогенов.
Второе событие — активная миграция нагруженных Аг АПК из кожи в направлении лимфатических сосудов откуда они попадают в ближайший лимфатический узел.
Этап II: Формирование популяции Аг-специфических эффекторов
В паракортикальной зоне лимфатических узлов АПК вступают в прямой контакт с наивными Т лимфоцитами-хелперами (Тх0 клетки). Этот контакт обеспечивается большой группой рецепторов (молекулы адгезии), но главное значение для развития иммунного ответа со стороны АПК имеют молекулы ГКГС класса II, а со стороны Т лимфоцитов — Т-клеточный рецептор (CD3). Молекулы ГКГС класса II взаимодействуют с молекулами CD4 Т клеток, тогда как Т-клеточный рецептор связывается с процессированными пептидами Аг. В результате контактного взаимодействия происходит передача Аг от АПК Тх0 клеткам, которые активируются и дифференцируются или в Тх1, или в Тх2 клетки. Эти две популяции Т лимфоцитов отличаются по спектру секретируемых цитокинов и за счет этого способны направлять дальнейшее течение иммунного ответа по одному из двух возможных путей: клеточному (Тх1-зависимый) или гуморальному (Тх 2-зависимый).
Тх1 продуцируют два важнейших цитокина, регулирующих развитие клеточного иммунного ответа — ИЛ-2 и интерферон-γ (ИФН-γ). ИЛ-2, являясь аутокринным фактором, вызывает размножение Т лимфоцитов и дифференцировку их в клетки-эффекторы (Тэ). В качестве Тэ могут выступать два вида клеток: CD8+ Т лимфоциты и CD4+ клетки, известные как ТГЗТ.
Второй цитокин, секретируемый Тх1, — ИФН-γ можно считать не только регуляторным, но и эффекторным. Помимо поддержания популяции Тх1 и подавления активности Тх2, он обладает широким спектром эффектов, большинство из которых прямо направлено на элиминацию Аг.
Цитокины, секретируемые Тх2 (ИЛ-4, -5 -6), регулируют все этапы развития и функционирования В лимфоцитов и, таким образом, обеспечивают контроль за гуморальным иммунным ответом. Каждый из упомянутых интерлейкинов помимо стимуляции пролиферации и/или дифференцировки В клеток обладает определенной специфичностью действия. Под влиянием ИЛ-4 стимулируется в основном синтез Ig класса E, а также угнетается дифференцировка Тх0 в направлении Тх1 и ускоряется созревание тучных клеток. ИЛ-5 преимущественно стимулирует синтез Ig класса А и индуцирует пролиферацию и дифференцировку эозинофилов. Для ИЛ-6 характерно участие в воспалительной реакции.
Этап III: Эффекторная фаза иммунного ответа — элиминация Аг
Накопившиеся в лимфатических узлах клоны Тх1-зависимых Тэ (CD8-позитивные клетки и/ или ТГЗТ) проникают в капилляры и с током крови распределяются по вторичным органам иммунной системы (лимфатические узлы, селезенка, неинкапсулированные лимфатические фолликулы) и по нелимфоидным тканям, где эти клетки могут осуществлять лизис вирус-инфицированных и опухолевых клеток (обе эти популяции экспрессируют измененные молекулы ГКГС класса I), через активацию эозинофилов и макрофагов участвовать в реакциях гиперчувствительности замедленного типа и продуцировать, так называемые, эффекторные цитокины (ФНО, лимфотоксины).
Также как и в случае с Тэ, зрелые В лимфоциты (Тх2-ответ) расселяются по тканям и продуцируют Аг-специфические Ig, относящиеся к классам M, A, G, Е и D. Эффекторные реакции с участием этих молекул подразделяются на два вида и зависят от характера Аг. Растворимые Аг связываются с Ig в экстрацеллюлярной жидкости с образованием иммунных комплексов, которые поглощаются макрофагами и расщепляются внутриклеточно. Для удаления Аг, ассоциированных с мембраной клетки, необходимо подключение каскада активации комплемента, который заканчивается формированием мембрано-атакующего комплекса и лизисом мишени.
После элиминации Аг в течение нескольких недель более 90% Тх1 и Тх 2, также как и клетки-эффекторы погибают за счет апоптоза, а оставшиеся Т лимфоциты (клетки-памяти) являются длительно живущими и играют ключевую роль при повторном попадании Аг в организм.
В заключение следует отметить, что представленное описание иммунного ответа во многом является идеализированным. На практике в большинстве случаев имеет место смешанный иммунный ответ, протекающий с преимуществом того или иного пути. Среди причин, приводящих к наложению клеточного и гуморального ответа, можно выделить две основные.
Во-первых, попадающий в организм чужеродный материал (вирусы, бактерии, внутриклеточные патогены), как правило, характеризуется полиантигенностью, т.е. несет не одну, а несколько антигенных детерминант. Часть из них может индуцировать клеточный иммунный ответ (антигены клеточной стенки бактерий), тогда как другая — гуморальный (токсины и продукты жизнедеятельности).
Во-вторых, длительное (хроническое) поступление в организм антигенов (даже в форме моноантигена) и их персистенция могут приводить к переключению иммунного ответа с одного пути на другой. Например, в случае вирусной инфекции в стадии внутриклеточного развития вируса иммунный ответ будет протекать преимущественно по клеточному пути, а при высвобождении вируса и выходе его во внеклеточное пространство очень высока вероятность подключения гуморального пути.
Иммунопатология: связь нарушений в иммунной системе с дерматологическими заболеваниями.
Бурное развитие иммунологии в последние десятилетия позволило выявить ключевую роль иммунологических нарушений в патогенезе ряда заболеваний, ранее традиционно рассматриваемых как кожные (табл. 1 и 2). Необходимо отметить, что такие заболевания характеризуются хронизацией и тяжелым течением, часто резистентны к традиционной симптоматической терапии и имеют высокий риск развития осложнений вплоть до гибели пациента.
По направленности изменений все происходящие в иммунной системе нарушения можно разделить на три группы: гиперергические состояния (иммуноагрессия), гипоергические состояния (иммунодефициты) и дисбаланс (сочетание первого и второго типа).
- Иммунологическая агрессия
К гиперергическим состояниям, более известным среди специалистов как иммунологическая агрессия, относятся аллергические и аутоиммунные заболевания, а также псориаз и ряд иммуноактивных опухолей.
Аллергические заболевания, протекающие по механизму гиперчувствительности немедленного типа, характеризуются иммунным ответом, развивающимся по Тх2-пути, гиперпродукцией ИЛ-4 и преимущественной дифференцировкой В клеток в сторону IgE-продуцирующих клонов. В дерматологии наиболее яркими примерами такого рода патологий могут быть атопический дерматит и другие аллергодерматозы. К дерматологическим заболеваниям, имеющим в патогенезе аллергический компонент, также относится контактный дерматит, протекающий по механизму гиперчувствительности замедленного типа.
Аутоиммунные процессы с локализацией в коже характеризуются широким спектром как специфических для этой ткани, так и системных заболеваний с множественными поражениями органов. В основе патогенеза различных видов пузырчатки (обыкновенная, листовидная, лекарственноиндуцированная, паранеопластическая и т.д.) и аутоиммунных субэпидермальных заболеваний (пемфигоид, эпидермолитическая пузырчатая водянка, линейная болезнь и т.д.) лежит развитие иммунного ответа против десмосомальных белков, в норме обеспечивающих плотные кон такты между кератиноцитами или против компонентов базальной мембраны. В случае ревматоидных заболеваний с преимущественной локализацией иммуновоспалительного процесса в коже (острая и хроническая кожная красная волчанка, склеродермия, дерматомиозит и т. д.) также выявляется аутоиммунная агрессия, которая развивается или по гуморальному или по клеточному типу (см. табл. 1).
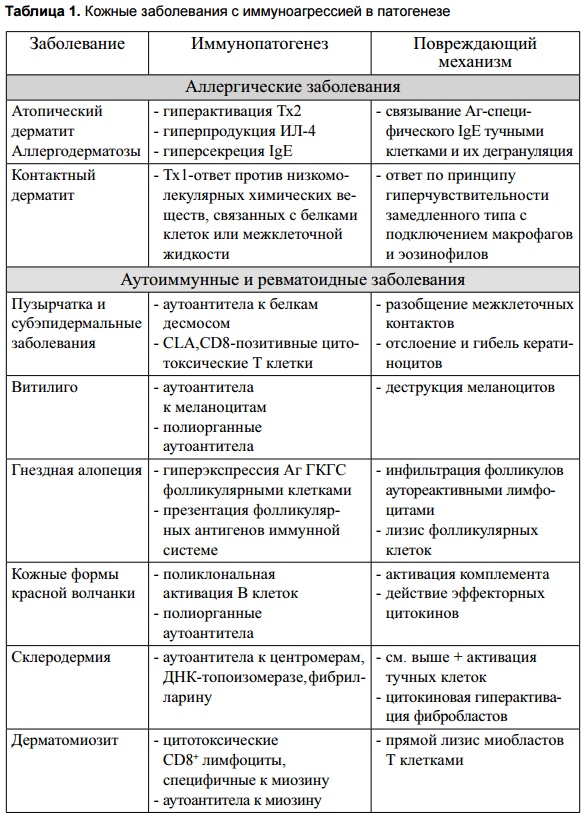
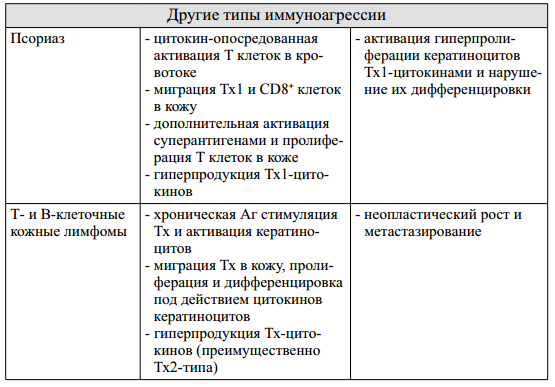
Патогенез псориаза и кожных лимфом в меньшей степени связан с иммунным ответом на какой-либо Аг и скорее может рассматриваться как нарушение регуляции функционирования иммунной системы в коже. В первом случае ключевым событием в патогенезе является гиперпродукция лимфоцитарных цитокинов (ИФН-гамма, ИЛ-2, ФНО-альфа), которые активируют пролиферацию кератиноцитов и нарушают нормальное течение их дифференцировки. Наоборот, в случае Т- и В-клеточных кожных лимфом, причиной гиперпролиферации лимфоцитов в коже являются цитокины, секретируемые активированными кератиноцитами (ИЛ-1, ИЛ-7, ИЛ-15 и др.).
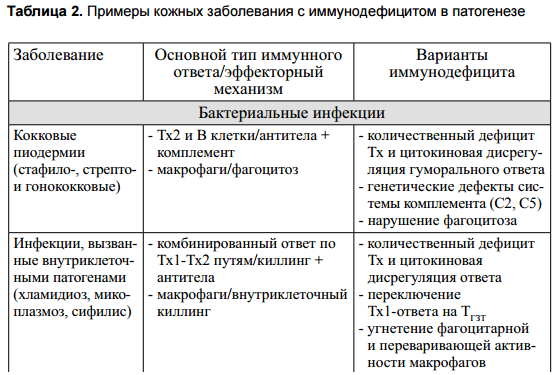
- Иммунодефициты
Иммунодефициты (гипоергические состояния) характеризуются дефектами в развитии иммунокомпетентных клеток (угнетение иммунопоэза, нарушение формирования АГ-специфических клонов) или их функционировании (низкая продукция регуляторных цитокинов, незавершенность эффекторных функций). По механизму возникновения иммунодефициты разделяют на первичные (генетически-детерминированные) и вторичные (приобретенные). Иммунодефицитные состояния имеют, как правило, системный характер и сопровождаются полиорганной симптоматикой. Иначе говоря, неспособность справится с антигенной нагрузкой и незавершенность иммунного ответа будут проявляться клинически одинаково во многих тканях.
Несмотря на то, что кожные заболевания, одним из элементов патогенеза которых является иммунодефицит, представлены меньшим по сравнению с иммуноагрессией количеством нозологических форм (табл. 2), по частоте встречаемости они, безусловно, занимают первое место. Клиническим проявлением иммунологической недостаточности наиболее часто является инфекционный синдром вирусной, бактериальной или грибковой природы. Инфекции, протекающие на фоне иммунодефицита, характеризуются затяжным течением (хронизация), упорным рецидивированием, резистентностью к стандартной химиотерапии и полипатогенностью (комбинированная вирусно-бактериальная, бактериально-грибковая и т.д.). Вторыми по частоте заболеваниями, возникающими при иммунодефиците, считаются опухоли.
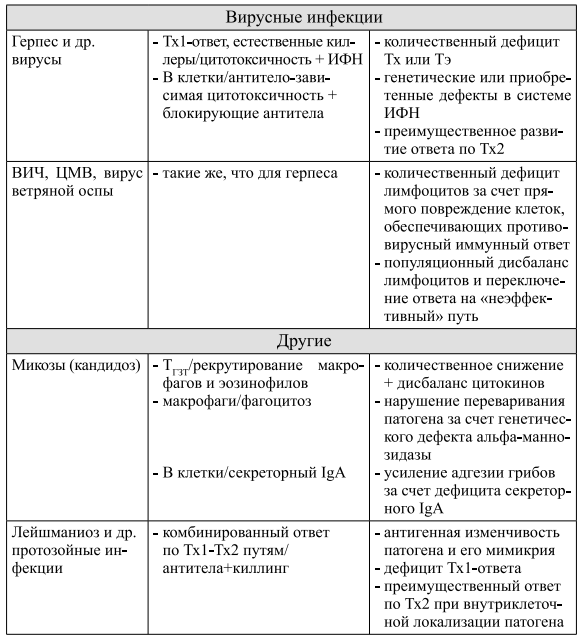
III. Комбинированная иммунопатология
Дисбаланс или комбинированная иммунопатология является наиболее частым нарушением в иммунной системе, выявляемым на практике. В основе возникновения дисбаланса, как правило, лежит описанный выше антагонизм Тх 1 и Тх2 клеток. Исходя из этого антагонизма, на фоне длительного протекания иммунного ответа по одному из двух Тх-путей (хроническое поступление чужеродного Аг в организм, ответ на аутоантигены) должна происходить гиперпродукция цитокинов, подавляющих развитие ответа по другому Тх-пути. Клинически подобная ситуация будет проявляться как сочетание иммуноагрессии с иммунодефицитом. Например, при пузырчатках в условиях интенсивно протекающего аутоиммунного гуморального ответа в коже (иммунологическая агрессия по Тх2-пути) очень высока вероятность подключения вирусной, грибковой, протозойной (Тх1-дефициты) или бактериальной (Тх2-дефицит на другой антиген) инфекций.
Приведенный выше краткий обзор демонстрирует, что все три типа иммунологических нарушений (иммуноагрессия, иммунодефицит и дисбаланс) играют значительную роль при возникновении ряда дерматологических заболеваний и, во многом, определяют характер их течения. Осознание этого факта привело к тому, что в последние два десятилетия стандартная терапия кожных заболеваний значительно пополнилась за счет большой группы иммунотропных препаратов.
Современный иммунотропный препарат

На правах рекламы
Ознакомьтесь с инструкцией
Список сокращений:
Аг — антиген
АПК — антиген-представляющие клетки
ГЗТ — гиперчувствительность замедленного типа
ГКГС — главный комплекс гистосовместимости
ИЛ — интерлейкин
ИФН — интерферон
Тх — Т хелпер
Тэ — Т эффектор
ФНО — фактор некроза опухолей
ЦМВ — цитомегаловирус
Ig — иммуноглобулины
ЛИТЕРАТУРА
- Лесков В.П., Чередеев А.Н., Горлина Н.К., Новоженов В.Г. Иммуностимуляторы. В кн.: Клиническая иммунология для врачей. — М., Фармарус Принт, 1997, с. 63-86.
- Королькова Т.Н., Смирнов В. С. Состояние иммунной системы у больных с кожными и венерическими заболеваниями. В кн.: Иммунодефицитные состояния. — СПб., Фолиант, 2000, с. 119-158.
- Справочник по иммунотерапии для практического врача. — СПб., Диалог, 2002, с. 1-478.
- Насонова В.А., Насонов Е.Л. Рациональная фармакотерапия ревматических заболеваний. -М., Литтера, 2003, с. 34-54, с. 312-313, с. 395-399, 474-476.
- Юшков В.В., Юшкова Т.А., Казьянин А.В. Иммунокорректоры. — Екатеринбург., 2002, с. 1-252.
- Burg G., Dummer R.G. Strategies for immunointerventions in dermatology. — Berlin-New York, Springer-Verlag, 1997, pp. 1-418.
- Waldmann T.A. Immnuotherapy: past, present and future. Nat. Med., 2003, vol. 9, No3, p. 269-277.







Комментировать