Обзор и обсуждение современных, научно-обоснованных представлений относительно использования рГР в клинической практике показаний к применению. Оценка ростового ответа на терапию и ее мониторинге, безопасности на ранних и отдаленных сроках лечения. Выбор наиболее оптимальной стратегии терапии на основании ее персонификации.
И.Л. Никитина, д.м.н., зав. НИЛ детской эндокринологии Института эндокринологии, профессор кафедры внутренних болезней ФГБУ «Федеральный Медицинский Исследовательский Центр им. В.А. Алмазова» МЗ РФ; член Европейского общества детских эндокринологов, член Европейской нейроэндокринной ассоциации
Рекомбинантный гормон роста (рГР) в настоящее время широко используется в терапии различных форм низкорослости. Многолетний опыт применения рГР в клинической практике свидетельствует о позитивных результатах и имеющихся проблемах. Пациенты с низкорослостью получили реальные возможности восстановления роста наряду с высокой вариабельностью результатов терапии. Наиболее важными предикторами ответа на ростстимулирующую терапию являются корректный диагноз, темпы роста на первом году лечения, возраст старта терапии, доза ГР, приверженность к лечению, персонализированные подходы к терапии с использованием предиктивных моделей. ИФР-1 может быть использован в качестве маркера приверженности к терапии и безопасности дозы рГР, однако его роль в мониторинге терапии низкорослости остается не окончательно ясной. Безопасность и эффективность высокодозной терапии рГР в периоде пубертата остается предметом продолжающейся дискуссии. Продолжается исследование новых фармако-геномных и фармако-протеомных маркеров предикции ответа на ростстимулирующую терапию с целью совершенствования существующих предикторных моделей. Вопросы, касающиеся безопасности длительного применения рГР, равно как и стратегии, направленные на снижение стоимости терапии низкорослости, остаются нерешенными до настоящего времени.
Хорошо известно, что оценка роста и веса является чрезвычайно важной частью педиатрического обследования, интегрально характеризующей уровень здоровья и самочувствия ребенка. При этом такие нарушения, как задержка роста и низкорослость, могут быть ранними, а иногда единственными индикаторами соматических, нейроэндокринных, нутритивных, генетических, психо-социальных и проч. расстройств, позволяя заподозрить и диагностировать патологию на преклинической стадии, до развития манифестного симптомокомплекса, что, в свою очередь, влечет своевременное планирование и оказание помощи пациенту. С данных позиций диагностика низкорослости, равно как и установление ее причины, представляется чрезвычайно значимой.
Согласно определению, низкорослость следует диагностировать при SDS (standard deviation score) роста <-2 (или ниже 2,5 перцентиля), однако могут быть некоторые различия для диаграмм роста различных национальных и этнических групп [1, 2]. Низкорослость может сопровождать широкий круг заболеваний, среди которых дефицит гормона роста (ГР) составляет примерно 10–12% [3].
К ним относятся генетические синдромы (синдром Тернера, Прадера-Вилли, Сильвера-Рассела, Нунан и др.), костные дисплазии, врожденные и приобретенные метаболические заболевания, задержка внутриутробного развития (ЗВУР), хронические соматические заболевания, варианты семейной и идиопатической низкорослости, эндокринные расстройства. (Рис. 1).

Согласно этиологической классификации Европейского общества детских эндокринологов (ESPE), выделены 3 основные группы низкорослости:
1) первичная низкорослость;
2) вторичная низкорослость;
3) идиопатическая низкорослость, когда этиологию установить не удается. [4]. (Табл. 1.).

Очевидно, что при большинстве вышеназванных заболеваний низкорослость является не только синдромом, отражающим метаболические, генетические, гормональные и проч. расстройства, но и самостоятельной патологией, значимо влияющей на психологическую, социальную, эмоциональную адаптацию человека в окружающем его обществе, а значит, определяющей в значительной степени качество его жизни. Ибо низкорослость, или карликовость, часто сопровождается формированием патологических личностных установок (инфантильности, замкнутости, неуверенности, неудовлетворенности), что в итоге может привести к тяжелым психо-эмоциональным стрессам и личностной депривации. Именно это определило многолетний поиск терапевтических возможностей, направленных на коррекцию низкорослости, а открытие и внедрение в клиническую практику препаратов ГР открыли широкие перспективы реального восстановления генетически детерминированного прогноза роста и, следовательно, возвращения физического и психического комфорта низкорослым пациентам.
История открытия ГР относится к началу прошлого века, когда в 1920-х г.г. была расшифрована биохимическая структура, 1944 г. учеными Лайем и Эвансом выделен кристаллический препарат ГР из гипофизов животных, а в 1956 г. получен человеческий соматотропин, который в 1958 г. впервые был использован в клинической практике эндокринологом М. Рабеном в клинике Бостона для лечения низкорослости у подростка.
Однако в течение последующих двух десятилетий применение ГР было ограничено в связи с недостаточным количеством препарата (для получения ГР требовалось большое количество трупных гипофизов), а в 1980-х человеческий соматотропин был и вовсе снят с производства и запрещен к использованию, что связано с увеличением количества случаев тяжелого нейродегенеративного заболевания – синдрома Крейцфельдта-Якоба, у лиц, получавших данный препарат [5]. Создание в 1985 году при помощи генно-инженерных технологий рекомбинантного ГР (рГР) положило начало новой эре практически неограниченных возможностей в терапии низкорослости. Препарат стал использоваться не только для лечения подтвержденного дефицита ГР, но и при других, эндокриннезависимых, задержках роста.
В настоящее время Европейским Медицинским Агентством (EMA) рГР одобрен для лечения низкорослости при дефиците ГР, синдроме Тернера, Прадера-Вилли, ЗВУР, SHOX-дефиците, хронической почечной недостаточности (ХПН); в США, дополнительно к вышеперечисленным, Агентством по контролю продуктов и медикаментов (FDA) одобрено также применение рГР для лечения низкорослости при идиопатических задержках роста и синдроме Нунан [6].
В России с начала 1990-х рГР также успешно используется в терапии различных форм низкорослости, и ведущими отечественными учеными отмечены позитивные результаты не только в отношении ростстимулирующих эффектов препарата, но и в направлении коррекции метаболических, кардиоваскулярных, психо-социальных расстройств, часто сопутствующих дефициту ГР [7, 8].
Анализируя почти 30-летний опыт широкого использования рГР в клинической практике, представляется важным обсуждение ряда связанных с этим вопросов.
С одной стороны, терапия данным препаратом открыла невероятные, ранее представлявшиеся фантастическими, возможности с точки зрения восстановления роста и качества жизни лицам с тяжелыми формами низкорослости. Однако, с другой стороны, в научной литературе последних лет увеличиваются фактические данные, свидетельствующие о высокой вариабельности ростового ответа на терапию практически при всех вариантах патологии, о недостаточной удовлетворенности результатами лечения, сохраняется беспокойство в отношении безопасности длительной терапии, равно как и стоимость терапии остается высокой, с отсутствием реальных стратегий, направленных на ее снижение [5, 6, 9].
Научные исследования, проведенные в течение последних десятилетий, среди которых особое место принадлежит National Cooperative Growth Study (NCGS, n=7000) [10] и Kabi International Growth Study (KIGS, n=8500) [11], предоставили большие базы данных как в отношении анализа факторов, влияющих на эффективность терапии рГР, так и для обоснования стратегий, направленных на ее повышение.
Таким образом, цель настоящей публикации состоит в обзоре и обсуждении современных, научно-обоснованных представлений относительно использования рГР в клинической практике – показаний к применению, оценке ростового ответа на терапию и ее мониторинге, безопасности на ранних и отдаленных сроках лечения, выборе наиболее оптимальной стратегии терапии на основании ее персонификации.
Действительно, почему, спустя десятилетия использования рГР, стал очевидным факт, что ростовой ответ на терапию чрезвычайно широко варьирует практически при всех вариантах низкорослости? Исключением могут быть, вероятно, лишь тяжелые формы дефицита ГР с пиком стимулированной секреции ГР, по разным данным, ниже 5 мкг/л – 3 мкг/л, при которых большинством исследователей был документирован хороший ответ на терапию, в то время, как менее тяжелый дефицит ГР практически не имеет отличий от ЗВУР и идиопатической низкорослости с точки зрения эффекта ростстимулирующей терапии [9, 11, 12, 13]. (Рис. 2).
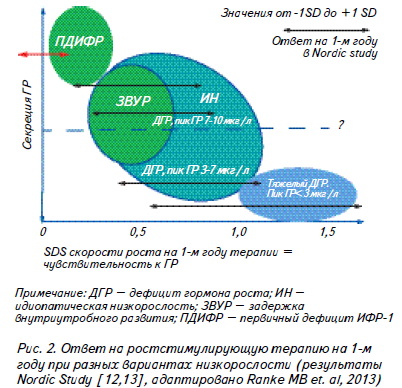
Неудовлетворительный эффект терапии ГР ведет к ухудшению конечного ростового прогноза и неудовлетворенности многолетним дорогостоящим лечением, в то время, как понимание причин низкого ответа способно повлиять на своевременную оптимизацию терапевтической тактики.
Факторы, влияющие на ростовой ответ при терапии рГР
Переходя к обсуждению факторов, способных оказывать влияние на эффект ростстимулирующей терапии, следует в первую очередь определить, что подразумевается под неудовлетворительным ответом. Согласно определению P. Bang et al, M.Ranke et al., неудовлетворительным ответом на терапию ГР следует считать низкие параметры роста на 1-м году лечения: возрастание SDS роста < 0,3–0,5; темпы роста <3 см/год у детей старше 5 лет; увеличение SDS скорости роста <+1 SD (относительно популяции, здоровых детей сопоставимых по возрасту и полу) [5, 6, 11]. Следует подчеркнуть, что последний пункт относится к пациентам с подтвержденным дефицитом ГР, у которых терапия рассматривается, как заместительная и, соответственно, возможно сравнение со здоровой популяцией. При других, не сопровождающихся дефицитом ГР, вариантах низкорослости, оценка SDS скорости роста должна сравниваться с таковой у пациентов с тем же диагнозом, что обосновывает необходимость создания эмпирических кривых роста для каждого ГР-независимого варианта низкорослости.
Большинство таких эмпирических кривых роста были созданы на основании баз данных NCGS и KIGS, куда входили пациенты с синдромом Тернера, ЗВУР, идиопатической низкорослостью, получавшие терапию рГР [5].
Корректный диагноз низкорослости является ключевым фактором в отношении прогнозирования ростового ответа на терапию. Диагностика нозологического варианта низкорослости должна базироваться на комплексе
данных, включая анализ семейной истории, клиническое, биохимическое обследование, по показаниям возможны лучевая диагностика, молекулярно-генетическое обследование. Что касается диагностики дефицита ГР, то в функциональной оценке оси ГР–ИФР «золотым стандартом» по-прежнему остается стимуляционный тест с различными фармакологическими стимуляторами эндогенной секреции ГР (чаще с инсулином и клонидином, но также могут быть использованы аргинин, орнитин, L-DOPA,вазопрессин и др.), при котором диагностическим считается пик ГР < 7–10 мкг/л [3, 6, 14].
Часть исследователей используют термин «тяжелый дефицит ГР» при пике ГР < 5 мкг/л и «легкий дефицит ГР», соответственно, при пике ГР > 5 мкг/л, однако данная терминология, подчеркивающая тяжесть дефицита ГР, не является общепринятой [15]. Однако в научной литературе последних лет имеются публикации, свидетельствующие о высокой частоте ложно-положительных результатов стимуляционных тестов у лиц с изолированным дефицитом ГР. Так, в исследовании Loche S. et al. было показано, что 85% пациентов с изолированным дефицитом ГР (пик ГР в 2-х тестах < 10 мкг/л и отсутствием патологии гипоталамо-гипофизарной области по данным МРТ) при ретестировании через 1–6 мес. имели пик ГР > 10 мкг/л. [16].
Подобные результаты у пациентов с изолированным дефицитом ГР, ЗВУР и идиопатической низкорослостью были описаны в исследовании Kristrom B. et al. [17]. В целом высокий уровень ложных субнормальных результатов, затрудняющих дифференциальную диагностику парциальных вариантов изолированного дефицита ГР с низкорослостью при ЗВУР, идиопатической низкорослостью, прогнозирует ограничение диагностической ценности стимуляционных тестов в будущем [6]. Базальный уровень ГР в ночные часы определяется в некоторых центрах, однако ценность его, учитывая импульсный характер секреции, для диагностики дефицита ГР невелика, а обычно учитывается для предикции ответа на терапию рГР. В комплексной диагностике низкорослости возможно определение инсулиноподобного фактора роста 1 (ИФР-1), белка, связывающего ИФР (ИФР-СБ3) и ГР (ГР-СБ), проведение магнитно-резонансной томографии при подтвержденном дефиците ГР для исключения органических причин, проведение молекулярно-генетического обследования.
Следует отметить, что ИФР-1 неспецифичен для дефицита ГР, может варьировать и снижаться при множестве соматических заболеваний, меняется в зависимости от возраста, стадии пубертата, функциональной способности печени; используется для диагностики периферических форм низкорослости (резистентность в ГР, пострецепторные дефекты). Генетическое обследование не является рутинным и может быть рекомендовано при семейной истории низкорослости, наличии синдромального фенотипа пациента. В отсутствии нарушений оси ГР-ИФР-1 генетическое обследование, в зависимости от характера синдромальных
проявлений, может заключаться в цитогенетическом обследовании (синдром Тернера, Блума), FISH (синдромы Прадера-Вилли, Вильямса, SHOX), хромосомном и молекулярном анализе для подтверждения X-сцепленной хондродисплазии, гипофосфатемического рахита, array-гибридизации (SOX3, неуточненные синдромы). При подтверждении дефекта ГР-ИФР-1 оси для уточнения генеза патологии возможно проведение сиквенса вероятностно аффектных генов (PROP1, POU1F1, LHX3, GHR, STAT5b, IGF1, PTPN11).
Однако до настоящего времени молекулярно-генетическое обследование проводится в основном в структуре научных исследований либо в целях генетического консультирования, при этом данные о влиянии того или иного варианта при подтверждении моногенного характера низкорослости на ростовой ответ отсутствуют.
Таким образом, установление нозологического варианта низкорослости вносит значимый вклад в предикцию ответа на терапию ГР. Подтвержденный дефицит ГР, особенно его тяжелые формы, определяют наилучший
ростовой ответ, в то время как при остальных, не связанных с секрецией ГР, вариантах низкорослости, равно как и при легком и парциальном дефиците ГР, ростовой ответ может быть чрезвычайно вариабельным, что обосновывает необходимость тщательного мониторинга терапии с оценкой других факторов риска и ранней персонализацией терапии при констатации неудовлетворительного эффекта с точки зрения линейного роста.
Следующим важным в предикции ростового ответа фактором является возраст старта терапии. Это объясняется физиологическими закономерностями роста ребенка – известно, что в более раннем возрасте темпы роста более высокие, затем постепенно снижаются до старта пубертата.
Например, средние значения скорости роста в возрасте 2,7 и 11 лет составляет соответственно 9, 6 и 5 см/год. Результаты нескольких исследований показали лучший ростовой ответ при старте терапии ГР в более раннем возрасте, что связано не только с физиологическими возраст зависимыми изменениями скорости роста, но также и с количеством лет до пубертата, в течение которых ребенок получает ГР – чем их больше, тем выше накопленный потенциал роста [18, 19, 20].
Период пубертата, с точки зрения процессов роста, имеет определенные особенности. С одной стороны, физиологически данный период характеризуется ростовым скачком, или спуртом, во время которого темпы роста значительно ускоряются. С другой стороны, рост в пубертате является результатом взаимодействия между ГР-ИФР-1 системой и половыми стероидами, количество которых кратно повышается и определяет, в итоге, завершение костной дифференцировки и прекращение линейного роста. В физиологических условиях конечный рост здорового ребенка в большой степени зависит от его роста к началу пубертата и возраста старта последнего. Так, дети с более ранним стартом пубертата могут иметь более низкий рост по сравнению с теми, у кого пубертат стартовал в более позднем возрасте. Что касается подростков с низкорослостью, то, в связи с предикцией более низкого ростового потенциала терапии рГР в пубертате, изучаются и предлагаются разные тактические решения, такие, как кратное повышение дозы ГР во время пубертата либо, напротив, создание при помощи пролонгированных аналогов гонадотропин-рилизинг гормона медикаментозной супрессии его старта. Однако следует подчеркнуть, что ни одно из данных решений не является общепринятым и нуждается в дальнейшем изучении с позиции эффективности и безопасности [21, 22, 23].
В последние годы предметом активного исследовательского интереса с точки зрения понимания неудовлетворительного ответа на ростстимулирующую терапию является оценка приверженности, или комплаентности, к ней пациента и его родителей. На первый взгляд, ситуация представляется парадоксальной, ибо трудно представить, как пациент и его родственники, с одной стороны, отчетливо понимающие перспективы необратимой карликовости на протяжении всей взрослой жизни, с другой – имеющие возможность предотвратить ее, способны небрежно относиться к заместительной гормональной терапии, пропускать ежедневные инъекции и манкировать врачебными рекомендациями. Однако, изучая причины вариабельности ростового ответа среди детей, получающих рГР, многие исследователи констатировали нарушения режима терапии, при этом пропуск инъекции составлял от 1 до более 4 инъекций в неделю.
Причины некомплаентности были связаны с болезненностью инъекций, длительностью многолетней ежедневной инвазивной терапии, снижением мотивации, отсутствием быстрой ощутимой динамики в состоянии, боязнью побочных эффектов и проч. [5, 6, 24]. Медицинский контроль ежедневного введения ГР представляется достаточно сложным, поэтому, встретившись с данной проблемой, были сформулированы разумные рекомендации. В качестве биохимического маркера, свидетельствующего о поддержании определенной концентрации уровня ГР, удобно и информативно использование повторных, с интервалом около 2 недель на этапе контрольного тестирования, определений уровня ИФР-1 в плазме крови. При поддержании примерно одинаковой концентрации ГР в плазме крови, что достигается ежедневным его введением, следует ожидать
незначительные различия уровней ИРФ-1 при повторных определениях. Высокая вариабельность последнего свидетельствует о нерегулярном введении ГР, требующем более пристального внимания к пациенту. Кроме того, очевидно, что только мотивация и повторное обучение, профессиональное информирование пациента и его родителей в отношении заболевания и его последствий, способны повысить приверженность к терапии.
Установлено, что ежегодного визита пациента в специализированные центры недостаточно. Оптимально более частое общение, не реже 2–4 раз в год, обсуждаются дистантные формы обучения и контроля с точки зрения повышения комплаентности к терапии [5, 6].
Таким образом, низкая приверженность к терапии может быть частой и серьезной причиной неудовлетворительного ростового ответа.
В многофакторном поиске причин вариабельности ростового ответа значимая роль принадлежит количественной оценке дозы ГР. Приступая к обсуждению данного раздела, следует акцентировать внимание на том, что доза ГР для лечения его подтвержденного дефицита относится к категории заместительной гормональной терапии, в то время, как дозы ГР в терапии других, не зависящих от дефицита ГР, форм низкорослости, были одобрены по результатам III фазы клинических исследований и, как правило, они превышают дозы, рекомендованные для заместительной терапии. В Табл. 2 представлены дозы рГР, одобренные для терапии низкорослости в разных странах. Так, для терапии подтвержденного дефицита ГР рекомендуемая доза составляет 0,025–0,033мг/кг/сут. в Европе и 0,023– 0,043 мг/кг/сут. в США; соответственно дозы рГР для лечения синдрома Тернера 0,045–0,05 мг/кг/сут. и 0,047–0,067 мг/кг/сут., для ЗВУР–0,035 мг/кг/сут. (Европа) и 0,067–0,069 мг/кг/сут. (США) [5].

В последние годы в США было одобрено повышение дозы ГР в пубертате до 0,1 мг/кг сут. Однако, несмотря на достаточно длительный опыт лечения рГР, сохраняется ряд вопросов, касающихся как технических сторон дозирования препарата, так и чрезвычайно важных аспектов, связанных с безопасностью, особенно в отношении отдаленных результатов применения высоких доз рГР, способов мониторинга терапии. Что касается первой части, то продолжается обсуждение преимуществ расчета дозы – на кг массы или площадь поверхности тела? Это особенно важно для пациентов с экстремально высокой массой или младенцев – в этих группах рекомендуется расчет проводить с учетом площади поверхности тела [5]. Обсуждая вопросы безопасности применения рГР, следует подчеркнуть, что, несмотря на тот факт, что безопасность применения ГР в детском возрасте в настоящее время хорошо документирована, продолжается дискуссия в отношении отдаленных последствий длительного лечения ГР (метаболические болезни, риск малигнизации), что особенно касается низкорослости, не связанной с дефицитом ГР.
Исследования, направленные на повышение ясности в данном вопросе, продолжаются, однако уже получены данные, на основании которых не рекомендуется повышение дозы рГР в терапии идиопатической низкорослости более 0,05 мг/кг/сут. Одобренное FDA повышение дозы рГР в пубертате до 0,1 мг/кг/сут. применяется в клинической практике только в 1/3 центров США, а большинство практикующих врачей Европы, США, Японии при старте терапии назначают дозы даже более низкие, чем одобрены для данного нозологического варианта низкорослости, с последующим их титрованием [5]. Более того, редкие побочные эффекты, возникающие на ранних сроках терапии (внутречерепная гипертензия, сколиоз, остеохондропатия головки бедренной кости), равно как и все возможные риски, связанные с применением рГР, рекомендуется обсудить с пациентом, который вместе с родителями должен быть хорошо информирован и обучен тактике в случае возникновения неблагоприятного события.
Важным, исследуемым и не окончательно ясным остается вопрос мониторинга безопасности терапии ГР. С клинических позиций, следует контролировать и избегать любых метаболических нарушений, включая избыточные прибавки в весе, нарушения углеводного и жирового метаболизма.
В качестве биохимического маркера контроля дозы ГР могут быть использованы зависящие от ГР параметры, например, ИФР-1, но каковы должны быть его критические значения (>+2; +2,5; +3 SDS относительно возрастной кривой?), сколь долго они должны поддерживаться, чтобы судить о критичности дозы ГР – все эти аспекты продолжают обсуждаться [25,26]. Также остается неясным вопрос, должны ли, с точки зрения безопасности, стартовые дозы рГР при лечении низкорослости соответствовать целевым значениям ИФР-1, и какова роль при этом ИФР-связывающих протеинов? [27]. Таким образом, взаимодействие между ростом
и параметрами внутри оси ГР-ИФР-1 остаются предметом активного исследовательского интереса. В исследовании, опубликованном Cohen P. и соавт. (2007), предложен новый новый подход к оценке вышеописанных взаимоотношений, а именно высказана гипотеза о том, что уровень ИФР-1 может быть более важным, чем доза ГР, в определении ростового ответа, из чего авторы заключили, что доза ГР должна титроваться до достижения максимальных для возраста и пола значений ИФР-1 [28]. Исследование базировалось на изучении ростового ответа в группе детей с дефицитом ГР, получавших рГР в разных дозах (0,025, 0,05 и 0,1 мг/кг/сут.).
В соответствии с результатами, дети с низким ответом и низкой чувствительностью, у которых ИФР-1 остается низким или не повышается адекватно на фоне терапии ГР, должны быть оценены, как нечувствительные к ГР, с последующей его отменой. Дети с недостаточным ответом на вводимую дозу рГР, но с нормальной чувствительностью к нему, нуждаются в повышении дозы рГР до тех пор, пока уровень ИФР-1 остается в референсном для пола и возраста диапазоне. Дети со значительно повышенным уровнем ИФР-1 (>+2,3 SDS), независимо от ростового ответа и чувствительности, требуют снижения дозы рГР (шаг снижения 20% предыдущей дозы) под контролем ИФР-1 каждые 4 нед. в течение 3 месяцев и поддержанием его уровня в целевом диапазоне [28].
Таким образом, ростовой ответ может значительно различаться в зависимости от дозы рГР, что необходимо учитывать, анализируя причины вариабельности ростового ответа. Понимание данного факта стало основанием проведения серии исследований, основанных на сравнении ростового ответа при различных дозах рГР, т.е. персонализации терапии. Дизайн большинства исследований базировался на титрации дозы рГР у пациентов, которые показали неудовлетворительный ростовой ответ на 1-м году терапии ГР.
Следует подчеркнуть, что ответ на ростстимулирующую терапию в течение 1-го года лечения является еще одним важным фактором, определяющим вариабельность результатов терапии ГР. Несмотря на предлагаемые некоторыми авторами рекомендации по оценке ростового ответа через 3, 6, 12 месяцев терапии, именно через год а иногда и несколько позже можно в полной мере судить о характере эффекта ГР [5, 6]. Возвращаясь к ранее упомянутым исследованиям, следует отметить, что в большинстве из них было установлено снижение вариабельности ростового ответа в группах с персонализированной дозой по сравнению с результатами
в группах с фиксированной дозой ГР. Например, результаты Swedish Prediction-Based GH Dosing Study (2000) показали снижение вариабельности ростового ответа в группе детей с дефицитом ГР и персонализированной дозой ГР (от 0,017 до 0,1 мг/кг/сут.) на 32%, а также снижение вариабельности первой фазы инсулиновой секреции по оценке гомеостатической модели по сравнению с группой контроля (фиксированная доза 0,043 мг/кг/сут.) [29].
Подводя итог части обзора, посвященной современным подходам к применению рГР в клинической практике, необходимо подчеркнуть следующее. Основная цель терапии ГР состоит в обеспечении быстрого достижения целевого роста относительно SDS для возраста и пола, адекватного роста в пубертате и обеспечении конечного роста, максимально приближенного к генетически детерминированному с учетом семейных и этнических особенностей. Многолетний опыт терапии рГР различных форм низкорослости показал высокую вариабельность результатов, что потребовало поиска причин данного феномена и возможностей прогнозирования и предикции неудовлетворительного ростового ответа. Среди факторов, влияющих на результат терапии ГР, важное значение принадлежит ростовому ответу на 1-м году терапии, возрасту старта терапии, нозологическому варианту низкорослости, дозе и режиму терапии ГР, а также приверженности пациента к продолжительному лечению. Остаются не полностью ясными вопросы, связанные с безопасностью длительного применения рГР, особенно в высоких дозах и при низкорослости, не связанной с недостаточной секрецией ГР. Также продолжаются исследования, направленные на оптимизацию мониторинга терапии, в том числе с позиции ее безопасности. Совокупность полученных данных обосновала необходимость разработки стратегий оптимизации терапии, основанной на предикции ростового ответа и персонализации терапевтической тактики.
Персонализация терапии ГР на основе применения предиктивных моделей
Накопление обширной базы фактических данных в отношении лечения ГР и ростового ответа при различных нозологических вариантах низкорослости позволило создать математические модели, с помощью которых на основе многофакторного регрессионного анализа персональных характеристик пациента (возраст, пол, диагноз, ростовой ответ на терапию в течение 1 года, индекс чувствительности, уровень ИФР-1, маркеры костного метаболизма и проч.) возможно осуществлять предикцию в отношении эффективности применения ГР и конечного ростового прогноза. На основании полученных данных терапевтическая тактика может изменяться в направлении титрации дозы (повышение или снижение) или полной отмены ГР при констатации резистентности к нему.
Использование предиктивных моделей помогает объяснить 50–80% вариабельности ответа на терапию. В настоящее время разработаны 3 предиктивные модели: KIGS System of Growth Prediction; Gothenburg Prediction Model; Cologne Model [9].
В предиктивных моделях предусмотрен анализ не только ответа на терапию, но и оценка чувствительности, коэффициент которой рассчитывается в процессе пошагового алгоритма. В целом предиктивные модели направлены на применение персонализированных терапевтических стратегий и в целом персонификацию терапию пациентов с низкорослостью. В перспективе обсуждается расширение маркеров предикции за счет использования протеомных и метаболомных маркеров. Так, опубликованы исследования, где в качестве биохимических предикторов изучались ИФР-СБ3, лептин, транстиретин, аполипопротеины и др.[30]. Проводится поиск предикторных маркеров среди полиморфизма ряда генов. Так, в исследовании NESTEGG Study проводится поиск микроаномалий (SNPs) в 10 генах, регулирующих ростовые эффекты [9]. В целом расширение возможностей предикции роста при лечении рГР позволит значительно индивидуализировать подходы к терапии.
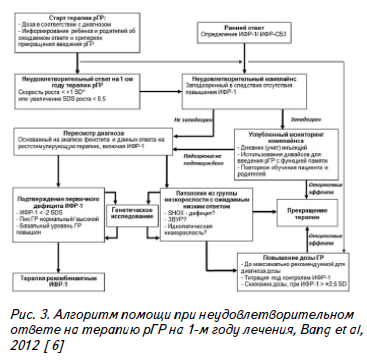
В заключении представлен алгоритм, предложенный Bang Р. и соавт. (2012) для оптимизации терапевтической тактики в отношении пациентов с низкорослостью и неудовлетворительным ответом на терапию рГР. Первый шаг – назначение стартовой терапии препаратом рГР в дозе, рекомендованной для диагноза низкорослости, а также информирование пациента и его родителей об ожидаемом ответе на терапию, возможных побочных эффектах и критериях, требующих прекращение терапии.
Следующий шаг – оценка ростового ответа через год терапии. При наличии критериев неудовлетворительного ответа – оценка комплаентности пациента клинически и по уровню ИФР-1 двукратно. При подтверждении неудовлетворительного комплайнса – работа с пациентом и родителями, мотивация на проведение корректной терапии. В случае сохранения неудовлетворительного комплайнса – прекращение терапии ГР. Если
у пациента с неудовлетворительным ответом на терапию не подтверждается плохой комплайнс, то следует пересмотреть критерии диагноза, включая оценку уровня ИФР-1 на фоне введения ГР. В случае подтверждения первичной резистентности к ИФР-1 показан старт терапии рекомбинантным ИФР-1. Если же данный диагноз не подтвержден, то следует провести поиск среди других вариантов низкорослости.
В случае диагностики одного из них предлагаются 2 пути.
Первый – отмена терапии ГР. Второй – повышение дозы ГР методом титрации с контролем уровня ИФР-1 каждые 4 нед.; при повышении его > 2,5 SDS требуется снижение дозы ГР с последующим повторным контролем уровня ИФР-1, который не должен превышать значения +2,5 SD для пола и возраста. (Рис. 3).
Выводы
- Многолетний опыт применения рГР в клинической практике свидетельствует о позитивных результатах и имеющихся проблемах. Пациенты с низкорослостью получили реальные возможности восстановления роста наряду с высокой вариабельностью результатов терапии.
- Наиболее важными предикторами ответа на ростстимулирующую терапию являются корректный диагноз, темпы роста на первом году лечения, возраст старта терапии, доза рГР, приверженность к лечению, персонализированные подходы к терапии с использованием предиктивных моделей.
- ИФР-1 может быть использован в качестве маркера приверженности к терапии и безопасности дозы рГР, однако его роль в мониторинге терапии низкорослости остается не окончательно ясной.
- Безопасность и эффективность высокодозной терапии рГР в периоде пубертата остается предметом продолжающейся дискуссии.
- Продолжается исследование новых фармако-геномных и фармако-протеомных маркеров предикции ответа на ростстимулирующую терапию с целью совершенствования существующих предикторных моделей.
- Вопросы, касающиеся безопасности длительного применения рГР, равно как и стратегии, направленные на снижение стоимости терапии низкорослости, остаются нерешенными до настоящего времени.
В заключение следует отметить, что история понимания места, роли, индивидуальных терапевтических возможностей рГР, несмотря на его широкое внедрение в клиническую практику, продолжается.




Комментировать