Гиперплазия эндометрия: общее описание. Классификации. Этиопатогенез. Факторы риска. Этиология, патогенез, клиническая картина, диагностика и лечение.
(клиническая лекция)
З.М. Дубоссарская, Ю.А. Дубоссарская
Днепропетровская государственная медицинская академия
Гиперплазия эндометрия (ГЭ) — это доброкачественная патология слизистой оболочки матки, которая характеризуется прогрессированием клинико-морфологических проявлений от простой и комплексной гиперплазии до атипичных предраковых состояний эндометрия и развивается на фоне абсолютной или относительной гиперэстрогении [3, 8, 14, 15]. Гиперпластические процессы эндометрия в структуре гинекологических заболеваний составляют 15-40%, но 75% всех случаев ГЭ приходится на перименопаузальный период. Именно в этом возрасте резко увеличивается число ановуляторных циклов, в результате чего в нейроэндокринной системе женщины формируется состояние «хронической» гиперэстрогении [3, 10, 12, 15].
В настоящее время диагноз «гиперплазия эндометрия» ставится только на основании гистологического исследования соскоба эндометрия с использованием диагностических критериев ВОЗ (2004), в основе которых лежит оценка состояния эпителиального и стромального компонентов эндометрия [8].
Согласно классификации ВОЗ (2004):
- Для простой неатипической гиперплазии эндометрия характерно увеличение количества как железистых, так и стромальных элементов, при незначительном преобладании первых.
- Основным признаком комплексной неатипической гиперплазии эндометрия является наличие тесного расположения желез распространенного или очагового характера. Железы плотно прилегают друг к другу, с потерей стромы между ними. Другой важный признак этого вида гиперплазии — повышенная структурная сложность желез с многочисленными латеральными и внутрижелезистыми выступами эпителия в просвет желез и строму. В железах обычно наблюдается более выраженная многорядность эпителия, чем в случае простой гиперплазии.
Мы делаемся иногда моложе— иногда старше.
А.С. Грин
- Простая атипическая железистая гиперплазия эндометрия отличается от простой и комплексной неатипической гиперплазий наличием атипии клеток желез, что проявляется потерей полярности расположения и необычной конфигурацией ядер, которые часто приобретают округлую форму. Ядра клеток при данном виде гиперплазии — полиморфные, и в них нередко выделяются большие ядрышки. Этот вариант атипической гиперплазии встречается достаточно редко.
- Комплексная атипическая гиперплазия эндометрия характеризуется выраженной пролиферацией эпителиального компонента, которая сочетается с тканевой и клеточной атипией без инвазии базальной мембраны железистых структур. Железы теряют обычную для нормального эндометрия регулярность расположения, они крайне разнообразны по форме и размерам. Эпителий, который выстилает железы, состоит из крупных клеток с полиморфными, округлыми или вытянутыми ядрами с нарушенной полярностью и многорядностью их расположения [8].
Для проведения патогистологического исследования эндометрия требуется квалифицированный врач-патоморфолог, специализирующийся в области гинекологической патологии, поскольку для решения вопроса о последующем ведении пациенток крайне важно разделение ГЭ на две подгруппы:
- Гиперплазия с низкой вероятностью малигнизации
- Интраэпителиальная неоплазия эндометрия, характеризующаяся уменьшением объема стромы и клеточной атипией, которую относят к предраковому состоянию.
Этиопатогенез
Гиперпластические процессы эндометрия, как известно, являются следствием нарушения гормонального баланса в результате нарушений в гипоталамо-гипофизарно-яичниковой системе, что приводит к нарушению фолликулои стероидогенеза в яичниках, или патологии гепатобилиарной системы [1, 3, 4, 5, 15]. При этом наблюдаются относительная или абсолютная гиперэстрогения и дефицит прогестерона, который не обеспечивает нормальную секреторную трансформацию гиперплазированного эндометрия, возникшего вследствие монотонного воздействия на него эстрогенов.
Гиперэстрогения может быть обусловлена:
- Избыточной периферической конверсией андрогенов в эстрогены при ожирении, особенно висцеральном, характеризующемся наибольшим ферментным потенциалом, обеспечивающим ароматизацию
- Наличием гормонпродуцирующих структур в яичнике (текоматоз, опухоли)
- Патологией печени с нарушением инактивационной и белковосинтетической функций (снижение глобулина, связывающего половые стероиды (ГСПС), приводящее к увеличению биологически активной, так называемой «свободной», фракции стероидных гормонов)
- Патологией надпочечников
- Гиперинсулинемией (при сахарном диабете), приводящей к гиперплазии и стимуляции стромы яичников.
Ожирение рассматривают как независимый фактор риска развития гиперплазии и рака эндометрия [5, 15]. В жировой ткани происходит ароматизация андростендиона в эстрон, увеличивающаяся с возрастом, а эстрон активно превращается в эстрадиол. С другой стороны, при ожирении снижается синтез в печени ГСПС и протеинов, связывающих инсулиноподобный фактор роста-1 (ИПФР-1). В результате этих изменений повышается биодоступность эстрадиола и ИПФР-1, что приводит к значительному усилению пролиферативных процессов в эндометрии и составляет основу его гиперплазии. Развитие и склонность к рецидивированию ГЭ в значительной мере определяются метаболическими нарушениями, часто обусловленными наличием ожирения, артериальной гипертензии, сахарного диабета 2 типа.
Гиперэстрогения в настоящее время рассматривается как основная, но не единственная причина возникновения пролиферативных процессов эндометрия. В основе развития ГЭ также лежат нарушения процессов пролиферации и апоптоза клеток, которые регулируются клеточными и внеклеточными компонентами на молекулярном уровне [3, 6, 15].
Причем влияние половых стероидов на развитие опухолевого процесса эндометрия реализуется в большей степени путем стимуляции клеточной пролиферации, чем посредством действия на процессы апоптоза. В этой связи факторы, способствующие повышению клеточной пролиферации в миометрии и эндометрии, следует рассматривать как факторы риска развития патологических процессов в матке [3, 6].
Пролиферацию клеток эндометрия могут вызывать:
- Дисгормональные нарушения. Прогестерон и эстрогены сочетанно стимулируют пролиферативный потенциал клеток путем индуцирования факторов роста (инсулиноподобного, трансформирующего и др.) и их рецепторов, а также регулируют процессы ангиогенеза.
- Травматические повреждения клеток, вследствие которых формируются инфильтраты, состоящие из макрофагов, лейкоцитов, лимфоцитов и др., индуцируют как факторы, стимулирующие рост стромы, так и протеолитические ферменты, разрушающие экстрацеллюлярный матрикс.
- Воспалительные вирусные заболевания, ингибирующие апоптоз, что позволяет вирусам закончить цикл репликации до гибели клетки и тем самым ускорить трансформацию поврежденных клеток.
- Другие факторы (механические повреждения ткани, метаболические нарушения).
В ответ на действие определенного патологического стимула первоначально происходят адаптационные изменения в эндометрии (гиперплазия клеток), а в связи с особенностями генотипа эти изменения приобретают патологический характер. С клинической точки зрения важно понимать, что гиперпластические процессы эндометрия могут трансформироваться из доброкачественных в злокачественные.
Факторы риска развития рака эндометрия (В) включают: бесплодие в анамнезе; ожирение; поликистоз яичников; сахарный диабет, преимущественно 2 типа; инсулинорезистентность; семейный вариант неоплазий молочной железы, яичников, толстого кишечника и тела матки (LynchSyndromeTypeІІ).
Активность пролиферативных изменений в эндометрии различна (И.С. Сидорова, 2006): существует покоящаяся, умеренно-активная и активная формы гиперплазии, которые отличаются характером, степенью выраженности и длительностью патологических изменений слизистой матки [13].
В последние годы все больше внимания уделяется состоянию специфических белков-рецепторов в органах-мишенях, чувствительных к определенным стероидам, посредством взаимодействия которых и обеспечивается реализация биологического эффекта стероидных гормонов в тканях-мишенях, в частности в эндометрии [1, 12]. Реализация гормонального эффекта в эндометрии зависит как от концентрации соответствующего стероида в крови, так и от содержания стероидов других классов, и начинается с образования комплекса гормона со специфическим рецептором. В течение нормального менструального цикла содержание в эндометрии рецепторов к половым стероидам претерпевает закономерные колебания, синхронные с изменением эстрадиола и прогестерона в крови. В течение менструального цикла происходят изменения как суммарного содержания рецепторов, так и количества рецепторов эстрадиола и прогестерона в цитоплазме и в ядрах эндометрия. Известно, что рецепторы к прогестерону развиваются опосредованно через развитие эстрогенных рецепторов. С другой стороны, избыточная терапия прогестинами может обусловить арецептивность эндометрия изза чрезмерного подавления синтеза рецепторов прогестерона.
Недостаточность рецепторного аппарата эндометрия может быть функционального характера (из-за дисбаланса половых гормонов) или органического — вследствие перенесенного воспалительного процесса в сочетании (или без) с травматическими повреждениями при выскабливаниях полости матки. Изменения состояния рецепторного аппарата эндометрия также могут наблюдаться при длительном использовании внутриматочного контрацептива и связанном с этим неспецифическим хроническим эндометритом, пороках развития матки и наличии доброкачественных опухолей (например, лейомиомы матки).
Частота выявления рецепторов эстрогенов и прогестерона, а также их концентрация варьируют в зависимости от вида патологии эндометрия и уменьшаются по мере прогрессирования пролиферативных процессов эндометрия [1, 12].
Таким образом, основными причинами развития гиперплазии эндометрия могут быть ановуляция и дефицит прогестерона; нарушение процессов пролиферации и подавление процессов апоптоза; нарушение рецепторного аппарата эндометрия.
Клиника
Гиперплазия эндометрия может клинически проявляться кровянистыми выделениями из половых путей (менометроррагией). Степень выраженности ГЭ определяет интенсивность и длительность кровянистых выделений из половых путей, т.к. анатомическим субстратом кровотечения являются очаги кровоизлияний и некроза в гиперплазированном эндометрии. Кроме того, на интенсивность кровотечения влияют как общие, так и местные факторы гемостаза. В 10-30% случаев ГЭ протекает бессимптомно, что служит предпосылкой для поздней диагностики предрака и рака эндометрия, поэтому женщинам группы риска развития рака эндометрия даже без клинических проявлений нужно рекомендовать скрининговое ультразвуковое обследование гениталий 2 раза в год [3, 8, 14, 15].
Диагностика
Основными задачами диагностики являются:
- Выявление гиперпластического процесса и клиническая интерпретация результатов гистологического исследования эндометрия
- Установление гормонозависимости гиперпластического процесса и оценка особенностей гормонального дисбаланса у данной конкретной женщины.
Одним из основных методов ранней диагностики гиперпластических процессов эндометрия является ультразвуковое исследование, диагностическая ценность которого особенно возрастает при бессимптомном течении патологии [4, 8, 14]. При диагностике ГЭ предпочтительно использование трансвагинальной эхографии, в ходе которой, кроме определения толщины эндометрия и эндометриально-маточного коэффициента (ЭМК) — отношение толщины эндометрия к величине переднезаднего размера матки — следует обязательно оценивать однородность структуры, особенности эхогенности и контуров М-эхо.
Ультразвуковыми показаниями для морфологического исследования эндометрия являются:
— В перименопаузе и репродуктивном периоде:
- увеличение толщины эндометрия более 16 мм или ультразвуковые признаки нарушения структуры эндометрия
- ЭМК>0,33
— В постменопаузе:
- увеличение толщины эндометрия более 5 мм
- ЭМК >0,15 [8].
Основным методом получения образцов эндометрия для гистологического исследования является фракционное диагностическое выскабливание цервикального канала и полости матки, возможности которого значительно увеличиваются при использовании гистероскопии. Фракционное диагностическое выскабливание под контролем гистероскопии при отсутствии противопоказаний в репродуктивном возрасте проводится за 7 дней до очередной менструации. Необходимо помнить о том, что у значительного числа женщин (до 50%) в климактерическом периоде с атипической гиперплазией эндометрия, выявленной при гистологическом исследовании соскоба эндометрия, впоследствии была обнаружена инвазивная карцинома эндометрия. Таким образом, диагностическая ценность гистологического метода исследования высока при выявлении карциномы эндометрия [3, 10, 14, 15].
Лечение
Врач-гинеколог при решении вопроса о лечении гиперплазии эндометрия нередко следует девизу, сформулированному Halban еще 50 лет назад: «Гиперплазия эндометрия — не рак, но матку лучше удалить».
Однако при выработке врачебной тактики при ГЭ необходимо учитывать следующие факторы:
- Причины, вызывающие развитие и поддержание патологических процессов в эндометрии, в каждом конкретном случае
- Возраст женщины
- Форму гиперплазии эндометрия
- Наличие сопутствующей генитальной (опухоли яичников, лейомиома матки, аденомиоз) и экстрагенитальной (заболевания печени, ожирение, сахарный диабет 2 типа и др.) патологии.
Этапы лечения пациенток с гиперплазией эндометрия (приказ Минздрава Украины № 676 от 31.12.2004) включают:
I этап — удаление измененного эндометрия с последующим морфологическим исследованием и определением дальнейшей тактики в зависимости от вида патологии эндометрия.
II этап — гормональная терапия, направленная на супрессию эндометрия.
Длительность данного этапа гормональной терапии — 6 месяцев с повторным гистологическим исследованием через 3 и 6 месяцев. При условии гистологического подтверждения гиперплазии эндометрия через 3 месяца на фоне гормонотерапии проводится коррекция лечения, а у женщин с атипическими формами гиперплазии — метод лечения согласовывается с онкогинекологом.
Гормонотерапия проводится в репродуктивном периоде, а в перии постменопаузе — только при неатипических формах гиперплазии эндометрия.
Группы препаратов, которые применяются для гормонотерапии гиперпластических процессов эндометрия включают:
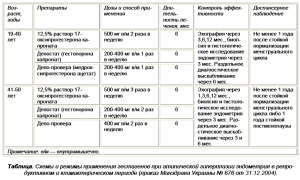
- Гестагены — дидрогестерон применяется только при неатипической гиперплазии эндометрия в репродуктивном возрасте с 5 по 25 день менструального цикла в дозе 20-30 мг в сутки; также при ГЭ используются медроксипрогестерона ацетат; гестонорона капронат; 12,5% 17-оксипрогестерона капронат.
Некоторые авторы рекомендуют при простой неатипической гиперплазии эндометрия у женщин репродуктивного возраста применять микронизированный прогестерон в дозе 300 мг в сутки с 5 по 25 день менструального цикла [3]. Преимуществом производных прогестерона является хорошая переносимость и отсутствие андрогенных эффектов — минимальное воздействие на метаболические процессы в организме, поэтому они предпочтительны у пациенток с дислипидемией и нарушениями углеводного обмена [3, 5]. Пролонгированный режим использования прогестагенов с 5 по 25 день менструального цикла способствует ингибированию пролиферации эндометрия. Длительность лечения составляет не менее 6 месяцев, хотя прием препаратов в зависимости от переносимости и эффективности терапии может осуществляться до момента планирования желанной беременности.
У женщин репродуктивного и климактерического периода при атипической гиперплазии эндометрия, а также при сочетанных формах патологии эндои миометрия, лучше использовать непрерывный режим терапии гестагенами (медроксипрогестерона ацетат; гестонорона капронат; 12,5% 17оксипрогестерона капронат), приводящий к блокаде гипоталамо гипофизарно-яичниковой системы, атрофии эндометрия и аменорее (табл.).
- Агонисты гонадотропин-рили-зинг-гормона (ГнРГ)
Показания к применению агонистов ГнРГ у женщин с гиперплазией эндометрия (В) следующие:
- Простая неатипическая ГЭ в перии постменопаузе
- Рецидивирующее течение простой неатипической ГЭ в репродуктивном возрасте после монотерапии гестагенами
- Неатипическая комплексная ГЭ в репродуктивном возрасте и перименопаузе
- Рецидивирующая комплексная неатипическая ГЭ в репродуктивном возрасте
- Простая и комплексная атипическая ГЭ в репродуктивном возрасте
- ГЭ в сочетании с лейомиомой матки или аденомиозом [8].
Механизм действия агонистов ГнРГ заключается в их специфическом связывании с рецепторами клеток гипофиза [2, 7, 11, 16]. ГнРГ синтезируется в гипоталамусе порциями 1 раз в 90 мин, поступает в гипофиз через воротную вену и специфически связывается с рецепторами клеток передней доли гипофиза. Из-за пульсирующего режима выделения ГнРГ гипоталамусом не все гонадотропные рецепторы гипофиза связываются одним импульсом. Обычно имеется избыток таких рецепторов на поверхности клеток гипофиза, а их постоянный ресинтез обеспечивает адекватную реакцию на каждый последующий выброс. Поскольку шнтетические аналоги ГнРГ во много раз активнее природных ГнРГ, то они связываются с рецепторами гипофиза очень прочно. Поэтому постепенно все существующие рецепторы оказываются связанными, а новые не успевают ресинтезироваться. Постепенно отмечается полное исчезновение рецепторов к ГнРГ, блокируется секреция гипофизом фоллитропина (ФСГ) и лютропина (ЛГ), и, соответственно, эстрогенов, прогестерона и тестостерона. Благодаря такому механизму действия в начале применения агонистов ГнРГ отмечается усиление секреции ФСГ и ЛГ, а в дальнейшем, на 7-14 день от начала применения, возникает блокада секреции ФСГ и ЛГ и, соответственно, синтеза всех половых гормонов в яичниках. Уровень эстрогенов в крови становится менее 100 пмоль/л, что соответствует их содержанию в менопаузе. Необходимо отметить, что такая «псевдо-менопауза» не идентична естественной менопаузе. Естественная менопауза характеризуется низким уровнем эстрогенов и высоким уровнем ФСГ и ЛГ, а при лекарственной менопаузе агонистами ГнРГ снижается уровень ФСГ, ЛГ и эстрогенов [3, 15]. Многочисленными исследованиями было показано, что гипофизарная блокада агонистами ГнРГ обратима, и в течение одногодвух месяцев после отмены препарата у женщины восстанавливается функция яичников и ее фертильность [2, 7, 11, 16].
Применение агонистов ГнРГ позволяет значительно снизить риск рецидива ГЭ и ее перехода в рак за счет снижения уровня эстрогенов до менопаузальных значений и связанной с этим атрофией эндометрия. Кроме того, за счет надежной блокады секреции всех половых гормонов достигается состояние «псевдоменопаузы», быстро устраняется состояние меноррагии, без применения железосодержащих препаратов устраняется анемия.
Использование агонистов ГнРГ дает возможность минимизировать побочные эффекты, особенно для пациенток в возрасте старше 40 лет, с сахарным диабетом 2 типа, заболеваниями печени, артериальной гипертензией [2, 11]. Однако при назначении агонистов ГнРГ более 6 месяцев развиваются симптомы эстрогенного дефицита (приливы, диспареуния, деминерализация костной ткани и др.).
Согласно приказу Минздрава Украины № 676 от 31.12.2004 применение агонистов ГнРГ в сочетании с гестагенами целесообразно в течение 3 месяцев, а в случае необходимости (при условии отсутствия атрофии эндометрия при контрольном гистологическом исследовании эндометрия после 3-х месяцев терапии) — до 6 месяцев. В случае подтвержденной атрофии эндометрия через 3 месяца в последующем проводится монотерапия гестагенами еще 3 месяца. Агонисты ГнРГ в этих случаях используются с целью повышения эффективности консервативной терапии и профилактики метаболических и психопатологических нарушений в результате длительного применения высоких доз пролонгированных гестагенов — гестонорона капроната, медроксипрогестерона (депо-провера), 17оксипрогестерона капроната.
В случае комплексного применения гестагенов с агонистами ГнРГ возможно применение непролонгированных форм гестагенов.
Ш этап — оптимизация гормонального статуса с целью предупреждения развития гиперэстрогенемии.
В репродуктивном возрасте при ГЭ гормональная терапия должна быть направлена на формирование нормального ритма менструаций, устранение прогестерондефицитного состояния, уменьшение кровопотери путем подавления роста эндометрия и, главное, служить профилактикой рецидивов ГЭ. Гормональная терапия включает:
- Возобновление двухфазного менструального цикла при условии необходимости сохранения репродуктивной функции (стимуляция овуляции)
- Использование гормональных контрацептивов с гестагеном диеногестом, имеющим выраженный антипролиферативный эффект на эндометрий (монофазные эстроген-гестагенные препараты С)
- Локальное использование гестагенов (внутриматочная система с левоноргестрелом В).
Принимая во внимание необходимость длительных курсов (до 6 мес.) с использованием высоких доз прогестагенов на II этапе лечения, а также целесообразность гестагенного воздействия в корригирующем режиме на III этапе, выбирая препараты для гормональной терапии, необходимо руководствоваться следующими требованиями:
- Целенаправленно воздействовать на характер пролиферативных процессов в эндометрии
- Не нарушать фолликулои гаметогенез у женщин репродуктивного возраста
- Не оказывать отрицательного влияния на другие гормонозависимые органы
- Гармонизировать вегетативную и центральную нервную деятельность
- Не способствовать обострению хронических соматических заболеваний.
У женщин репродуктивного возраста на третьем этапе лечения ГЭ широко используют комбинированные оральные контрацептивы (КОК), при этом предпочитают монофазные препараты [3, 15]. Отмечено, что женщины на фоне использования КОК реже страдают меноррагиями (кровопотеря снижается примерно на 50%) и анемией. У 60-90% женщин наблюдается не только снижение интенсивности менструальной кровопотери, но и купирование болевого синдрома. Механизм лечебного действия КОК обусловлен блокадой синтеза ГнРГ и, как следствие, подавлением циклической секреции ФСГ и ЛГ, а также развитием ановуляции. Использование этих препаратов вызывает регресс пролиферативных процессов в фолликулиновой фазе менструального цикла и неполноценную секреторную трансформацию — в лютеиновой. При длительном приеме КОК происходит инволюция железистого эпителия эндометрия, а нередко и его атрофия, строма подвергается децидуальной трансформации (состояние «псевдобеременности»), степень выраженности которой зависит от типа и дозы гестагенного компонента. Существуют данные, что менструальная кровопотеря ниже при использовании препаратов с более высокой дозой прогестагена. В связи с этим предпочтение следует отдавать препарату, в составе которого доза прогестагена диеногеста 2 мг превышает в два раза дозу, необходимую для контрацепции. Кроме того, полагают, что механизм действия диеногеста, который относят к разряду так называемых «гибридных» прогестагенов, может быть не просто прогестагенным, но и специфическим антипролиферативным, что с успехом применяется также при лечении эндометриоза. Результаты изучения характеристики кровянистых выделений показали, что интенсивность маточных кровотечений снижалась при применении КОК с диеногестом в 75% случаев, а у части женщин наблюдалось даже отсутствие менструальноподобной реакции. Исходя из основных целей, которые стоят перед гинекологами при лечении ГЭ наиболее целесообразным является непрерывный прием препарата на протяжении 6-9 месяцев или пролонгированный — в течение 3-4 месяцев с последующим 7-дневным перерывом. Подобный подход к лечению оправдан тем, что у многих женщин в течение 7-дневного перерыва в приеме КОК начинается созревание фолликулов. Сокращение или пропуск интервалов в приеме КОК приводит к более управляемому подавлению функции яичников и, следовательно, обеспечивает стабильную блокаду овуляции [4, 8, 15].
В последние годы появились сообщения об успешном применении локальной терапии прогестагенами для лечения ГЭ путем использования внутриматочной системы с левоноргестрелом (ВМС-ЛНГ). К морфологическим изменениям, которые происходят при воздействии ВМС-ЛНГ, относятся атрофия железистого компонента и децидуоподобная реакция стромы функционального слоя эндометрия. Базальный слой эндометрия не претерпевает подобной трансформации, так как он не является гормональнозависимым. Обнаруживаемые в редких случаях лимфоциты, нейтрофилы и гистиоциты являются нормальными компонентами эндометрия, такие признаки как инфильтрация воспалительными клетками и обызвествление стромы также могут быть проявлениями локального ответа на ВМС-ЛНГ и не требуют дополнительного лечения [3, 9, 15].
Для молодых женщин, не реализовавших репродуктивную функцию, крайне важен факт сохранения фертильности, которая сразу же восстанавливается после удаления ВМС-ЛНГ. Необходимо предупредить пациентку, что в первые несколько месяцев после введения ВМС-ЛНГ могут отмечаться межменструальные кровянистые выделения, что может более остро восприниматься женщинами, страдающими меноррагией, однако они носят преходящий характер [9].
Повышение уровня гемоглобина при применении ВМС-ЛНГ связано с уменьшением объема менструальной кровопотери. Терапевтический эффект ВМС-ЛНГ обусловлен снижением уровня простагландинов и факторов фибринолитической активности в эндометрии, а также уменьшением степени васкуляризации эндометрия и торможением в нем пролиферативных процессов.
Продолжительность использования ВМС-ЛНГ составляет 5 лет. Помимо лечебного эффекта ВМСЛНГ обеспечивает 100% контрацептивный эффект [9].
В перименопаузе при ГЭ гормональная терапия включает меностаз с применением агонистов ГнРГ (3 месяца) на фоне приема гестагенов в течение 6 месяцев.
При наличии умеренно выраженных или тяжелых климактерических расстройств у женщин в перименопаузе с неатипической ГЭ после основного курса лечения, а также у пациенток с гиперпластическими процессами эндометрия в анамнезе, возможно проведение заместительной гормональной терапии. Препаратами выбора являются таблетки, в состав которых входит наиболее мощный прогестаген левоноргестрел в дозе 0,15 мг или дидрогестерон в дозе 10 мг.
IV этап — диспансерное наблюдение в течение 5 лет после эффективной гормональной терапии и 6 месяцев после оперативного лечения (УЗИ органов малого таза 2 раза в год, приказ Минздрава Украины № 503 от 28.12.2002).
Параллельно с гормонотерапией по клиническим показаниям проводится коррекция обменноэндокринных нарушений, нормализация состояния центральной и вегетативной нервных систем, коррекция иммунного статуса.
Коррекция функции печени, в которой происходит метаболизм половых стероидных гормонов, является обязательным условием гиперэстрогенных состояний.
Использование гормональных препаратов одновременно с курсовым лечением растительным гепатопротектором хофитолом, обладающим холеретическим, диуретическим и антиоксидантным действием, позволяет существенно снизить риск сопутствующих осложнений со стороны гепатобилиарной системы [3].
Учитывая наличие хронической анемии и дефицита железа, пациенткам с гиперплазией эндометрия с лечебно-профилактической целью, а также для восстановления и обеспечения запасов железа в организме применяют преимущественно пероральные препараты двухвалентного сульфата железа.
При неэффективности консервативной терапии ГЭ показано хирургическое лечение. В случае неатипических форм ГЭ, особенно у женщин репродуктивного возраста, целесообразно использование гистероскопической резекции или абляции эндометрия (В), а при атипических — преимущество отдается гистерэктомии. Однако в репродуктивном возрасте и в любом возрасте при условии наличия соматической патологии возможно применение абляции эндометрия и при атипических формах ГЭ (С). В последнее десятилетие постоянно совершенствуется техника резекции и удаления эндометрия, результатом которой является наступление аменореи. Существует три основных метода удаления эндометрия: лазерная абляция, диатермическая loop-резекция или диатермическая rollerballабляция. По сравнению с гистерэктомией эти методы терапии обладают рядом преимуществ: реже наблюдаются послеоперационные осложнения, короче срок реабилитации и ниже стоимость лечения. Однако после проведения деструкции эндометрия с помощью этих методов требуется динамическое наблюдения за пациенткой с проведением трансвагинального ультразвукового контроля за состоянием эндометрия, потому что всегда остается вероятность неполного удаления эндометрия [3, 15].
Показания к оперативному лечению больных с гиперпластическими процессами эндометрия (В) следующие:
- В репродуктивном возрасте:
- Комплексная атипическая ГЭ при условии отсутствия эффекта от консервативной терапии через 3 месяца
- Простая атипическая и комплексная неатипическая гиперплазия при условии неэффективности терапии через 6 месяцев.
- В климактерическом периоде:
- Комплексная атипическая гиперплазия — при установлении диагноза
- Простая атипическая и комплексная неатипическая гиперплазия — при условии отсутствия эффекта от консервативной терапии через 3 месяца [8].
- Нецелесообразно расширять показания к гистеректомии при ГЭ без предварительной консервативной терапии, особенно у пациенток в возрасте до 49 лет. В то же время важно подчеркнуть необходимость расширения показаний к оперативному лечению при риске возможной малигнизации индивидуально у каждой конкретной пациентки с учетом факторов риска развития рака эндометрия [8, 10, 15].
Прогноз при гиперпластических процессах коррелирует не только с видом патологии эндометрия, но и с пролиферативным потенциалом ткани эндометрия.
Высокий риск рецидива, прогрессирования и малигнизации характерен для морфологических форм предрака эндометрия — атипической его гиперплазии и полипов, при которых, по данным исследования хроматина интерфазных ядер (морфоденситометрия), отмечается высокая пролиферативная активность клеток.
Риск развития рака эндометрия в зависимости от гистологической картины эндометрия составляет: при простой неатипической ГЭ — 1-3%; при комплексной неатипической ГЭ — 3-10%; при простой атипической ГЭ — 10-20%; при комплексной атипической ГЭ — 22-57% [3, 10, 15].
В связи с вышеизложенным, можно сформулировать следующие ключевые выводы для практического врача:
- Целью лечения ГЭ является контроль симптомов, таких как кровотечения, а главное — профилактика рецидивов, своевременное выявление сопутствующего инвазивного рака эндометрия или предотвращение его развития в будущем
- Клеточная атипия — единственный значимый признак возможного наличия инвазивного рака тела матки в сочетании с ГЭ, а также весьма вероятной персистенции, рецидивирования и прогрессирования процесса в сторону карциномы эндометрия в случае использования консервативной терапии
- При неэффективности гормональной терапии ГЭ показано хирургическое лечение.
Литература
- Адамян Л.В., Алексеева М.Л., Минина Л.С. Гормональный статус и стероидрецепторная системы эндометрия у пациенток с доброкачественными опухолями и эндометриоидными кистами яичников // Акушерство и гинекология. 1990. № 9. О 55-57.
- Бугрова Т.И., Черевишник И.В. Использование бусерелина в лечении гиперпластических процессов репродуктивной системы женщины // Журнал Российского общества акушеровгинекологов. 2004. № 1. С. 15-16.
- Дубоссарская З.М., Дубоссарская Ю.А. Репродуктивная эндокринология (перинатальные, акушерские и гинекологические аспекты). Днепропетровск: Лира ЛТД, 2008. 416 с.
- Задорожная Т.Д., Бурлака Е.В., Сольский Я.П. и др. Принципы диагностики и лечения гиперпластических процессов эндометрия у женщин репродуктивного возраста // Репродуктивное здоровье женщины. 2005. № 2 (22). С. 125-128.
- Кузнецова И.В., Якутова М.В. Комплексный подход к терапии женщин с гиперпластическими процессами эндометрия и ожирением // Акушерство и гинекология. 2007. № 6 . С. 15-18.
- Кулагина Н.В., Семенова Е.А., Попова С.С. Комплексное лечение гиперпластических процессов в эндометрии у женщин с миомой матки // Российский вестник акушера-гинеколога. 2006. Т. 6, № 1. С. 41.
- Кулаков В.И., Сметник В.П. и др. Применение бусерелина агониста гонадотропин-рилизинггормона в гинекологии. Пособие для врачей. М., 2004. 46 с.
- Наказ МОЗ України № 676 від 31.12.2004 «Про затвердження клінічних протоколів з акушерської та гінекологічної допомоги».
- Применение левоноргестрелсодержащей внутриматочной системы «Мирена» в лечении гиперпластических процессов эндометрия у женщин в перименопаузальном периоде / Пестрикова Т.Ю., Даниленко И.А., Ковалева Т.Д. и др. //Consilium medicum. 2007. Т. 9, № 6. С. 31-34.
- Профилактика возможного развития предрака эндометрия у женщин в перименопаузе / Манухин И.Б., Тихомиров А.Л., Шаркова С.М., Шаповалова М.В. // Фарматека. 2007. № 1 (136). С. 55-59.
- Резниченко Г.И., Резниченко Н.Ю., Белай И.М. и др. Применение бусерелина при пролиферативных процессах эндометрия безопасный путь сохранения репродуктивного здоровья // Здоровье женщины. 2006. № 4 (28). С. 158161.
- Рецепция половых стероидов при гиперпластических процессах в эндометрии у женщин позднего репродуктивного возраста / Краснопольский В.И., Гаспарян Н.Д., Карева Е.Н. и др. // Российский вестник акушера-гинеколога. 2005. № 2. С. 5-7.
- Сидорова И.С., Шешукова Н.А., Закаблукова С.В. Патология эндометрия при наличии миомы матки // Гинекология. 2006. Т. 8, № 4. С. 3135.
- Татарчук Т.Ф., Бурлака Е.В. Современные принципы диагностики и лечения гиперпластических процессов эндометрия // Здоровье женщины. 2003. № 4. С. 107-113.
- Татарчук Т.Ф., Сольский Я.П. Эндокринная гинекология (клинические очерки). Ч. 1. К.: Изд-во «Заповіт», 2003. 303 с.
- Эффективность применения бусерелина в лечении доброкачественных и гиперпластических процессов женской репродуктивной системы / Пирогова В.И., Гроховская М.В., Кишакевич И.Т. и др. // Здоровье женщины. 2006. № 1. С. 134-136.








Комментировать