Профессор М.Е. Стаценко, профессор С.В. Туркина, к.м.н. Н.Н. Шилина, А.А. Винникова., А.М. Бондарев, ГБОУ ВПО «Волгоградский государственный медицинский университет» Минздрава России
Хроническая сердечная недостаточность (ХСН), по данным мировых эпидемиологических исследований, является одним из самых тяжелых и прогностически неблагоприятных осложнений всех заболеваний сердечно-сосудистой системы и представляется значимой медико-социальной и экономической проблемой современного общества во всех странах мира [1]. Значительно ухудшает прогноз жизни для больных с ХСН наличие инфаркта миокарда (ИМ) или сахарного диабета (СД), число лиц с этими заболеваниями неуклонно растет во всех странах. Развитие и прогрессирование как ХСН, так и СД 2-го типа ассоциировано с поражением органов-мишеней, таких как сердце, почки, печень, магистральные артерии. Поражение печени при ХСН у пациентов с СД 2-го типа развивается в достаточно большом числе случаев, а показатели ремоделирования сердца и структурно-функциональные изменения печени при этом тесно взаимосвязаны и взаимообусловлены, тяжелое поражение печени ассоциируется с плохим прогнозом при ХСН [2].
Говоря о гепатокардиальных взаимоотношениях, следует отметить, что сочетание ХСН и СД 2-го типа приводит к более раннему и тяжелому повреждению печени у этой категории пациентов. При этом можно говорить о 3 аспектах этих взаимосвязей: во-первых, о повреждении печени на фоне имеющей место ХСН, во-вторых, о кардиальных осложнениях при заболеваниях печени per se, в-третьих, о взаимоотягощающем поражении сердца и печени при сочетанной патологии.
Повреждение печени при ХСН носит двоякий характер. С одной стороны, оно обусловлено нарушениями портальной гемодинамики, снижением линейной скорости кровотока по портальным венам, значительным расширением нижней полой и печеночных вен, увеличением застоя в воротной вене, повышением механического давления в печеночных синусоидах и желчных канальцах (при этом повышается уровень сывороточного билирубина в сыворотке крови даже при самых умеренных уровнях сердечной недостаточности) («застойная гепатопатия»). С другой стороны, формируется ишемическое повреждение печени, опосредованное снижением сердечного выброса, обеднением перфузии органа («ишемическая гепатопатия») [3, 4]. Ишемическое повреждение печени ассоциировано с формированием острых «печеночных некрозов» (манифестирующихся повышением уровня ферментов цитолиза — аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (ACT)), активацией купферовских клеток, продуцирующих выработку провоспалительных цитокинов, активных форм кислорода, оказывающих прямое цитотоксическое действие на гепатоциты [5].
Интересным является тот факт, что изменения биохимических маркеров повреждения печени ассоциируются с тяжестью течения и смертностью от ХСН. По данным исследования CHARM (2009), повышенный уровень билирубина был наиболее важным предиктором госпитализаций по поводу декомпенсации ХСН и кардиоваскулярной смертности [6]. Аналогичным предиктором независимо от возраста, индекса массы тела (ИМТ), функционального класса (ФК) ХСН и уровня натрийуретического пептида (N-terminal pro-B-type natriuretic peptide) служит уровень сывороточной γ-глутамилтранспептидазы (ГГТП) [7].
Кроме того, «застойная» и «ишемическая» гепатопатия сопровождаются нарушением метаболизма лекарственных препаратов в гепатоците [8], что привело FDA к созданию рекомендаций по использованию лекарственных препаратов у пациентов с ХСН и нарушенными функциями печени [9].
В основе формирования поражения печени при СД 2-го типа — неалкогольной жировой болезни печени (НАЖБП) (стеатоз, стеатогепатит, фиброз) лежат иные патогенетические механизмы и прежде всего метаболические расстройства. Присутствие НАЖБП ассоциировано с высоким риском прогрессирования и смерти от всех сердечно-сосудистых причин, а также значимо ухудшает течение и прогноз ХСН [10, 11]. Уже на стадии стеатоза отмечается высокий риск формирования диастолической и систолической дисфункции, многократно повышающийся на стадии стеатогепатита [12]. Так, в работе О.М. Silvestre et al. (2013) [13] продемонстрировано, что тяжесть структурно-функциональных нарушений со стороны сердца (размер левого предсердия, конечно-диастолический объем, давление в легочной артерии) коррелирует с тяжестью поражения печени по шкале MELD. Интересны результаты исследования, показавшего, что у пациентов с НАЖБП, при прочих равных условиях, значимо выше степень гипертрофии левого желудочка (ЛЖ) [14], а активность ГГТП является независимым предиктором сердечно-сосудистых осложнений [15]. Поэтому поиск препаратов, действие которых будет направлено на предупреждение поражения органов-мишеней у больных с ХСН и СД 2-го типа, является одним из приоритетных направлений улучшения лечения.
На сегодняшний день выполнено достаточно много экспериментальных и клинических исследований, показывающих перспективность применения таурина в терапии пациентов с сердечно-сосудистой патологией и СД 2-го типа [16-19]. Таурин (2-аминоэтансульфоновая кислота) — свободная аминокислота, содержащаяся в миллимолярных концентрациях во всех тканях млекопитающих. Таурин обладает различными биологическими эффектами, направленными на поддержание физиологического гомеостаза, включая антиоксидацию, модуляцию ионного транспорта, осморегуляцию, регуляцию нейротрансмиттеров и конъюгацию желчных кислот.
Большой интерес представляют экспериментальные данные, свидетельствующие о гепатопротекторных свойствах таурина в лечении НАЖБП. Результаты экспериментального исследования Gentile et al. (2011) свидетельствуют о возможности таурина снижать выраженность стресса эндоплазматического ретикулума, окислительного стресса, подавлять активность каспазы-3 и апоптоз гепатоцитов, проявления хронического системного воспаления в гепатоцитах. Кроме того, таурин подавлял аккумуляцию триглицеридов в гепатоцитах, что позволяет рассматривать его как перспективный препарат для профилактики и лечения НАЖБП [20]. На модели неалкогольного стеатогепатита (НАСГ) на крысах было показано, что при диете, обогащенной жирами, таурин существенно уменьшает вес печени, активность трансаминаз в сыворотке, уровень триглицеридов и глюкозы, окислительный стресс, количество экспрессируемой mRNA фактора некроза опухоли-α, трансформирующего ростового фактора и проколлагена 1; значительно увеличивает экспрессию адипонектина по сравнению с опытной группой животных.
Продемонстрирована клиническая эффективность таурина при лечении НАЖБП у пациентов с СД 2-го типа. В двойном слепом плацебо-контролируемом сравнительном исследовании, проведенном О.Н. Овсянниковой и Л.А. Звенигородской (2012) [21], показано, что в группе пациентов, у которых применялась комбинированная с таурином терапия (препарат Дибикор назначался в дозе 0,5 г 2 р./сут за 20 мин до еды в течение 3 мес.) отмечался достоверно более выраженный гиполипидемический эффект (снижение уровня общего холестерина), чем у больных, получавших плацебо. Проведенная терапия способствовала снижению уровней ферментов цитолиза, маркеров воспаления у больных с НАЖБП. По данным Н.В. Лосева и Е.Е. Моисеенко (2010), таурин продемонстрировал гепатопротекторное и дополнительное липидоснижающее действие у пациентов с НАСГ, ассоциированным с ожирением и СД, в виде положительного влияния на динамику печеночных проб и атерогенных фракций липидов у пациентов, принимающих статины [22].
Целью нашего исследования было изучение влияния таурина в составе базисной терапии ХСН и СД 2-го типа на тяжесть сердечной недостаточности, функциональное состояние печени, инсулинорезистентность (ИР), углеводный и липидный обмен.
Материалы и методы
В исследовании приняли участие 60 больных СД 2-го типа обоего пола, которые перенесли ИМ от 1 до 12 мес., с ХСН ФК по классификации Общества специалистов по сердечной недостаточности (ОССН) (2002). Критериями исключения из исследования были: ХСН IV ФК, неконтролируемая злокачественная артериальная гипертензия (АГ), прогрессирующая стенокардия, состояние после аортокоронарного шунтирования и стентирования, гемодинамически значимые пороки сердца и нарушения ритма, СД 1-го типа, ожирение III степени, тяжелые заболевания эндокринной системы, помимо СД, терапия инсулином, клинически выраженная печеночная и почечная недостаточность, зависимость от алкоголя (прием алкоголя более 30 г/сут), любые другие заболевания, которые могли повлиять на результаты исследования. Протокол исследования одобрен региональным этическим комитетом. Терапия ХСН проводилась в соответствии с национальными рекомендациями ОССН, Российского кардиологического общества (РКО) и Российского научного медицинского общества терапевтов (РНМОТ) по диагностике и лечению ХСН (4-й пересмотр) [1]. Медикаментозное лечение СД 2-го типа соответствовало алгоритмам специализированной медицинской помощи больным СД [23]. Пациенты были распределены методом простой рандомизации в 2 группы по 30 человек: 1-ю (контрольную) группу составили пациенты, получающие базисную терапию по поводу сердечной недостаточности и базисную сахароснижающую терапию (метформин и/или глибенкламид); 2-ю группу — пациенты, принимающие дополнительно к основному лечению ХСН и СД таурин (Дибикор, «ПИК-Фарма», Россия) в дозе 500 мг 2 р./сут). Средние дозы базисных препаратов, применяемых для лечения ХСН и СД 2-го типа, статистически достоверно не различались между группами. Обе группы не имели достоверных различий по возрасту, половому составу, тяжести СД, перенесенному ИМ и тяжести ХСН (табл. 1).
Для решения поставленных задач проводили клиническое обследование пациентов с определением ФК ХСН по тесту 6-минутной ходьбы (ТШХ). Для оценки выраженности проявлений ХСН определяли уровень Nt-proBNP методом иммуноферментного анализа (ИФА) на биохимическом анализаторе Liasys (AMS, Италия).
Эхокардиографическое (ЭхоКГ) исследование для изучения структурно-функционального состояния миокарда и центральной гемодинамики выполнено на аппарате Siemens Sonoline G50 (Германия). Рассчитаны основные структурные и функциональные параметры сердца в соответствии с рекомендациями по количественной оценке, структуры и функций камер сердца. ФВ определялась по Симпсону.
Состояние углеводного обмена изучали по уровню глюкозы крови натощак (исследовали с помощью наборов фирмы Lachema (Чехия) унифицированным колориметрическим глюкозооксидазным методом), базальный инсулин определяли методом ИФА на иммуноферментном анализаторе «Униплан» («Пикон», Россия), HbA1c -методом боратного аффинного анализа на анализаторе NycoCard Reader II (Axis-Shield РоС AS, Норвегия). Рассчитывали индекс HOMA-IR (ИР, Homeostasis Model of AssessmentInsulin Resistance). Для оценки состояния липидного обмена крови на биохимическом анализаторе Liasys определяли уровни общего ХС, ТГ, ЛПНП, ЛПВП, индекс атерогенности. Для исследования функционального состояния печени изучали активность АЛТ и ACT, щелочной фосфатазы (ЩФ) и ГГТП, уровни общего белка, альбумина, общего билирубина, показатель тимоловой пробы и протромбиновый индекс (ПТИ) в сыворотке крови по общепринятым методикам на биохимическом анализаторе Liasys-2 (AMS, Италия). Для оценки выраженности процессов фиброзообразования в печени определяли в крови содержание коллагена IV типа при помощи иммуноферментного анализа (R&D Systems, США, Канада).
Статистическая обработка результатов была проведена с использованием функций Microsoft Excel, 2010 и пакета статистических программ Statistica 6.0. Были применены методы параметрической и непараметрической статистики. Вычислены средние значения исследуемых величин (М) и ошибка средней величины (m) для каждого показателя. Достоверность различий между данными, полученными в исследуемых группах, оценивали с использованием t-критерия Стьюдента. Статистически значимым считали отклонение при p<0,05.
Результаты исследования и обсуждение
В конце 16 нед. терапии по результатам ТШХ толерантность к физическим нагрузкам у пациентов достоверно увеличилась в обеих группах: на 38,5% в основной и на 24,8% в контрольной группах, в то время как ФК тяжести ХСН снизился на 18,2 и 16,1% соответственно. Достоверного различия между группами не выявлено. В конце исследования во 2-й группе пациентов, принимавших дибикор 1,0 г/сут, выявлено достоверное снижение уровня Nt-proBNP, отражающего степень тяжести сердечной недостаточности у обследованных больных, — на 28,9 vs 13,7% в группе сравнения. Различие между группами по данному показателю — на уровне статистической тенденции (p=0,07).
По данным ЭхоКГ позитивные изменения наблюдались и в структурно-функциональных параметрах сердца на фоне приема таурина [16]. Статистически значимым оказалось увеличение ФВ ЛЖ у больных, которым дополнительно назначали таурин, — на 15 vs 2,4% в группе сравнения по завершении исследования (различие между группами при p=0,03).
Включение таурина в базисную терапию ХСН и СД 2-го типа оказало позитивное влияние на выраженность диастолической дисфункции (ДД). Частота выявления ДД II стадии у больных ХСН и СД 2-го типа в основной группе снизилась на 28,6 vs 25% в группе контроля (р>0,05). Число пациентов с нормальной диастолической функцией увеличилось на 10% в 1-й и на 6,7% во 2-й группе. ДД III стадии, выявленная при первичном обследовании, не встретилась в обеих группах по окончании 16-недельной терапии. По-видимому, положительное влияние таурина на течение ХСН обусловлено доказанными антиоксидантными [24] и противовоспалительными свойствами данной аминокислоты [25], способностью нивелировать эффекты ангиотензина II, соответственно, снижая скорость прогрессирования ремоделирования ЛЖ [25].
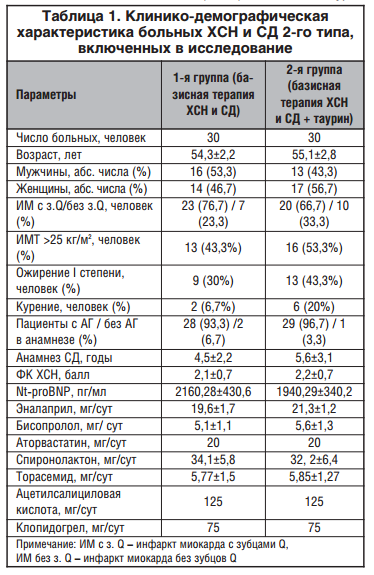
В ходе исследования отмечено, что под влиянием включения в состав комбинированной терапии Дибикора у пациентов с ХСН и СД 2-го типа наблюдалась благоприятная динамика показателей, отражающих функциональное состояние печени. Исходно повышение активности АСТ и АЛТ выше нормальных значений (но не более 3-кратного превышения верхней границы нормы) отмечалось в 20% случаев во 2-й группе и в 23,3% — в 1-й группе. Через 16 нед. приема таурина в составе комбинированной терапии СД 2-го типа и ХСН ни у одного пациента во 2-й группе не регистрировалась гиперферментемия, тогда как в 1-й группе в 10% случаев сохранилось повышение уровня активности АСТ. Различие между группами было статистически значимо. Кроме того, отмечено достоверное снижение активности АСТ и АЛТ во 2-й группе пациентов, дополнительно принимающих таурин (А, %= -39,06 и А, %= -26,93 соответственно против А, %= -4,1 и А, % = -0,98 в 1-й группе). Выявлено снижение активности как ЩФ, так и ГГТП у пациентов, получающих комбинированную терапию с включением таурина. Активность ЩФ снизилась на 22,7% во 2-й группе против 0,34% в 1-й группе (р<0,05), а ГГТП — на 41,86% против 6,94% во 2-й и 1-й группах соответственно (р<0,05). Кроме того, в группе пациентов, получающих таурин в составе комбинированной терапии ХСН и СД 2-го типа, статистически значимо уменьшился процент больных с гиперферментемией ГГТП (с 26,7 до 0%), тогда как в 1-й контрольной группе повышение уровня ГГТП выше 54 ед./л у мужчин и более 35 ед./л у женщин сохранилось у 20% пациентов. Обращает на себя внимание достоверное увеличение ПТИ во 2-й группе (А, % = 7,54 vs А, %= -1,04 во 2-й и 1-й группах соответственно, р<0,05). Отмеченное в ходе исследования положительное влияние таурина на функциональные показатели, характеризующие синдром цитолиза и холестаза, по-видимому, связаны с антиоксидантными и противовоспалительными свойствами. Одновременно на фоне приема таурина у пациентов 2-й группы в сыворотке крови отмечено достоверное уменьшение коллагена IV типа с 27,8±2,9 до 19,7±2,4 нг/мл (А, %= 41,1), что свидетельствует об уменьшении прогрессирования фиброгенеза в печени. В 1-й контрольной группе уровень коллагена IV типа снижался незначительно с 26,1±2,4 до 24,3±2,8 (А, %= 7,4). Различия между группами по конечному результату были достоверны.
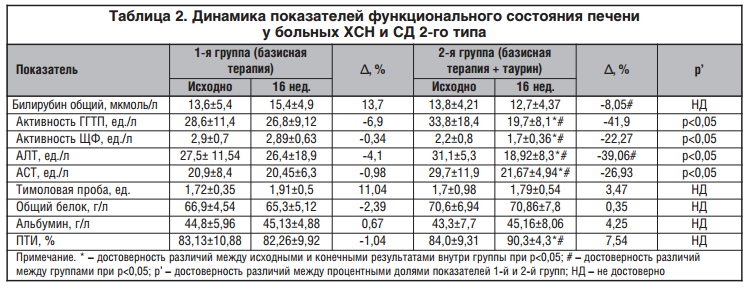
У больных 2-й группы на фоне включения в комбинированную терапию таурина выявлено статистически значимое улучшение показателей углеводного обмена (табл. 3): снижение уровня глюкозы крови натощак (А, % = -20,6%) и HbA1c (А, % = -18,8%), а достоверное снижение индекса HOMA говорит о клинически значимом уменьшении ИР (А, % = — 11,7%).
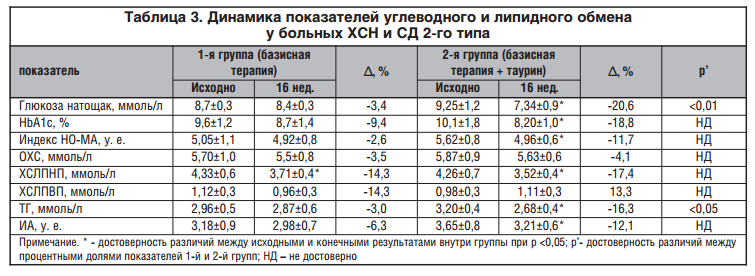
При изучении липидного обмена обнаружено статистически значимое снижение уровня ХС ЛПНП (А,% = 17%) и ТГ (А,% = 16%) в группе пациентов, принимавших таурин в дополнение к базисной терапии ХСН и СД 2-го типа. Благоприятное влияние таурина на функциональное состояние печени и уровень ТГ и ХС ЛПНП является патогенетически значимым, т. к. нарушение функционального состояния печени — один из наиболее важных факторов развития дислипопротеинемии, поскольку изменения липидного метаболизма начинаются на уровне гепатоцита, с другой стороны — печень является органом-мишенью при атерогенной дислипидемии.
В исследованиях, проведенных ранее, у пациентов с СД 2-го типа также показано благоприятное влияние таурина на углеводный и липидный обмен [21, 22]. Гипогликемический и липидоснижающий эффекты таурина объясняются снижением выраженности ИР, которая лежит в основе развития СД 2-го типа.
При проведении корреляционного анализа установлены достоверные связи между уровнем коллагена IV типа в крови и значениями индекса HOMA (r=0,37, р<0,05), а также между уровнем коллагена IV типа и стадией диастолической дисфункции (r=0,32, р<0,05).
Выводы
- Включение Дибикора в состав базисной терапии ХСН и СД 2-го типа достоверно увеличивает толерантность к физическим нагрузкам и уменьшает ФК ХСН, способствует снижению уровня Nt-proBNP и значимо увеличивает ФВ ЛЖ, оказывает позитивное влияние на выраженность диастолической дисфункции.
- Дибикор у больных с ХСН и СД 2-го типа значимо улучшает нарушенную функцию печени; обладает антифибротическим эффектом, достоверно уменьшая содержание коллагена IV типа в крови.
- 16-недельная терапия Дибикором пациентов с ХСН и СД 2-го типа оказывает благоприятное действие на углеводный и липидный обмен: достоверно снижаются уровень глюкозы натощак, HbA1c, ИР, а также уровни ЛПНП и ТГ в крови.
Литература
- Национальные рекомендации ОССН, РКО и РНМОТ по диагностике и лечению ХСН (4-й пересмотр) // Сердечная недостаточность. 2013. Т. 14. № 7 (81). С. 1-94.
- Yasser M. F., Reem Y. Hepato-cardiac disorders // World J Hepatol. 2014. Vol. 6 (1). Р. 41-54.
- Giallourakis C.C., Rosenberg P.M., Friedman L.S. The liver in heart failure// Clin Liver Dis. 2002. Vol. 6. Р. 947-967.
- Samsky M.D., Patel C.B., DeWald T.A. et al. Cardiohepatic interactions in heart failure: an overview and clinical implications // J Am Coll Cardiol. 2013. Vol. 61. Р. 2397-2405.
- Vollmar B., Menger M.D. The hepatic microcirculation: mechanistic contributions and therapeutic targets in liver injury and repair // Physiol Rev. 2009. Vol. 89. Р. 1269.
- Allen L.A., Felker G. M., Pocock S. et al. for the CHARM Investigators. Liver function abnormalities and outcome in patients with chronic heart failure: data from the Candesartan in Heart Failure: Assessment of Reduction in Mortality and Morbidity (CHARM) program // European Journal of Heart Failure. 2009. Vol. 11. Р. 170-177.
- Poelzl G., Eberl C., Achrainer H. et al. Prevalence and prognostic significance of elevated gamma-glutamyltransferase in chronic heart failure // Circ Heart Fail. 2009. Vol. 2. Р. 294-302.
- Verbeeck R.K. Pharmacokinetics and dosage adjustment in patients with hepatic dysfunction // Eur J Clin Pharmacol. 2008. Vol. 64. Р. 1147-1161.
- Guidance for industry: pharmacokinetics in patients with impaired hepatic function: study design, data analysis, and impact on dosing and labeling. Food and Drug Administration Web site, updated May 2003. Available at: http://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinfor-mation/guidances/ucm072123.pdf. Accessed January 11, 2013.
- Armstrong M.J., Adams L.A, CanbayA., Syn W.K. Extrahepatic complications of nonalcoholic fatty liver disease// Hepatology. 2014. Vol. 59. Р. 1174-1197.
- Soderberg C., Stal P., Askling J. et al. Decreased survival of subjects with elevated liver function tests during a 28-year follow-up // Hepatology. 2010. Vol. 51. Р. 595-602.
- Pacifico L., Di Martino M., De Merulis A. et al. Left ventricular dysfunction in obese children and adolescents with nonalcoholic fatty liver disease // Hepatology. 2013. Epub ahead of print [PMID: 23843206 DOI: 10.1002/hep.26610.
- Silvestre O.M. et al. Impact of the severity of end-stage liver disease in cardiac structure and function //Ann Hepatol. 2013. Vol. 12. N 1. Р. 85-91.
- Fallo F. et al. Non-alcoholic fatty liver disease is associated with left ventricular diastolic dysfunction in essential hypertension // Nutr Metab Cardiovasc Dis. 2009. Vol. 19. N 9. Р. 646-653.
- Mason J.E., Starke R.D., Van Kirk J.E. Gamma-glutamyl transferase: a novel cardiovascular risk biomarker// Prev Cardiol. 2010. Vol. 13. N 1. Р. 36-41.
- Стаценко М.Е., Винникова А.А., Ронская А.М., Шилина Н.Н. Таурин в терапии хронической сердечной недостаточности и сахарного диабета 2 типа: влияние на микроциркуляцию и эластические свойства магистральных сосудов // Сердечная недостаточность. 2013. Т. 14. № 6 (80). С. 347-53.
- El ldrissi A., Okeke E, Yan X. et al. Taurine regulation of blood pressure and vasoactivity//Adv Exp Med Biol. 2013. Vol. 775. Р. 407-425.
- Покровская Е.М., Волов Н.А., Васильева И.С. Новые возможности лечения пациентов с сердечной недостаточностью вследствие постинфарктного кардиосклероза // Медицинский совет. 2012. № 12. С. 18-23.
- Walczewska M., Marcinkiewicz J. Taurine chloramine and its potential therapeutical application // PrzeglLek. 2011. Vol. 68 (6). Р. 334-338.
- Gentile C.L., Nivala AM. et al. Experimental evidence for therapeutic potential of taurine in the treatment of nonalcoholic fatty liver disease // Am J Physiol Regul Integr Comp Physiol. 2011. Vol.301 (6). Р. 1710-1722.
- Овсянникова О.Н., Звенигородская Л.А. Целесообразность применения таурина в лечении неалкогольной жировой болезни печени // Эффективная фармакотерапия. Гастроэнтерология. 2012. № 2. С. 34-39.
- Лосева Н.В., Моисеенко Е.Е. Опыт применения препарата Дибикор в комплексной терапии неалкогольной жировой болезни печени // Фарматека. 2010. № 13. С. 63-67.
- Алгоритмы специализированной медицинской помощи больным диабетом / под ред. И. И. Дедова, М.В. Шестаковой. М., 2013.
- Schaffer S.W., Azuma J., Mozaffari M. Role of antioxidant activity of taurine in diabetes // Can J Physiol Pharmacol. 2009. Vol. 87 (2). Р. 91-99.
- Schaffer S. W., Lombardini J.B., Azuma J. Interaction between the actions of taurine and angiotensin II //Amino Acids. 2000. Vol. 18 (4). Р. 305-318.









Комментировать