Авторы: Летяева О.И., Зиганшин О.Р., Кудревич Ю.В., Гизингер О.А.,ГБОУ ВПО «ЮУГМУ» Минздрава России, г. Челябинск
Впервые вирус герпеса был выделен W. Gruter в 1912 г. Сегодня известно более 80 представителей human herpes virus-HHV, 8 из которых наиболее патогенны для человека. С точки зрения вирусологии это филогенетически древнее семейство крупных ДНК-вирусов, подразделяющихся на 3 подсемейства – α, β, γ, однако наиболее быстрой репликацией и цитопатическим действием на культуры инфицированных клеток обладают α-герпес-вирусы, включающие HSV-1, HSV-2 и VZV. Уникальность герпес-вирусов заключается в их способности поражать различные органы и системы (кожа, слизистые оболочки, ЦНС, периферическая нервная система, эндотелий сосудов, Т-лимфоциты, эритроциты, тромбоциты; интеграция в геном клеток хозяина), вызывая самые разнообразные клинические проявления [1–4]. Несколько лет назад экспертами ВОЗ была представлена общая эпидемиологическая картина, свидетельствующая о практически 100% инфицировании населения планеты вирусом простого герпеса (ВПГ) типа 1 и 2, при этом у 10–20% инфицированных имеются различные клинические проявления герпетической инфекции [5–8]. Европейское региональное бюро ВОЗ относит герпес-вирусные инфекции к группе болезней, которые определяют будущее инфекционной патологии. Масштабы заболеваемости в сочетании с наносимым ими уроном – психологическим и физиологическим – определяют важное медицинское и социальное значение этих инфекций [9–11].
И проблема заключается не только в том, что вирус характеризуется быстрой репликацией, но и в распространении бессимптомной и недиагностированной форм болезни, что способствует формированию вторичного иммуносупрессивного состояния. Рецидивирующие формы герпеса оказывают негативное воздействие на иммунную систему больного, приводя к астении, нервно-психическим расстройствам, вызывая в 30% случаев спонтанные аборты на ранних сроках беременности, свыше 50% поздних выкидышей, и занимают второе место после вируса краснухи по тератогенности [11–17]. Доказана роль герпетической инфекции в ускорении интеграции вируса папилломы человека (ВПЧ) в геном клетки хозяина, что повышает риск онкопатологии полости рта, шейки матки, влагалища и прямой кишки. При этом коинфекция ВПГ и ВПЧ при дисплазии в 34 раза повышает риск малигнизации и в 61 раз – вероятность трансформации в плоскоклеточный рак [9, 16, 18].
В значительной мере осложняют постановку диагноза такие факторы, как изменение цикла развития герпетических элементов в очаге поражения, необычная локализация очага и анатомические особенности подлежащих тканей; преобладание субъективных ощущений в очаге. При этом все чаще практикующие врачи сталкиваются с атипичными формами, встречающимися, как правило, при рецидивах генитального герпеса и сопровождающимися неспецифическими симптомами, такими как: раздражение области вульвы; локализованная эритема; слизисто-гнойный цервицит; геморрагический цистит; рецидивирующий уретрит; боль в нижних отделах спины; вульварные спайки, рецидивирующая трещина ануса, зудящая форма герпеса ануса и герпетическое поражение геморроидальных узлов [2, 11, 18, 19].
Формирование единого подхода к вопросам диагностики и тактики ведения больных является важной задачей современного здравоохранения.
В 1974 г. Гертрудой Элион был синтезирован ацикловир, за создание которого в 1988 г. ей была присуждена Нобелевская премия по медицине. Механизм действия ациклических нуклеозидов связан с избирательным фосфорилированием в инфицированных ВПГ клетках и конкурентным субстратным ингибированием полимеразы дезоксирибонуклеиновой кислоты, ведущей к окончанию считывания цепи ДНК вируса. Однако они отличаются специфичностью и сродством к своим ферментам вируса-мишени [1, 2, 5, 19, 20]. Ацикловир является первым препаратом, использованным для терапии герпетических поражений, и избирательным аналогом нуклеозида с профилем приемлемой безопасности для широкого применения. Этот препарат, вызывающий минимальные побочные реакции, применяли у больных для купирования генитального герпеса до 10 лет [2, 6, 21, 22]. Однако появляется все больше сообщений о развитии резистентности вируса к ацикловиру. Так, по данным Patrick D., у 57% пациентов, страдающих рецидивирующим генитальным герпесом, развивается резистентность к ацикловиру или он изначально оказывается не эффективен [20]. Кроме того, наличие у герпес-вирусов молекулярной мимикрии, нюансы индивидуальных провоцирующих факторов и множество других причин зачастую становятся на пути полноценного контроля над этой инфекцией [16, 20].
Валацикловир (L-валил-эфир ацикловира) обеспечивает в 3–5 раз более эффективную биодоступность ацикловира. Обширная программа клинических исследований по оценке положительного действия валацикловира при генитальном герпесе показала, что он не менее эффективен, чем ацикловир. Так, при пероральном приеме биодоступность составляет 57%, и его применение в дозе 500 мг 2 р./сут эквивалентно приему ацикловира 5 р./сут в дозе 200 мг, а прием валацикловира в дозе 1000 мг 3 р./сут обеспечивает концентрацию, которая приближается к таковой при в/в введении ацикловира в дозе 15 мг/кг/сут, что позволяет заменить в/в введение ацикловира пероральным приемом валацикловира в высоких дозах [2, 12, 14, 15, 20, 21]. Кроме того, использование более простой схемы, при которой валацикловир рекомендован 2 р./сут по сравнению с ацикловиром (5 р./сут) для лечения эпизода, и прием валацикловира 1 р./сут по сравнению с ацикловиром 2–3 р./сут для длительной супрессивной терапии однозначно имеют превосходство в плане приверженности к терапии. На фоне лечения валацикловиром предотвращаются рецидивы инфекции, вызываемой ВПГ, или задерживается их возникновение на 71–85% (анализ соотношения опасностей) по сравнению с плацебо [1, 2, 20, 21]. Супрессивная терапия при генитальном герпесе оказывает положительное психосоциальное действие, а также уменьшает степень риска его передачи. По клинической эффективности на 25–40% превосходит ацикловир.
Проведенные ранее исследования свидетельствуют о том, что валацикловир является особенно эффективным препаратом при лечении привычного невынашивания беременности, ассоциированного с генитальным герпесом, а также в случае профилактики генитального герпеса и цитомегаловирусной (ЦМВ) инфекции одновременно [23].
На фармацевтическом рынке существует значительное количество препаратов, где действующим началом является валацикловир. Одно из таких лекарственных средств – препарат Валогард, показанием к назначению которого является в т. ч. и генитальный герпес.
Цель исследования: провести сравнительный клинико-иммунологический анализ эффективности и безопасности длительной супрессивной терапии препаратами ацикловир и валацикловир у пациенток с атипичными формами рецидивирующего генитального герпеса.
Материалы и методы:
на кафедре дерматовенерологии ГБОУ ВПО ЮУГМУ было проведено простое открытое рандомизированное исследование, в которое вошли 35 женщин репродуктивного возраста. Средний возраст составил 27,2±0,3 года. Материалом для выделения и последующей амплификации ДНК ВПГ послужили соскобы эпителия цервикального канала, уретры, анальной области, взятые одноразовыми цитощетками и /или плейферами. План исследования соответствовал положениям Хельсинкской декларации Всемирной медицинской ассоциации последнего пересмотра (г. Эдинбург, Шотландия, 2000 г.), с учетом разъясняющего примечания п. 29, одобренного Генеральной ассамблеей ВМА (Сеул, 2008), и был одобрен этическим комитетом ГБОУ ВПО ЮУГМУ Минздрава РФ. Всем пациенткам было проведено комплексное исследование, включавшее: осмотр врача, микроскопическое исследование отделяемого цервикального канала, цитологическое исследование мазков-отпечатков, исследование показателей местного иммунитета. Материалом для исследования местного иммунитета репродуктивного тракта служила цервикальная слизь. Всем женщинам проводили исследование фагоцитарной активности нейтрофилов цервикальной слизи. Исследование внутриклеточного кислородзависимого метаболизма проводили с использованием НСТ-теста. Также рассчитывали функциональный резерв нейтрофилов (ФРН), лизосомальную активность. Определение концентрации IgМ, IgG, уровня цитокинов проводилось с использованием соответствующих тест-систем для иммуноферментного анализа.
Критериями включения в дальнейшее исследование были: наличие клинических проявлений герпетической инфекции, частота рецидивов от 4 до 6 в год, выявление ДНК ВПГ, репродуктивный возраст, согласие пациенток на участие в исследовании. Критериями исключения являлись: наличие тяжелой соматической патологии, гормональные нарушения, беременность, лактация, наличие других инфекций, передаваемых половым путем (ИППП), ВИЧ, несогласие пациенток на участие в исследовании.
В соответствии с МКБ-Х и клиническими рекомендациями РОДВК по ведению больных ИППП и урогенитальными инфекциями, был выставлен диагноз: А.60.0 Герпетическая инфекция половых органов и мочеполового тракта, рецидивирующее течение, средняя степень тяжести.
Частота рецидивов составляла 4–6 раз в год, межрецидивный период – не более 2–3 мес. Были сформированы следующие группы: №1 – здоровые (n=15), состояла из женщин, не имеющих клинических проявлений герпетической инфекции, группа №2 (n=18) – получали терапию валацикловиром по 500 мг 1 р./сут на протяжении 6 мес., группа №3 (n=17) – принимали ацикловир по 400 мг 2 р./сут в течение 6 мес. Группы были стратифицированы между собой на начальном этапе (до назначения лечения) по всем признакам, характеризующим заболевание: жалобы, клинические проявления, лабораторные показатели.
Результаты и обсуждение: пациенток с герпетической инфекцией урогенитального тракта беспокоили зуд, жжение в области гениталий различной интенсивности, у 22 (62,8%) женщин отмечались дискомфорт в области уретры, болезненность при мочеиспускании. При осмотре наблюдались гиперемия наружного отверстия уретры, наличие скудных слизистых выделений. У 10 (28,5%) женщин при уретроскопии в передней части уретры выявлены мелкие поверхностные эрозии, отечность слизистой оболочки. В 25,7% (9 женщин) случаев пациентки предъявляли жалобы на слизистые выделения и дискомфорт в области наружных половых органов, при объективном осмотре были выявлены: отечность слизистой оболочки шейки матки, поверхностные эрозии, слизистые выделения из цервикального канала. Клинически у всех женщин, страдающих генитальной герпетической инфекцией, на момент осмотра выявлены эрозивные поражения гениталий. У 12 (34,2%) пациенток эрозии имелись в области малых половых губ, у 15 (42,8%) – на задней спайке, у 4 (11,4%) пациенток отмечались утолщение складки анального отверстия, интенсивный зуд, жжение в периоды обострения герпетической инфекции (рис. 1).
В 100% случаев пациентки были тревожны, отмечали снижение качества жизни из-за страха возникновения рецидива, боязни инфицировать полового партнера, 5 (10,4%) женщин отметили, что во время рецидива избегают даже дополнительных бытовых контактов с близкими. Все пациентки обратились за медицинской помощью во время очередного рецидива, из анамнеза удалось установить, что средняя продолжительность болезни составляла 3,8±0,4 года.
Лабораторное исследование выявило повышение числа лейкоцитов в цервикальном канале – 47,6±2,9 в поле зрения, пласты эпителиальных клеток, количество лейкоцитов в уретре составляло 18,3±1,2. Оценка локального иммунологического статуса показала достоверное увеличение общего числа лейкоцитов, жизнеспособных клеток, снижение показателей спонтанного и индуцированного НСТ-теста, функционального резерва нейтрофилов. Фагоцитарная активность нейтрофилов у больных с герпетической инфекцией была значительно ниже, чем у здоровых женщин, что свидетельствует о дисфункциях в противовирусной защите макроорганизма (р<0,02). Уровень CD95 и CD11b был снижен по сравнению с таковым у здоровых женщин в 2,6 и 1,13 раза соответственно. Нами также было установлено существенное снижение уровня INF-γ, одного из ключевых цитокинов, осуществляющих контроль над внутриклеточными инфекциями.
Контрольные исследования были проведены по истечении 6 и 12 мес. от начала лечения. В течение 6 мес. приема препаратов в группе «ацикловир» рецидив герпетической инфекции отмечен у 3 (17,6%) пациенток, при этом интенсивность клинических проявлений была менее выраженной, чем до лечения. В группе «валацикловир» рецидив отмечен у 1 (5,5%) пациентки. За год наблюдения в группе «ацикловир» по 1 рецидиву было у 5 (29,4%) женщин, 2 рецидива – у 3 (17,6%) и 3 эпизода – у 2 (11,7%). В группе «валацикловир» за этот же период наблюдения по 1 эпизоду рецидива генитального герпеса отмечены у 3 (16,6%) женщин, 2 – у 1 (5,5%). Длительность рецидива составила 3,0±1,5 дня.
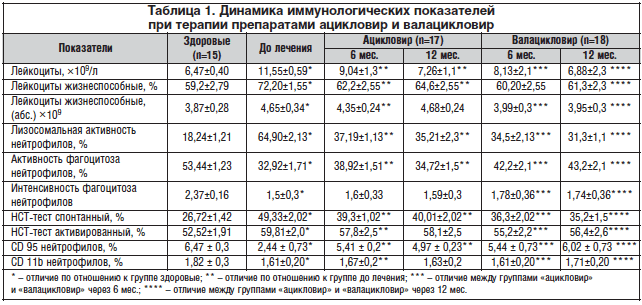
Сравнительный анализ динамики иммунологических показателей после проведенной терапии показал снижение общего числа лейкоцитов в цервикальном секрете, абсолютного и относительного числа жизнеспособных клеток, повышение функциональной активности нейтрофилов, усиление их апоптотической активности в обеих группах. Динамическое наблюдение в течение года показало, что сразу после проведенной терапии имелась четкая тенденция к нормализации клеточных факторов локального иммунитета, спустя 6 мес. после окончания терапии в группе «ацикловир» наметилась тенденция к увеличению общего числа лейкоцитов, снижению активности и интенсивности фагоцитоза. В группе «валацикловир» эти показатели оказались более стабильными. Данные о динамике изменений иммунологических показателей в процессе лечения представлены в таблице 1.
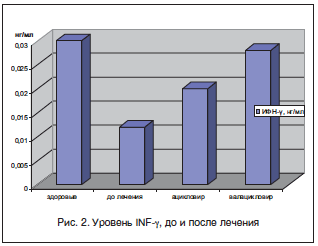
Длительная супрессивная противовирусная терапия способствовала также повышению уровня INF-γ, что может свидетельствовать о восстановлении противовирусной защиты организма (рис. 2).
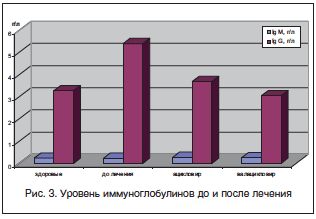
Нами также был установлен факт некоторого снижения уровня Ig G, что является одним из показателей снижения вирусной нагрузки (рис. 3).
Оценивая приверженность пациенток к проводимой терапии, мы установили, что в группе «ацикловир» 5 (29,4%) женщин нарушали рекомендованный режим приема препарата, при этом объясняя причины такого поведения, 2 отметили появление дискомфорта в области печени, изжогу, и все 5 «иногда» забывали принять лекарство, даже если не было дискомфорта. В группе «валацикловир» лишь 2 (11,1%) пациентки пропускали прием препарата, объяснив это забывчивостью. Оценка этиологической эффективности проведенной терапии показала отсутствие ДНК ВПГ через 6 мес. в группе «ацикловир» у 88,2% и в группе «валацикловир» – у 94,49%. Через 1 год ДНК ВПГ не выявлялся у 82,3% и 94,4% больных соответственно. Полученные данные были достоверны (р<0,05).
Следует также отметить, что существенное снижение частоты рецидивов при использовании препарата Валогард (валацикловир), удобный режим приема, отсутствие нежелательных реакций позволили заметно улучшить качество жизни пациенток.
Выводы:
- У женщин с хронической рецидивирующей герпетической инфекцией чаще отмечаются атипичные клинические проявления, дисфункции в локальном иммунологическом статусе, проявляющиеся снижением фагоцитарной активности нейтрофильных гранулоцитов, их апоптотической способности, снижением уровня INF–γ.
- Длительная супрессивная противовирусная терапия способствует снижению частоты рецидивов, устранению дисфункций в системе локального иммунитета и повышению качества жизни пациентов.
Читайте также: Иммуномодуляторы в лечении герпетической инфекции, вызванной вирусом простого герпеса







Комментировать