Эндометриоз – описание болезни и теории ее возникновения. Классификации. Обследования, диагностики. Лечение.
С. М. КОРНИЕНКО, к.м.н., доцент кафедры акушерства, гинекологии и перинатологии ФИПО Донецкого национального медицинского университета им. М. Горького,
Г.Д. МИСУНА, ст.н.с. НИИ медицинских проблем семьи Донецкого национального медицинского университета им. М. Горького
Эндометриоз остается нерешенной научной и клинической проблемой, к основным дискуссионным вопросам которой относятся следующие: всегда ли эндометриоз является болезнью; механизмы развития и классификация; генетические и иммунологические аспекты эндометриоза; наружный, внутренний эндометриоз и аденомиоз; ретроцервикальный эндометриоз; эндометриоз и тазовые боли; эндометриоз и спаечный процесс; эндометриоз и бесплодие; диагностические критерии; традиционные и нетрадиционные подходы к диагностике и лечению (Л.В. Адамян, 2007).
Эндометриоз считают одним из самых распространенных и загадочных гинекологических заболеваний женщин репродуктивного возраста. Возможно возникновение эндометриоза у 10 % девочек в период менархе и у 2-4 % женщин в менопаузе (Л.В. Адамян, 2007).
Частота заболеваемости, по данным различных авторов, такова: среди женщин климактерического периода — 17,5 % (С.А. Гаспарян, 1996); женщин с гинекологическими заболеваниями — 20-30 % (Конгресс по эндометриозу, 1996); пациенток репродуктивного возраста — 12-50 % (Л.В. Адамян, 1996); за последние 25 лет — рост от 2 до 25 % (Е.А. Вихляева, 1993); средний возраст — 42,3 года (И.В. Дудко, 1996). Среди женщин, подвергшихся различным гинекологическим операциям, частота данного заболевания составляла 6-10 %, возрастая до 25 % при гистерэктомии (удаление матки). Во время лапароскопии, проводимой по поводу болевого синдрома, диагноз эндометриоза ставится в 4-80 % случаев, а при бесплодии — в 12-80 %.
Эндометриоз — это разрастания, сходные по строению со слизистой оболочкой матки, за пределами обычной локализации эндометрия. Согласно современным представлениям о природе эндометриоза, данное заболевание следует рассматривать как патологический процесс с хроническим рецидивирующим течением. Эндометриоз формируется и развивается на фоне нарушенных иммунных, молекулярно-генетических и гормональных взаимоотношений в женском организме. Эндометриоидный субстрат имеет признаки автономного роста и нарушений пролиферативной активности клеток (В.А. Бенюк, 2002).
Независимо от локализации и размеров эндометриоидных очагов гистологически эндометриоз характеризуется доброкачественной пролиферацией железистого эпителия, напоминающего функционирующие железы стромы эндометрия. Однако соотношение железистого эпителия и стромы в эндометриоидных гетеротопиях различной локализации неодинаково. Наиболее частый вариант злокачественных опухолей в эндометриоидных гетеротопиях — эндометриоидная карцинома (около 70 %). Но отличие ее от опухоли — отсутствие клеточной атипии (Ф.И. Давыдов, 2003).
Существует множество теорий возникновения эндометриоза, наиболее рапространенными из них являются следующие.
Генетическая теория. Приверженцы этой теории определенное значение придают наследственному фактору, учитывая наличие наблюдений семейной склонности к эндометриозу. В настоящее время не выявлено гена наследственности эндометриоза, что говорит в пользу совокупности генов. Обнаружение специфических генетических маркеров в перспективе позволит выявлять генетическую предрасположенность, проводить профилактику и диагностировать доклинические стадии заболевания.
Эмбриональная теория. Согласно этой теории, очаги эндометриоза возникают из остатков парамезонефральных (мюллеровых) протоков или зачаточного материала, из которого развиваются половые органы, в том числе и ткань эндометрия. В пользу этой теории свидетельствуют данные о развитии эндометриоза у девочек 11-12 лет, а также его сочетание с пороками развития половых органов (В.А. Бенюк, 2002).
Трансплантационная теория. Согласно данной теории, жизнеспособные элементы эндотелия заносятся в другие ткани, приживаются на новом месте, образовывая эндометриоидную гетеротопию. Попадание частиц эндометрия в полость малого таза считается критическим моментом развития эндометриоза. Одним из очевидных вариантов такого заноса являются хирургические манипуляции, включая диагностические выскабливания, акушерские и гинекологические операции, связанные со вскрытием полости матки и хирургической травмой слизистой оболочки матки. Ятрогенный момент развития заболевания доказан ретроспективным анализом этиологии эндометриоза у женщин, которым проводились те или иные операции. Предполагается возможность метастазирования долек эндометрия лимфогенным и гематогенным путями с последующей их имплантацией. Такой тип диссеминации частиц эндометрия считают одной из важнейших причин возникновения известных вариантов экстрагенитального эндометриоза, таких как эндометриоз легких, кожи, мышц. Распространение жизнеспособных клеток эндометрия по лимфатическим путям — нередкое явление, о чем свидетельствует достаточно частое обнаружение значительных очагов эндометриоза в просвете лимфатических сосудов и узлах. Гипотезу о ретроградной менструации как причине эндометриоза подтверждает характер распределения очагов эндометриоза, которые чаще всего наблюдаются в прямокишечно-маточном углублении и на заднем листке широкой связки матки (J.F. Sampson, 1921).
Согласно метапластической теории происхождения эндометриоз а, предложенной Н.Н. Ивановым (1897), R. Meyer(1903), эмбриональные клеточные элементы, расположенные между зрелыми клетками серозного покрова малого таза, могут трансформироваться в эпителий маточно-трубного типа, т.е. очаги эндометриоза могут возникать из мультипотентных клеток мезотелия брюшины. В 1986 г. H. Minhи соавт. возвратились к единой теории гистогенеза наружного и внутреннего эндометриоза. Авторы считают, что участки эндометриоза происходят из клеток целомического эпителия, который персистирует в переходной зоне между миометрием и эндометрием. Эти клетки появляются в мезотелии, который покрывает яичники, маточные трубы, тазовую брюшину, под действием дегенерирующей эпителиальной ткани во время менструации. Эта теория позволяет объяснить морфологическую схожесть эндометриоидных очагов и эндометрия, хотя их биологическая сущность различна (Н.И. Кондриков, 1999).
Сторонники иммунологической теории считали, что клетки эндометрия, попадая в кровь и другие органы, представляют собой аутоантигены. Пролиферация эндометриоидных клеток в других тканях возможна в результате повышения уровня эстрогенных гормонов, которые стимулируют секрецию кортикостероидов. Последние, в свою очередь, являясь депрессантами, подавляют местный клеточный и гуморальный иммунитет, тем самым обеспечивая благоприятные условия для инвазии и развития жизнеспособных клеток эндометрия (M. Jonesko, 1975).
Дальнейшие исследования позволили обнаружить антиэндометриальные аутоантитела у больных эндометриозом. Так, были выявлены IgGи IgA-ан-титела к яичниковой и эндометриальной тканям, которые определяли в сыворотке крови, в секретах влагалища и шейки матки.
Таким образом, у больных с эндометриоидными поражениями наблюдаются общие признаки иммунодефицита и аутоиммунизации, приводящие к ослаблению иммунного контроля, которые создают условия для имплантации и развития функциональных очагов эндометрия вне их нормальной локализации (W.P. Danovsky, 1988; R.W. Chav, 1993).
В многочисленных исследованиях, посвященных эндометриозу, в патогенезе развития заболевания значительная роль отводится различным нейроэндокринным нарушениям.
У больных эндометриозом возникают хаотические пиковые выбросы фолликулостимулирующего и лютеинизирующего гормонов, наблюдается снижение базального уровня прогестерона, у многих выявлены гиперпролактинемия и нарушение андрогенной функции коры надпочечников (Л.В. Адамян, 1998; И.С. Сидорова, 2002).
В ряде работ отмечено, что синдром неовулировавшего фолликула способствует возникновению эндометриоза. Высокий уровень прогестерона в первые дни менструации рассматривают как фактор, способствующий выживанию жизнеспособных клеток эндометрия, что подтверждают экспериментальные данные, полученные на кастрированных животных.
Опосредованную роль в развитии эндометриоидных очагов отводят дисфункции щитовидной железы. Отклонения от физиологической секреции тиреоидных гормонов, являющихся модуляторами эстрогенов на клеточном уровне, могут способствовать прогрессированию нарушений гистои органогенеза гормоночувствительных структур и формированию эндометриоза (Л.В. Адамян, 1998; И.С. Сидорова, 2002).
При обследовании больных эндометриозом выявлены и локальные морфологические изменения яичников, особенно при поражении самих яичников. Показано, что вне зон эндометриоидного поражения яичники имеют признаки дегенерации яйцеклеток, кистозной и фиброзной атрезии фолликулов, текоматоза стромы, фолликулярные кисты. Полагают, что это связано с воздействием на яичники токсических агентов воспаления, например простагландинов, содержание которых при эндометриозе возрастает (Б.И. Железнов, 1985; А.Н. Стрижаков, 1987).
Однако следует отметить, что дисфункция системы «гипоталамус — гипофиз — яичники», как и другие нарушения, не может считаться непременным спутником эндометриоза и нередко не определяется у многих больных.
Комбинированная теория предполагает всевозможное сочетание различных теорий.
Несмотря на множество теорий происхождения эндометриоза, истиные причины заболевания окончательно так и не изучены. Ключевой момент развития эндометриоза — возникновение эндометриоидной гетеротопии — пока не объяснен ни одной из теорий.
За последние полвека предложено более 10 различных классификаций эндометриоза.
Накопление новых сведений об этиологии и патогенезе эндометриоза, клинических, структурных, функциональных, иммунологических, биологических, генетических вариантах этого заболевания позволит предложить новые классификации (В.А. Бенюк, 2002).
Классификация по МКБ-10
N80 Эндометриоз
N80.0 Эндометриоз матки (аденомиоз)
N80.1 Эндометриоз яичника
N80.2 Эндометриоз маточной трубы
N80.3 Эндометриоз тазовой брюшины
N80.4 Эндометриоз прямокишечно-влагалищной перегородки и влагалища
N80.5 Эндометриоз кишечника
N80.6 Эндометриоз кожного рубца
N80.8 Другой эндометриоз
N80.9 Эндометриоз неуточненный
Согласно локализации патологического процесса выделяют:
I. Генитальный эндометриоз.
- Внутренний эндометриоз.
1.1.Эндометриоз тела матки (аденомиоз) I, II, III стадий в зависимости от глубины поражения миометрия: железистая, кистозная, фиброзная (очаговая, узловая, диффузная) формы.
1.2.Эндометриоз цервикального канала.
1.3. Эндометриоз интрамуральной части маточных труб.
- Наружный эндометриоз.
2.1. Перитонеальный эндометриоз: эндометриоз яичников (инфильтративная, опухолевая формы); эндометриоз маточных труб; эндометриоз тазовой брюшины (красные, черные, белые формы).
2.2. Экстраперитонеальный эндометриоз: эндометриоз влагалищной части шейки матки; эндометриоз влагалища, вульвы; ретроцервикальный эндометриоз; эндометриоз маточных связок; эндометриоз параметральной, паравезикальной, паракольпальной клетчатки с прорастанием в мочевой пузырь, прямую кишку и без такового.
- Наружно-внутренний эндометриоз.
- Сочетанные формы генитального эндометриоза (генитальный эндометриоз в сочетании с другой генитальной или экстрагенитальной патологией).
II. Экстрагенитальный эндометриоз (эндометриоз желудочно-кишечного тракта, мочевыводящих органов, кожи, пупка, послеоперационных ран, легких, плевры и др.).
Классификация наружного эндометриоза по A. Acostaи соавт. (1973)
Малые формы:
- одиночные гетеротопии на тазовой брюшине;
- одиночные гетеротопии на яичниках без спаек и рубцов.
Эндометриоз средней тяжести:
- гетеротопии на поверхности одного или обоих яичников с образованием мелких кист;
- невыраженный периовариальный или перитубарный спаечный процесс;
- гетеротопии расположены на брюшине внематочного пространства с рубцовым процессом и смещением матки без вовлечения в патологический процесс толстого кишечника.
Тяжелые формы наружного эндометриоза:
- эндометриоз одного или обоих яичников с образованием кист диаметром более 2 см;
- поражение яичников с выраженным периовариальным и/или перитубарным спаечным процессом;
- поражение маточных труб с деформацией, рубцеванием, нарушением проходимости;
- поражение брюшины с облитерацией внематочного пространства;
- поражение крестцово-маточных связок и брюшины внематочного пространства;
- вовлечение в патологический процесс мочевыводящих путей и/или кишечника.
Классификация в зависимости от локализации
Эндометриоз тела матки (аденомиоз):
I степень — процесс ограничен слизистой оболочкой тела матки;
II степень — распространение эндометриоза до середины толщины миометрия;
III степень — вовлечение в патологический процесс всей стенки матки;
IV степень — вовлечение в патологический процесс париетальной брюшины и соседних органов.
Эндометриоз яичников:
I степень — небольшие участки эндометриоза на поверхности яичников и на брюшине прямокишечноматочного углубления;
II степень — односторонняя эндометриоидная киста диаметром не более 5-6 см, небольшие участки эндометриоза на брюшине малого таза, спаечный процесс в области придатков;
III степень — эндометриоидные кисты обеих яичников диаметром более 5-6 см, участки эндометриоза на серозном покрове матки, маточных труб, брюшине малого таза, выраженный спаечный процесс;
IV степень — двусторонние кисты больших размеров с переходом на соседние органы.
Ретроцервикальный эндометриоз:
I степень — эндометриоидные участки в пределах ректовагинальной клетчатки;
II степень — эндометриоидная ткань переходит на шейку матки и стенку влагалища с образованием мелких кист;
III степень — процесс распространяется на крестцовоматочные связки и серозный покров прямой кишки;
IV степень — процесс распространяется на слизистую оболочку прямой кишки, облитерирует прямокишечно-маточное пространство с возникновением спаечного процесса в области придатков матки.
Одной из наиболее широко применяемых в мировой практике стала предложенная в 1979 г. Американским обществом фертильности (с 1995 г. — Американское общество по репродуктивной медицине) и пересмотренная в 1996 г. классификация, основанная на оценке лапароскопических данных и подсчете общей площади и глубины эндометриоидных гетеротопий, выраженных в баллах: I стадия — минимальный эндометриоз (1-5 баллов), II стадия — легкий эндометриоз (6-15 баллов), III стадия — умеренный эндометриоз (16-40 баллов), IV стадия — тяжелый эндометриоз (более 40 баллов).
Эндометриоз характеризуется разнообразием симптоматики — от бессимптомного течения до клиники «острого живота». В значительной мере клиническая картина зависит от локализации, продолжительности, течения сопутствующих заболеваний, психоэмоциональной характеристики пациентки (степень болевого синдрома, отношение к возникающим нарушениям репродуктивной функции и др.). В зависимости от локализации клиническая картина эндометриоза включает:
Эндометриоз тела матки (аденомиоз):
- бесплодие;
- постоянно нарастающая альгодисменорея: жалобы на боль, ощущение тяжести внизу живота;
- нарушения менструальной функции: гиперполименорея, метроррагия, кровянистые выделения до и после менструации, вследствие которых нередко развивается анемия;
- дизурические нарушения перед началом менструации.
Эндометриоз яичников:
- бесплодие;
- боль: постоянная, усиливается накануне и во время менструации, иррадиирует в поясницу, крестец, прямую кишку. Резкое усиление боли, которая нередко сопровождается рвотой, сильной болезненностью и напряжением мышц живота, наблюдается при микроперфорации стенки кисты и излитии части ее содержимого в брюшную полость;
- дизурические и гастроинтестинальные нарушения: запоры, вздутие живота (спаечный процесс в малом тазу).
Ретроцервикальный эндометриоз:
- бесплодие;
- боль: ноющая, резко усиливается до и во время менструации и при половых контактах; иррадиирует во влагалище, крестец, прямую кишку. При прорастании стенки прямой кишки боль усиливается во время дефекации.
Лишь незначительная часть женщин с эндометриозом не имеет никаких признаков заболевания, что объясняется индивидуальной чувствительностью к болевым ощущениям. Также установлено, что не всегда степень выраженности болевого синдрома соответствует степени распространения и размерам эндометриоидных гетеротопий, что выявляется при одновременном клиническом и эндоскопическом обследовании (В.П. Баскаков, 1990).
Наиболее значимым в проблеме эндометриоза является его сочетание с бесплодием, что диагностируется у 35-45 % больных. В связи с этим представляют интерес данные о причинах возникновения бесплодия у больных с эндометриозом. Отмечено, что к этим факторам относятся изменения в перитонеальной жидкости, нарушение процессов овуляции, развитие иммунологической патологии и трубно-перитонеальные нарушения.
Так, считают, что наличие в перитонеальной жидкости интерлейкинов и некротизирующего опухолевого фактора, а также увеличение числа макрофагов приводит к снижению подвижности спермы. Повышение уровня простагландинов, выявляемое при бесплодии и эндометриозе, снижает сократительную активность маточных труб.
Такие нарушения менструального цикла, как ановуляция (17-27 %) на фоне повышенного уровня пролактина, преждевременной овуляция или синдрома неовулирующего фолликула, нередко встречаются у больных с эндометриозом (В.А. Бенюк, 2002).
Выделение крови во время каждой менструации из эндометриоидных гетеротопий, расположенных в малом тазу на связках, трубах, брюшине и яичниках, вызывает возникновение новых очагов эндометриоза, спаечного процесса, нарушение проходимости маточных труб и последующее бесплодие.
Факторы, влияющие на возникновение и последующее развитие эндометриоза, делятся на 2 большие группы: повышающие и снижающие риск заболевания (В.А. Бенюк, 2002).
Факторы, повышающие риск эндометриоза:
- наследственная предрасположенность;
- нарушение гормонального и иммунного гомеостаза;
- воспалительные заболевания гениталий;
- хирургические вмешательства (диатермокоагуляция, кесарево сечение, миомэктомия);
- возраст старше 35-45 лет;
- нарушения менструального цикла;
- высокий инфекционный индекс в детстве;
- злоупотребление алкоголем и кофеином;
- влияние химических веществ.
Факторы, снижающие риск эндометриоза:
- прием гормональных контрацептивов;
- предыдущее использование ВМС;
- курение.
Диагностическая стратегия. Разнообразие клинических проявлений эндометриоза и отсутствие патогномоничного именно для этого заболевания симптома определяют сложную диагностическую задачу в практической деятельности гинеколога (Л.В. Филонова, 2001). В связи с этим заслуживает внимания мнение Е.М. Вихляевой о том, что «эндометриоз нередко не диагностируется вообще или, наоборот, служит поводом для ошибочной постановки диагноза».
Наиболее часто при эндометриозе отмечается так называемый синдром хронической боли в области малого таза. По рекомендации Американской ассоциации акушеров и гинекологов, в диагностике эндометриоза большое значение имеет последовательное исключение других причин боли этой локализации. Выявленные при тщательном гинекологическом исследовании узловые образования вдоль утолщенных крестцовоматочных связок, увеличение и фиксация матки в ретроверсии, тяжистость или увеличение яичников заставляют лишь предположить наличие эндометриоза. Лабораторные тесты и магнитно-резонансное исследование также не имеют достаточной диагностической точности. Поэтому в настоящее время методом выбора в диагностике эндометриоза является лапароскопия, которая позволяет выявить и оценить распространенность заболевания, а также установить его стадию (И.С. Сидорова, 2002). Лапароскопия остается золотым эталоном диагностики эндометриоза (Брозенс, 1996).
Перечень необходимых диагностических мероприятий:
- анализ жалоб, клиническое и гинекологическое обследование;
- УЗИ-диагностика эндометриоидных кист и аденомиоза;
- гистеросальпингография для диагностики аденомиоза;
- лапароскопия — выявление наружного генитального эндометриоза, спаечного процесса, патологии маточных труб, кист яичников;
- гистероскопия — диагностика аденомиоза.
Наиболее широко используемым диагностическим маркером является опухолевый антиген СА-125. Этот высокомолекулярный гликопротеин может быть определен иммунными методами с помощью моноклональных антител. По данным литературы, у 95-97 % здоровых женщин уровень СА-125 не превышает 35 Ед/мл. Высокий уровень СА-125 в сыворотке крови определяют при эндометриозе, а также при циррозе печени, остром панкреатите, раке желудка и миоме матки. Поэтому диагностика эндометриоза с помощью данного теста без полного комплекса лабораторно-инструментальных исследований не правомерна. Однако бесспорную ценность имеет мониторинг концентрации СА-125 в сыворотке крови пациенток для определения динамики заболевания, тактики последующего лечения и его эффективности. Опухольассоциированным является также углеводный антиген СА 19-9. Несмотря на невысокую чувствительность данного маркера для диагностики эндометриоза, одновременное исследование содержания СА-125 и СА 19-9 позволяет улучшить диагностику заболевания. Большой диагностический интерес представляет также определение уровня воспалительных маркеров — интерлейкина-6 в сыворотке крови и фактора некроза опухоли в перитонеальной жидкости (Л.В. Адамян, 2001).
Гистологическая диагностика эндометриоза основывается на идентификации цилиндрического эпителия и подэпителиальной стромы, имеющих сходство с подобными составляющими слизистой оболочки матки (P.R. Ko-nincks, 1994).
Согласно классификации J.F. Brosens (1993), выделяют 3 типа гистологической структуры эндометриоидных поражений:
- слизистый (с жидкостным содержимым), представленный в виде эндометриоидных кист или поверхностных поражений яичника;
- перитонеальный, который диагностируется микроскопически по активным эндометриоидным очагам (красные, железистые или пузырьковидные, прорастающие в глубь тканей, черные, складчатые и регрессирующие — белые, фиброзные), которые чаще выявляются в репродуктивном возрасте;
- узловой — аденома, локализованная между гладкомышечными волокнами и фиброзной тканью, как правило, выявляемая в связочном аппарате матки и ректовагинальной перегородке.
Многочисленные исследования указывают на особенности морфологической структуры различных локализаций эндометриоза:
- вариабельность соотношений эпителиального компонента и стромы очагов эндометриоза;
- несоответствие морфологической картины эндометрия и эндометриоидных поражений;
- митотическая (секреторная) активность эктопий эндометриоза, не коррелирующая с морфологической характеристикой эндометрия;
- полиморфизм железистого компонента очага эндометриоза (высокая частота обнаружения у одной и той же больной в эндометриоидных имплантатах эпителия, соответствующего разным формам менструального цикла);
- разнообразие васкуляризации стромы эндометриоидных гетеротопий.
Состав и количество стромы имеет определенное значение для циклических изменений эпителия в очагах эндометриоза. Пролиферация эпителия невозможна без стромальной составляющей. Именно в строме содержится программа эпителиальной цитодифференцировки и функциональной активности тканей. Достаточное количество стромы с преобладанием фибробластов и многочисленными сосудами способствует циклической перестройке железистого эпителия в эндометриоидных гетеротопиях. Очаги эндометриоза без признаков функциональной активности (уплощенный атрофичный эпителий) характеризуются незначительным содержанием стромального компонента и слабой васкуляризацией.
Следует помнить, что в 25 % случаев в очагах не находят эндометриальных желез и стромы и, напротив, в 25 % случаев морфологические признаки эндометриоза обнаруживают в образцах визуально не измененной брюшины. Окончательный диагноз аденомиоза также устанавливают путем патоморфологического исследования материала при обнаружении следующих признаков: наличие эндометриальных желез и стромы на расстоянии более 2,5 мм от базального слоя эндометрия; реакция миометрия в виде гиперплазии и гипертрофии мышечных волокон; увеличение желез и стромы, окружающей гиперплазированные гладкомышечные волокна матки; наличие пролиферативных и отсутствие секреторных изменений (Л.В. Адамян, 2003, 2007).
Лечение эндометриоза в последние годы стало наиболее широко дискутируемым аспектом этой проблемы (В.П. Прилепская, 2005; Л.В. Адамян, 2007). Бесспорное на сегодняшний день положение — невозможность ликвидации анатомического субстрата эндометриоза ни одним из воздействий, кроме хирургического, остальные методы лечения обеспечивают у ограниченного контингента больных снижение выраженности симптомов заболевания и восстановление функций различных звеньев репродуктивной системы. Однако хирургическое лечение не всегда целесообразно или приемлемо для больной. В качестве альтернативы можно рассматривать пробное (без верификации диагноза) медикаментозное лечение минимального и умеренного эндометриоза, а точнее, симптомов, предположительно обусловленных этим заболеванием. Такая терапия может быть предпринята лишь врачом, имеющим большой опыт лечения эндометриоза, при условии исключения объемных образований в брюшной полости, отсутствия других (негинекологических) возможных причин симптомов и только после тщательного обследования больной (М.Н. Дамиров, 2003).
Недопустимо медикаментозное лечение эндометриоидных кист яичников, которое хотя и приводит к уменьшению размеров образования и толщины его капсулы, но противоречит принципам онкологической настороженности. Несмотря на данные ряда авторов о достаточно высокой эффективности гормональной терапии в отношении болевого симптома, преимущества ее положительного воздействия на фертильность перед хирургическим уничтожением очагов не доказаны (сообщаемая частота наступления беременности составляет 30-60 % и 37-70 % соответственно), профилактическая ценность в отношении дальнейшего прогрессирования болезни сомнительна.
С другой стороны, в отсутствие однозначных статистических данных в пользу хирургического или медикаментозного лечения минимального/умеренного эндометриоза право выбора остается за пациенткой (Н.И. Волков, 2002). Предпочитают хирургическое удаление очагов, адекватность которого зависит от опыта и эрудиции хирурга. При случайно выявленном при лапароскопии эндометриозе нужно удалить очаги без травмирования репродуктивных органов. Визуально определяемые границы эндометриоидного очага не всегда соответствуют истинной степени распространения, что заставляет критически оценивать полноценность выполненного вмешательства. Инфильтративный ретроцервикальный эндометриоз удаляют лапароскопическим или комбинированным лапароскопическим — влагалищным доступом с одновременной резекцией пораженного участка стенки прямой кишки или в едином блоке с маткой. При эндометриоидных кистах принципиально важно полностью удалять капсулу кисты, как из соображений онкологической настороженности, так и для предотвращения рецидивов, частота которых после применения альтернативных методик (пункции, дренирование кисты, деструкция капсулы путем различных воздействий) достигает 20 %. При узловатой или очагово-кистозной форме аденомиоза возможно выполнение реконструктивно-пластических операций молодым пациенткам в объеме резекции миометрия, пораженного аденомиозом, с обязательным восстановлением дефекта, при этом больная должна быть предупреждена о высоком риске рецидивирования, обусловленном отсутствием четких границ между аденомиозным узлом и миометрием. Радикальным лечением аденомиоза можно считать лишь тотальную гистерэктомию. Допустимо динамическое наблюдение или неагрессивное симптоматическое лечение больных аденомиозом, а также глубоким инфильтративным эндометриозом после уточнения диагноза с помощью биопсии и гистологического исследования. Лекарственная терапия может стать компонентом лечения, на который ложится основная нагрузка при недостаточной эффективности оперативного лечения или отказе от него. Особая роль отводится нестероидным противовоспалительным препаратам (ингибиторы синтетаз простагландинов), а также гормональным или антигормональным препаратам, лечебный эффект которых основан на подавлении стероидогенеза в яичниках, создании гипоэстрогенного состояния или ановуляции. Это — гормональные контрацептивы, прогестагены, производные андрогенов, антигонадотропины, агонисты гонадотропин-рилизинг гормона (ГнРГ); в настоящее время проводятся испытания антагонистов ГнРГ и прогестагенов нового поколения. Препарат нужно подбирать строго индивидуально, с учетом побочных эффектов, по возможности начиная с наименее агрессивного (Ф.И. Давыдов, 2003; В.П. Прилепская, 2005). Обсуждается предоперационное назначение агонистов ГнРГ, сторонники которого обосновывают его целесообразность уменьшением размеров очагов эндометриоза, васкуляризации и инфильтративного компонента. В результате такого воздействия затрудняется радикальное удаление гетеротопий за счет маскировки мелких очагов, идентификация истинных границ поражения при инфильтративных формах, вылущивание склерозированной капсулы эндометриоидной кисты. Терапия агонистами ГнРГ показана в качестве первого этапа лечения симптомов эндометриоза нерепродуктивных органов в отсутствие облитерации.
При наличии облитерации методом выбора является операция с привлечением смежных специалистов и последующей гормональной терапией. Послеоперационное лечение агонистами ГнРГ целесообразно проводить при распространенном эндометриозе женщинам детородного возраста, у которых радикальное удаление очагов эндометриоза не было выполнено в интересах сохранения репродуктивного потенциала или в связи с опасностью ранения жизненно важных органов, а также пациенткам группы высокого риска рецидива или персистенции заболевания. При распространенном эндометриозе послеоперационную гормональную терапию следует сочетать с противовоспалительным и санаторно-курортным лечением, что способствует удлинению ремиссии болевого синдрома и снижению риска повторных операций.
Особое место среди вариантов гормонального лечения занимает заместительная гормональная терапия после радикальных операций, выполненных по поводу эндометриоза (гистерэктомия с удалением придатков или без него). Описана персистенция очагов эндометриоза с рецидивированием симптомов после радикального хирургического лечения. Принимая во внимание опасность как возможного рецидива, так и малигнизации остаточных очагов, эстрогены рекомендуется использовать в комбинации с прогестагенами.
Рецидивирование или персистенция эндометриоза после лечения — одна из наиболее дискутируемых проблем в современной гинекологии, обусловленная непредсказуемостью течения заболевания. Большинство авторов согласны с тем, что в отсутствие метода, обеспечивающего точную оценку адекватности выполненного вмешательства, удаление всего эндометриоидного субстрата не может быть гарантировано ни одной хирургической методикой и тем более медикаментозной терапией. С другой стороны, признавая роль системных нарушений в патогенезе эндометриоза, нельзя отрицать возможность появления эндометриоза de novo. Частота рецидивирования эндометриоза варьирует, по данным разных авторов, от 2 до 47 %. Наиболее высока частота рецидивирования (19-45 %) ретроцервикального эндометриоза, что связано как с трудностями определения истинных границ поражения при инфильтративных формах эндометриоза, так и с сознательным отказом от агрессивного подхода к удалению очагов, находящихся вблизи жизненно важных органов.
Таким образом, для эндометриоза характерны парадоксальные аспекты этиопатогенеза и клинические контрасты течения, не нашедшие пока объяснения. В самом деле, при доброкачественном характере заболевания возможно агрессивное течение с локальной инвазией, широким распространением и диссеминацией очагов; минимальный эндометриоз нередко сопровождается тяжелыми тазовыми болями, а эндометриоидные кисты больших размеров — бессимптомным течением; циклическое воздействие гормонов вызывает развитие эндометриоза, тогда как непрерывное их применение подавляет заболевание. Эти загадки стимулируют дальнейшее углубление и расширение как фундаментальных, так и клинических исследований по всем направлениям проблемы эндометриоза.
Эндометриоз — это загадочное заболевание, патогенез которого уже не одно десятилетие будоражит умы ученых всего мира. Однако каждое новое открытие в этой области, приподнимая очередную завесу, еще больше убеждает нас в том, что клинические проявления, которые мы наблюдаем в своей гинекологической практике (дисменорея, диспареуния, тазовые боли, бесплодие), — это лишь видимая верхушка огромного айсберга проблем, в основе которого — сложнейший комплекс нейрогуморальных, иммунных, эндокринных и, возможно, генетически детерминированных патологических изменений.
Термин «эндометриоз» древнегреческого происхождения: «энд» — внутри, «метро»— матка, «озис» — болезнь. Итак, эндометриоз — это заболевание, при котором клетки эндометрия, в норме выстилающие полость матки, обнаруживаются в других местах, сохраняя при этом свою функциональную активность.
История изучения эндометриоза как заболевания берет свое начало еще с XVII века [16, 20]:
- 1690 год — впервые были описаны симптомы эндометриоза немецким доктором DanielShroen, который обозначил их как «женское расстройство, связанное с половым созреванием»;
- 1885 год —von Recklinghausen впервые назвал это состояние эндометриозом, а Carl von Rokitansky (чешский патологоанатом) впервые дал детальную патогистологическую картину этого состояния и описал эндометриоз яичников;
- 1896 год —Thomas Cullenо писал аденомиому крестцово-маточных связок; в 1919 году он же описал аденомиому ректовагинального пространства (ретроцервикальный эндометриоз);
- 1921 год —John Albertson Sampson описал эндометриоидную кисту яичника и назвал ее «шоколадной кистой», а также указал на возможность ее малигнизации в последующем; он же предложил теорию ретроградной менструации и ключевые аспекты патогенеза эндометриоза.
Среди множества существующих теорий возникновения эндометриоза сегодня по-прежнему серьезно воспринимаются и обсуждаются три основных [1, 2, 20]:
- метапластическая теория (предполагающая трансформацию мезотелия брюшины в эндометриоидную ткань под воздействием различных факторов);
- дизонтогенетическая теория (объясняющая развитие эндометриоидных очагов из аномальных эмбриональных зачатков);
- транслокационная (имплантационная) теория Сэмпсона, или, иными словами, теория ретроградной менструации, сущность которой заключается в том, что элементы эндометрия заносятся в другие ткани половых органов и имплантируются, образуя эндометриоидную гетеротопию.
Имплантационная теория возникновения эндометриоза получила наибольшее распространение. В соответствии с ней занос частиц эндометрия различными путями в полость малого таза считается критическим моментом развития эндометриоза. Одними из очевидных вариантов такого заноса являются хирургические манипуляции, связанные со вскрытием полости матки и хирургической травмой эндометрия.
Значительный интерес представляет возможность метастазирования эндометриоза по кровеносным и лимфатическим сосудам. Такой тип диссеминации частиц эндометрия считают одной из важнейших причин возникновения известных вариантов экстрагенитального эндометриоза, таких как эндометриоз легких, кожи, мышц и др. Критическим недочетом этой теории является отсутствие доказательств жизнеспособности десквамированного менструального эндометрия и его способности к эктопической имплантации. Сегодня уже известно о том, что ретроградная менструация встречается практически у каждой нормальной женщины, но только у 10 % из них развивается эндометриоз. По всей видимости, в норме участки эндометрия, попавшие в брюшную полость, лизируются макрофагами, опознающими инородную ткань путем хемотаксиса. В противоположность этому в случаях развития эндометриоза макрофаги полноценно не выполняют свою функцию. В настоящее время достаточно трудно ответить на вопросы: почему эндометриоз развивается у одних женщин и не встречается у других? Почему заболевание по-разному проявляется? Почему тяжелые формы встречаются только у некоторых женщин и почему прослеживается такая слабая корреляционная связь между степенью распространенности заболевания, его типом и тяжестью симптомов?
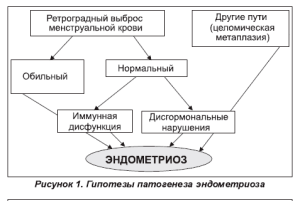
Существующие гипотезы патогенеза эндометриоза предполагают его формирование и развитие на фоне нарушенных иммунных, молекулярно-генетических и гормональных взаимоотношений в женском организме (рис. 1). Согласно современным представлениям о природе эндометриоза, в качестве ключевых звеньев его патогенеза рассматриваются следующие этапные процессы:
- прикрепление эндометриальных клеток к мезотелиальным клеткам;
- внедрение эндометриальных клеток в мезотелий;
- ангиогенез в эндометриоидных имплантантах;
- пролиферация эктопических эндометриальных клеток;
- вовлечение воспалительных клеток, которые поддерживают развитие имплантантов [3-6, 8, 16, 21].
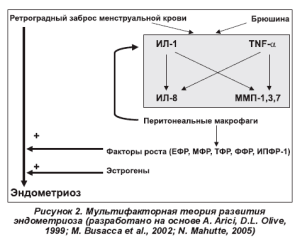
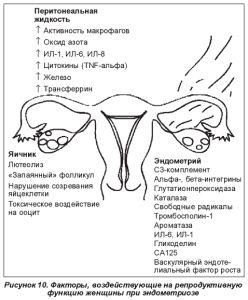
В настоящее время большинство авторов пришли к единому мнению о мультифакторной теории развития эндометриоза, в контексте которой важнейшая роль принадлежит перитонеальной жидкости (рис. 2) [5]. Из всех компонентов перитонеальной жидкости наибольшее внимание привлекают к себе перитонеальные макрофаги, продуцирующие факторы роста, цитокины и влияющие на брюшину через систему матричных металлопротеиназ (ММП), регулируя процесс эктопического внедрения ткани эндометрия и развития эндометриоза [20].
Многими исследованиями показано, что у женщин с эндометриозом в перитонеальной жидкости нарушен баланс клеток, обеспечивающих локальную резистентность брюшины [5, 15, 20]. Так, отмечается снижение уровня естественных киллеров, повышение содержания интерлейкинов-1, 6, 8 (ИЛ-1, ИЛ-6, ИЛ-8), обеспечивающих активацию ангиогенеза, а также повышение уровня фактора некроза опухоли альфа (TNF-a), который усиливает адгезию стромальных клеток эндометриоидных гетеротопий на мезотелий, тем самым инициируя имплантацию элементов эндометрия, попавших в брюшную полость [7, 11].
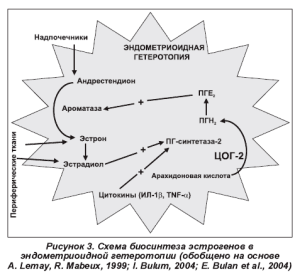
Данные литературы свидетельствуют также о зависимости развития эндометриоидных структур от гормонального статуса. У больных эндометриозом возникают хаотические пиковые выбросы ФСГ и ЛГ, наблюдается снижение базального уровня прогестерона, у многих также выявлены гиперпролактинемия и нарушение андрогенпродуцирующей функции коры надпочечников. Во многих исследованиях подчеркивается важная роль синдрома «неовулировавшего фолликула» и соответственно относительной гиперэстрогении в патогенезе эндометриоза [1, 2, 9, 20]. При этом невероятно интересной, на наш взгляд, представляется способность эндометриоидной гетеротопии синтезировать эстрогены (рис. 3), что в определенной степени объясняет рецидивирующий характер течения заболевания.
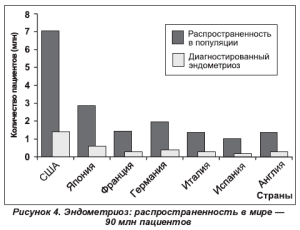
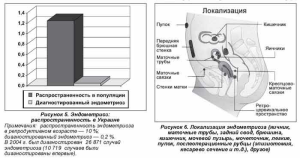
Безусловно, эндометриоз — это вызов современной науке. Он до сих пор остается загадкой, несмотря на возрастающее количество публикаций (более 500 в год). Точная распространенность эндометриоза неизвестна. По данным разных авторов [1, 2, 6, 20], он встречается в среднем у 15-50 % женщин репродуктивного возраста. Отсутствие четких данных об истинной частоте эндометриоза объясняется бессимптомным течением заболевания у 12-22 % женщин и, соответственно, трудностями диагностики (рис. 4, 5).
Диагностика эндометриоза требует достаточно высокой квалификации врача и соблюдения определенных этапов.
Этапы диагностики эндометриоза включают:
- клинический осмотр, при котором необходимо обращать внимание на болезненность заднего свода, латеропозицию или ретрофлексию матки, боль при смещении матки и придатков;
- трансвагинальное УЗИ — пожалуй, единственная из широкодоступных неинвазивных методик;
- гистеросальпингографию, которая может быть информативна лишь при глубоком проникновении очагов в миометрий;
- МРТ, что особенно информативно в диагностике аденомиоза и кист;
- определение онкомаркера СА125;
- гистероскопию с гистологическим исследованием тканей;
- лапароскопию с гистологическим исследованием тканей.
При этом необходимо помнить, что единственным методом абсолютной верификации диагноза является гистологическое исследование тканей.
Типичными симптомами эндометриоза принято считать дисменорею, диспареунию, бесплодие, тазовые боли, нарушения менструального цикла, наличие объемных образований в малом тазу, а также кишечные и урологические расстройства, связанные с циклом. Некоторыми исследованиями отмечены атипичные симптомы эндометриоза: циклические боли в ногах, боли в ягодицах, гематурия, обструкция уретры, асцит, пневмоторакс, боли в грудной клетке, циклические головные боли и кожные проявления [1, 8, 23].
Иногда дифференциальная диагностика эндометриоза представляется достаточно сложной. Так, кровотечения следует дифференцировать с дисплазией шейки
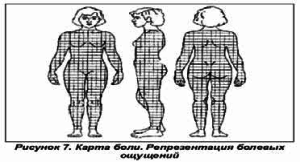
матки, полипами эндоцервикса, эндоцервицитами, дисфункциональными маточными кровотечениями, злкачественными новообразованиями шейки и тела матки, гиперпластическими процессами эндометрия и фибромой матки. Кишечные симптомы — с заболеваниями желудочно-кишечного тракта, геморроем, парапроктитом. Диспареунию — с хроническим кольпитом, краурозом, лейкоплакией вульвы, нейрогенным мочевым пузырем. Болевой синдром является, пожалуй, наиболее частым проявлением эндометриоидной болезни, а поскольку локализация эндометриоидных гетеротопий может быть разной (рис. 6), то и иррадиация тазовой боли у женщин с эндометриозом также может существенно различаться (табл. 1)

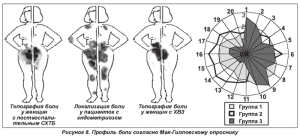
Дифференциальная диагностика тазовой боли при эндометриозе сложна. Она предполагает исключение у женщины поствоспалительного синдрома хронической тазовой боли (СХТБ) или просто хронического воспалительного заболевания органов малого таза (ХВЗ). В этих случаях рационально использование карты боли, на которой женщина указывает локализацию своих болевых ощущений (рис. 7) При этом обращают на себя внимание полиморфность болевых ощущений и размах их иррадиации у женщин с эндометриозом, которые к тому же достаточно красочно и драматично характеризуют свои ощущения (рис. 8).
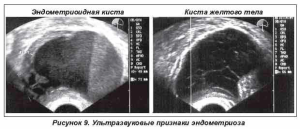
Дифференциальный диагноз объемных образований, имеющих сходную эхографическую картину (по данным УЗИ), следует проводить с гематомой желтого тела (рис. 9), туберкулезным абсцессом яичника, доброкачественной зрелой тератомой (дермоидом), муцинозной цистаденомой, гранулезно-клеточной карциномой.
Достаточно сложной остается диагностика аденомиоза, ибо в этих случаях практически невозможно получить гистологическое подтверждение диагноза без нарушения целостности органа. При этом используют критерии как УЗИ, так и МРТ [10].
Диагноз аденомиоза устанавливается при наличии не менее трех из представленных ниже УЗ-критериев:
- наличие кист в миометрии;
- асимметричное утолщение миометрия;
- увеличение матки;
- шаровидная форма матки;
- маленькие эхогенные узлы миометрия без четких контуров;
- боль во время УЗИ матки;
- линейная исчерченность миометрия;
- нечеткие границы соединительной зоны эндои миометрия.
В последние десятилетия большие надежды в диагностике аденомиоза возлагаются на МРТ. Диагностика основана на высокоразрешающей способности этого метода в выявлении нарушений структуры различных тканей.
В качестве МРТ-критериев аденомиоза принято рассматривать:
- диффузное или локальное уплощение соединительной зоны (зоны соединения эндои миометрия):
а)3 12 мм — симптом аденомиоза;
б)£ 8 мм — исключение аденомиоза;
в) при 8-12 мм необходимо учитывать другие критерии;
- нечеткая граница соединительной зоны;
- наличие высоких фокусных сигналов Т2 и Т1 участков (кисты);
- линейная исчерченность [12, 13].
Адекватная диагностика аденомиоза черезвычайно важна у пациенток со стертой клинической симптоматикой, в случаях, когда, пожалуй, единственным проявлением заболевания является бесплодие. Согласно ВОЗ, причины бесплодия в процентном соотношении распределяются следующим образом: эндокринные факторы — в 15-30 %, эндометриоз — в 20-30 %, трубноперитонеальный фактор — в 40-50 %, мужской фактор — в 20-40 %, бесплодие неясного генеза — в 5-10 % случаев. Такой высокий удельный вес эндометриоза в структуре бесплодия объясняется тем, что у данного контингента пациенток активизируется комплекс эндометриально-яичниково-перитонеальных механизмов, приводящих к развитию различных форм бесплодия (рис. 10) [17]. Эти механизмы лежат в основе частых неудачных попыток ЭКО у пациенток с эндометриозом. При этом предполагаемыми причинами, их объясняющими, могут быть наличие спаечного процесса, что затрудняет лапароскопический доступ к яичникам; эмбриотоксический эффект перитонеальной жидкости; повышенная экспрессия перитонеальных цитокинов; сниженный потенциал ооцитов; сниженная экспрессия гена васкулярно-эндотелиального фактора роста, повышение апоптоза фолликула, снижение экспрессии эндометриальных avb3-интегринов и синтетазы оксида азота в эндометрии, имеющих важное значение в процессе имплантации оплодотворенной яйцеклетки.
Сложнейший клубок патологических механизмов, разных у каждой женщины приводит к одной огромной проблеме, имя которой — эндометриоз.
Как избежать подобной участи? Каковы «риски» и «антириски»? Где та жизненная тропа, по которой безопасно пройти женщине, не рискуя свалиться в «болото эндометриоза»?
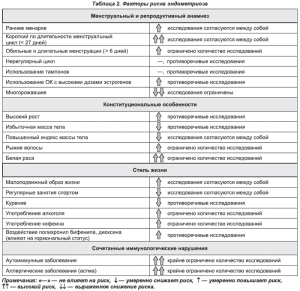
Эти загадки будоражат умы ученых не одно десятилетие. Итог не столь утешителен, как хотелось бы. Вопросов больше, чем ответов (табл. 2). Мнения ученых согласуются лишь по некоторым позициям, которые можно определить как факторы риска: раннее менархе, короткий менструальный цикл, малоподвижный образ жизни и принадлежность к белой расе. Существуют также убедительные данные о том, что регулярные занятия спортом и повышенный индекс массы тела снижают риск развития данной патологии.
Однако есть общее мнение, и оно доказано сотнями публикаций: гиперэстрогения лежит в основе развития эндометриоза и повышает риск его возникновения [3, 20, 23]. Следовательно, риск заболевания высок у женщин с синдромом относительной эстрогенной доминантности, который клинически характеризуется артериальной гипертензией, отеками, повышенной свертываемостью крови, гиноидным ожирением, аутоиммунным тиреоидитом с гипотиреозом, мастодинией, гиперпролиферацией эндометрия и эпителия протоков молочных желез, мигренью, бронхоспазмом.
Также высок риск у женщин с симптомами прогестероновой недостаточности, у которых выявляются немотивированная прибавка массы тела, слабость, снижение либидо, депрессивные состояния, головные боли, боли в суставах, эмоциональная лабильность.
Такому контингенту женщин следует избегать внешних факторов, усугубляющих эстрогенное влияние, к которым относятся:
1) натуральные эстрогены (мясные продукты);
2) синтетические эстрогены (диэтилстилбестрол и др., входящие в состав корма домашнего скота);
3) промышленные продукты;
- пестициды (дихлорид трихлорэтан (ДДТ) и метоксихлор);
- химикаты, применяемые в производстве пластмассы (бифенол А);
- микоэстрогены (вырабатываются грибковой плесенью, содержатся в проросших злаках и продуктах, из них приготовленных);
4) натуральные эстрогены растительного происхождения (фитоэстрогены):
- изофлавоноиды (соя и ее продукты);
- флавоноиды (фрукты и овощи);
- коуместаны (проросшие бобы);
- лигнаны (льняное масло).
Если можно — предупредить! А если уже нельзя?..
Длительное время хирургическое вмешательство являлось единственным видом лечения эндометриоза. И сегодня хирургический метод в комплексном лечении больных эндометриозом остается единственным способом радикальной ликвидации его очагов. На наш взгляд, мнение некоторых клиницистов, приуменьшающих значение хирургических вмешательств в связи с появлением новых терапевтических препаратов, является несостоятельным. Это объясняется тем, что ткань эндометриоидных гетеротопий является постоянным раздражителем для сенсибилизированных базофильных лейкоцитов, в результате чего образуется порочный круг, приводящий к увеличению вероятности распространения очагов эндометриоза. Поэтому в настоящее время признано, что полное хирургическое удаление или уничтожение эндометриоидных гетеротопий патогенетически обоснованно и весьма желательно. Невзирая на использование высокотехнологичных малоинвазивных хирургических методик, актуальность проблемы хирургического лечения эндометриоза не снижается. Сегодня нет такой операции, которая обеспечивала бы полное удаление эндометриоидных очагов, абсолютное отсутствие рецидивов заболевания, ликвидацию болевого синдрома и была бы лишена осложнений.
В связи с этим наряду с хирургическим лечением необходимо лечебное воздействие, направленное на пре
кращение поступления жизнеспособных клеток эндометрия в брюшную полость, а также на восстановление гормонального и иммунного статуса.
Смягчить, подавить, выключить эстрогенное влияние на эутопический и гетеротопический эндометрий — один из путей гормонального лечения эндометриоза.
Особо важное место занимает своевременно назначенное консервативное лечение аденомиоза как возможной причины бесплодия, учитывая вышеизложенный комплекс факторов, неблагоприятно воздействующих на процесс созревания яйцеклетки, на ее оплодотворение и имплантацию оплодотворенной яйцеклетки в эндометрий при эндометриозе.
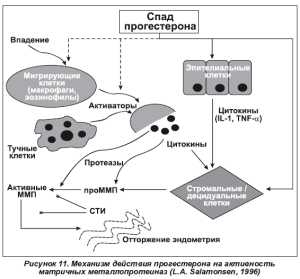
С этой точки зрения вполне обоснованным является назначение как прогестерона, так и его синтетических аналогов. Подавление прогестероном митотической активности клеток эндометрия, по данным различных авторов, достигается за счет снижения активности эстрогенных рецепторов на ядерной мембране, увеличения продукции эстрадиолконвертирующих энзимов, угнетения инкорпорации тимидина клетками эндои миометрия и снижения их чувствительности к эстрогенам и андрогенам, воздействия на факторы роста и цитокины эндометрия, а также угнетения матричных металлопротеиназ — ферментов, обеспечивающих процессы ремоделирования в тканях с физиологическим отторжением [14, 22, 23].
Поскольку увеличение воспалительных цитокинов (ИЛ-1) при эндометриозе стимулирует активность ММП, обеспечивая репарацию и рост эндометрия, а повышенный уровень ИЛ-1 в эндометрии активирует ММП и снижает чувствительность к гестагенам, воздействие прогестерона на ММП является чрезвычайно важным [18, 19]. Прогестагены не только угнетают ММП прямым и непрямым действием и предотвращают эктопическую имплантацию эндометриальной ткани, но и обеспечивают стромальную супрессию эндометрия и уменьшают локальную гиперэстрогенемию (рис. 11).
На сегодня арсенал гестагенных препаратов достаточно широк, что обеспечивает возможность индивидуального подхода в выборе препарата, минимизируя возможные побочные эффекты. При этом в качестве лечения бесплодия у женщин с эндометриозом, а также на этапе прегравидарной подготовки у данного контингента пациенток предпочтительнее всего, на наш взгляд, использовать препарат, максимально приближенный по своим свойствам к прогестерону, однако обладающий более выраженным гестагенным действием.
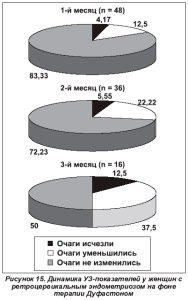
В нашей практике мы широко применяем дидрогестерон, обладающий хорошей переносимостью, выраженным супрессорным действием на гетеротопический эндометрий при отсутствии значительных побочных эффектов (он не влияет на концентрацию факторов свертывания крови и агрегацию тромбоцитов в отличие от некоторых других гестагенных препаратов). Предполагается, что дидрогестерон может влиять на взаимодействие между клетками эндометрия и брюшины в момент имплантации или на более поздних этапах развития эндометриоза. Препарат вызывает атрофию эктопических очагов и ингибирует развитие новых зон эндометриоза, при этом он не приводит к атрофии и не нарушает активность нормального эндометрия в полости матки. В последние годы большинство пациенток с эндометриозом — женщины репродуктивного возраста, заинтересованные в реабилитации репродуктивной функции. Учитывая то, что дидрогестерон не подавляет овуляцию, он особенно показан пациенткам с бесплодием, обусловленным эндометриозом. По данным разных авторов [3, 9, 20], наблюдается полное или частичное исчезновение симптомов заболевания в 71 % случаев. Это совпадает и с результатами нашей клинической практики. Так, при назначении дидрогестерона 120 женщинам с аденомиозом по 30 мг в сутки с 5-го по 25?й день цикла у всех пациенток наблюдалось достоверное снижение степени выраженности альгодисменореи уже через 3 месяца лечения с 14,5 ± 3,1 до 4,0 ± 1,4 балла по среднему числу избранных дескрипторов согласно Мак-Гилловскому опроснику (рис. 12). Кроме того, достоверно уменьшалась средняя длительность менструального кровотечения с 10,7 ± 1,8 дня до 4,8 ± 0,8 дня через 3 месяца (рис. 13). Достаточно высокая клиническая эффективность наблюдалась нами также при применении дидрогестерона у 74 пациенток с ретроцервикальным эндометриозом в аналогичном режиме. Так, среднее число избранных дескрипторов боли по опроснику Мак-Гилла уменьшалось с 16,8 ± 2,4 до 8,4 ± 1,1 балла через 3 месяца приема препарата (р < 0,05) (рис. 14). Положительная клиническая динамика подтверждалась также и результатами УЗИ: уменьшение количества и размеров очагов спустя 3 месяца применения Дуфастона (рис. 15).
В назначении гормональной терапии в большей степени также нуждаются многие пациентки с полисистемными проявлениями заболевания и в послеоперационном периоде при невозможности радикального удаления эндометриоидных гетеротопий. В настоящее время гормональное лечение больных эндометриозом базируется на применении гормономодулирующих препаратов, включая, помимо гестагенов, оральные контрацептивы, антигонадотропины, агонисты Гн-РГ, при этом арсенал гормональных препаратов с каждым годом расширяется.
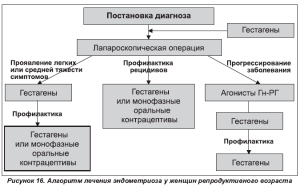
Таким образом, основополагающим принципом терапии больных с эндометриоидной болезнью является адекватное хирургическое вмешательство с соответствующей гормональной и иммуномодулирующей терапией, направленной на угнетение эндометриоидных очагов и профилактику рецидивов при распространенных формах эндометриоза (рис. 16).
Эндометриоз по-прежнему остается загадкой… Пытливый ум исследователя не удовлетворяют в полной мере ответы на множество вопросов, генерируемых этой масштабной задачей.
Необходимо выделить наиболее перспективные направления в решении проблемы эндометриоидной болезни:
- дальнейшие изыскания в области генетики, эндокринологии, иммунологии и морфологии эндометриоза, которые бы позволили углубиться в патогенез заболевания и кардинально обосновать новые подходы к диагностике, лечению и мониторингу эндометриоидной болезни;
- разработка новых технологических решений и хирургического лечения распространенных форм эндометриоза с использованием различных видов энергии, что обеспечивало бы минимальную травматичность и максимальную точность в применении, в частности, у больных с распространенными формами эндометриоза и вовлечением в процесс смежных органов малого таза и брюшной полости;
- дальнейший поиск оптимальных хирургических и консервативных методов лечения аденомиоза;
- изучение патогенеза и разработка методов лечения тазовых болей при эндометриозе;
- углубление исследований по проблеме перитонеального эндометриоза и бесплодия;
- изучение механизмов онкотрансформации эндометриоидных гетеротопий и разработка методов ее предупреждения.









Комментировать