Синдром диабетической стопы в клинической практике. Факторы риска развития. Патогенез, диагностика. Принципы лечения.
Оболенский В.Н., Семенова Т.В., Леваль П.Ш., Плотников А.А.
Определение
На симпозиуме ВОЗ «Сахарный диабет» (Женева, 1987) синдром диабетической стопы (СДС) был определен как патологическое состояние стопы при сахарном диабете (СД), возникающее на фоне патологии периферических нервов и сосудов, характеризующееся поражением кожи и мягких тканей, костей и суставов, проявляющееся в виде трофических язв, костно–суставных изменений и гнойно–некротических процессов [1].
В Международном соглашении по диабетической стопе (2000) было принято определение СДС как комплекса анатомо–функциональных изменений стопы у больного СД, связанного с диабетической нейропатией, ангиопатией, остеоартропатией, на фоне которых развиваются гнойно–некротические процессы [2].
Подход к лечению больных с СДС должен быть мультидисциплинарным и объединять специалистов различных профилей: эндокринолог (диабетолог), хирург (сосудистая и гнойная хирургия), ортопед (подиатр), психолог, терапевт, анестезиолог–реаниматолог, а также подготовленный средний медицинский персонал.
Классификация
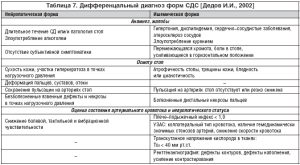
С 1991 г. ВОЗ было принято выделение нейропатической (без остеоартропатии и с остеоартропатией), ишемической и нейроишемической форм СДС [1].
В последнее время, по данным ряда авторов, ишемическую форму как отдельную не выделяют, относя ее к нейроишемической, мотивируя тем, что у больных СД в той или иной степени есть поражение периферической нервной системы [3–5]. Кроме того, как отдельную выделяют нейроостеоартропатическую форму [5].
По степени выраженности поражения тканей стопы при СДС наиболее широко используется классификация Wagner F.W. (1979) (табл. 1)[6].
Многие авторы считают недостатком классификации Вагнера отсутствие учета в ней различных вариантов сочетания факторов глубины поражения тканей, наличия инфекции и ишемии.
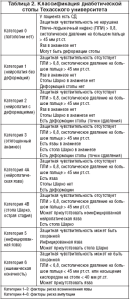
Предпочтительнее выглядит классификация Техаского университета, которая впервые была опубликована Lavaery L.A., Armstrong D.G., Harkless L.B. в журнале Foot Ankle Surg. 35, с. 528–531, в 1996 г. (табл. 2 и 3) [7,8]. Классификация состоит из двух частей:
– классификация диабетической стопы, которая оценивает риск возникновения язвы и риск ампутации;
– классификация диабетических язв, которая учитывает степень (по горизонтали) и стадию (по вертикали) язвенного дефекта.
Степень 0 – отсутствие язвенного дефекта, I – поверхностное поражение мягких тканей, II – язва, распространяющаяся до сухожилия или суставной сумки, III – язва, распространяющаяся до кости или сустава; стадия A – поражение без инфекции и ишемии, B – поражение с инфекцией, C – с ишемией, D – с инфекцией и с ишемией. Риск ампутации при I степени возрастает по стадиям A < C < B < D, при II–III степени A < В < С < D. Прогноз первичной эпителизации язвы ухудшается по стадиям A > C > B > D [8].
В 2000 г. Jeffcoat W.J., Macfarlane R.M., Treece K. (Великобритания) предложили новую систему классификации диабетических язв S(AD)SAD, основанную на пяти основных клинических признаках: объем – size (область и глубина), сепсис (sepsis), артериопатия и денервация, где каждый из признаков градируется от 0 до 3, используя количественные и качественные критерии [7]. Однако S(AD)SAD не получила пока широкого распространения.
Классификация PEDIS язвенных дефектов у больных с СДС представлена в таблице 4 [9].
Классификация диабетической остеоартропатии:
Стадия 1 – наличие отека стопы, гипертермия и гиперемия.
Стадия 2 – формирование деформации стопы; рентгенологически определяются костные изменения в виде остеопороза, костной деструкции, фрагментации костных структур.
Стадия 3 – выраженная деформация стопы, спонтанные переломы и вывихи.
Стадия 4 – образование язвенных дефектов, при инфицировании возможно быстрое развитие гангрены.
Для удобства клиницистов в 2004 г. было предложено ведение медицинской документации пациентов с хроническими раневыми дефектами по системе MEASURE, включающей в себя ключевые параметры, используемые при оценке и лечении таких ран: М (Measure) – измерение раны (длина, ширина, глубина и площадь), Е (Exudate) – экссудат (количество и качество), A (Appearance) – внешний вид (раневое ложе, тип ткани и количество), S (Suffering) – болевой синдром (характер и интенсивность боли), U (Undermining) – деструкция (наличие или отсутствие), R (Reevaluate) – наблюдение (регулярный контроль всех параметров), Е (Edge) – край (состояние краев раны и окружающей кожи) [11,12]. Данная система предназначена для стандартизации терминологии и определения последовательности подходов к клинической оценке раны.
Факторы риска развития СДС
Ведущие факторы риска диабетической язвы стоп: нейропатия, поражение периферических сосудов (периферический атеросклероз сосудов нижних конечностей – склероз Менкеберга), деформация стоп c формированием зон высокого давления; предшествующие язвы, длительный стаж диабета, курение, высокий уровень гликозилированного гемоглобина, недостаток обучения, снижение остроты зрения, неадекватная обувь, пожилой возраст [10].
Факторы риска развития СДС, по мнению ведущих специалистов [13], в настоящее время выглядят следующим образом:
– периферическая сенсомоторная и автономная нейропатия;
– хроническая артериальная недостаточность нижних конечностей;
– деформации стоп;
– предшествующие язвы и/или ампутации;
– травма;
– неправильно подобранная обувь;
– социально–психологические факторы;
– расовая принадлежность.
Факторы, предрасполагающие к язвообразованию у больных диабетом, можно представить следующим образом:
а) факторы, снижающие сопротивляемость тканей травме:
– патология крупных сосудов: атеросклероз, мужской пол, курение;
– патология мелких сосудов;
– автономная нейропатия;
б) факторы, увеличивающие вероятность травмы:
– моторная нейропатия;
– сенсорная нейропатия;
– ограничение подвижности суставов;
– другие осложнения диабета, включая нарушение остроты зрения;
– осложнения, связанные с возрастом:
шаткость походки, малоподвижность.
Эпидемиология
По данным Международной диабетической федерации, в настоящее время в мире насчитывается 4,9 млн больных СД 1–го типа и ожидается увеличение до 5,3 млн к 2011 г., в то время как количество больных СД 2–го типа в мире 151 млн, а к 2011 г. ожидается 213 млн [14].
Развитие гнойно–некротических процессов на фоне СДС в 50–75% случаев приводит к ампутации. Частота ампутаций у больных СД, по различным источникам, в 17–45 раз выше, чем у лиц, не страдающих СД; до 30% пациентов после первой ампутации подвергаются ампутации второй конечности в течение ближайших 3 лет, и до50% – в течение 5 лет.
Патогенез
В качестве факторов патогенеза развития диабетической нейропатии рассматривают хроническую недостаточность инсулина и гипергликемию (частота нейропатии при 1–м и 2–м типах СД одинакова); накопление сорбитола (сорбитол, накапливаясь в шванновских клетках периферических нервов, вызывают их дегенерацию, сегментарную демиелинизацию, аксонопатию); неферментное гликирование белков (приводящее к структурным и химическим изменениям в нерве и нарушающее его нормальную функцию); снижение активности антиоксидантов (глутатиона, супероксиддисмутазы, витаминов Е и С), приводящее к повышению уровня свободных радикалов; недостаток витаминов группы В, являющихся активными участниками цикла Кребса (нарушение метаболизма глюкозы в нервной ткани, увеличение уровня свободных радикалов и продуктов перекисного окисления липидов); снижение миоинозитола–субстрата синтеза фосфатидилинозитола–эндогенного регулятора почечной микросомальной Na–Ka АТФазы (в норме в периферическом нерве поддерживается 90–100–кратный градиент концентрации миоинозитола, а у пациентов с СД градиент концентрации миоинозитола снижается почти в 2 раза). Микроангиопатия сосудов, в том числе vasa nervorum, является основной причиной невропатии у пациентов с СД – отмечается характерное утолщение эндотелия эндоневральных сосудов, более выраженное, чем в капилярах кожи, мышц, в эпи– и периневральных сосудах.
Диабетическая нейропатия (ДН) – это симптомокомлекс, вызванный дегенерацией периферических и автономных нервов у больных СД [13]. При тщательном обследовании больных СД нейропатия выявляется в 100% случаев. Два механизма лежат в основе развития ДН – метаболические и сосудистые нарушения.
Диабетическую нейропатию подразделяют на автономную, сенсорную (острую и хроническую) и моторную; по морфологическому типу – аксональный тип, демиелинизированный тип, смешанный тип.
Раневой процесс при демиелинизированном типе протекает с непрерывным формированием вторичных некрозов, осложняется контактным остеомиелитом костей стопы; при смешанном типе течение раневого процесса несколько благоприятнее, при аксональном типе переход раневого процесса из I во II фазу происходит почти в 2 раза быстрее, однако регенерация протекает значительно медленнее.
Автономная (вегетативная) нейропатия (вегетативный дисбаланс, аутосимпатэктомия) – облигатное осложнение СД, влияет на возникновение и прогрессирование СДС; она приводит к нарушению регуляции микроциркуляторной вазодилатации, распределения кровотока и его ауторегуляции. Возрастает кровоток через артериовенозные шунты в коже и костной ткани, что приводит к усилению резорбции кости и развитию остеоартропатии; происходит обызвествление медии артерий, чаще на голени и стопе (склероз Менкенберга), нарастают нейропатические отеки, уменьшается потоотделение, что приводит к сухости кожи, образованию гиперкератоза, трещин и мозолей.
Острая сенсорная нейропатия наиболее часто встречается после метаболических нарушений, сопровождающихся кетоацидозом; появляются внезапные парестезии и гиперстезии, потеря тактильной чувствительности. Хроническая сенсорная нейропатия характеризуется нарушением всех видов чувствительности: температурной, болевой, вибрационной. При потере чувствительности наиболее высок риск безболезненной травмы (механической, термической, химической).
Моторная нейропатия способствует развитию паралича мышц стопы, что приводит к деформации стопы и нарушению походки. Вследствие этого возникают зоны повышенного давления (например, в области плюснефаланговых суставов), что способствует формированию мозолей и язв в этой области.
Диабетическая остеоартропатия, развивающаяся вследствие дегенеративных изменений костных структур и связочного аппарата, приводит к развитию остеопороза, остеолиза, гиперостоза, формированию деформаций стопы (в т.ч. молоткообразных пальцев, Hallus valgus, «сустава или стопы Шарко»), появлению зон повышенного плантарного давления, что также способствует образованию язв.
Диабетическая ангиопатия делится на макроангиопатию (артерии) и микроангиопатию (капилляры и артериолы). Макроангиопатия обусловлена атеросклерозом, кальцифицирующим склерозом Менкенберга и диффузным фиброзом интимы. Антитромбогенная активность эндотелия стенки сосуда достоверно ниже при наличии диабетической нейропатии. Снижение перфузионного давления в микрососудистом русле на фоне поражения как магистральных артерий, так и капилляров приводит к развитию комплекса патологических изменений и в итоге к некротическим изменениям мягких тканей.
Пусковым механизмом развития осложненных форм СДС чаще всего является микротравма – случайные повреждения при ходьбе босиком, неправильно подобранная обувь или индивидуальные особенности ходьбы, приводящие к потертостям или сдавлениям, повреждения мягких тканей при обработке ногтей, незамеченные ожоги (чаще от бытовых приборов и батарей).
Диабетические язвы стоп характеризуются хроническим течением в связи с рядом проблем, нарушающих процесс заживления. Во– первых, вызванная автономной нейропатией микроциркуляторная дисфункция сопровождается перераспределением кровотока с преобладанием артериовенозного сброса и обеднением нутритивного капиллярного звена кожи. Внутрикапиллярная гипертензия вызывает развитие тканевого отека, увеличение межкапиллярного расстояния и развитие гипоксии тканей. Сенсорная нейропатия способствует нарушению всех защитных сенсорных реакций, в том числе и снижению степени ухода за раной со стороны самого больного. Во–вторых, нарушенное заживление ран при диабете связано с комплексом нарушений местных воспалительных и иммунных реакций: снижением образования тромбоцитами ростовых факторов, развитием изменений внеклеточного матрикса, снижением функции капилляров и нейтрофильных лейкоцитов. Значительное влияние на скорость заживления оказывает местная оксигенация кожи – результат влияния ишемии и инфекции, основных прогностических факторов исхода лечения. Дополнительным фактором, оказывающим принципиальное влияние на скорость заживления и частоту рецидивов, является механический стресс в условиях снижения чувствительности и перераспределения давления на стопе. Таким образом, заживление диабетических поражений стоп происходит в крайне «неблагоприятных» условиях, и поэтому ведение диабетических ран на стопе должно максимально приближать условия заживления к физиологическим [17].
Возникновение и развитие гнойно– некротических форм СДС схематично можно представить так: факторы риска – образование язв, ишемия – гангрена – ампутация.
Диагностика
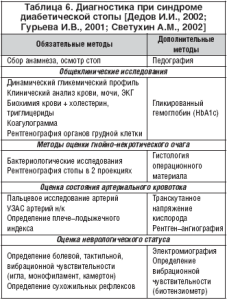
Диагностика при СДС включает в себя сбор анамнеза (длительность СД, длительность гипергликемии, характер лекарственной терапии, наличие в анамнезе язв на стопах и хирургических вмещательств, сердечно–сосудистых заболеваний, артериальной гипертонии, дислипидемии, нефропатии и ретинопатии, условия жизни, злоупотребление алкоголем и курением, характер обуви), осмотр стоп, оценку неврологического статуса, состояния артериального кровотока и опорно–двигательного аппарата, лабораторную и инструментальную диагностику, измерение распределения плантарного давления.
Лабораторная диагностика – определение уровня гликемии, уровня гликированного гемоглобина (HbA1c), наличия глюкозы и кетоновых тел в моче, уровня холестерина, триглицеридов, фибриногена, АЧТВ и ТВ, оценка состояния системы ПОЛ–АОЗ. При наличии раневого дефекта– бактериологические исследования, гистологические исследования операционного материала.
Диагностика нейропатии – оценка жалоб по шкалам TSS и NSS (показатели нейропатического симптоматического счета), исследование болевой, тактильной, вибрационной и температурной чувствительности (укол тупой иглой на тыльной поверхности большого пальца стопы, монофиламент 10 г, градуированный камертон, биотезиометрия), их оценка по шкале NDS (показатели нейропатического дисфункционального счета), оценка сухожильных рефлексов, электромиография. Исследование вегетативного дисбаланса – холтеровское мониторирование ритма сердца и суточный мониторинг АД.
Оценка кровотока и микроциркуляции – пальцевое исследование артерий, определение плече–лодыжечного индекса, ультразвуковая доплерография (УЗДГ) и сегментарная доплероманометрия, ультразвуковое ангиосканирование (УЗАС), транскутанная оксиметрия (ТсрО2), лазерная доплеровская флоуметрия (ЛПФ), полярография, компьютерная капилляроскопия, рентгеноконтрастная ангиография, магнитно– резонансная ангиография, мультиспиральная компьютерная томография–ангиография (МСКТ– ангиография), измерение пальцевого систолического давления, стресс–тесты (тредмил–тест), изучение эндотелий–зависимой вазодилятации (веноокклюзионная плетизмография на фоне введения ацетилхолина и нитроглицерина), реолимфовазография, импедансометрия, тепловизионное исследование.
Диагностика остеоартропатии – рентгенография стопы в двух проекциях, ренгенологическая и ультразвуковая денситометрия. Дифференциальная диагностика остеоартропатии и остеомиелита – биохимические маркеры костного метаболизма (остеокальцин, костный изофермент ЩФ).
При наличии раневого дефекта обязательными являются микробиологические исследования, которые должны производится повторно в процессе лечения (коррекция эмпирической антибактериальной терапии, высокая вероятность реинфицирования открытых послеоперационных ран, в т.ч. резистентными госпитальными штаммами микроорганизмов). При нейропатической форме СДС преобладает грамположительная флора (до 70% – Staphylococcus aureus), при наличии ишемии – грамотрицательная флора (чаще всего – Pseudomonas aeruginosa), при нейро–ишемической форме – смешанная флора, ассоциации микроорганизмов.
У больных СД часто (до 60%) выявляется микотическое поражение стоп (онихомикоз, микоз стоп). Выделение грибковой флоры из ран при СДС – до 80% случаев (дерматофиты, дрожжевые и плесневые грибы) (табл. 5).
Принципы лечения
При лечении гнойно–некротических форм СДС все пациенты с СД любого типа должны быть переведены на терапию инсулином короткого действия не реже 4 (6) раз/сут. до стабилизации уровня глюкозы крови в пределах 6–10 ммоль/л (гликемия натощак 6–7 ммоль/л, через 2 ч после еды 9–10 ммоль/л) или на схему введения пролонгированного инсулина утром и вечером и короткого действия в течение дня.
Уделяют внимание нормализации АД, применяя ингибиторы АПФ, b–блокаторы, блокаторы кальциевых каналов и диуретики. Также с целью уменьшения стрессорных реакций и болевого синдрома рекомендовано применение антидепрессантов.
В лечении больных с нейропатической формой диабетической стопы основное внимание уделяют полной разгрузке стопы (иммобилизация или разгрузка пораженной конечности с возможным применением ортопедических средств), тщательному местному лечению с удалением участков гиперкератоза и поэтапной некрэктомией.
При ишемической форме в первую очередь решают вопрос о необходимости и возможности реконструктивной сосудистой операции. В тяжелых случаях диабетической гангрены ввиду риска развития сепсиса в максимально ранние сроки показано расширенное оперативное вмешательство вплоть до ампутации.
Консервативная терапия
В лечении диабетической нейропатии применяются препараты a–липоевой кислоты – улучшение трофики нейронов, регулирование липидного и углеводного обмена, антиоксидантное, гепатопротекторное и дезинтоксикационное действие; толперизон – миорелаксант центрального действия, усиливающий периферический кровоток; препараты витаминов группы В, антидепрессанты, противосудорожные, нейролептики, ингибиторы альдоредуктазы, g–линолевая кислота.
Лечение нарушений свертывающей системы и сосудорасширяющее воздействие (ангиопротекторы, дезагреганты и реологические препараты) – ацетилсалициловая кислота, пентоксифиллин, дипиридамол, клопидогрел, тиклопидин, простагландины Е1, гепарин, низкомолекулярные гепарины, не требующие постоянного лабораторного мониторинга, гепарин–сульфаты – ломопоран, сулодексид, реополиглюкин; спазмолитики – папаверин, дротаверин, никошпан.
Активаторы клеточного метаболизма. В экспериментальных исследованиях было выявлено, что клетки различных тканей под воздействием Актовегина увеличивают потребление кислорода и глюкозы. Это приводит к повышению энергетического статуса клетки и к интенсификации ее метаболизма. Инсулиноподобный механизм действия Актовегина отличается от такового непосредственно инсулина, т.к. липогенез, липолиз и транспорт глюкозы не ингибируются при использовании антиинсулиновых антител; более того, Актовегин не оказывает влияния на фосфорилирование инсулиновых рецепторов или на зависимость инсулина от его рецепторов. Актовегин увеличивает потребление кислорода тканями, повышает устойчивость к гипоксии. Под влиянием препарата значительно улучшается диффузия и утилизация кислорода в нейрональных структурах [19].
Комплексное и ступенчатое применение препарата Актовегин (парентеральные, пероральные, местные формы) позволяет сохранить преемственность лечения и достичь отличного результата [20], однако следует помнить и о дозозависимости эффекта: по мнению многих отечественных и зарубежных авторов, суточная доза Актовегина должна составлять не менее 1000 мг [21–23]. Нами используется следующая схема введения препарата: в/в инфузия в течение 10 дней по 1000–2000 мг (инфузионные флаконы или ампулы по 5–10 мл) с последующим переходом на пероральную форму по 6 таблеток в сутки на 20 дней. По данным проведенного в 2008 г. в 26 центрах России, Украины и Казахстана мультицентрового рандомизированного двойного слепого плацебо–контролируемого исследования, у больных СД пероральный прием препарата рекомендован на срок до 5 мес. На материале исследования более чем 500 пациентов было доказано, что Актовегин эффективно уменьшает выраженность нейропатических симптомов, улучшает порог вибрационной чувствительности и уровень психического здоровья у пациентов с СД, а также обладает инсулиноподобным эффектом, что приводит к усилению потребления глюкозы с непосредственным воздействием на клеточный метаболизм и энергетический баланс в различных клеточных системах [24,25].
Коррекция липидного обмена – ингибиторы ГМГ–КоА–редуктазы (ловастатин), производные фиброевой кислоты (фенофибрат), препараты никотиновой кислоты, сулодекксид, эссенциальные фосфолипиды, препараты рыбьего жира.
Бенфотиамин влияет не только на нормализацию функций вегетативной нервной системы, уменьшение проявлений нейропатии (болевой синдром, парестезии, чувствительность), но и уменьшает активность перекисного окисления липидов и увеличивает активность антиоксидантной защиты.
Антиоксиданты – мексидол, витамины Е, С. Антиоксидантным действием обладают и препараты a–липоевой кислоты.
Антибактериальная терапия
Учитывая полимикробный ассоциативный характер микрофлоры инфицированных очагов на стопе диабетика с участием нескольких аэробных и анаэробных возбудителей, во всех случаях показана эмпирическая антибактериальная терапия антибиотиками широкого спектра действия (цефалоспорины, фторхинолоны, линкозамиды), при получении результатов бактериологического исследования производится коррекция назначений (деэскалационный принцип антибактериальной терапии). Клинически и экономически целесообразно также придерживаться ступенчатого принципа терапии – переход с парентерального пути введения препарата на энтеральный. Длительность антибактериальной терапии у больных с обширными гнойно–некротическими процессами на фоне хирургического лечения может составлять до 10 нед., неадекватность выбора препарата, дозы и длительности лечения может привести к развитию рецидива или суперинфекции. От применения аминогликозидов у больных с СД ввиду их нефротоксичности и риска прогрессирования нефропатии следует воздерживаться.
На фоне СД помимо микробных ассоциаций раны, как правило, контаминированы и грибами, чаще дрожжами (различные виды Candida), поэтому необходима их верификация и назначение соответствующего антимикотика (флуконазол, вориконазол, каспофунгин и др).
Хирургическое лечение
Целью хирургического пособия при СДС является сохранение жизни пациента, сохранение конечности и ее функции. Хирургическая тактика определяется не только выраженностью и объемом гнойно–некротического очага, но и формой процесса. Оперативное вмешательство должно быть своевременным, отвечать принципу разумной достаточности (бережное отношение к тканям, максимальное сохранение функции стопы), должно проводиться на фоне стабилизации общего состояния пациента, разгрузки пораженной конечности, коррекции нарушений углеводного обмена, антибактериальной и патогенетической терапии. Следует отметить, что уровень исходной гликемии влияет на результат хирургического пособия.
Экстренные операции производятся только в случае влажной гангрены конечности. Срочные вмешательства следует производить при наличии флегмон, абсцессов, неадекватно дренируемых гнойно–некротических ран и вторичных септических очагов. Этапные некрэктомии, операции при остеомиелите костей стопы, а также реконструктивные и пластические вмешательства производятся в плановом порядке.
Этапные некрэктомии необходимо производить по линии отграничения некротизированных тканей (демаркационная линия) с бережным отношением к сосудам и нервам любого калибра.
Метод катетеризации a. epigastrica inf. с последующим внутриартериальным введением лекарственных препаратов в пораженную конечность позволяет повысить эффективность лекарственной терапии.
Среди патогенетически обоснованных оперативных пособий следует отметить поясничную симпатэктомию (удаление ганглиев L3–L4 симпатического ствола) – воздействие на тонус вегетативной нервной системы, увеличение кровотока на стопе, а также шунтирование тонкого кишечника, применяемое с целью коррекции липидного обмена.
При неэффективности консервативной терапии, отсутствии противопоказаний, наличии анатомических возможностей, ишемии IIб – IV ст. применяются сосудистые реконструктивные операции, направленные на реваскуляризацию сосудов пораженной конечности – наложение шунтов, установка стентов, баллонная ангиопластика, артериализация венозного русла по методике Покровского А.А. с соавт. (2001). Также используется реваскуляризирующая роторная остеотрепанация, предложенная Зусмановичем Ф.Н. в 1996 г., и ее модификации.
При наличии гнойно–некротических процессов на стопе производят вскрытие и дренирование гнойников, первичные и этапные некрэктомии, некрсеквестрэктомии, «виртуальные ампутации» (изолированная резекция плюсневой кости или фаланги пальца, Калабрезе Е., 2005), ампутации и экзартикуляции пальцев, ампутации стопы на различных уровнях (экзартикуляции всех пальцев по Гаранжо, метатарзальные ампутации по Шарпу, ампутации стопы по Лисфранку и Шопару, костно–пластические ампутации по Сайму, Пирогову, Годунову и др.).
Из технических особенностей подобных операций следует отметить, что экзартикуляция I пальца стопы должна включать в себя удаление пальца, двух сесамовидных костей, располагающихся у основания пальца, резекцию головки I плюсневой кости и сухожилий сгибателя и разгибателя пальца. При ампутации на уровне голени при формировании мягкотканного лоскута необходимо иссекать камбаловидную мышцу, т.к. она кровоснабжается только задней большеберцовой артерией [Митиш В.А., Светухин А.М., 1998].
При более проксимальном распространении патологического процесса производятся ампутации конечности на уровне голени и бедра.
Определение уровня ампутации по плече– лодыжечному индексу: ПЛИ ниже 0,5 – ампутация на уровне бедра; ПЛИ на уровне 0,5 – ампутация на уровне голени; ПЛИ 0,5–0,7 – ампутация на уровне стопы; ПЛИ 0,7–1,0 – экзартикуляция пальца.
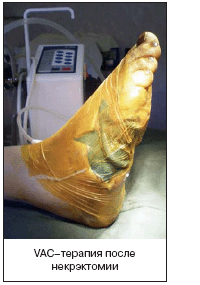
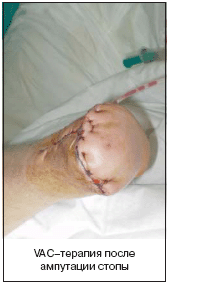
VAC–терапия – метод локального лечения инфицированных раневых дефектов, позволяющий эффективно и быстро очистить и снизить контаминацию раны, уменьшить ее объем, ускорить образование грануляционной ткани; экономически эффективен ввиду отсутствия необходимости перевязок в течение 3–7 дней. Дозированное отрицательное давление способствует удалению интерстициальной жидкости, снижению локального отека, стимуляции локальной микроциркуляции, увеличению скорости пролиферации клеток, снижению уровня микробной контаминации [26].
Существуют VAC–системы фирмы «KСI», США, которые, однако, не представлены на рынке России. Нами используется оригинальный аналог: повязка состоит из подведенной к ране через контрапертуру дренажной трубки с дополнительными сечениями для лучшего оттока из раны, поролона, который укладывается в рану двумя слоями, чтобы покрыть всю поверхность раны, причем дренаж располагается между слоями поролона (другой вариант – один слой поролона на рану с подведением дренажа к его поверхности с помощью плоского переходника); далее выполняется закрытие раны пленкой для операционного поля фирмы «3М»; дренажная трубка подсоединяется к медицинскому отсосу В–40А (Беларусь) для активной аспирации в режиме non stop. Одним из важных условий является герметичность системы; оптимальный уровень негативного давления, который должен создаваться в повязке, около 125 mmHg.
Закрытие обширных раневых дефектов целесообразно производить путем аутодермопластики свободным расщепленным кожным лоскутом, при необходимости перфорированным. Применяется пластика перемещенным лоскутом на питающей ножке, а также различные варианты вторичных швов и пластики местными тканями.
Для анестезиологического обеспечения оперативных пособий предпочтительнее эпидуральная анестезия с возможностью пролонгированной послеоперационной анестезии; также рекомендовано применение спинномозговой или перидуральной анестезии. С целью обезболивания без потери двигательной активности используют фентанил на растворе глюкозы. Ряд авторов отмечает положительный периоперационный эффект применения клофелина в составе премедикации.
Местное лечение [4,17,18]
Основными принципами местного лечения диабетических язв являются условия влажного заживления, термическая изоляция, отсутствие избыточного накопления экссудата, щадящие механические обработки, осторожное применение антисептических средств с возможным токсическим эффектом.
Очищение раны производится хирургическим путем с помощью ферментных препаратов (протеолитических ферментов – папаин, рибонуклеаза, гиалуронидаза, нуклеотидаза и нуклеозидаза, ультрализин, химопсин, трипсин, коллагеназа, террилитин и др.), а также вновь появился интерес к методу с применением личинок, известный со времен Первой мировой войны.
Промывание раны. При использовании растворов антисептиков необходимо выдерживать экспозицию препарата для получения антимикробного эффекта, однако при этом усиливается возможное токсическое воздействие. При применении 3%–ного раствора перекиси водорода отмечен цитотоксический эффект на грануляционную ткань и фибробласты, рекомендовано использование 1,5%–ного раствора. Применение йодофоров рекомендовано ограничить коротким курсом лечения инфицированных ран, т.к. выявлено цитотоксическое воздействие на фибробласты; также с осторожностью следует применять растворы перманганата калия и бриллиантового зеленого. Безопасным считается применение 0,05%–ного водного раствора хлоргексидина и 0,01%–ного раствора мирамистина, а также физиологического раствора.
Для ран с обильным гнойным отделяемым и тканевым детритом показана обработка пульсирующей струей жидкости (растворы антисептиков, высококонцентрированный озонированный раствор). Промывание раневых дефектов пульсирующей струей озонированного охлажденного физиологического раствора с концентрацией озона от 10 до 20 мкг/мл сопровождается механическим очищением раны, антимикробным, фунгицидным и противовоспалительным воздействием, снижением тканевой гипоксии, а также эффектами местной гипотермии – обезболиванием, уменьшением отека, повышением капиллярного кровотока и ликвидацией мышечного спазма.
Также в I фазу раневого процесса используется ультразвуковая кавитация ран с 0,02%– ным водным раствором хлоргексидина (механическое очищение раны, снижение бактериальной обсемененности, улучшение регионарной микрогемодинамики), использование воздушно– плазменных потоков (экзогенная NO–терапия).
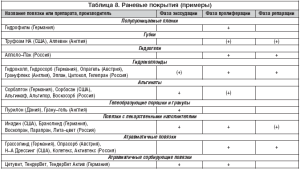
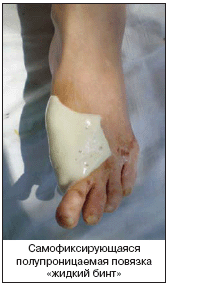
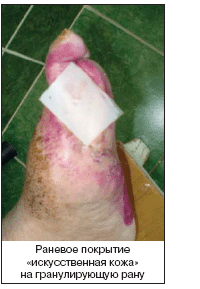
Раневое покрытие. Идеальная повязка должна отвечать следующим требованиям: удалять избыток экссудата и токсические компоненты, поддерживать высокую влажность, обеспечивать газообмен, поддерживать температурный режим, предотвращать от вторичного инфицирования, не содержать частиц и контаминантов, обеспечивать атравматичное снятие с раневой поверхности, быть привлекательной с точки зрения соответствия стоимости и эффективности. Существуют различные классы раневых покрытий: полупроницаемые пленки, губки, гидрогели, гидроколлоиды, альгинаты, покрытия с лекарственными наполнителями (в таблице 8 приведены примеры различных раневых покрытий), а также биологические покрытия.
Препараты местного применения: мази на полиэтиленоксидной основе, йодофоры, Актовегин– гель, спрей Ацербин и др.
При выявлении микозов стоп используются противогрибковые средства, при онихомикозах – лак Лоцерил и др.
Дополнительные методы
Среди дополнительных методов описано применение гипербарической оксигенации (ГБО), аэрации пораженной конечности озон– кислородной газовой смесью в пластиковом изоляторе, использование различных методов локального криовоздействия, фотодинамической и магнитно–лазерной терапии (улучшение микроциркуляции, снижение тканевой гипоксии, нормализация трофики и др.), а также управляемой абактериальной среды (УАС).
В/в озонотерапия применяется с целью детоксикации, оксигенации и иммуномодуляции, а также улучшения реологических свойств крови.
В лечении нейропатии используют магнитотерапию, электростимуляцию поясничного нервного сплетения и мышц голени, периневральный электрофорез Мидокалма на пораженной конечности.
С целью коррекции нарушений гемолимфоциркуляции применяют физиотерапевтическое воздействие с помощью аппратов «Лимовижин» и «Пролонг».
В ряде клиник в комплекс лечебных мероприятий включают экстракорпоральные методы – лифоцитаферез, регионарное внутриартериальное введение модифицированных иммуномодулятором аутолимфоцитов; плазмаферез, УФО аутокрови, инфузии гипохлорита Na.
Подиатрия. Ортопедия
Снижение плантарного давления у пациентов с нейропатической и нейроостеоартропатической формами СДС достигается применением ортопедической обуви (традиционно применяется «полубашмак») или индивидуальной иммобилизирующей разгрузочной повязки Total Contact Cast. Применяют также силиконовые корректоры и разгрузочные стельки.
Профилактика
Организация сети кабинетов «Диабетическая стопы», выявление групп риска, издание методической литературы для медицинских работников и пациентов с СД и СДС, создание санаторно– курортных программ для больных СД и с СДС, изготовление и снабжение больных протезами, ортезами, корригирующими стельками и ортопедической обувью.
Литература
1. Национальные стандарты оказания помощи больным сахарным диабетом. – М. – 2002.
2. Международное Соглашение по Диабетической стопе. – 2000.
3. Гурьева И.В. Профилактика, лечение, медико–социальная реабилитация и организация междисциплинарной помощи больным с синдромом диабетической стопы. Дисс…докт.мед.наук. – М. – 2001.
4. Светухин А.М., Земляной А.Б. Гнойно– некротические формы синдрома диабетической стопы. // Consilium medicum. – 2002. – № 10, том 4.
5. Бегма А. Н., Бегма И. В., Дёмин Д. И., Поташов Д.А.,Гурьева И.В.,Земляной А.Б. Оптимизация лечения нейроишемической формы синдрома диабетической стопы. // Здравоохранение Урала. – 2003. – № 9.
6. Wagner F.W. A classification and treatment program for diabetic, neuropatic and dysvascular foot problems. // In The American Academy of Ortopaedic Surgeons instructional course lectures. – St. Louis. – Mosby Year Book. – 1979. – P. 143 – 165.
7. Материалы I съезда Diabetic Foot Study Group. – Рим. – 2000.
8. Материалы симпозиума «Диабетическая стопа». – М. – 2005.
9. The Consensus of diabetic foot Supplement, Amsterdam. – 2003.
10. Бахарев И.В., Редькин Ю.А. Синдром диабетической стопы: диагностика, лечение, профилактика. // Сахарный диабет. – 2003. – № 1.
11. Токмакова А.Ю., Страхова Г.Ю., Галстян Г.Р. Современная концепция ведения больных с хроническими ранами и сахарным диабетом.// Сахарный диабет. – 2005. – № 1.
12. Keast DH, Bowering K, Evans AW, MacKean G, Burrows C, D’Souza L. MEASURE: A proposed assessment framework for developing best practice recommendations for wound assessment. // Wound Rep Reg 2004; 12:1 – 17.
13. Комелягина Е.Ю., Анциферов М.Б. Факторы риска и профилактика синдрома диабетической стопы. // РМЖ. – 2003. – Том 11. – № 27.– С. 1503 – 07.
14. Дедов И.И., Шестакова М.В. Сахарный диабет. – М. – 2003.
15. Анциферов М.Б., Староверова Д.Н. Методы диагностики и лечения диабетической макроангиопатии. // РМЖ. – 2003. – Том 11. – № 27.
16. Дибиров М.Д., Черкезов Д.И., Манушарова Р.А. Современные возможности консервативного и хирургического методов лечения гнойно–некротических поражений стоп у больных сахарным диабетом. // РМЖ. – 2005. – Том 13. – №28. – С. 1915 – 18.
17. Гурьева И.В. Возможности местного лечения диабетических поражений стоп. – М.
18. Светухин А.М., Амирасланов Ю.А. Гнойная хирургия: современное состояние проблемы. // В кн. «50 лекций по хирургии» под ред. Савельева В.С. – М. – 2004. – 752 с.
19. Ушкалова Е.А. Антиоксидантные и антигипоксические и свойства актовегина у кардиологических больных. // Трудный пациент. – 2005. –№ 3.
20. Гусева С.Л., Макарова Н.Н., Трухова В.В., Хисматов Р.Р. Актовегин в лечении трофических язв нижних конечностей венозной этиологии.// РМЖ. – 2008. – Т. 16. № 29.
21. Балаболкин М.И., Клебанова Е.М., Креминская В.М. Микроангиопатия – одно из сосудистых осложнений сахарного диабета. // Consilium medicum. 2000. – Т. 2. № 5.
22. Креминская В.М., Гурьева И.В. Возможность применения Актовегина при поздних осложнениях сахарного диабета. // РМЖ. 2006.
23. Львова Л.В. В центре внимания. // Провизор. – 2003. № 6.
24. Dan Zigler et al. Treatment of Symptomatic Polyneuropathy with Actovegin in Type 2 Diabetic Patients. // Diabetes Care 32:1479-1484, 2009.
25. Строков И.А. Актовегин по сравнению с плацебо у пациентов с диабетической полинейропатией. – М. – 2009. – 7 с.
26. Грекова Н.М., Бордуновский В.Н. Хирургия диабетической стопы. – М. – 2009. – 188 с.












Комментировать