Сахарный диабет и сердечная недостаточность. Более жесткий гликемический контроль или элевация кардиоваскулярного риска?
А.Е. Березин, Запорожский государственный медицинский университет
АКТУАЛЬНОСТЬ ПРОБЛЕМЫ
К настоящему времени на земном шаре насчитывается более 171 млн больных сахарным диабетом (СД), при этом по прогнозам экспертов к 2030 году эта величина как минимум удвоится (Padwal R. et al , 2005). В результате Фремингемского исследования установлено, что у пациентов с этим заболеванием очень высокий риск манифестации кардиоваскулярных заболеваний, в том числе и новых случаев сердечной недостаточности (СН) (Kannel W. B. et al., 1974; Nichols G. A. et al., 2001). СН выявляют приблизительно у 10–15% пациентов с СД и в 3% случаев у лиц, не имеющих такового; артериальную гипертензию, инсулинорезистентность, гипергликемию рассматривают в качестве одних из наиболее мощных факторов, опосредующих трансформацию диастолической дисфункции миокарда в манифестную ю СН (Füchtenbusch M. et al., 2007). При этом абсолютная величина гликозилированного гемоглобина (HbA 1c) в плазме крови тесно ассоциируется с риском манифестации любых фатальных и нефатальных кардиоваскулярных событий, в том числе и СН (Eshaghian S. et al., 2006). Так, относительный риск возникновения дисфункции левого желудочка (ЛЖ) в этой когорте больных прогрессивно возрастает приблизительно на 10–15% на каждый 1% HbA 1c (Stratto I. M. et al., 2000). СД рассматривают не только как один из наиболее мощных предикторов манифестации СН (Nichols G. A. et al., 2004), но и как фактор, оказывающий независимое негативное влияние на ближайший и отдаленный прогноз дисфункции ЛЖ любой этиологии (Chae C. U. et al., 1998; Iribarren C. et al., 2001). С другой стороны, СН отмечают как сопутствующий диагноз у 25–40% всех пациентов с документированным СД (Reis S. E. et al., 1997; Bell D. S., 2003; Nichols G. A. et et al., 2005). Имеются сведения, демонстрирующие, что риск возникновения СД у пациентов с СН вне зависимости от ее этиологии существенно выше, чем в общей популяции (Amat L. et. al., 1997; Fonarow G. C., 2004). Более того, ухудшение клинических исходов СН отмечали даже тогда, когда пациенты не имели документированного СД, а только признаки нарушения толерантности к глюкозе (De Groote P. et al., 2004; Ezekowitz J. et al., 2004). В этом случае многие исследователи отмечали достоверное повышение риска повторных госпитализаций, связанных с прогрессированием СН (Majumdar S. R. et al., 2004; Held C. et al., 2007).
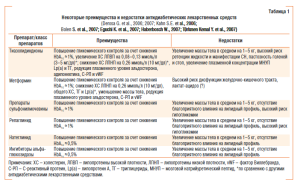
В целом, необходимость модуляции кардиоваскулярного риска с целью ю улучшения клинических исходов у пациентов с СД и СН сомнений не вызывает. Б Более того, постулируется, что достижение наиболее жесткого контроля за гликемией натощак и постпрандиально у пациентов этой категории позволит существенным образом снизить общую и кардиоваскулярную ю смертность (ribrreeIribribribarrenrrenrrenrr en C. et et et al., 2001). С другой стороны, влияние антидиабетических лекарственных средств на эволюцию ю СН у пациентов с сопутствующим СД точно не установлено и широко дискутируется (Masoudi F. A., Inzucchi S. E., 2007). Так, до сих пор точно не определен оптимальный уровень гликемии натощак в этой когорте больных. В Вместе с тем существуют серьезные опасения того, что жесткий контроль за плазменной концентрацией HbAbA1c (в среднем на уровне около 7% и ниже) может ассоциироваться с ухудшением выживаемости пациентов с СН независимо от их возраста (Eshaghian S. et al., 2006). S. Eshaghian и соавторы (2006) оценили взаимоотношения между величиной кардиоваскулярной смерти у 123 пациентов с манифестной систолической СН (фракция выброса (ФВФВ) ЛЖ <25,0±7,5959%) ишемической этиологии и документированным СД. Исследователи установили, что неадекватный контроль за течением СД (HbAbA1c >7,0%) ассоциировался с более высокой ФВ ЛЖ, применением блокаторов бета-адренорецепторов и препаратов сульфонилмочевины. В Вместе с тем у больных с HbAbA1c ≤7,0% обнаружена более высокая величина общей смертности по сравнению ю с таковой у пациентов с HbAbA1c >7,0% (35% против 20%, отношение рисков (hazard ratio/HR)=2,6; 95% доверительный интервал (confidence interval/CI)=1,3–5,2; p<0,01). При проведении мультивариантного анализа оказалось, что уровень HbAbA1c ≤7,0% тесно ассоциировался с повышением риска смертельного исхода (HR=2,3; 95% CI=1,0–5,2) независимо от вида использованных антидиабетических лекарственных средств. В В целом, S. Eshshaghihiannnnи соавторы (2006) пришли к парадоксальному выводу о том, что элевация плазменного уровня HbAbA1c в когорте пациентов с СД и предсуществующей манифестной СН сопровождается улучшением прогноза, однако природа подобной взаимосвязи осталась за рамками какого-либо научного объяснения. Сделаны определенные попытки связать ухудшение клинических исходов у пациентов с СД и СН при снижении HbAbA1c c <7% с применением ряда лекарственных средств, таких как инсулин, натеглинид, ингибиторы альфа-глюкозидазы, тиазолидиндионы (глитазоны) и препараты сульфонилмочевины (Füchtenbusch M. et al., 2007). Однако до сих пор этот вопрос остается дискутабельным, хотя многими экспертами и признается факт влияния на клинические исходы у пациентов с СД и дисфункцией ЛЖ непосредственного выбора антидиабетического лекарственного средства. Тем более что у многих препаратов отмечают наличие дополнительных метаболических эффектов (табл. 1) (Bano K. A., Batool A., 2007; Bolen S. et al., 2007). Х Хотя существует и прямо противоположные данные. Так, S. Maru и соавторы (2005), проанализировав сведения о 25 690 пациентах, применявших в течение 10 лет (1988–1999 гг.) различные антидиабетические лекарственные средства, в том числе и инсулин, пришли к выводу о том, что риск возникновения СН может быть не связан с непосредственным выбором определенного класса препаратов.
В недавно опубликованном систематическом обзоре рандомизированных клинических исследований, проведенном D. T. Eurich и соавторами (2007), установлено, что из всех лекарственных средств, рекомендованных для лечения СД 1-го или 2-го типа, только метформин не оказывал непосредственного негативного влияния на клинические исходы у пациентов с СН. Исследователи пришли к заключению, что применение метформина, по сравнению ю с другими антидиабетическими препаратами и инсулином, ассоциировалось со значительной редукцией риска общей смерти.
Таким образом в настоящее время отчетливо ощущается отсутствие серьезной доказательной базы в отношении использования различных стратегических подходов в лечении обсуждаемой когорты больных, что привело к необходимости разработки рекомендаций, больше основанных на патофизиологических представлениях и мнениях экспертов, чем на данных доказательной медицины (evidence based medicine) (Masoudi F. A., Inzucchi S .E., 2007; Peters A. L., 2007). Настоящий обзор посвящен обсуждению возможной взаимосвязи между применением антидиабетических препаратов и прогнозом у больных с СН.
АНТИДИАБЕТИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА И ЭВОЛЮЦИЯ ДИСФУНКЦИИ МИОКАРДА
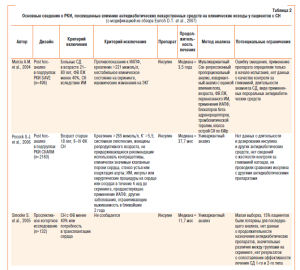
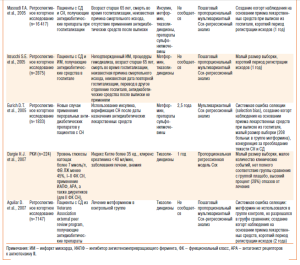
Большинство рандомизированных контролируемых испытаний (РКИ), посвященных месту и роли антидиабетических лекарственных средств в эволюции СН, результаты которых использовали в различных метаанализах, отличаются высокой статистической гетерогенностью популяции больных (.Eurich D. T. et al, 2007). В табл.2 суммированы основные данные о дизайне основных клинических исследований, посвященных применению антидиабетических лекарственных средств у пациентов с сопутствующей СН. Необходимо отметить, что полиморбидность пациентов, отобранных для проведения исследований, составляет наибольшую сложность при последующей интерпретации полученных данных. С этим связаны попытки исследователей как можно более жестко подойти к процессу формирования групп сравнения и метода обработки данных.
Клинические исходы у пациентов с СН, получавших инсулин (n=496), были проанализированы на основании дополнительного мультивариантного анализа результатов РКИ SAVE. Исследователи установили, что по сравнению с пациентами, не получавшими инсулин по поводу СД (n=328; диета, метформин и/или препараты сульфонилмочевины), в группе лиц, получавших инсулин (n=168), отмечали статистически значимое повышение риска общей (HR=1,66; 95% CI=1,20–2,31) и кардиоваскулярной смертности (HR=1,38; 95% CI=1,06–1,80) (Murcia A M et .al, 2004; Eurich D T et .al, 2007).
Эффект инсулина в отношении клинических исходов у пациентов с СН был также подвергнут оценке в РКИ CHARM (Pfeffer M. A. et al., 2003; .Pocock S J et al., 2006). Анализ полученных данных показал существование негативного влияния терапии инсулином на риск общей смертности (относительный риск (risk ratio, relative risk — RR)=1,25; 95% CI=1,03–1,51) и риск кардиоваскулярной смертности или частоту повторных госпитализаций (RR=1,55; 95% CI=1,29–1,86) по поводу прогрессирования СН по сравнению с теми пациентами, в терапии которых не использовали инсулин. Однако непосредственного сравнения влияния пероральных антидиабетических препаратов и инсулина на прогноз у пациентов с СД и СН сделано не было. Аналогичные результаты получены и в исследованиях S. Maru и соавторов (2005).
S. Smooke и соавторы (2005) обследовали 554 пациента (средний возраст 52,0±13,1 года) с СД 1го и 2го типа с уже документированной систолической манифестной СН (ФВ ЛЖ 24,6±7,4%). Исследователи установили, что одногодичная выживаемость в когорте больных с СН без СД составила в среднем 89,7%, для больных с СН и СД (n=89), принимавших пероральные антидиабетические средства, 85,8%, тогда как в когорте лиц, получавших инсулин (n=43), этот показатель снизился до 62,1% (p<0,00001). После проведения мультивариантного анализа по Cox авторы пришли к заключению о том, что применение инсулина может рассматриваться в качестве независимого предиктора смерти в группе больных с СН (HR=4,30, 95% CI 1,69–10,94), тогда как использование антидиабетических пероральных препаратов подобного влияния не имели (HR=0,95; 95% CI=0,31–2,93).
Вместе с тем существуют и прямо противоположные наблюдения. Так, при проведении ретроспективного наблюдения за пациентами с СН и СД (n=16 417) было установлено, что риск общей смертности в группе пациентов, получавших инсулин, и леченных другими антидиабетическими препаратами (метформин, тиазолидиндионы, препараты сульфонилмочевины) вполне сопоставим (HR.=0,96; 95% CI=0,88–1,05) (Masoudi F .A. et al, 2005; Eurich D. T. et al., 2007).
Предполагается, что снижение чувствительности тканей к инсулину, опосредованное его экзогенным поступлением, может негативно сказываться на уровне физической работоспособности и систолической функции ЛЖ у пациентов с СН (Adachi H. et. al, 2007). Во всяком случае ряд проводящихся в настоящее время РКИ, таких как ORIGIN (Outcome Reduction with an Initial Glargine Intervention), смогут несколько прояснить эту проблему и позволить более убедительно ответить на вопрос, способен ли инсулин приводить к редукции кардиоваскулярной смертности и улучшению прогноза (Gerstein H. et. al, 2008).
Таким образом, необходимость использования инсулина у больных с манифестной СН создает дополнительные риски в отношении ухудшения клинических исходов и снижения вероятности выживания.
ПЕРОРАЛЬНЫЕ АНТИДИАБЕТИЧЕСКИЕ СРЕДСТВА И КЛИНИЧЕСКИЕ ИСХОДЫ У БОЛЬНЫХ С СН
Метформин
Впервые в исследовании UKPDS (UK Prospective Diabetes Study) показано, что «жесткий» контроль за величиной гликемии натощак у больных СД не способствует существенному снижению риска макрососудистых осложнений, в основном и определяющих клинические исходы в этой когорте пациентов (.Scarpello J. H., 2003). В то же время применение метформина отчетливо ассоциировалось не только с возможностью осуществления адекватного гликемического контроля, но и с редукцией смертности, связанной с осложнениями СД на 42% (по сравнению с диетой, р=0,017), величины общей смертности на 36% (р=0,011), частоты инфаркта миокарда (ИМ) на 39% (р=0,01) и общей частоты твердых конечных точек, ассоциированных с эволюцией СД на 32% (р=0,002). Предполагалось, что позитивные качества метформина могут найти применение в лечении больных с СД 2го типа в сочетании с дисфункцией ЛЖ/манифестной СН, поскольку к этому времени уже существовали серьезные сомнения в позитивном влиянии инсулина на прогноз у этой категории больных.
Существуют веские основания предполагать, что дополнительное позитивное влияние метформина на клинические исходы у пациентов с СН и СД может быть опосредовано его внутренними дополнительными качествами, такими как способность к редукции уровня общего ХС и ХС ЛПНП, плазменных концентраций альдостерона, С-реактивного протеина и фактора Виллебранда, индекса HOMA-IR (homeostasis model assessment of insulin resistance) (Derosa G. et al., 2007; Eguchi K. et al., 2007). Кроме того, у метформина обнаружен некоторый антикоагуляционный потенциал, имеющий клиническое значение (Derosa G. et al., 2006).
Результаты первых проведенных ретроспективных наблюдений, посвященных этому вопросу, свидетельствовали о том, что применение метформина по сравнению с другими пероральными антидиабетическими препаратами и инсулином у пациентов с тяжелой СН, ассоциированной с СД (n=406), не сопровождается повышением риска смертности у пациентов с дисфункцией ЛЖ (.HR=0,92; 95% CI=0,72–1,18) (Inzucchi S. E. et al., 2005) или даже может приводить к умеренному снижению смертности и частоты госпитализации, ассоциированной с СН (.HR=0,92; 95% CI=0,86–0,99) (Masoudi F. A. et al, 2005). Необходимо отметить, что низкий риск повторных госпитализаций пациентов с СН регистрировали даже в том случае, когда метформин назначался в сочетании с тиазолидиндионами (.HR=0,82; 95% CI=0,69–0,96) или препаратами сульфонилмочевины (.HR=0,54; 95% CI=0,42–0,70) (Eurich D. T. et al., 2005; 2007). При этом почти 25% пациентов, включенных в РКИ, имели сопутствующие заболевания, непосредственно оказывающие влияние на ближайший и отдаленный прогноз и формально ограничивающие применение метформина (.Holstein A. et al., 1999; Emslie-Smith A. M. et al., 2001; Horlen C. et al., 2002).
Интересно, что в исследовании ADOPT (A Diabetes Outcome Progression Trial), проведенном при участии 4360 пациентов с СД 2го типа на протяжении 4 лет, не было установлено преимуществ в снижении кардиоваскулярного риска при применении метформина и розиглитазона, тогда как использование глибенкламида способствовало наиболее выраженной редукции частоты сердечно-сосудистых событий, включая и СН (p<0,001) (.Kahn S. E. et al, 2006). Вместе с тем наилучший гликемический контроль был достигнут при применении именно розиглитазона (Scheen A. J, 2007). Исследователи пришли к заключению о том, что потенциальные риски, безопасность и переносимость для метформина у пациентов с СН и СД являются вполне допустимыми (.Kahn S. E. et al., 2006; Scheen A. J., 2007).
Таким образом, метформин является в настоящее время одним из наиболее безопасных сахароснижающих препаратов, не оказывающих дополнительного влияния на прогноз у пациентов с СН.
Тиазолидиндионы
Как и метформин, тиазолидиндионы могут приводить к потенциально благоприятным дополнительным метаболическим эффектам, оказывающим позитивное влияние на клинические исходы у пациентов с СН. Так, установлено, что пиоглитазон эффективно снижает плазменный пул общего ХС, ХС ЛПНП, триглицеридов, значения HOMA-IR, концентрацию альдостерона, фактора Виллебранда, С-реактивного протеина, а также повышает уровень адипонектина и ХС ЛПВП (Eguchi K. et al., 2007; Derosa G. et al., 2006; 2007). Вместе с тем метаболические эффекты тиазолидиндионов если и можно назвать классовыми, то с большой долей приближения. Так, W. Haberbosch. (2007) установил, что между двумя представителями тиазолидиндионов розиглитазоном и пиоглитазоном имеет место существенное различие в их способности реверсировать плазменный уровень провоспалительных цитокинов, улучшать липидный профиль плазмы и крови при отсутствии различий в преодолении инсулинорезистентности и снижении уровня глюкозы натощак. Автор отметил, что пиоглитазон и розиглитазон способствуют редукции уровня HbA1c на 0,6% и 0,7% (р>0,1), триглицеридов на 51,9 мг/ дл и 13,1 мг/ дл (р<0,001), повышению ХС ЛПВП на 5,2 мг/ дл и 2,4 мг/ дл (р<0,001) соответственно. При этом концентрация ХС ЛПНП снижалась только при применении пиоглитазона (р<0,001). Вероятно, именно с этими различиями влияния на липидный спектр плазмы крови может быть связан неоднозначный эффект тиазолидиндионов в отношении выживаемости пациентов с кардиоваскулярными заболеваниями. Автор полагает, что обнаруженные им различия между глитазонами могут быть рассмотрены в качестве достаточного основания для предположения о том, что в основе возможного вазопротективного эффекта тиазолидиндионов лежат липидные механизмы. По мнению .D. J. Betteridge (2007), у пиоглитазона и розиглитазона действительно различный гиполипидемический потенциал. С другой стороны, имеются данные, свидетельствующие о том, что возможное негативное влияние тиазолидиндионов на эволюцию СН и возникновение новых случаев дисфункции ЛЖ может быть опосредовано элевацией плазменной концентрации мозгового натрийуретического пептида в плазме крови, который рассматривается в качестве мощного фактора риска прогрессирования СН (Turkmen Kemal Y. et al, 2007).
В ряде исследований продемонстрировано, что у пациентов с СД 2го типа, госпитализированных по поводу острого ИМ, риск общей смертности в течение первого года после выписки фактически не зависел от вида антидиабетического препарата (Delea T. E. et al., 2003; Maru S. et al., 2005; Kahn S. E. et al., 2006). Так, результаты мультивариантного анализа, основанного на базе данных The first Medicare study, свидетельствовали о том, что риск общей смертности в группе больных, принимавших препараты сульфонилмочевины, ингибиторы альфаглюкозидазы или инсулин по сравнению с пациентами, принимающими тиазолидиндионы (n=255), составлял .HR=1,04 (95% CI=0,83–1,31) (Inzucchi S. E. et al., 2005; Eurich D. T. et al., 2007). Тем не менее исследователи отметили небольшой тренд в направлении повышения риска повторных госпитализаций, связанных с прогрессированием СН, в когорте пациентов, получавших именно тиазолидиндионы (HR.=1,15; 95% CI=0,97–1,38). В последующем (.Тhe second Medicare study) мультивариантный анализ влияния вида сахароснижающих препаратов был основан уже на более представительной выборке пациентов с СН (n=12 069) (Masoudi F. A. et al., 2005; Eurich D. T. et al., 2007). Оказалось, что величина общей смертности в течение первого года после выписки больных из стационара в группе тиазолидиндионов была даже ниже, чем среди всех других когорт наблюдения (n=2226; .HR=0,87; 95% CI=0,80–0,94). Вместе с тем негативное влияние терапии тиазолидиндионами на частоту повторных госпитализаций не было подтверждено (.HR=1,04, 95% CI=0,99–1,10). При объединении обеих баз данных незначительное повышение риска повторных госпитализаций в группе пациентов, принимающих тиазолидиндионы, все же установлено (.HR=1,06,95% CI=1,00–1,12).
В ретроспективном когортном исследовании, включающем пациентов с СД, находившихся на амбулаторном лечении в Veteran Affairs medical centres. (n=814) на протяжении как минимум двух лет, установлено, что величина общей смертности и госпитализации по поводу прогрессирования СН в когорте больных, принимавших тиазолидиндионы, сопоставима с таковым среди лиц (n=4700), не получавших глитазоны (.HR.=0,98; 95% CI=0,81–1,17 и .HR=1,00; 95% CI=0,81–1,24 соответственно). Напротив, частота повторных госпитализаций среди пациентов, принимавших тиазолидиндионы и не получавших инсулин, была достоверно более высокой (.HR=1,62; 95% CI=1,15–2,29) (Aguilar D. et al., 2007; Eurich D. T. et al., 2007.). Аналогичные результаты получены также A. J. Karter. и соавторами (2005). Таким образом, тиазолидиндионы не продемонстрировали непосредственного негативного влияния на выживаемость среди пациентов с СН. Вместе с тем ответу на этот вопрос было адресовано небольшое РКИ, в котором пациенты с I–II ФК СН и СД могли получать на протяжении 52 нед либо розиглитазон (n=110), либо плацебо (n=114) в дополнении к стандартному режиму пероральной сахароснижающей терапии (Dargie H. J. et al., 2007; Eurich D. T. et al., 2007). Анализ полученных данных показал, что использование розиглитазона способствует повышению риска общей смертности (.HR.=1,50; 95% CI=0,49–4,59). При этом пропорция пациентов, требовавших повторной госпитализации, ассоциированной с прогрессированием дисфункции ЛЖ, была достоверно выше среди лиц, принимавших розиглитазон (RR=1,30; 95% CI=0,35–4,82). Кроме того, исследователи отметили и факт увеличения регистрации комбинированной точки — число случаев повторной госпитализации и прогрессирования СН (.HR=1,28; 95% CI=0,51–3,21).
Интересны наблюдения .R. Rajagopalan. и соавторов (2004), в которых сопоставлены эффекты пиоглитазона и инсулина на протяжении 2 лет лечения 1668 пациентов с СД (средний возраст 51,2±0,2 года). Результаты анализа полученных данных свидетельствуют о том, что в когорте больных, принимавших пиоглитазон, были достоверно ниже частота впервые возникших случаев СН (соответственно 2,0% против 4,0%, p<0,001; HR.=0,501; 95% CI=0,331–0,758, p=0,001) и госпитализаций по этой причине (0,7% против 2,5%, p<0,001; HR=0,263; 95% CI=0,135–0,511, p<0,001). Это одно из немногих исследований, в которых тиазолидиндионы продемонстрировали преимущества перед инсулином в отношении улучшения клинических исходов у больных СД.
В другом обсервационном исследовании установлено, что между группами пациентов, принимавших тиазолидиндионы и метформин, не было существенных различий в отношении величины общей и кардиоваскулярной смертности, хотя риск повторных госпитализаций, связанных с прогрессированием СН, в когорте больных СД, принимавших тиазолидиндионы, был достоверно выше (HR.=1,06; 95% CI=1,00–1,09), чем в группе пациентов, принимающих метформин (HR=0,92; 95% CI=0,92–0,99) (Masoudi F. A. et al., 2005).
В исследовании RECORD (Rosiglitazone Evaluated for Cardiac Outcomes and Regulation of Glycaemia in Diabetes) установлено, что розиглитазон способен повышать интенсивность ретенции жидкости и тем самым повышать частоту госпитализаций пациентов даже без предсуществующей СН (Home P D et .al, 2007). Многие исследователи полагают, что это класс-специфическое качество тиазолидиндионов (.Thomas M. L., Lloyd S. J., 2001; Gerstein H. C. et al., 2006; Home P. D. et al., 2007), тесно ассоциированное с их способностью повышать риск ИМ и смерти от кардиоваскулярных причин (Yki-Jarvinen H., 2005; Nissen S. E., Wolski K, 2007), не оказывая прямого кардиотоксического эффекта (.Mudaliar S. et al., 2003). Вместе с тем существуют мнения, согласно которым негативные результаты в отношении влияния тиазолидиндионов на выживаемость и кардиоваскулярный риск у больных СД могут быть обусловлены неоднородностью группы сравнения (.Deeks E. D., Keam S. J., 2007). Так, в исследовании UKPDS снижение риска кардиоваскулярных событий ассоциировано с применением метформина (UK Prospective Diabetes Study Group, 1998). В этой связи сопоставление тиазолидиндионов именно с метформином может способствовать так называемой ошибке выборки (bias), тогда как на самом деле тиазолидиндионы не приводят к изменению кардиоваскулярного риска (Rottlaender D. et al., 2007.). Напротив, по данным S. Singh и соавторов (2007b) риск (отношение шансов — odds ratio/OR) развития СН в когорте пациентов с СД, получающих тиазолидиндионы, составляет 2,1 (95% CI=1,08–4,08; p=0,03).
В то же время нельзя и абстрагироваться от результатов заранее спланированных рандомизированных РКИ и некоторых метаанализов, посвященных этому вопросу. Так, R. M. Lago и соавторы (2007) проанализировали результаты 3048 испытаний, посвященных применению тиазолидиндионов у пациентов с СД/ метаболическим синдромом, с последующей оценкой риска возникновения дисфункции ЛЖ, СН и кардиоваскулярной смерти. Систематический обзор отличает высокий уровень статистической мощности и низкая величина гетерогенности данных (I2=22,8%; р=0,26). Анализ полученных результатов свидетельствовал о повышении риска возникновения СН (RR=1,72; 95% CI=1,21–2,42, р=0,002) при использовании тиазолидиндионов в исследуемой популяции больных. Однако это не привело к повышению кардиоваскулярной смертности (RR=0,93; 95% CI=0,67-1,29, р=0,68). Исследователи полагают, что полученные данные свидетельствуют о том, что тиазолидиндионы не привносят ничего дополнительно к риску естественного возникновения и эволюции СН, поскольку их применение не отражается на частоте смертности от манифестной СН. Это в свою очередь диктует необходимость проведения дополнительных исследований с оценкой суммарной частоты кардиоваскулярных событий в когорте тщательно отобранных пациентов. Подобная гипотеза была подвергнута проверке в исследовании L. L. Lipscombe. и соавторов (2007) на популяции пациентов пожилого возраста с СД 2-го типа. В исследовании принимали участие 159 026 лиц в возрасте старше 66 лет, получающих тиазолидиндионы (розиглитазон или пиоглитазон) и/или их комбинацию с другими пероральными антидиабетическими препаратами. В течение 3,8 года от начала исследования с диагнозом манифестная СН был госпитализирован 12 491 пациент (7,9%), с диагнозом ИМ — 12 578 (7,9%) больных и 30 265 (19%) пациентов умерли вследствие кардиоваскулярных причин. Назначение тиазолидиндионов ассоциировалось со значительным увеличением риска возникновения СН (78 случаев; RR=1,60; 95% CI=1,21–2,10; p<0,001), ИМ (65 случаев; RR=1,40; 95% CI=1,05–1,86; p=0,02) и смерти (102 случая; RR=1,29; 95% CI=1,02–1,62; p=0,03) по сравнению с использованием других пероральных антидиабетических лекарственных средств или их комбинаций (3478 случаев СН, 3695 ИМ и 5529 случаев смертельного исхода). У авторов исследования возникло предположение, что негативное влияние тиазолидиндионов опосредовано в основном розиглитазоном.
Для проверки этой гипотезы проведен ряд РКИ и метаанализ. В РКИ PROactive (.PROspective pioglitAzone Clinical Trial In macroVascular Events) .включили пациентов с СД 2го типа и предсуществующими документированными кардиоваскулярными заболеваниями с высоким риском возникновения СН (n=5238), получающих пиоглитазон или плацебо (Erdmann E. et al., 2007).
Больные с манифестной СН II–IV ФК (New York Heart Association) не входили в число отобранных лиц. Результаты анализа полученных данных свидетельствуют о том, что в группе пиоглитазона частота впервые возникшей СН достоверно выше, чем в группе плацебо (5,7% против 4,1%; p=0,007). Однако смертность вследствие СН в обеих группах была сопоставимой (25 из 2605 [0,96%] для пиоглитазона против 22 из 2633 [0,84%] для плацебо; p=0,639). Более того, в группе лиц с впервые диагностированной СН, принимавших пиоглитазон, общая смертность оказалась достоверно ниже, чем в группе плацебо (40 из 149 [26,8%] для пиоглитазона против 37 из 108 [34,3%] для плацебо; p=0,1338). Соответственно для больных из группы пиоглитазона по сравнению с плацебо было зарегистрировано достоверно меньшее количество кардиоваскулярных событий (47,7% против 57,4%; p=0,0593).
При сопоставлении результатов четырех крупных исследований PROactive, ADOPT, DREAM и RECORD оказалось, что риск возникновения СН в когорте больных СД составляет OR=1,43 — при назначении пиоглитазона (против плацебо) в РКИ .PROactive trial, OR=1,22 — при назначении розиглитазона (против метформина) в РКИ ADOPT, OR=.2,15 — при назначении розиглитазона (против метформина или препаратов сульфонилмочевины) в РКИ RECORD. В целом относительный риск манифестации СН при назначении тиазолидиндионов в четырех РКИ варьировал от 1,06 до 1,76 по сравнению с другими пероральными антидиабетическими средствами. Это позволило авторам исследования заключить, что потенциальный риск применения тиазолидиндионов при лечении СД у больных с СН превышает их пользу (De Flines J., Scheen A. J., 2007).
Метаанализ, основанный на результатах наблюдения за 6421 пациентом, принимавшим розиглитазон по поводу СД на протяжении 1–4 лет, показал, что препарат способствует значительному повышению риска ИМ (RR=1,42; 95% CI=1,06–.1,91;р=0,02) и СН (RR=2,09; 95% CI=1,52–2,88; р<0,001) без повышения риска кардиоваскулярной смертности (RR=0,90; 95% CI=0,63.–1,26; р=0,53) (Singh S. et .al, 2007a). Обращает внимание отсутствие серьезной гетерогенности по этим конечным точкам в популяции пациентов, включенных в метаанализ (I2=0% для ИМ, I2=18% для СН и I2=0% для кардиоваскулярной смертности).
Подобные результаты были получены и для пиоглитазона. Так, A. M .Lincoff и соавторы (2007), проанализировав 19 РКИ (n=16 390) продолжительностью от 4 мес до 3,5 лет, пришли к заключению, что лечение пиоглитазоном пациентов с СД 2го типа ассоциируется с достоверным снижением частоты ИМ, кардиоваскулярной смертности и инсульта (HR=0,82; 95% CI=0,72–0,94; р=0,005) и, напротив, повышением риска манифестации СН (HR=1,41; 95% CI=1,14–1,76; р=0,002). Таким образом, пиоглитазон, в отличие от розиглитазона, не приводит к повышению риска возникновения инсульта, ИМ и кардиоваскулярной смерти. Однако негативное влияние в отношении возникновения и прогрессирования СН у обоих препаратов сохраняется.
Таким образом, тиазолидиндионы не должны рутинно применяться у пациентов с СН и СД, а также у пациентов с СД, у которых особенно высокий риск манифестации дисфункции ЛЖ и ФВ ЛЖ менее 40% (Nesto R. W. et al., 2004; Shah M. et al., 2004; Granberry M. C. et al., 2007). Этот вывод касается применения препаратов этой группы как в высоких, так и низких дозах соответственно (Gerstein H. C. et al., 2006; Richter B. et al., 2006).
Препараты сульфонилмочевины Несколько РКИ формально оценивали влияние использования препаратов сульфонилмочевины на эволюцию СН у больных СД 2-го типа. Вместе с тем во многих ограниченных исследованиях, посвященных взаимосвязи применения любых сахароснижающих средств и прогнозу СН, эта группа лекарственных средств назначалась почти в 55% случаев. F A Masoudi. и соавторы (2005) не обнаружили негативного влияния препаратов сульфонилмочевины на ближайший и отдаленный прогноз по сравнению с инсулином, метформином, тиазолидиндионами, ингибиторами альфа-глюкозидазы (HR=0,99; 85% CI=0,91–1,08).
Существуют два специально спланированных исследования, целью которых явилось изучение влияния препаратов сульфонилмочевины на кардиоваскулярный риск у больных, перенесших ИМ. В одном из них в качестве препарата сравнения был метформин (.Johnson J. A. et. al., 2002), а в другом плацебо (Garratt K. N. et al., 1999). Анализ полученных результатов показал, что препараты сульфонилмочевины уступают метформину по способности редуцировать кардиоваскулярные риски и по сравнению с плацебо могут увеличивать количество сердечнососудистых событий и смертность. С другой стороны, некоторые исследователи полагают, что подобный эффект может иметь дозозависимый характер (Simpson S. H. et al., 2006; Snoek F. J., 2007). Вместе с тем в ряде РКИ (Masoudi F. A. et al., 2005) и метаанализе не подтверждена способность препаратов сульфонилмочевины к повышению кардиоваскулярного риска (Gangji A. S. et al., 2007).
ЗАКЛЮЧЕНИЕ
Таким образом, к настоящему времени отсутствует научно обоснованная концепция лечения СД у пациентов с манифестной СН или сниженной ФВ ЛЖ. Современная стратегия лечения СД более основана на экстраполяции данных РКИ, проведенных в когорте широко круга пациентов с СД. Ограниченность данных доказательной медицины привела к серьезной дискуссии о возможности использования инсулина и тиазолидиндионов у пациентов с высоким риском возникновения СН. С другой стороны, научный поиск привел к подтверждению существующего мнения о высокой эффективности и безопасности ряда антидиабетических лекарственных средств у пациентов с СД в сочетании с дисфункцией ЛЖ (метформин, препараты сульфонилмочевины). Очевидно, недостаточность научных данных серьезно ограничивает наши возможности в отношении контроля за эволюцией одного из наиболее грозных факторов риска СН — СД. Это приводит к необходимости продолжения клинических исследований в этом направлении.
ЛИТЕРАТУРА
Adachi H., Ohno T., Oguri M. et al. (2007) Effect of insulin sensitivity on severity of heart failure. Diabetes Res. Clin. Pract., 77(Suppl. 1): S258– S262.
Aguilar D., Bozkurt B., Pritchett A. et al. (2007) The impact of thiazolidinedione use on outcomes in ambulatory patients with diabetes mellitus and heart failure. J. Am. Coll. Cardiol., 50(1): 32–36.
Amato L., Paolisso G., Cacciatore F. et al. (1997) Congestive heart failure predicts the development of noninsulin-dependent diabetes mellitus in the elderly. The Osservatorio Geriatrico Regione Campania Group. Diabetes Metab., 23(3): 213–218.
Bano K.A., Batool A. (2007) Metabolic syndrome, cardiovascular disease and type-2 diabetes. J. Pak. Med. Assoc., 57(10): 511–555.
Bell D.S. (2003) Heart failure: the frequent, forgotten, and often fatal complication of diabetes. Diabetes Care,26(8): 2433–2441.
Betteridge D.J. (2007) Effects of pioglitazone on lipid and lipoprotein metabolism. Diabetes Obes. Metab., 9(5):640–647.
Bolen S., Feldman L., Vassy J. et al. (2007) Systematic review: comparative effectiveness and safety of oral medications for type 2 diabetes mellitus. Ann. Intern. Med.,147(6): 386–399.
Chae C.U., Glynn T.J., Manson J.E. et al. (1998) Diabetes predicts congestive heart failure risk in the elderly. Circulation, 98(Suppl. I): 721.
Dargie H.J., Hildebrandt P.R., Riegger G.A. et al. (2007) A randomized, placebo-controlled trial assessing the effects of rosiglitazone on echocardiographic function and cardiac status in type 2 diabetic patients with New York Heart Association Functional Class I or II Heart Failure. J. Am. Coll. Cardiol., 49(16): 1696–1704.
De Flines J., Scheen A.J. (2007) Glitazones and congestive heart failure: update on PROactive, ADOPT, DREAM and RECORD clinical trials. Rev. Med. Suisse, 3(122):1876, 1878–1883.
De Groote P., Lamblin N., Mouquet F. et al. (2004) Impact of diabetes mellitus on long-term survival in patients with congestive heart failure. Eur. Heart J., 25(8): 656–662.
Deeks E.D., Keam S.J. (2007) Rosiglitazone: A Review of its Use in Type 2 Diabetes Mellitus. Drugs. 67(18): 2747–2779.
Delea T.E., Edelsberg J.S., Hagiwara M. et al. (2003) Use of thiazolidinediones and risk of heart failure in people with type 2 diabetes: a retrospective cohort study. Diabetes Care, 26(11): 2983–2989.
Derosa G., D’Angelo A., Ragonesi P.D. et al. (2006) Metformin-pioglitazone and metformin-rosiglitazone effects on non-conventional cardiovascular risk factors plasma level in type 2 diabetic patients with metabolic syndrome. J. Clin. Pharm. Ther., 31(4): 375–383.
Derosa G., Fogari E., Cicero A.F. et al. (2007) Blood pressure control and inflammatory markers in type 2 diabetic patients treated with pioglitazone or rosiglitazone and metformin. Hypertens. Res., 30(5): 387–394.
Eguchi K., Tomizawa H., Ishikawa J. et al. (2007) Comparison of the effects of pioglitazone and metformin on insulin resistance and hormonal markers in patients with impaired glucose tolerance and early diabetes. Hypertens. Res., 30(1): 23–30.
Emslie-Smith A.M., Boyle D.I., Evans J.M. et al.; DARTS/ MEMO Collaboration (2001) Contraindications to metformin therapy in patients with type 2 diabetes — a populationbased study of adherence to prescribing guidelines. Diabet. Med., 18(6): 483–488.
Erdmann E., Charbonnel B., Wilcox R.G. et al.; PROactive investigators (2007) Pioglitazone use and heart failure in patients with type 2 diabetes and preexisting cardiovascular disease: data from the PROactive study (PROactive 08). Diabetes Care, 30(11): 2773–2778.
Eshaghian S., Horwich T.B., Fonarow G.C. (2006) An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure. Am. Heart J., 151(1): 91.
Eurich D.T., Majumdar S.R., McAlister F.A. et al. (2005) Improved clinical outcomes associated with metformin in patients with diabetes and heart failure. Diabetes Care,28(10): 2345–2351.
Eurich D.T., McAlister F.A., Blackburn D.F. et al. (2007) Benefits and harms of antidiabetic agents in patients with diabetes and heart failure: systematic review. BMJ,335(7618): 497.
Ezekowitz J., McAlister F.A., Humphries K.H. et al. (2004) The association among renal insufficiency, pharmacotherapy, and outcomes in 6,427 patients with heart failure and coronary artery disease. J. Am. Coll. Cardiol., 44(8): 1587–1592.
Fonarow G.C. (2004) Approach to the management of diabetic patients with heart failure: role of thiazolidinediones. Am. Heart J., 148(4): 551–558.
Fuchtenbusch M., Standl E., Otter W., Hummel M. (2007) Diabetes mellitus and heart failure. MMW Fortschr. Med.,149(37): 41–44.
Gangji A.S., Cukierman T., Gerstein H.C. et al. (2007) A systematic review and meta-analysis of hypoglycemia and cardiovascular events: a comparison of glyburide with other secretagogues and with insulin. Diabetes Care, 30(2):389–394.
Garratt K.N., Brady P.A., Hassinger N.L. et al. (1999) Sulfonylurea drugs increase early mortality in patients with diabetes mellitus after direct angioplasty for acute myocardial infarction. J. Am. Coll. Cardiol., 33(1): 119–124.
Gerstein H., Yusuf S., Riddle M.C. et al.; Origin Trial Investigators (2008) Rationale, design, and baseline characteristics for a large international trial of cardiovascular disease prevention in people with dysglycemia: the ORIGIN Trial (Outcome Reduction with an Initial Glargine Intervention). Am. Heart J., 155(1): 26–32.
Gerstein H.C., Yusuf S., Bosch J. et al.; DREAM (Diabetes REduction Assessment with ramipril and rosiglitazone Medication) Trial Investigators (2006) Effect of rosiglitazone on the frequency of diabetes in patients with impaired glucose tolerance or impaired fasting glucose: a randomised controlled trial. Lancet, 368(9541): 1096–1105.
Granberry M.C., Hawkins J.B., Franks A.M. (2007) Thiazolidinediones in patients with type 2 diabetes mellitus and heart failure. Am. J. Health Syst. Pharm., 64(9): 931–936.
Haberbosch W. (2007) Effects of thiazolidinediones on dyslipidemia in patients with type 2 diabetes. Are all equally vasoprotective? Herz, 32(1): 51–57.
Held C., Gerstein H.C., Yusuf S. et al.; ONTARGET/ TRANSCEND Investigators (2007) Glucose levels predict hospitalization for congestive heart failure in patients at high cardiovascular risk. Circulation, 115(11): 1371–1375.
Holstein A., Nahrwold D., Hinze S., Egberts E.H. (1999) Contra-indications to metformin therapy are largely disregarded. Diabet. Med., 16(8): 692–696.
Home P.D., Pocock S.J., Beck-Nielsen H. et al.; RECORD Study Group (2007) Rosiglitazone evaluated for cardiovascular outcomes — an interim analysis. N. Engl. J. Med., 357(1): 28–38.
Horlen C., Malone R., Bryant B. et al. (2002) Frequency of inappropriate metformin prescriptions. JAMA, 287(19):2504–2505.
Inzucchi S.E., Masoudi F.A., Wang Y.F. et al. (2005) Insulinsensitizing antihyperglycemic drugs and mortality after acute myocardial infarction — Insights from the National Heart Care Project. Diabetes Care, 28(7): 1680–1689.
Iribarren C., Karter A.J., Go A.S. et al. (2001) Glycemic control and heart failure among adult patients with diabetes. Circulation, 103(22): 2668–2673.
Johnson J.A., Majumdar S.R., Simpson S.H., Toth E.L. (2002) Decreased mortality associated with metformin use compared to sulfonylurea monotherapy in type 2 diabetes mellitus. Diabetes Care, 25(12): 2244–2248.
Kahn S.E., Haffner S.M., Heise M.A. et al.; ADOPT Study Group (2006) Glycemic durability of rosiglitazone, metformin, or glyburide monotherapy. N. Engl. J. Med.,355(23): 2427–2443.
Kannel W.B., Hjortland M., Castelli W.P. (1974) Role of diabetes in congestive heart failure: the Framingham study. Am. J. Cardiol., 34(1): 29–34.
Karter A.J., Ahmed A.T., Liu J. et al. (2005) Pioglitazone initiation and subsequent hospitalization for congestive heart failure. Diabet. Med., 22(8): 986–993.
Lago R.M., Singh P.P., Nesto R.W. (2007) Congestive heart failure and cardiovascular death in patients with prediabetes and type 2 diabetes given thiazolidinediones: a meta-analysis of randomised clinical trials. Lancet,370(9593): 1129–1136.
Lincoff A.M., Wolski K., Nicholls S.J., Nissen S.E. (2007) Pioglitazone and risk of cardiovascular events in patients with type 2 diabetes mellitus: a meta-analysis of randomized trials. JAMA, 298(10): 1180–1188.
Lipscombe L.L., Gomes T., Levesque L.E. et al. (2007) Thiazolidinediones and cardiovascular outcomes in older patients with diabetes. JAMA, 298(22):2634–2643.
Majumdar S.R., McAlister F.A., Cree M. et al.; ATLAS Study Group (2004) Do evidence-based treatments provide incremental benefits to patients with congestive heart failure already receiving angiotensin-converting enzyme inhibitors? A secondary analysis of one-year outcomes from the assessment of treatment with lisinopril and survival (ATLAS) study. Clin. Ther., 26(5): 694–703.
Maru S., Koch G.G., Stender M. et al. (2005) Antidiabetic drugs and heart failure risk in patients with type 2 diabetes in the U.K. primary care setting. Diabetes Care, 28(1): 20–26.
Masoudi F.A., Inzucchi S.E. (2007) Diabetes mellitus and heart failure: epidemiology, mechanisms, and pharmacotherapy. Am. J. Cardiol., 99(4A): 113B–132B.
Masoudi F.A., Inzucchi S.E., Wang Y. et al. (2005) Thiazolidinediones, metformin, and outcomes in older patients with diabetes and heart failure: an observational study. Circulation, 111(5): 583–590.
Mudaliar S., Chang A.R., Henry R.R. (2003) Thiazolidinediones, peripheral edema, and type 2 diabetes: incidence, pathophysiology, and clinical implications. Endocr. Pract., 9(5): 406–416.
Murcia A.M., Hennekens C.H., Lamas G.A. et al. (2004) Impact of diabetes on mortality in patients with myocardial infarction and left ventricular dysfunction. Arch. Intern. Med., 164(20): 2273–2279.
Nesto R.W., Bell D., Bonow R.O. et al. (2004)Thiazolidinedione use, fluid retention, and congestive heart failure: a consensus statement from the American Heart Association and American Diabetes Association. Diabetes Care, 27(1):256–263.
Nichols G.A., Gullion C.M., Koro C.E. et al. (2004) The incidence of congestive heart failure in type 2 diabetes: an update. Diabetes Care, 27(8): 1879–1884.
Nichols G.A., Hillier T.A., Erbey J.R., Brown J.B. (2001) Congestive heart failure in type 2 diabetes: prevalence, incidence, and risk factors. Diabetes Care, 24(9): 1614–1619.
Nichols G.A., Koro C.E., Gullion C.M. et al. (2005) The incidence of congestive heart failure associated with antidiabetic therapies. Diabetes Metab. Res. Rev., 21(1):51–57.
Nissen S.E., Wolski K. (2007) Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N. Engl. J. Med., 356(24): 2457–2471.
Padwal R., Majumdar S.R., Johnson J.A. et al. (2005) Asystematic review of drug therapy to delay or prevent type2 diabetes. Diabetes Care, 28(3): 736–744.
Peters A.L. (2007) Identification of appropriate patients for cardiometabolic risk management. Rev. Cardiovasc. Med., 8(Suppl. 4): S9– S16.
Pfeffer M.A., Swedberg K., Granger C.B. et al.; CHARM Investigators and Committees (2003) Effects of candesartan on mortality and morbidity in patients with chronic heart failure: the CHARM-Overall programme. Lancet, 362(9386):759–766.
Pocock S.J., Wang D., Pfeffer M.A. et al. (2006) Predictors of mortality and morbidity in patients with chronic heart failure. Eur. Heart J., 27(1): 65–75.
Rajagopalan R., Rosenson R.S., Fernandes A.W. et al. (2004) Association between congestive heart failure and hospitalization in patients with type 2 diabetes mellitus receiving treatment with insulin or pioglitazone: a retrospective data analysis. Clin. Ther., 26(9): 1400–1410.
Reis S.E., Holubkov R., Edmundowicz D. et al. (1997) Treatment of patients admitted to the hospital with congestive heart failure: specialty-related disparities in practice patterns and outcomes. J. Am. Coll. Cardiol., 30(3):733–738.
Richter B., Bandeira-Echtler E., Bergerhoff K. et al. (2006) Pioglitazone for type 2 diabetes mellitus. Cochrane Database of Systemic Reviews, Issue 4, CD006060.
Rottlaender D., Michels G., Erdmann E., Hoppe U.C. (2007) Therapy with glitazones — a risk for cardiovascular disease? Dtsch. Med. Wochenschr., 132(49): 2629–2632.
Scarpello J.H. (2003) Improving survival with metformin:the evidence base today. Diabetes Metab., 29 (4 Pt 2): 6S36–43.
Scheen A.J. (2007) ADOPT study: which first-line glucose-lowering oral medication in type 2 diabetes? Rev. Med. Liege., 62(1): 48–52.
Shah M., Kolandaivelu A., Fearon W.F. (2004) Pioglitazone-induced heart failure despite normal left ventricular function. Am. J. Med., 117(12): 973–974.
Simpson S.H., Majumdar S.R., Tsuyuki R.T. et al. (2006) Dose-response relation between sulfonylurea drugs and mortality in type 2 diabetes mellitus: a population-based cohort study. CMAJ, 174(2): 169–174.
Singh S., Loke Y.K., Furberg C.D. (2007a) Long-term risk of cardiovascular events with rosiglitazone: a meta-analysis. JAMA, 298(10): 1189–1195.
Singh S., Loke Y.K., Furberg C.D. (2007b) Thiazolidinediones and heart failure a teleo-analysis. Diabetes Care, 30(8):2148–2153.
Smooke S., Horwich T.B., Fonarow G.C. (2005) Insulintreated diabetes is associated with a marked increase in mortality in patients with advanced heart failure. Am. Heart J., 149(1): 168–174.
Snoek F.J. (2007) Self management of type 2 diabetes. BMJ, 335(7618): 458–459.
Stratton I.M., Adler A.I., Neil H.A. et al. (2000) Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study. BMJ, 321(7258): 405–412.
Thomas M.L., Lloyd S.J. (2001) Pulmonary edema associated with rosiglitazone and troglitazone. Ann. Pharmacother., 35(1): 123–124.
Turkmen Kemal Y., Guvener Demirag N., Yildirir A. et al. (2007) Effects of rosiglitazone on plasma brain natriuretic peptide levels and myocardial performance index in patients with type 2 diabetes mellitus. Acta Diabetol., 44(3):149–156.
UK Prospective Diabetes Study Group (1998) Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet, 352(9131): 854–865.
Yki-Jarvinen H. (2005) The PROactive study: some answers, many questions. Lancet, 366(9493): 1241–1242.












Комментировать