Несахарный диабет. Этиология, патогенез, клиническая картина, диагностика и лечение. Симптоматика.
Пигарова Е.А., ФГУ «Эндокринологический научный центр», г. Москва, Россия
Резюме
Несахарный диабет является тяжелым заболеванием, имеющим в своей основе дефект синтеза, секреции или действия аргинин-вазопрессина, что приводит к утрате способности почек реабсорбировать воду и концентрировать мочу и проявляется выраженной жаждой и экскрецией большого количества разведенной мочи. Распространенность его в популяции составляет 0,004–0,01 % с пиком заболеваемости в 20–30 лет. Выделяют несколько типов несахарного диабета, характеристика, патогенез, клиническая картина и дифференциальная диагностика которых освещены в данной лекции. Представлены также современные подходы к лечению различных типов несахарного диабета и приведены варианты наиболее эффективных схем медикаментозной терапии в зависимости от этиологии заболевания и сопутствующих осложнений.
Несахарный диабет (НД) (лат. diabetes insipidus) — тяжелое заболевание, имеющее в своей основе дефект синтеза, секреции или действия аргинин-вазопрессина (АВП), что приводит к утрате способности почек реабсорбировать воду и концентрировать мочу, и проявляющееся выраженной жаждой и экскрецией большого количества разведенной мочи.
Гормон АВП является самым важным регулятором водно-электролитного обмена в организме человека. Его функция заключается в поддержании осмотического гомеостаза и объема циркулирующей жидкости. АВП синтезируется в телах нейронов, образующих супраоптическое и паравентрикулярное ядра гипоталамуса, связывается с белком-носителем нейрофизином [3, 4]. Комплекс «АВП — нейрофизин» в виде гранул транспортируется к терминальным расширениям аксонов нейрогипофиза и срединного возвышения, где накапливается и секретируется в кровь [7, 14].
После попадания в кровь АВП связывается с вазопрессиновыми рецепторами 2-го типа (V2) на базальной мембране клеток собирательных канальцев почек, активация которых приводит к каскаду и встраиванию белка «водной поры», аквапорина-2, на поверхность апикальной мембраны, а аквапорина-3 и -4 — на поверхность базальной мембраны клеток собирательных канальцев, что повышает проницаемость клеток для воды и обеспечивает ее реабсорбцию из просвета канальцев обратно в кровяное русло, уменьшает диурез [8, 9, 13].
Эпидемиология
Распространенность НД, как было показано на московской популяции, составляет 0,004 %, что полностью сопоставимо с данными зарубежных источников (0,004–0,01 %) [5, 21, 23]. Отмечается мировая тенденция к росту распространенности НД, в частности за счет его центральной формы, что связывают с повышением числа оперативных вмешательств, проводимых на головном мозге, а также количества черепно-мозговых травм, при которых случаи развития НД составляют до 30 % [12, 17, 20]. Считается, что НД одинаково часто страдают как женщины, так и мужчины, но, по данным ФГУ «Эндокринологический научный центр» (ЭНЦ), соотношение заболеваемости женщин и мужчин составляет 2,2 : 1. Пик заболеваемости приходится на вторую-третью декады жизни [1, 2, 9].
Патогенез и клиническая симптоматика
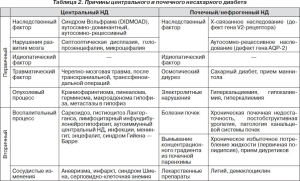
Выделяют несколько различающихся по патогенезу типов НД, которые представлены в табл. 1.
При НД, за исключением первичной полидипсии, абсолютная (отсутствие/снижение гормона в крови) или относительная (резистентность к действию гормона) недостаточность АВП проявляется снижением реабсорбции воды в почках и выделением большого количества неконцентрированной мочи, что приводит к дегидратации (дефициту внутриклеточной и внутрисосудистой жидкости), развитию гиперосмоляльности плазмы, активации осморецепторов гипоталамуса и возникновению жажды [10, 16, 24, 25].
Основные симптомы НД [1]:
— жажда (полидипсия; количество выпиваемой жидкости колеблется от 3 до 20 л);
— обильное, учащенное мочеиспускание (полиурия), ночное мочеиспускание (никтурия);
— общая дегидратация (сухость кожи и слизистых оболочек, уменьшение слюнои потоотделения; при неадекватности восполнения потерь жидкости наступает резко выраженная дегидратация, проявляющаяся общей слабостью, головными болями, тошнотой, рвотой, лихорадкой, судорогами, тахикардией, сгущением крови, коллаптоидными состояниями или психомоторными возбуждениями);
— желудочно-кишечные проявления (постоянная перегрузка водой приводит к растяжению желудка, снижению секреторной функции желудочно-кишечного тракта, запорам).
При первичной полидипсии не выявляется какого-либо дефицита секреции или действия АВП [23]. Причинами заболевания, как правило, служат снижение порога чувствительности центра жажды, когда пациент чувствует жажду при совершенно нормальной или даже сниженной концентрации электролитов/осмоляльности крови, а также избыточный прием жидкости вследствие компульсивного (маниакального) желания пить, что может наблюдаться при манифестации различных психических заболеваний. Объем циркулирующей жидкости в организме у таких пациентов повышен, поэтому для клинической картины не характерно наличие симптомов дегидратации — напротив, пациенты могут предъявлять жалобы на потливость или слюнотечение. Разведение крови проявляется снижением уровней электролитов/осмоляльности, что приводит к физиологическому блоку синтеза и секреции АВП и, таким образом, к водному диурезу, целью которого является выведение лишней воды, поступившей в организм [4, 6, 18, 22, 26].
Дифференциальная диагностика
В клинической практике, как правило, приходится проводить дифференциальную диагностику между тремя основными типами НД: центральным НД, почечным НД и первичной полидипсией, разделение которых крайне важно для назначения патогенетического лечения, предупреждения потенциально опасных побочных эффектов неправомерно назначенного лечения и для дальнейшего направленного поиска причин заболевания (табл. 2) [2].
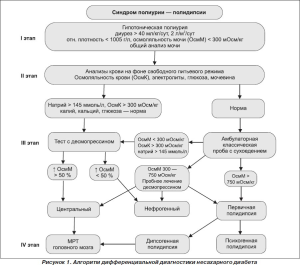
В ФГУ ЭНЦ разработан диагностический алгоритм заболевания. Дифференциальная диагностика НД базируется на четырех основных этапах: на первом подтверждается гипотоническая полиурия у пациентов с синдромом полиурии — полидипсии, на втором исключаются наиболее распространенные причины нефрогенного НД (сахарный диабет, гиперкальциемия, гиперкалиемия, гипокалиемия, хроническая почечная недостаточность, мочевая инфекция и др.), на третьем проводятся проба с сухоедением и тест с десмопрессином для исключения первичной полидипсии и нефрогенного НД соответственно, на четвертом ведется активный поиск причин, например при подтверждении центрального НД осуществляется МРТ-исследование головного мозга [2, 22, 23] (рис. 1).
Измерение осмотической концентрации крови и мочи при проведении дифференциальной диагностики НД имеет первостепенное значение, так как именно этот показатель влияет на секрецию АВП через осморецепторы гипоталамуса и является косвенным показателем действия гормона на V2-рецепторы почек [14, 18]. В норме осмоляльность крови составляет 280–300 мОсм/кг, ночной или максимально концентрированной порции мочи — 600–1200 мОсм/кг. Определение относительной плотности мочи менее специфично для НД и имеет некоторые ограничения, такие как невозможность измерения этого показателя в крови, выраженная зависимость результата от присутствия клеточных и неклеточных элементов (клеток крови, эпителия, бактерий и др.) и ошибки диагностики [23, 24]. Как было показано в исследованиях, проводившихся в ФГУ ЭНЦ, определение относительной плотности мочи для диагностики НД сопряжено с гипердиагностикой заболевания более чем у 15 % пациентов и неправомерным назначением десмопрессина.
Осмотическая концентрация может измеряться специальным прибором — осмометром — по снижению точки замерзания жидкости или рассчитываться по формуле из показателей биохимического анализа, которая имеет следующий вид: Осмолярность = 2 × × [Na (ммоль/л) + К (ммоль/л)] + глюкоза (ммоль/л) + + мочевина (ммоль/л) + 0,03 × общий белок (г/л).
Лечение
История лечения центрального НД берет свое начало с 1912 г., с первого применения при этом заболевании вытяжки задней доли гипофиза. В 1954 г. американский биохимик Vincent du Vigneaud описал структуру и синтезировал АВП, годом позже за эти успехи ему была присуждена Нобелевская премия. Препараты синтетического АВП обладали теми же недостатками, что и эндогенный АВП, — очень низкой эффективностью и малой продолжительностью действия, частыми побочными явлениями при интраназальном применении. Таннат АВП (питрессин), максимальная длительность действия которого составляла 5–6 дней, в то время считался наиболее эффективным. Причинами ограничения его применения были болезненность внутримышечных инъекций, развитие абсцессов в месте введения, частые эпизоды передозировки препарата. Переломным моментом стало появление в 1974 г. десмопрессина — синтетического аналога природного АВП, специфического агониста V2-рецепторов, лишенного сосудосуживающей активности и обладающего более выраженным и продолжительным антидиуретическим эффектом [3, 19].
Более 30 лет в заместительной терапии центрального НД применялся десмопрессин в каплях для интраназального введения (адиуретин). В настоящее время в России имеются две формы десмопрессина: таблетки минирин (Ferring, Швеция) и спрей назальный дозированный пресайнекс (Mipharm, Италия).
При центральном НД назначается терапия десмопрессином в начальной дозе 0,1 мг 2–3 раза в сутки внутрь за 30–40 минут до или через 2 часа после еды либо 10 мкг 2 раза в сутки интраназально. Как было показано при обследовании пациентов, получающих постоянную терапию десмопрессином, в ФГУ ЭНЦ, средние суточные дозы препарата для лечения центрального НД варьируют от 0,1 до 1,6 мг внутрь и от 10 до 40 мкг интраназально, что обусловлено индивидуальной чувствительностью к препарату и особенностями кишечного и назального всасывания [4, 5, 22, 25]. Потребность в препарате зачастую не коррелирует с объемом выпиваемой/выделяемой жидкости без лечения, индексом массы тела или полом пациента. Однако отмечено, что наименьшая потребность в препарате (0,1–0,2 мг/сут) характерна для пациентов с центральным НД послеоперационного и травматического генеза, а самая высокая потребность (до 1,2–2,4 мг/сут в 5–6 приемов) — для некоторых пациентов с идиопатическим вариантом центрального НД [5].
При использовании препарата внутрь натощак антидиуретическая активность наступает в течение 1 часа и длится от 7 до 12 часов. Интраназальное применение характеризуется более быстрым началом действия — через 15–30 минут. Прием препарата внутрь с пищей снижает его биодоступность и, следовательно, выраженность и продолжительность действия, поэтому при невозможности приема натощак (что нередко бывает при кратности назначения более 2 раз в сутки в середине дня) возможен прием под язык до полного рассасывания. Разжевывание или другое измельчение таблетки не снижает эффективности препарата. При простудных или аллергических заболеваниях, сопровождающихся отеком слизистой носа и невозможностью интраназального применения десмопрессина, распыление препарата в полость рта в дозах, превышающих интраназальные в 1,5–2 раза, может помочь компенсировать симптомы полиурии — полидипсии [11,23].
В случае необходимости смены одной формы десмопрессина на другую можно воспользоваться следующим ориентировочным пересчетом дозы: клиническая эффективность 0,2 мг таблетированного десмопрессина равна таковой у 10 мкг интраназального. На практике таблетированная форма более удобна при небольшой (до 0,4 мг/сут) потребности пациента в препарате, так как таблетки выпускаются в двух различных дозировках (0,1 и 0,2 мг) и при необходимости легко делятся на части. Интраназальная форма бывает практически незаменима у пациентов с высокой потребностью в препарате (более 40 мкг/сут), которые составляют примерно 10–15 % от всех пациентов с центральным НД.
Основная цель лечения десмопрессином — подбор минимально эффективной дозы препарата для купирования избыточной жажды и полиурии. Не следует ставить целью лечения обязательное повышение относительной плотности мочи, особенно в каждой из проб анализа мочи по Зимницкому, поскольку не у всех пациентов с центральным НД на фоне клинической компенсации заболевания достигаются нормальные показатели концентрационной функции почек (с учетом физиологической вариабельности концентрации мочи в течение дня, пожилого возраста, сопутствующей патологии почек и др.) [14, 22, 23].
При лечении десмопрессином необходимо инструктировать пациентов о правилах питьевого режима — рекомендовать им пить только при жажде, избегать приема избыточных объемов жидкости.
Залог успеха лечения центрального НД заключается в адекватной чувствительности центра жажды, нарушения которой могут сопутствовать и осложнять течение НД [5, 15, 18, 26]. При изменении функционального состояния центра жажды в сторону снижения порога чувствительности, гипердипсии, пациенты предрасположены к развитию такого осложнения терапии десмопрессином, как водная интоксикация, являющаяся потенциальным жизнеугрожающим состоянием [8]. Таким пациентам рекомендуется периодически пропускать приемы препарата для выделения задержанного избытка жидкости или принимать жидкость фиксированно [2, 6].
Состояние адипсии при центральном НД может проявляться чередованием эпизодов гипои гипернатриемии [2].
Ведение таких пациентов осуществляется при фиксированном ежедневном объеме потребления жидкости или с рекомендациями приема жидкости в объеме выделенной мочи. Пациентам с нарушением ощущения жажды требуется особый динамический контроль состояния с ежемесячным, а в некоторых случаях и более частым определением осмоляльности и концентрации натрия крови.
Особого внимания требует лечение центрального НД после нейрохирургических вмешательств или черепно-мозговых травм, поскольку до 75 % случаев заболевания имеют транзиторное, а 3–5 % — трехфазное течение (I фаза — 5–7 дней — центральный НД; II фаза — 7–10 дней — синдром неадекватной секреции АВП; III фаза — постоянный центральный НД) [12, 17, 20]. После операции на головном мозге или черепномозговой травмы лечение десмопрессином назначается при наличии симптомов НД (полидипсии, полиурии, гипернатриемии, гиперосмоляльности крови) в дозе 0,05–0,1 мг 2–3 раза в сутки. Каждые 1–3 дня оценивается необходимость приема препарата: пропускается очередная доза, контролируется возобновление симптомов НД. Через 3–4 недели назначается постоянная терапия в подобранной дозе. Такой подход позволяет избежать возможных осложнений лечения, связанных с транзиторным или трехфазным течением центрального НД, которые проявляются водной интоксикацией (гипонатриемией, повышением артериального давления, отеками, слабостью, снижением уровня сознания вплоть до комы). Учитывая высокую вероятность ремиссии послеоперационного центрального НД, которая обычно приходится на 3–6-й месяц после операции, при выписке из стационара пациента целесообразно инструктировать о симптомах водной интоксикации и мерах по ее предотвращению и лечению (рекомендовать снижение дозы/отмену десмопрессина, в тяжелых случаях — применение фуросемида) [8, 12, 17].
Каких-либо контролированных исследований по применению десмопрессина у беременных женщин не проводилось. В настоящее время известно о более чем 150 случаях использования десмопрессина у беременных без вреда для женщины и плода. Десмопрессин для матери в терапевтических дозах трансплацентарный барьер не проходит. Репродуктивные исследования на крысах и кроликах изменений у плодов на фоне приема препарата не выявили. Поэтому при наступлении беременности у пациентки с центральным НД лечение препаратом продолжают в необходимых дозах, которые практически не нуждаются в коррекции [22, 23]. НД при беременности нередко выделяют как отдельный тип НД — гестагенный (табл. 1). Диагностика и лечение гестагенного НД не отличаются от таковых при центральном НД. Причиной заболевания служит разрушение эндогенного АВП активными ферментами плаценты — вазопрессиназами [8, 22, 23]. Уровень АВП в крови пациентов снижен. Полиурия начинается обычно в III триместре, а после родов спонтанно исчезает. Поли-урия не реагирует на экзогенный АВП, но поддается лечению десмопрессином [1, 8].
Лечение почечного НД при первичной форме заболевания проводится с помощью тиазидных диуретиков и нестероидных противовоспалительных средств (НПВС). Данное лечение не является патогенетическим, но позволяет уменьшить объем суточной мочи и жажду у большинства пациентов. К сожалению, применение этих препаратов не так эффективно, как терапия десмопрессином при центральном НД, и объем диуреза редко снижается более чем на 50 % от его первоначальных значений. Много вопросов вызывает также безопасность такой терапии, поскольку и тиазидные диуретики, и препараты группы НПВС при продолжительной терапии обладают рядом серьезных побочных эффектов [23]. Применяются гидрохлортиазид в дозах 25–50 мг/сут, ибупрофен — 600–800 мг/сут, индометацин — 25–75 мг/сут. При приобретенном нефрогенном НД в обязательном порядке проводится лечение сопутствующего заболевания (гиперпаратиреоза, гипокалиемии и др.) [2, 14].
Лечение частичных/легких форм НД (с объемом выделяемой мочи менее 4 л в сутки) может проводиться без медикаментозной терапии — назначением потребления достаточных количеств жидкости для удовлетворения жажды [14].
Лечение первичной полидипсии. При психогенной полидипсии в части случаев происходит «выздоровление» после объяснения пациенту причины его заболевания или наглядной демонстрации концентрации мочи при ограничении приема жидкости в ходе дифференциальной диагностики. У некоторых пациентов эффективным бывает назначение карбамазепина в дозе 200–400 мг/сут — облегчение жажды может наблюдаться не сразу, а развиваться постепенно в течение месяца, при отсутствии положительного влияния препарата более 1–2 месяцев продолжение его приема не рекомендовано [8]. Одним из подходов к лечению первичной полидипсии может являться применение десмопрессина в прерывистом режиме, т.е. с обязательным пропуском очередной дозы (от ежедневного до нескольких раз в неделю). Это позволяет сократить объем выделяемой мочи и нивелировать проявления жажды. Но необходимо заметить, что такая терапия подойдет только тем пациентам с первичной полидипсией, которые могут испытывать чувство насыщения жидкостью, у других пациентов неминуемым будет развитие водной интоксикации на фоне приема десмопрессина. В некоторых случаях могут оказаться неэффективными как психотерапия, так и применение психотропных препаратов [14, 23, 25].
Заключение
Таким образом, в лекции представлены последние данные о состоянии проблемы несахарного диабета в настоящее время: эпидемиология, классификация, патогенез, клиническая симптоматика, дифференциальная диагностика, а также подробно обсуждаются современные подходы к лечению несахарного диабета.
Литература
1. Дзеранова Л.К., Назарова Е.А. Минирин в лечении несахарного диабета // Русский медицинский журнал: Эндокринология. — 2005. — Т.13. — № 28(252). — С. 1961-1965.
2. Дзеранова Л.К., Пигарова Е.А. Несахарный диабет // Эндокринология: национальное руководство / Под ред. И.И. Дедова, Г.А. Мельниченко. — М.: ГЭОТАР-Медиа, 2008. — С. 673-677.
3. Дзеранова Л.К., Пигарова Е.А. Центральный несахарный диабет: современные аспекты диагностики и лечения // Лечащий врач. —2006. — № 10. — С. 42-47.
4. Мельниченко Г.А., Петеркова В.А., Фофанова О.В. Диагностика и лечение несахарного диабета: Метод. рекомендации. — М., 2003. — 26 с.
5. Пигарова Е.А. Центральный несахарный диабет: патогенетические и прогностические аспекты, дифференциальная диагностика: Дис. … канд. мед. наук. — М., 2009. —203 с.
6. Пигарова Е.А., Дзеранова Л.К., Рожинская Л.Я. Клинический случай центрального несахарного диабета, осложненного патологией центра жажды // Ожирение и метаболизм. — 2008. —№ 3(16). — С. 28-31.
7. Ball S.G., Baylis P.H. Vasopressin, diabetes, and syndrome of inappropriate antidiuresis // Endocrinology, 5th ed. / Ed. by L.J. De-Groot and J.L. Jameson. — Philadelphia: Saunders, 2006. — 2. —1324-1367.
8. Baylis P.H. Posterior pituitary // Comprehensive Endocrinology, Revised Series / Ed. by Hiroo. — Imura Raven Press; 2 Sub. edition, 1994. — 41-85.
9. Bichet D.G. Chapter 7: The posterior pituitary // The pituitary, 2nd ed. / Ed. by S. Melmed. — Wiley-Blackwell, 2002. — 747 s.
10. Ghirardello S. et al. Current perspective on the pathogenesis of central diabetes insipidus // J. Pediatr. Endocrinol. Metab. — 2005. — 18(7). —631-645.
11. Sheehan J.M. et al. DDAVP use in patients undergoing transsphenoidal surgery for pituitary adenomas // Acta Neurochir. (Wien.). — 2006. —148(3). — 287-291.
12. Adams J.R. et al. Disorders of water metabolism following transsphenoidal pituitary surgery: a single institution’s experience // Pituitary. — 2006. —9(2). — 93-99.
13. Fenton R.A., Moeller H.B. Recent discoveries in vasopressin-regulated aquaporin-2 trafficking// Progress in Brain Research. — Amsterdam; NewYork: B.V. Elsevier, 2008. — Vol. 170. — 571-579.
14. Goodfriend T.L., Friedman A.L., Shenker Y. Chapter 133: Hormonal regulation of electrolyte and water metabolism // Endocrinology, 5th ed. / Ed. by L.J. DeGroot and J.L. Jameson. — Philadelphia: Saunders, 2006. — 2. — 1324-1367.
15. Hawkins R.C. Age and gender as risk factors for hyponatremia and hypernatremia // Clin. Chim. Acta. — 2003. — 337(1–2). — 169-172.
16. Lin M., Liu S.J., Lim I.T. Disorders of water imbalance // Emerg. Med. Clin. North. Am. —2005. — 23(3). — 749-770.
17. Loh J.A., Verbalis J.G. Diabetes insipidus as a complication after pituitary surgery // Nat. Clin. Pract. Endocrinol. Metab. — 2007. — 3(6). — 489-494.
18. McKinley M.J., Johnson A.K. The physiological regulation of thirst and fluid intake // News Physiol. Sci. — 2004. — 19. — 1-6.
19. Manning M. et al. Peptide and nonpeptde agonists and antagonists for the vasopressin and oxytocin V1a, V1b, V2 and OT receptors: research tools and potential therapeutic agents // Progress in Brain Research. — Amsterdam; New York: B.V. Elsevier, 2008. — Vol. 170. — 473-512.
20. Dumont A.S. et al. Postoperative care following pituitary surgery // J. Intensive Care Med. —2005 May — Jun. — 20(3). — 127-140.
21. Prevalence and incidence for diabetes insipidus. US Census Bureau, International Data Base, 2004, http://www.wrongdiagno- sis.com/d/diabetes_insipidus/stats-country.htm (ac-cessed on 01.10.2008).
22. Robertson G.L. Disorders of Neurohypophysis // Harrison’s Principles of Internal. Medicine/ Еd. by E. Braunwald, A.S. Fauci, D.L. Kasper, S.L. Hauser, D.L. Longo and J.L. Jameson. — New York:McGraw-Hill, 2005. — 2097-2101.
23. Robinson A.G., Verbalis J.G. Posterior pituitary // Ch. 9 in William’s textbook of endocrinology,11th ed. — Saunders, 2008. — 2. — 263-273.
24. Saladin K.S. Anatomy & Physiology: The Unity of Form and Function (3nd edition). — McGraw-Hill Science/Engineering/Math, 2003. —635-677.
25. Goldman M.B. et al. The influence of polydipsia on water excretion in hyponatremic, polydipsic, schizophrenic patients // J. Clin. Endocrinol. Metab. — 1996. — 81(4). — 1465-1470.
26. Verbalis J.G. How does the brain sense osmolality? // J. Am. Soc. Nephrol. — 2007. —18(12). — 3056-3059.









Комментировать