Роль постпрандіальної гіперглікемії у патогенезі серцево-судинних ускладнень діабету. Експериментальне вивчення механізмів дії гострої гіперглікемії на кровопостачання, метаболізм та функцію міокарда.
А.І. Хомазюк, О.П. Нещерет, І.В. Гончар, Н.В. Охріменко
Інститут ендокринології та обміну речовин ім. В.П. Комісаренка АМН України, м. Київ
Дані клінічних досліджень свідчать, що у патогенезі серцево-судинних ускладнень цукрового діабету відіграє вважливу роль не стільки рівень глікемії натще, скільки періодичне підвищення рівнів глікемії, які зумовлені прийманням їжі – так звані постпрандіальні гіперглікемії. Результати проведених досліджень з цієї проблеми були нещодавно узагальнені в кількох оглядах [6, 7].
Дані про роль постпрандіальної гіперглікемії у патогенезі серцево-судинних ускладнень діабету одержані в епідеміологічних дослідженнях, при цьому механізми патогенетичної дії гіперглікемії натще і після приймання їжі залишаються неідентифікованими. Серед можливих загальних факторів патогенезу дії гіперглікемії прийнято розглядати оксидативний стрес, глікозилювання білків, дисфункцію ендотелію та порушення ліпідного обміну. Питома вага цих факторів залишається невизначеною. Однак епідеміологічні дані, опис феномену та клінічних його характеристик стали приводом для перегляду тактики лікування хворих на цукровий діабет, зокрема корекції режиму призначення цукрознижувальних препаратів, використання при інтенсивній інсулінотерапії препаратів швидкої та пролонгованої дії та узгодження режиму харчування з їх фармакодинамікою. Для подальшої розробки цієї проблеми необхідно вивчити механізми патогенетичної дії гострої гіперглікемії на серце та судини.
Мета проведеного дослідження – експериментальне вивчення механізмів дії гострої гіперглікемії на кровопостачання, метаболізм та функцію міокарда. Для цього використано оригінальний комплекс методів дослідження на собаках без розтину грудної порожнини, застосовуючи техніку катетеризації, екстракорпоральної програмованої автоперфузії вінцевих артерій, катетеризації та дренажу вінцевого синуса, катетеризації серця, багатоканальної синхронної реєстрації параметрів кардіота гемодинаміки, дихання, насичення крові киснем, визначення споживання міокардом субстратів окиснення та виділення метаболітів у вінцевий синус.
Матеріал і методи
Експерименти проведено на безпородних собаках обох статей масою 12–28 кг із застосуванням морфіннохлоралозного наркозу (відповідно 2,5 мг/кг та 60–100 мг/кг). Перед катетеризацією серця та судин внутрішньовенно вводили 500 МЕ/кг маси гепарину. Через ліву сонну артерію в огинаючу гілку лівої вінцевої артерії вводили спеціальний катетер з обтуратором, який встановлювали дистальніше відгалуження передньої міжшлуночкової артерії. За допомогою екстракорпорального роликового насоса проводили перфузію вінцевої артерії постійним об’ємом артеріальної крові, яку забирали з аорти через катетер, введений через стегнову артерію. Об’єм перфузії встановлювали на рівні, при якому перфузійний тиск перевищував тиск в аорті на кілька мм рт. ст. Надійність обтурації контролювали при тестовому виключенні перфузії на кілька секунд. Під рентгеноскопічним контролем через яремну вену у вінцевий синус вводили рентгенконтрастний катетер для його постійного дренажу. Для реєстрації параметрів кардіота гемодинаміки катетери вводили у лівий та правий шлуночки серця й аорту. В артеріальній крові серця, яка відтікає у вінцевий синус, визначали вміст енергетичних субстратів. Вінцеву артеріо-венозну різницю (ВАВР) за вмістом субстратів при постійному об’ємі перфузійного потоку визначали з урахуванням коефіцієнта відповідності зон перфузії та відбору венозної крові серця. Коефіцієнт відповідності зони перфузії міокарда та зони відбору крові з вінцевого синуса визначали методом розведення індикатора [5]. Вміст глюкози визначали ортотолуїдиновим способом, піровиноградної кислоти – за її реакцією із 2,4-динітрофенілгідразином, вільних жирних кислот – за кольоровою реакцією їх кабольтових мил з a-нітро-b-нафтолом. Вміст молочної кислоти визначали за реакцією відновлення НАД+ за участю лактатдегідрогенази. Методологія досліджень метаболізму міокарда в дослідах на собаках in vivo викладена в спеціальній роботі [1]. Протягом експерименту синхронно реєстрували тиск у правому та лівому шлуночках серця, першу похідну тиску в лівому шлуночку серця (dP/dtmax), тиск перфузії вінцевої та стегнової артерій, насичення киснем крові у вінцевому синусі, пневмотахограму (“Мінгограф-81”, “Elema”, Швеція) та електрокардіограму у відведеннях I, II, III, V2,V4, V6 (6 NEK-401, Німеччина).
Епізоди відносної ішемії міокарда та тестові адренергічні реакції моделювали шляхом імпульсного введення у потік вінцевої артеріальної крові адреналіну (0,05; 0,5; 5,0 мкг). Тестові холінергічні реакції серця моделювали імпульсним введенням ацетилхоліну у перфузійний потік вінцевої крові (0,001–1,0 мкг). Інфузію 20–40 % розчину d-глюкози вводили у потік вінцевої артеріальної крові. Протягом експерименту концентрація глюкози в системній циркуляції не змінювалася. Більш детально методика проведення досліджень кровообігу та метаболізму міокарда in vivo в експериментах на собаках була описана раніше [4].
Результати та їх обговорення
Короткочасне підвищення вмісту глюкози в крові у клінічній практиці і в експериментальних дослідженнях з використанням тестів на толерантність до глюкози можна викликати за допомогою перорального та внутрішньовенного введення глюкози. При цьому підвищення вмісту глюкози в системній циркуляції спричиняє відповідні нейрогормональні реакції, в тому числі не тільки адекватне або неадекватне підвищення секреції інсуліну, а й збільшення секреції контрінсулінових гормонів. Тому для ідентифікації патогенетичного впливу глюкози на вінцеві судини та міокард, яке б не залежало від його системного впливу, використано екстракорпоральну програмовану перфузію вінцевих артерій.
Для неперервної подачі 20 % розчину d-глюкози в екстракорпоральний шунт (потік) артеріальної крові, яку забирали з аорти через катетер і подавали екстракорпоральним насосом в огинаючу гілку лівої вінцевої артерії, використовували мікроін’єктор. В екстракорпоральному шунті глюкоза змішувалася з артеріальною кров’ю, і у вінцевій артерії, таким чином, створювалася досліджувана концентрація глюкози. Зміни об’єму інфузії розчину глюкози у межах 0,5–2,0 мл/хв, який подавали в екстракорпоральний шунт, та об’єму перфузійного потоку вінцевої артеріальної крові в межах 30–50 мл/хв дозволяли моделювати зміни концентрації глюкози в крові вінцевої артерії в межах 7,5–25,0 ммоль/л. Із зони перфузії серця кров надходила через вінцевий синус, потім у правому передсерді змішувалася з кров’ю, яка надходила через порожнисті вени, далі потрапляла в мале коло кровообігу, лівий шлуночок та аорту. З аорти частина крові знов надходила до екстракорпорального шунта та у загальну циркуляцію. Таким чином, гіперглікемію моделювали тільки в зоні міокарда, яку перфузували через огинаючу гілку лівої вінцевої артерії, а концентрація глюкози в системній циркуляції суттєво не змінювалася. Так було розроблено модель гострої вінцевої гіперглікемії для експериментального вивчення її впливу на метаболізм і функцію міокарда.
У контрольних дослідах інфузія 0,9 % розчину хлористого натрію 0,5–1,0 мл за 1 хв у потік вінцевої крові у більшості дослідів не викликала доступних для вимірів змін кардіогемодинаміки, споживання субстратів окиснення та виділення метаболітів. В окремих випадках виявлено незначні зміни деяких показників, серед них найчастіше спостерігали невелике розширення вінцевих судин.
Шляхом емпіричного підбору швидкості інфузії 20 % розчину d-глюкози в перфузійний потік вінцевої артерії створювали модельні локальні гіперглікемічні стани серця із заздалегідь заданою концентрацією глюкози в артеріальній крові лівої вінцевої артерії на рівнях (7,4±0,8), (15,5±1,9) та (24,8±2,7) ммоль/л. Під час інфузії глюкози у вінцевий кровоток проводили контрольні визначення рівня глюкози у крові стегнової артерії. Не було виявлено достовірних змін рівня глікемії у системному кровообігу. Це дає підстави виключити можливий вплив системних гормональних та гуморальних регуляторних факторів, зокрема інсуліну, на реалізацію метаболічних та гемодинамічних ефектів, які викликані саме гіперглікемією. Визначення рівня поглинання субстратів на тлі гіперглікемії проводили через 10 хв після стабілізації рівня глікемії.
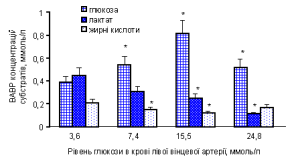
При незначному збільшенні рівня глюкози у вінцевій артерії (до (7,4±0,8) ммоль/л) її поглинання міокардом збільшувалося на 42 %. При цьому поглинання серцем інших вуглеводів – лактату та пірувату достовірно не змінювалося, що вказує на збереження вихідного рівня їх окиснення (рис. 1). Разом з тим, поглинання вільних жирних кислот (ВЖК) у цій групі дослідів знижувалося на 25 %, що узгоджується з уявленнями про фізіологічні механізми регуляції субстратами енергетичного метаболізму, а саме – обмеження окиснення ліпідних субстратів при підвищенні доступності вуглеводних джерел енергії [10].
Рис. 1. Вплив різних рівнів глікемії в потоці артеріальної вінцевої крові на поглинання міокардом енергетичних субстратів.
* – різниця показників достовірна порівняно з вихідними контрольними значеннями (Р<0,05).
Така величина підвищення концентрації глюкози в перфузійному потоці (до (7,4±0,8) ммоль/л) призводила до незначного зниження опору вінцевих судин лише у частині дослідів. При статистичному аналізі ці зміни вінцевого кровообігу були недостовірними [9]. Скорочувальна функція серця у цій серії дослідів, як правило, залишалася незмінною. Дані про вплив такого рівня вінцевої гіперглікемії на серце можна гіпотетично зіставити зі змінами при постпрандіальній гіперглікемії у здорових людей і припустити, що ці зміни не виходять за межі фізіологічних коливань рівня глюкози в крові.
За умов підвищення рівня вінцевої гіперглікемії до (15,5±1,9) ммоль/л поглинання глюкози міокардом зростало у 2,2 разу порівняно з вихідним рівнем, і ВАВР досягала (0,82±0,12) ммоль/л. Такий рівень вінцевої гіперглікемії не впливав на рівень глюкози в системному артеріальному кровотоці і на вихідний рівень інсуліну. Тому таке значне підвищення споживання глюкози міокардом, при відсутності посилення стимулюючого сигналу інсуліну, могло спричинятися, найвірогідніше, тільки за рахунок зростання доставки субстрату. Це пов’язане з особливостями фізіологічного стану серця, для якого характерна висока щільність локалізованих у сарколемі переносників глюкози. Наявність у міокарді двох типів переносників – Glut-1 та Glut-4 з високою та низькою константою Міхаеліса Кm для субстрату, дозволяє забезпечувати потреби серця в глюкозі при значних коливаннях рівня постачання субстрату. Навіть за умов гіпоглікемії (глюкоза крові в межах – 2,2–2,6 ммоль/л) ВАВР за глюкозою може зберігатися на рівні, який спостерігали при нормоглікемії (3,3–5,5 ммоль/л) [2]. Крім того, не виключене існування в серці прямих механізмів, активації переносників глюкози у відповідь на зміни доставки субстрату.
У наших дослідах при рівні глюкози у крові вінцевої артерії (15,5±1,9) ммоль/л спостерігали більш суттєві зміни у споживанні альтернативних енергетичних субстратів: поглинання ВЖК зменшилося вдвічі, а також спостерігали тенденцію до зменшення ВАВР за піруватом та лактатом. Зменшилася позитивна ВАВР за рН та насиченням киснем крові серця та від’ємна ВАВР за СО2 (відповідно –(0,056±0,015), –(3,8±0,4) % та +(3,2±0,8) ммоль/л), що свідчило про зменшення закиснення крові серця.
Потребують спеціального аналізу отримані дані про те, що за умов високої вінцевої гіперглікемії (до 24,8±2,7 ммоль/л) не спостерігали подальшого підвищення поглинання глюкози міокардом. Так, ВАВР за глюкозою становила всього (0,520±0,096) ммоль/л, тобто практично збігалася з тією, що відзначали при рівні глікемії (7,4±0,8) ммоль/л ((0,540±0,075) ммоль/л).
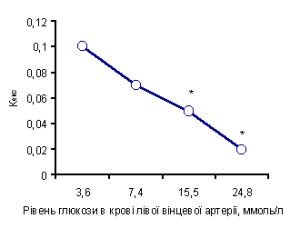
При значних коливаннях рівня субстрату в крові доцільно аналізувати коефіцієнт його екстракції (Кекс), який розраховується як відношення АВР концентрацій субстрату до його вмісту в артеріальній крові. Зміни Кекс глюкози залежно від рівня вінцевої гіперглікемії наведені на рис. 2. Зіставивши ці дані з результатами проведених раніше досліджень з вивчення споживання глюкози міокардом тварин з експериментальним цукровим діабетом [2], виявили важливу закономірність. Величина поглинання глюкози міокардом у тварин з алоксановим діабетом (рівень глюкози в артеріальній крові (15,6±0,9) ммоль/л) та її Кекс були такими ж, як у здорових тварин за умов високої вінцевої гіперглікемії ((24,8±2,7) ммоль/л): ВАВР становила відповідно (0,41±0,06) та (0,52±0,09), Кекс – 0,025 та 0,020. Спостерігали також односпрямований вплив експериментального цукрового діабету та гіперглікемії на поглинання інших енергетичних субстратів. За умов високої вінцевої гіперглікемії, як і при алоксановому діабеті, поглинання інших вуглеводних субстратів – пірувату та лактату (відповідно (50,5±12,7) мкмоль/л і (0,11±0,08) ммоль/л), було значно зменшеним порівняно з контролем, і спостерігали тенденцію до підвищення ВАВР за концентрацією ВЖК (див. рис. 1).
Рис. 2. Зміни коефіцієнта екстракції глюкози міокардом залежно від рівня гіперглікемії в потоці артеріальної вінцевої крові. * – різниця показників достовірна порівняно з вихідними контрольними величинами (Р<0,05). Така вінцева гіперглікемія ((24,8±2,7) ммоль/л) завжди викликала значне розширення вінцевих судин та зменшення тиску їх перфузії на (5,40±1,25) кПа. У частині дослідів розширення вінцевих судинсупроводжувалося значним збільшенням скорочувальної функції серця ((105,6±23,0) кПa/c), підвищенням тиску в лівому шлуночку серця, зниженням насичення крові киснем у вінцевому синусі на (2,30±0,45) %, збільшенням ВАВР за насиченням крові киснем на (10,20±1,45) %. У частині дослідів на фоні аналогічного розширення вінцевих судин зміни скорочувальної функції серця та інших параметрів кардіота гемодинаміки були відсутніми або були незначними за величиною і, таким чином, статистично недостовірними.
У динаміці кардіогемодинамічної реакції були зареєстровані також незначні зміни ЕКГ, зокрема збільшення зубця R (на 2–3 мм) у відведенні ІІ, а іноді і у відведенні V4 (на 2–4 мм) та збільшення зубця Р (на 1–2 мм). Не виявлено залежності змін ЕКГ від наявності або відсутності змін скорочувальної функції серця: збільшення зубця R відзначено як у дослідах з підвищенням скорочувальної функції серця у відповідь на вінцеву гіперглікемію, так і у дослідах, коли зміни скорочувальної функції серця були практично відсутніми. Все ж таки, в окремих дослідах у результаті значного збільшення скорочувальної функції серця та зниження насичення крові киснем у вінцевому синусі можна було знайти деякі ознаки невідповідності кровопостачання і функції серця, зокрема зміщення сегмента ST понад 1 мм.
Таким чином, необхідно констатувати, що найбільш постійним компонентом реакції серця на вінцеву гіперглікемію було розширення вінцевих судин. Після зупинки інфузії глюкози та при відновленні вихідного рівня глікемії у вінцевому потоці опір вінцевих судин також нормалізувався.
Було проаналізовано можливу участь ендотелійзалежних механізмів у вінцевій вазодилатації в реакціях на гіперглікемію. Внутрішньовінцева інфузія Nw-L-аргініну метилового ефіру (1–2 мг/хв) або ін’єкція атропіну (0,5 мг/кг внутрішньовенно) не усували розширення вінцевих судин при вінцевій гіперглікемії. В деяких дослідах розширення вінцевих судин було помітно меншим, проте динаміка та величина реакції кардинально не змінювалися.
Аналізуючи механізми дії вінцевої гіперглікемії на серце, не можна не розглянути також зміни осмотичних характеристик артеріальної крові, яка надходить до серця. Моделювання еквімолярних концентрацій розчинів глюкози, манітолу та поліглюкіну у потоці артеріальної крові не привели до однозначних результатів. Усі три розчини при еквімолярних концентраціях у потоці вінцевої крові викликали розширення вінцевих судин, однак ступінь розширення судин був неоднаковий. Найбільше розширення викликала глюкоза, менше – манітол і зовсім незначне – поліглюкін. Таким чином, можна зробити висновок, що на цьому етапі досліджень механізми впливу гіперглікемії на тонус вінцевих судин не можна вважати до кінця з’ясованими. Хоча усі три еквімолярні розчини викликають різне за величиною розширення вінцевих судин, осмотичний вплив на тонус судин не можна повністю виключити.
У зв’язку з викладеним необхідно з’ясувати, у першу чергу, можливість патогенетичної дії розширення вінцевих судин на серце. Цей ефект є найбільш вираженим і постійним при моделюванні вінцевої гіперглікемії.
У раніше проведених дослідженнях було констатовано, що при неускладненому діабеті, насамперед при діабеті I типу, вінцеві судини розширені. В результаті неадекватного розширення судин збільшується проникність судин, зростає кількість внутрішньоклітинної та позаклітинної рідини, міоцити судин та кардіоміоцити набухають і набрякають [3]. Такі зміни у вінцевих судинах та міокарді раніше були нами виявлені у щурів з експериментальним стрептозотоциновим діабетом [8]. У подальшому це призводить до зменшення пропускної здатності мікросудин, порушення водно-сольового обміну та ін.
Очевидно, що ці зміни не можна розглядати незалежно від інших факторів патогенезу, зокрема порушень ліпідного обміну, глікозилювання білків, активації сорбітолового шунта та інших системних змін метаболізму та кровообігу. Немає сумнівів у тому, що в експериментальних дослідженнях можуть бути встановлені фактори і механізми пошкоджуючої дії гіперглікемії, однак їх питому вагу у патогенезі серцево-судинних ускладнень цукрового діабету можна оцінювати, провівши широкомасштабні клінічні дослідження.
Метааналіз результатів 22 епідеміологічних досліджень, які були проведені у нашій країні і за кордоном, підтвердив взаємозв’язок між рівнемглікемії та розвитком серцево-судинних ускладнень діабету [7]. Встановлено також, що постпрандіальна гіперглікемія сприяє збільшенню серцевих ускладнень при серцевому діабеті [11]. Перед дослідниками постає питання: чи є постпрандіальна гіперглікемія або збільшення коливань рівня глюкози в крові самостійним патогенетичним механізмом чи незалежним фактором ризику розвитку серцевосудинних ускладнень цукрового діабету, а також чи можна розглядати її як один з факторів патогенезу уражень серця?
Вирішення цього важливого питання сприятиме поліпшенню тактики лікування хворих з цукровим діабетом. Результати наших досліджень дозволяють виділити вінцеву і, можливо, системну гіперглікемію як незалежні фактори патогенезу метаболічних та кардіогемодинамічних ускладнень цукрового діабету.
Висновки
1. Підвищення вмісту глюкози в потоці вінцевої крові в середньому до (7,4±0,8) ммоль/л не викликало значних змін опору вінцевих судин, споживання глюкози міокардом дещо зростало, а споживання вільних жирних кислот зменшувалося.
2. Підвищення рівня глюкози в потоці вінцевої крові до (15,5±1,9) ммоль/л супроводжувалося більш суттєвим розширенням вінцевих судин, зменшенням споживання вільних жирних кислот та збільшенням споживання глюкози.
3. Підвищення глікемії у потоці вінцевої крові до (24,8±2,7) ммоль/л не призводило до подальшого зростання поглинання глюкози міокардом та розширення вінцевих судин.
Література
1. Глебова Л.М., Гапич О.Л., Хомазюк А.І. Утилізація енергетичних субстратів міокардом // Доповіді Академії наук УРСР. – 1988. – С. 63-66.
2. Гончар И.В. Влияние инсулина на поглощение энергетических субстратов миокардом здоровых животных и животных с экспериментальным сахарным диабетом // Журн. АМН України. – 2000. – Т. 6, № 2. – С.382-390.
3. Хомазюк А.И. Экстракорпоральная перфузивная резистография коронарных артерий у животных с интактной грудной клеткой // Патол. физиол. и экспер. терапия. – 1986. – № 2. – С. 74-77.
4. Хомазюк А.И. Инсулин в регуляции кровообращения и патогенезе болезней сердечно-сосудистой системы // Укр. кардіол. журн. – 1999. – № 6. – С. 62-70.
5. Xомазюк А.І., Нещерет О.П., Глєбова Л.М., Гончар І.В. Визначення показників матаболізму в окремих зонах міокарда в дослідженнях з екстракорпоральною перфузією вінцевих артерій // Укр. кардіол. журн. –1998. – № 5. – С. 52-55.
6. Bonora E., Muggeo M. Postprandial blood glucose as a risk factor for cardiovascular disease in type II diabetes: the epidemiological evidence // Diabetologia. – 2001. – Vol. 44, № 2. – P. 2107-2114.
7. Heine R.J., Dekker J.M. Beyond postprandial hyperglycaemia: metabolic factors associated with cardiovascular disease // Diabetologia. – 2002. – Vol. 45, № 4. – P. 461-475.
8. Khomazjuk A., Bogdanova T., Zurnadji Ju., Voskoboinic L. Cardiac vessels reactivity and ultrastructure in experimental diabetes mellitus // Intern. J. Microvasc. Clin. Exp. – 1992. – Vol. 11 (Suppl. 1). – P. 209.
9. Khomazjuk A.I., Nescheret A.P., Shepelenko I.V. et al. The effect of hypoglycemia on myocardial blood supply, function and metabolism // Endocrinology. – 1992. – № 9. – P. 94.
10. Nuutlia P., Koivisto V., Knuuti J. Glucose–free fatty acids cycle operates in human heart and skeletal muscle in vivo // J. Clin. Invest. – 1992. – Vol. 89, № 9. – P. 1769-1774.
11. Shaw J.E., Hodge A.M., Courten M. et al. Isolated post-challenge hyperglycemia confirmed as a risk factor for mortality // Diabetologia. – 1999. – Vol 42, № 9. – P. 1050-1054.









Комментировать