Эссенциальная артериальная гипертензия: определение и классификация. Оценка риска. Патогенез. Клиническая картина. Лечение и терапия.
Е.П. Свищенко, Л.В. Безродная, О.П. Борткевич
Национальный научный центр «Институт кардиологии им. Н.Д. Стражеско» АМН Украины, Киев
ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ
Артериальная гипертензия (АГ,), по определению Комитета экспертов ВОЗ — это постоянно повышенное систолическое и/или диастолическое артериальное давление (САД и ДАД соответственно).
Эссенциальная гипертензия (первичная гипертензия, гипертоническая болезнь) — это повышенное артериальное давление (АД) при отсутствии очевидной причины его повышения.
Вторичная гипертензия (симптоматическая) — это гипертензия, причина которой может быть выявлена.
Термин «эссенциальная гипертензия» впервые использовал E. Frank в 1911 г. для обозначения повышения АД, не обусловленного заболеванием почек (брайтовой болезнью) или другой патологией, вызывающей повышение АД. Этот термин не вполне удачен, так как английское слово «essential» обозначает «существенный, необходимый», в связи с чем понятие «эссенциальная гипертензия» может быть истолковано как повышение АД, необходимое для обеспечения кровоснабжения тканей организма. Поэтому некоторые зарубежные авторы предпочитают термин «первичная гипертензия». Эквивалентом этих названий является термин «гипертоническая болезнь» (ГБ), введенный Г.Ф. Лангом в 1922 г. и применяемый в настоящее время в странах СНГ, в частности в России и Украине. Он более удачен, чем термин «эссенциальная гипертензия», так как отражает сущность повышения АД как болезненного состояния, а не компенсаторного процесса.
ГБ отмечают у 95% лиц с повышенным АД. У остальных 5% АД повышено вследствие различных заболеваний — поражения паренхимы почек, опухолей надпочечников, заболеваний аорты (коарктация, аортоартериит), почечных артерий и многих других.
Классификация. В соответствии с рекомендациями ВОЗ, Европейского общества гипертензии и Европейского общества кардиологов (2007), выделяют несколько уровней АД (табл. 1.1).
Согласно этой классификации, АГ — повышение САД до 140 мм рт. ст. и выше или ДАД до 90 мм рт. ст. и выше, если такое повышение стабильно, то есть подтверждается при повторных измерениях АД (не менее чем 2-3 раза в разные дни на протяжении нескольких недель).
Разделение уровней АД на нормальный и 51 сокий условно, так как разграничительная черта между ними отсутствует. Однако известно, что уровень АД и смертность вследствие сердечно-сосудистых заболеваний находятся в прямой взаимосвязи: чем выше АД, тем выше смертность. Даже АД 120/80 мм рт. ст. сопряжено с более существенным риском развития сердечнососудистых заболеваний, чем, например, АД 110/75 мм рт. ст. Риск прогрессивно повышается, когда АД достигает 140/90 мм рт. ст. и выше.
Для установления стадии АГ используется классификация в зависимости от поражения органов-мишеней (табл. 1.2), рекомендованная Украинской ассоциацией кардиологов (1999; 2004). Она представляет собой незначительно модифицированную классификацию ВОЗ (1996) и отличается от последней тем, что в нее не включены: ультразвуковые проявления атеросклероза сосудов как критерий II стадии; стенокардия и окклюзивные заболевания артерий как критерий III стадии. Наличие атеросклероза сосудов в значительно большей степени характеризует выраженность атеросклеротического процесса, чем АГ.
Использование, например, стенокардии или перемежающейся хромоты в качестве критерия III стадии ГБ может приводить к неоправданному завышению стадии заболевания.
Эту классификацию следует использовать для установления стадии как ГБ (эссенциальной гипертензии), так и вторичной АГ.
Диагноз формулируют с указанием стадии заболевания, его степени, характера повреждения органовмишеней, а также риска осложнений. Если ставится диагноз ГБ II стадии, необходимо конкретно указать, на основании чего устанавливается эта стадия: наличие гипертрофии левого желудочка (ГЛЖ) или папертензивной нефропатии, сужение артеррй сетчатки. Диагноз ГБ III стадии также необходимо обосновать Кналичием сердечной недостаточности (СН), перенесенного мозгового инсильта и т.д).
В соокоеистрои с рекомендациями Украинской ассоциации оардиологов, диагиоз ГБ III стадии при лиличии инфаркта миокарда (ИМ), мозионоро инсульта или других призатков этой стадии следует устанакливткн только в тех случаих, когда эти осложнения со стороны сердечкисосудастой системы развились на фоне длтаельно пюотекающей ГБ, что подтнерждается имеющимися объективными признаками гипертензивного поврежденик органов-мише ней (ГЛЖ, генерализованное сужение артерий сетчатки и др.). При отсутствии подобных изменений следует индивидуально подходить к решению вопроса о наличии ГБ и ее стадии. Повышение АД на фоне мозгового инсульта или болевого синдрома у больного с ИМ может быть реактивным, преходящим. Кроме того, ГБ (как и вторичная гипертензия) может быть у таких больных сопутствующим заболеванием в начальной стадии развития. В этих случаях устанавливают диагноз ГБ I стадии, несмотря на острый или перенесенный ранее мозговой инсульт, ИМ или другие заболевания, характерные для III стадии ГБ.
Оценка риска. Повышение АД — фактор риска развития заболеваний сердечно-сосудистой системы. Чем выше АД, тем выше риск развития инсульта, ишемической болезни сердца (ИБС) и преждевременной смерти. Длительное течение гипертензии приводит к поражению органов-мишеней — сердца, головного мозга и почек. Даже незначительное повышение АД представляет существенную опасность для здоровья. Так, 60% осложнений со стороны сердечно-сосудистой системы отмечают у больных с умеренным повышением ДАД (не выше 95 мм рт. ст.). Ниже приведены данные р слкянии АД на продолжительность жизни 35-летнего мужчины, рассчитанььые ассоциацией стртховых компаний США (1979):
Наблюдается положительная корреляция между уровнем АД и общей смертностью: чем ниже САД или ДАД (у любом возрасте), тем ниже смертность, и наоборот. С! повышением АД на каждые 10 мм рти ст. риск развития заболеваний серцечно-сосудистод система1 повышаеюся на 10%).
Максимально полезной для больного признана стратагая лечения, базирующаяся на определении общего рисиа. Под последним понимают тот риск осложнений, который есть у данного больного вследствие повышения АД, поражения органов-мишеней, наличия сопутствующих сердечно-сосудистых заболеваний и основных факторов риска (табл. 1.3). Можно выделить несколько групп риска (табл. 1.4).
В группу обычного риска относят лиц с АД ниже 140/90 мм рт. ст. без дополнительных факторов риска. Группа людей, имеющих дополнительный (к обычному) риск осложнений, но он сравнительно невысок, выделена как группа умеренного риска. Ее составляют лица с давлением 140-179/90-109 мм рт. ст., имеющие не более 1-2 факторов риска атеросклероза, без поражения органов-мишеней, сахарного диабета или других показателей, перечисленных в табл. 1.3. Иными словами, это больные с ГБ I стадии, 1-2-й степени, имеющие не более 2 факторов риска. Повышение АД до 180/110 мм рт. ст. и выше повышает вероятность осложнений и такие больные уже составляют группу высокого риска. К группе высокого риска относятся также больные с ГБ II стадии. пациенты с ГБ III стадии составляют группу очень высокого риска.
В соответствии с Фремингемскими критериями, термины «низкий», «умеренный», «высокий» и «очень высокий» риск означают 10-летнюю вероятность сердечнососудистых осложнений (фатальных и нефатальных) <15%, 15-20%, 20-30% и >30% соответственно. С 2003 г. в практику европейской кардиологии вводится еще одна модель оценки риска — шкала SCORE, которая позволяет предвидеть вероятность фатальных сердечно-сосудистых событий на протяжении 10 лет. Шкала SCORE отвечает такой вероятности фатальных сердечно-сосудистых осложнений: <4% — низкий, 4-5% — умеренный, 5-8% — высокий и >8% — очень высокий риск.
ПАТОГЕНЕЗ
Есть основания полагать, что ГБ — относительно новое в истории цивилизации заболевание. В его развитии участвуют как генные механизмы, так и внешние факторы (табл. 1.5).
Роль генетических факторов в развитии АГ. Наследственная предрасположенность к АГ считается одним из наиболее достоверных факторов риска возникновения и прогрессирования болезни и часто отмечается у ближайших родственников. У 80% пациентов с АГ близкие или дальние родственники также имеют повышенное АД. Согласно современным представлениям, указанная предрасположенность реализуется во взаимодействии с различными факторами окружающей среды, вероятность наследования АГ составляет около 30%.
В настоящее время существуют несколько теорий наследования предрасположенности к АГ.
Моногенная теория основана на предположении о едином для всех больных дефекте в сердечнососудистой системе или в механизмах регуляции АД, обусловленных нарушениями на уровне одного гена. Этой теории, однако, противоречат результаты экспериментальных исследований: к настоящему времени получено несколько линий крыс с генетически обусловленной АГ, существенно различающихся по механизмам наследования АГ.
Полигенная теория основана на предположении о дефекте нескольких генов (сочетаний генов), контролирующих развитие сердечно-сосудистой системы (метаболизм сосудистой стенки, определяющий ответ на регулирующие воздействия), или же группы генов, ответственных за функционирование систем регуляции кровообращения, в том числе и АД. Допускается возможность, что у конкретного больного какой-либо генный дефект является доминантным и определяет особенности возникновения, развития и исхода АГ.
Теория пороговой модели генетической предрасположенности к АГ предполагает, что повышение АД отражает сумму нарушений активности различных генов, ни один из которых не является доминантным.
В настоящее время наука еще не располагает достаточными фактическими данными, чтобы отдать предпочтение той или иной гипотезе. Не до конца постигнуты также конкретные механизмы реализации наследственной предрасположенности к АГ.
Наиболее важные доказательства того, что в повышении АД задействованы полигенные механизмы, дает биометрический анализ, показывающий существование корреляции между уровнями АД у родственников. Иными словами, у родителей с низким уровнем АД большая вероятность рождения детей с низким АД и наоборот. Эта значимая зависимость может быть объяснена не наличием одного главного опосредующего гена, а лишь полигенных последовательностей, в которых каждый ген оказывает влияние на АД. Регионы хромосом или гены, влияющие на АД, определяются как такие, в которых молекулярная идентичность между сибсами ассоциирована со сходными изменениями АД, наблюдающимися чаще, чем ожидается в соответствии с теорией вероятностей. Сходство может определяться качественно (например оценка случаев АГ у сибсов) или количественно (как производное численных различий уровней АД между сибсами), причем в современных исследованиях для обоих видов оценки используют статистические методы.
Есть ряд заболеваний, сопровождающихся АГ, для которых определены генные последовательности и тип наследования (табл. 1.6).
Ниже приведен перечень генов, предположительно ответственных за развитие АГ или обусловливающих повышение АД вследствие мутаций:
- 6-фосфоглюконатдегидрогеназа;
- ангиотензинпревращающий фермент (АПФ);
- ангиотензиноген;
- рецептор глюкокортикоидов;
- рецептор инсулина;
- комплемент C3F;
- Р2-адренорецептор;
- липопротеинлипаза;
- тип 1А-допаминовый рецептор;
- а1В-адренорецептор;
- эндотелиальная NO-синтаза;
- панкреатическая фосфолипаза;
- а2-адренорецептор;
- рецептор ангиотензина II (АТ1);
- G-протеин B3-субъединица;
- простациклинсинтаза;
- гормон роста.
Роль симпатической нервной системы в развитии острого и хронического повышения АД. В классических работах Г.Ф. Ланга указывалось, что начальным патогенетическим звеном АГ является чрезмерное тоническое сокращение артериол в ответ на появление очага застойного возбуждения высших центров, регулирующих АД. Его последователь А.Л. Мясников (1954) подтвердил первичность психогенного нарушения функции вазомоторной системы в регуляции АД. В дальнейшем была обнаружена тесная связь симпатической нервной системы с другими прессорными механизмами, зависящая от стадии заболевания и соотношения прессорных и депрессорных механизмов его прогрессирования.
Результаты исследований D.J. Reis и соавторов (1984, 1989) позволили установить роль различных ядер сим-
патическои нервнои системы в краткои долговременной регуляции АД. Контроль АД интегрирован в ростральном вентролатеральном ядре (РВЯ) продолговатого мозга, иногда назынсаемом вазомоторным контролирующим центром. Тела клеток эфферентные стимулирующих сердечно-сосудистую систему симпатических нейронов находятся в субрегионе С1,который взаимодействует с различными центрами центральной нервной системы! (ЦНС), получая ок них и посытая в них нервные импульсы. Наиболее важны— сигналы в РВЯ приходят из смежного nucleus tractus solitarius (NTS), получающего афферентны1е волокна из баромеханорецепторов каротидного синуса и дуги аорты1 (аортокаротидные барорефлексы!). Сионалы! из NTS подавляют симпатическую активность РВЯ,уменьшая острое повышение АД.
Ингибирующие барорецепторные системы сонтролируют активность симпатаческого звена нервной системы: одна аз них онвеоает за регутярованте АД (аортокаротидныц РарорефлексыО, другая — за изменения секдечного объема (кардиопульмоннлыныю ба-орефлоксар. Эти две системы! работают согласонанно, сохраняя постоянство объема циркулирующей крови (ОЦК) и АД.
Артериальные барсфецепторы играюа важную роль в процессе «хнонинации» АО из-за присущей им неспособности реаоировреы на длительные изменения АД (феномен, известнаш как барорнфлекторное переключение). Ei условиях постоянно поваишетного АД барорецепторы! сорраняют способность веагировать на крааковременныю изменения довленая, но не могут возвратить его н нормальным црфрам. Следовательно, симпатическая нервная система не угнетается в должномере, даже при высоком АД. Хроническая «<н ечуаствительность»» барорецепыоров -вязана состарением, повышенной активносаью этой системы! и избыточным действиемангиотензина II .
Нарушенная чувствительность кардиопульмональных барорецопто ров также может иметь больш ое значение в поддержании длительного повышения активности симпатической нервной системы! и АД. На это указывает, в частности, такой факт: при уменьшении минутного объема крови (МОК) у лиц с пограничной АГ активация симпатических нервов более выражена, чем у лиц с нормотензией. В экспериментах на собаках с почечной недостаточностыю и АГ при нагрузке объемом отсутствуют как аортокаротиднын, так и кардиопульмональные рефлетсыв Продемонстрировчно также, что нарушение кардиопульмоналтоые рефлексов вл ияет на повышение активности сымпатчческой нервной системы! с возрастом.
Роль ттресса в развитии АГ. Стимуляция симпатической нервной системы! вследствке психическил или физических накручок ччвытает транзиторное угеличение продукции корчдреналинач соответственно повышение АД. и наиболее важным стимулам еледует отнести физические упражнания, которыые краткоаременно повышают АД, однтко ари регулярных занятиях счоиобствуют развинкю тренисованносоа и эффективному снижению базальной и стимулиро вчнной оетионости симпатической неркной системы! и АД и, следовательно, снижают риск сердечно-сосудистыю заболеваний (рис.1.1).
Доугим важным стимулятором симпатической нервной ткстемы является курение: несмотвя на то, что повышение АД после вынкуремнсй сигаре™ кратковременное, длителеное куренче может обусловливать длительное повышесче АД.
К смльнейшим стрессовым факиорам, вызывающим кезкое повышение АД, часто с развитием клин ики гипертензивноао криза, относятся ожоти, ткавмы! головного мозга, хирургические тмешвнельства, общая анестезия, каждыш из которые приводит к выраженной активации симаатииосной нервной системые Холодовые нкфузти или передозироекч некоторые лекарственные препааатов (например опиоадов), татже могус вызвать резкую ансииацию оимчнсической нервной системы и повышение АД.
С конца 70-х годов ХХ в. предметом дискуссий является гипотеза, заключающаяся в том, что у лиц с гиперреакцией на стресс в виде значительного повышения АД и частоты сердечных сокращений (ЧСС) и другихсердечнососудистых реакций высок риск развития хронической АГ. В исследование CARDIA (J.H. Markovitz и др., 1998)
были включены более 3300 человек молодого возраста, подвергавшихся эмоциональным нагрузкам (видеоегры). Период наблюдения составил 5 лет. Отмечено, что у мужчин с гиперреакцией на психологическую иагрузку в виде значительного повышения САД (на 10-30 мм рт. ст.) был высок риск рззвития АГ, в зо время как. у женщин подобной закономерности не выявлено. Такая же связь обнаружена в исследовании А. Steptoe/ М. МагтсЯ (2007) —у нормотензивных людей с замедленнор нормализацией САД в постнагрузочный период (нспользовчлся ментальный стресс) н течение последующих 3 лет гипертензия развивалась в 3,5 раза чаще, чем улиц з нормальным снижением АД в восстанонительный период.
Ренин-ангиотензиновая система относится к основным регуляторам сосудистого тонуеа, водноэлектролитного баламса и утр)овня АД. В структурном отношении она представляет собзй нанкадную «гормональную ось?», включающую цепь энзиматических реакций, вследствие которых обраауются биолотически активные пептиды — ангиотензины I, II и III. Изучение содержания ангиотензина II в крови больных ГБ показало отсутстви е корреляции между уровнем АД и концентрацией этого пептида. Вместе! с тем установлено, что угнетение ренин-ангиотензиновой системы с помощью препаратов, Нлокирующих образование или действие ангиотензина II, обусловливает у большинства больных ГБ существенное снижение АД (рис. 1.2).
Эни противоречивые данные находян частичное объяснение в типотезе, предложенной J. Иaаaghgh и соавторами (1973,1980). Согласно ртзрнботанной ими объемновазоконстрикгорной модели ратин-анниотензиновая система так или ираче принимает учаниие во всех видах повышения АД. У пациентов с ГБ с высокой активностью ренина а плазме крови, ренин-ангиотензиновая система непосредственно влияел на вазоконскрикцию и является главным фактором поддержания АГ. У больных с низкой аргивностью рангна ведущий механизм в повышении АД — это задержка наирия и воды; актианость ренина снижена вследствие подавления его секреции увеличенным объемом крови.
У больных с нормальной активностью ренина вазоконстрикторный и объемный механизмы также участвуют в поддержании АГ. У этих больных, несмотря на то что ренин-натриевые профили находятся в нормальных пределах, уровень ренина неадекватно высок для данного состояния натриевого баланса и данного уровня АД, то есть имеет место непропорциональное соотношение между вазоконстрикторным и объемным факторами, что может способствовать поддержанию повышенного уровня АД.
К настоящему времени установлено, что активация ренин-ангиотензиновой системы, помимо повышения АД, является фактором риска развития осложнений АГ. По данным J. Laragh (1996), у больных АГ с одинаковым уровнем АД, но различной активностью ренина в плазме крови частота развития ИБС или инсульта в течение 5 лет наблюдения составляет 11% в группе пациентов с умеренным повышением активности ренина и 14% — с его значительной активацией, однако такие осложнения редко бывают у больных с низким уровнем активного ренина в плазме крови. Повышенная активность ренин-ангиотензиновой системы является также независимым фактором риска развития ИБС и ее осложнений. Очевидно, это связано со значительной ролью ренин-ангиотензиновой системы в процессах атерогенеза, гипертрофии и патологического ремоделирования миокарда. Установлено, что ангиотензин II оказывает атерогенное действие, стимулируя миграцию макрофагов и нейтрофильныхгранулоцитов в сосудистую стенку, повышая окисление холестерина (ХС) и липопротеинов низкой плотности (ЛПНП). В итоге это приводит к эндотелиальной дисфункции с нарушением высвобождения NО и активацией синтеза мощного вазоконстрикторного агента эндотелина-1, цитокинов и факторов роста, играющих важную роль в структурном ремоделировании сердца и сосудов.
Эйкозаноиды играют роль как про-, так и антигипертензивных субстанций. Их вклад в регуляцию АД не поддается однозначной трактовке как из-за многочисленности этих веществ, так и вследствие их разнонаправленного биологического действия. К прогипертензивным эйкозаноидам относятся, в частности, тромбоксан А2 (ТхА2) и простагландин Н2 (ПГН2). Во многих исследованиях показано, что изменения в системе простагландинов (ПГ) классов Е1 и F2a выявляются еще на этапе пограничной АГ и характеризуются повышением их суммарного уровня и смещением соотношения в сторону преобладания прессорных фракций. При прогрессировании заболевания суммарный уровень вышеуказанных фракций снижается, однако сохраняется преобладание прессорных простагландинов, причем отмечается снижение модулирующего влияния ПГЕ1 на симпатическую нейротрансмиссию.
У здоровых людей чрезмерной активации вышеназванных прогипертензивных эйкозаноидов противостоит система антигипертензивных простагландинов — ПГЕ2 и ПП2.
Продукты метаболизма арахидоновой кислоты оказывают значительное влияние на кровеносные сосуды и транспорт ионов, модуляцию и опосредование действия вазоактивных гормонов. Таким образом, они также являются частью системы контроля АД.
Вторичными посредниками действия ангиотензина II служат и липоксигеназные субстанции, в частности, 12-гидроксипероксиэйкозатетраеновая кислота и продукт ее пероксидации 12-гидроксиэйкозатетраеновая кислота, которые способны также подавлять синтез ПГ12.
Медиаторы сосудистой стенки и АГ. Известно,что эндотелий является высокоактивным клеточным слоем, осуществляющим многие метаболические функции, в частности регуляцию тонуса сосудов, тромбоцитарного гемостаза, процессов коагуляции, миграции и пролиферации гладкомышечных клеток стенки сосудов.
Эндотелиальные клетки способны продуцировать как медиаторы с вазодилатирующей активностью (оксид азота и простациклин), так и вазоконстрикторы (тромбоксан А, эндотелин). Следовательно, изменения функции клеток эндотелия, выработки ими специфических медиаторов могут быть существенным звеном патогенеза нарушений регуляции тонуса сосудов.
В начале 80-х годов ХХ в. появились сообщения о том, что эндотелиальные клетки, полученные из аорты быка и выращенные в культуре тканей, продуцируют вазоконстрикторный пептид, который был выделен из супернатанта культуры клеток эндотелия и назван эндотелином-1 (ЭТ-1). ЭТ представляют семейство регуляторных пептидов, состоящих из 21 аминокислоты, и имеют несколько изоформ: ЭТ-1, ЭТ-2, ЭТ-3 и ЭТ-р.
ЭТ являются мощными вазоконстрикторами, продуцируемыми эндотелием сосудов. Роль ЭТ в патогенезе АГ еще недостаточно изучена: в одних работах отмечено нормальное содержание этих пептидов в плазме крови при экспериментальной АГ, в других — парадоксальное снижение ответа сосудов на их введение. Однако большинство исследователей полагают, что эффекты ЭТ играют важную роль в патогенезе АГ. Исследования, проведенные с использованием ингибиторов эндотелинпревращающего фермента (ЭПФ) или блокаторов рецепторов ЭТ, свидетельствуют, что ЭТ вносят существенный вклад в поддержание повышенного АД (Th. Luscher и др., 1993). Однако уровень циркулирующего ЭТ-1 не всегда определяет регуляцию тонуса сосудов при АГ, поскольку основным механизмом его действия является локальное влияние на стенку сосуда.
Роль почек в развитии АГ. Уровень АД регулируется почками посредством механизма «давление-натрийурез»: повышение системного АД (и соответственно перфузионного давления в почках) вызывает усиление натрийуреза и диуреза, благодаря чему объемы внеклеточной жидкости, циркулирующей крови и сердечный выброс уменьшаются до такого уровня, который обеспечивает возвращение АД к исходному. По мнению А. С. Guyton и соавторов, в этом заключается механизм долгосрочной регуляции АД. Он действует по принципу обратной связи, то есть уровень АД влияет на натрийурез, который, в свою очередь, определяет значение системного АД.
При ГБ фулкциональные параматры полки относительно системного АД существенно смещены, поэтому полный объем экскреции воды и солей возможен лишь при повышенном уров не АД. Сеижелие АД по механизму обратной связи активирует прессорные механизмы, возвращая его к требуемому для сохраоения водносолевого гомеостаза, то еств почка становится фактором поддержания постоянно повышенного уровня АД (Ю. В. Постнов) (рис. 1 .3).
Сравнителоно неданно е. M. Brenner и S. Anderson (1992) предложили гипотеау, объясняющую влвяние почек на развитое АГ уменьшением количества функцьонирующих нефронов, которое может быть врожденным или приобретиннв1м вследствие хронического заболевания или хирургического вмешательства. Уменошение количества нефеонов и связанное с этим снижение экскреции натрия и воды неотвратимо приводят оувеличению ОЦК и АД. Эссенциальная гипертензия обусловлена, по крайней! мере отьасти, сокращением суммарной фильтрующей поверхности почек вследствие уменьшения количества гломерул или фильтрующей площади в каждой гломеруле. Задержка натрия почками и повышение АД, в свою очередь, дают толчок к оов ышен ию давления в капнллярах клубочков и их склерозированию. Последнее еще больше уменишает фильтрующую площадь гломерул, замыкая пеоочный оруг.
Каждая поока содержит около 1 тлн нефроьов. Их количество может колебаться ыт 500 тыс. до 1,2 млн. Новые нефроны не образуются после рожденея, но их количество наченает уменьшатоия в процессе нормал ьного старения после 30-леинего возраста. B. М. Втеотег и S. Anderson полагают, что люди, родпвшиеся с относительно небольшим количеством нефронов (менее 70р тыс. в каждой почке), предрасположены к развитию АГ, в то время как те, у кого количество нефтонов оаходится на вееиней границе распределения, имеют наибоиее низкие значения АД в пределах физиологической нормоь Гипермензия может разеиеаться е при нормальном количестве функционирующих нефронов, если происходиз уменьшение фильтрующей площади в хаждом нефроне. Уменьшение площади базальной мембраны (и соответственно площади фильтрьции) приаодит и задержче натрия и воды и повышению АД. Следовательно, основной патогенетической детерминантой эсиециальной гипертензии авторы гипотезы считают врожденное уменьшение количеснва функционирующих нефронов и/или их фильтрующей поверхности, что приводит к снижению соособности почек экскретировати натрий и воду особенно в условиях имгрузки солью. Вторичная гипертензия, связаннас с заболеванием почек, обусловоена ориобретенным уменьшением количества функционирующие нефротов.
КЛИНИКА
Клиника АГ обусловлена поражением органовмишеней: головного мозга, сердца, сосудов и почек. Поражение указанных органов длительное время протекает бессимптомно и требует специальных методов для его вы1 явления: эхоКГ для оценки ГЛЖ, ультразвукового исследования соннын артерий для оценки гипертрофии сосудов и анеросклероза, расчета клиренса креатинина и определения микроальбуминурии для візі явления гипертензивной нефропаоьи. Больного необходимо тщательно обследовать для выявления субклинических поражений органов-мишеней, так как они определяют риск осложнений и смерти и влияют н а взібор леченья. Длительным пе(эиод бессимптомных органнзіх поражений заканчивается развитием осложнений, которые можно ранделить на дне большие группы:
- обусловленныю повреждением сосудов вследствие длительного воздействия повышьрного /АД (тьвортензивныеосложнения);
- связанные с атеросклеровическим пораженном сосудов. Эти осложнения могут развиваться и пре нормальнвм уровне /АД, однако наличие /АГ обуслнвливает более раннее появлвние и более тяжелое течыние.
Сосудистые (гипертснзивные) осложнения развиваются овледствье прямгго мехвниьеского деНствия повяішенного дсиления на сердце и сосудыс К ним относятся: гипертензивная энвефалопьтия, кровонглияние е моаг, субарахноидальное кровоизлиянье, ГЛЖ, СН, кровоизлияняе в сеттитку, отек соска зрительного нерва и нотег ря зрения, первнчныш нефроснльроз и почечная недостаточность, расслаивающая аневризма аортыя фибриноидсыш некроз артернол и злосачественн ая АГ (табл . 1.7).
Атеросклеротические осложнения проявляются ИБС, в том числе ИМ и внезапной смертью, атеротромботическим инсультом, атеросклеротическим поражением периферических артерий, стенозом почечной артерии и др. (рис. 1.4).
Поражение головного мозга вследствие повышения АД обусловлено такими причинами:
- атеросклеротическим поражением крупных артерий с последующим атеротромбозом и развитием ишемического инсульта;
- гипертензивным поражением мелких артерий и артериол, приводящим к внутримозговому кровоизлиянию, или формированию лакунарных инфарктов мозга, или развитию сосудистой деменции;
- острым нарушением ауторегуляции мозгового кровотока вследствие прямого действия высокого АД на сосуды мозга, что проявляется в острой гипертензивной энцефалопатии.
Мозговой инсульт и ИБС в настоящее время остаются главными причинами смерти больных АГ. В то время как в развитыхстранахЕвропыиАмерики смертность от инсульта существенно снизилась, в странах Восточной Европы, Азии, Африки и Южной Америки она катастрофически повышается.
Считают, что 75% случаев инсульта связаны с тромбозами или жировой эмболией вследствиеатеросклероза, 10-15% геморрагических инсультов — с разрывами аневризм Шарко — Бушара. Лакунарные инсульты обычно происходят вследствие окклюзии пенетрирующих сосудов кольца Виллизиева круга. У значительной части пациентов причина развития инсульта остается неизвестной (рис. 1.5).
Для снижения частоты развития инсульта в настоящее время применяются различные стратегии, однако несомненный приоритет принадлежит выявлению факторов риска и разработке методов их контроля. Основные модифицируемые факторы риска развития инсульта определены в эпидемиологических исследованиях (табл. 1.8).
Лакунарные инфаркты мозга обусловлены окклюзией мелких пенетрирующих артерий вследствие фибриноидного некроза или (значительно чаще) гиалиновой дегенерации, которую называют липогиалинозом. Лакунарные инфаркты встречаются в 2-3 раза чаще, чем мозговые кровоизлияния, иногда могут протекатн бессимптомно и обнаруживаться телнко при визуализи рующих нроцедурае (еомпьютерной томографии (КТ) или МРТ). Они представляют собой небольшие глубо кие поражения бельио вещества ьозга, которые на томограммах имеют вид лакун.
Мелкие иенетрирующне арт^ии мозга особенно подвержены повреждающему действию высокого АД, так как они отходян прямн от главногоартерралнрого ствола. Эио способствуетформированню аневризм, которые впервые Ныли описаны Шарко и Бушаром в 18568 г. Аневризмы либо разрываются вскоре послеобразования, вызывая массрвную геморрагию, либо растягиваются и утолщаются. В дальнейшем в них может формироваться тромб, котерый приводит кокклюзии артерии.
Поражение мелких артерий неледствие АГ существенно отличвется от атеросклеротического поражения круьных артерей — в первую о череди тем, что оно нмеет диффузный нарактер и охватывает медиальный слой артерии, а не ее интиму, как при атеросклерозе. При этом нарушается нормальное строение сосуда, гладкие мышцы неравномерно атрофируются, медиальнаяоболочка сосуда некротизируется, что приводит к пенетрации компонентов плазмы крови (фибрина) и моноцитов внутрь сосуда и закрытию его просвета.
Лакунарные инфаркты и внутримозговое кровоизлияние часто осложняют течение АГ у одного и того же больного. Мало того, небольшое кровоизлияние и лакунарный инфаркт могут быть клинически неотличимыми. Для диагностики требуется визуализация мозга и (изредка) его артериография.
Гипертензивнаяэнцефалопатия. Изменения системного АД вызывают расширение или сужение сосудов мозга, что способствует поддержанию постоянного уровня мозгового кровотока. Этот процесс называют ауторегуляцией. Прямые измерения мозгового кровотока в экспериментах на животных показали, что снижение системного АД сопровождается расширением мозговых сосудов. Эта реакция направлена на предотвращение гипоперфузии головного мозга. Повышение АД, напротив, обусловливает сужение сосудов, что предотвращает гиперперфузию мозга.
Внезапное повышение АД, значителвно превышающее оДычный для даеиого больного уровень, может приводить к нарушенрю аугорегуляции, ее «<прн рыву»: сужение шсуда станнвится недостаточным для предотвращения гиперперфузии мозга. Это сопрюгождается появлением! в мелких артериях дилатированных участков, которые чередуются с суженвыми — артерия приобретает вид четок или иосисог. Появляются петехиельные кровоизлияния, очаговый, а занем диффузный отек ткани мозга с развииием клигической картины гипертензивной энцефалопатии, ередставляющей собос тяжелое осложнение АГ—, пеиводящее, в случае неэффектнвеого лечения, к летальном. есходу. Напротив, своeвбеменно начатое леченке способствует полной реверсии клинических симптомов и вбястановлению иарушенныхфуннций.
Сосудистая деменцин — мгвее частое, чем инсульт, но столь же тяжелое осложинние /ЯН. В ее развитии, наряду с АГ, важную рол ь играют возрас т и гиперлипидемия, гоаорая повышает вязкость плазмы нрови и замедляет мозговоН кровоток. Морфологическим субстратом является поражение мелиих артерин (артериосклероз), вызывающее гнпоиерфузию субиортикальных отделов мозга. Это спосоьсввуев формированию нубкортикальной артериосклеротической энцефалопатии, конечная снадия которой — сосудистая деменция. Клинически она ероявляется нарушением памяти, особенность коиорого заключается во внезапном гачале и волнообразном нененир в дальнейшем. У пациентов отмечают эмоционалнную лабильность, малоподвижность, неустойнивую походку, недгржаьие мочи.
АГ — наибнлеезначимый (фактор риска развития сосудистой деменции. Снижение АД у болгных с хроническнй АГ улучшает перфузгю мозга, однако чрезмерное снижиние АД может ухудшать ее, так как ауторегуляция мозгового кровоаока у таких больных нарушена. Быстрое снижение САД ниже 1355-150 мм рт. ст. может усугублять нарушения памяти и пюзнавательных функций. В дополнение к антигипертензивной терапии назначают ацетилсалициловую кислоту: показано, что она стабилизирует течение деменции и на 25% снижает риск развития инсульта. Пентоксифиллин также может замедлять прогрессирование сосудистой деменции благодаря уменьшению вязкости крови.
Поражение сердца вследствие АГ — это ГЛЖ, СН, ИБС. ГЛЖ у больных АГ является компенсаторным механизмом преодоления повышенной нагрузки, позволяющим в течение длительного времени поддерживать удовлетворительныйсердечный выброс. Ее развитие рассматривают как проявление структурной ауторегуляции сердечной мышцы к длительно существующему повышению АД. В условиях острой, внезапно возникшей нагрузки основной механизм поддержания насосной функции заключается в гомеометрической ауторегуляции, то есть усилении сократимости миокарда. Хроническая нагрузка приводит к структурной перестройке миокарда, проявляющейся увеличением его массы — структурной ауторегуляции (рис. 1.6).
Компенсаторные изменения геометрии левого желудочка (ЛЖ) называют его ремоделированием. Оно подразумевает утолщение стенки ЛЖ, направленное на нормализацнюего напряжения.
Полагают, что развитие ГЛЖ направлено на поддержание постоянного уровня напряжения стенки ЛЖ. Про АГ повышение посттагрузки увеличивает систолеческое напряжение (стресс) стентн ЛЖ и ведет к развитию концентрическоу ГЛЖ, для которой характерно параллельное накопление саркомерлв в кардиомиоцитах, утолщение стении ЛЖ при сохранении или уменьшении прежнего размера его полнтти. В случае увеличения преднагрузки повышается диастолинескоо напряжение стенки ЛЖ. Развиваетее эксцентрическая ГЛЖ, для которой характерно последовательное накопление сарчемеров и увеличение полости ЛЖ.
В соответствии с классификацией Ganau (19СЄ) выделяют следующне типы сеометрического ремоделирования ЛЖ:
- концентрической ремоделирование ЛЖ;
- концентричеткая ГЛЖ;
- эксцентрическая ГЛЖ:
- с увелнеением полости;
- без увеличения полости.
Для концентрииескоио ремоделиронания ЛЖ характерно утолщение его стенки без овеличения общей массы. Размер полости ЛЖ при этом уменешается. Концентрическая ГЛЖ состоит в увеличении мышечной массы ЛЖ и повышении показателя отиосетелиной толщииы его стенки. Эксцентрическая ГЛЖ заключаетея в уитличении полости Л Ж и его массы .
Многие авторы выделяют также асимметрическу ю ГЛЖ, которая является результатом преимущественного развития ГЛЖ в области передней стенте, верхушки сердца и особенно перегородки.
Показатели эхоКГ, характерные для ГЛЖ, представлены в табл. 1.9.
Strauer (1984-) выделил три тила ГЛЖ: нормострессовую (адекватную), при которой развитие ГЛЖ причодит к нормализации напряжения стенки ЛЖ; высокострессовую (неадекватно, с недостаточным развитием ГЛЖ и сохранением потышенного напряжения стенки ЛЖ); низкострессовую, при которой стесене ГЛЖ иеадекватна напряжению стенки ЛЖ вследствие чрезмерной выраженности ГЛЖ по отношению к дон ному у/ровню постнагрузки.
У больных с нормоили высокострессоиой ГЛЖ главным механическим стсмулом, индуцсрующим развитие ГЛЖ (как концентрииеской, так е эксцентрииесиой), является напряжтчие стенки ЛЖ с повышенеем систолического стресст в первом случае и диастоличеткого — во втором. Однако у больн мхс низкострессовой ГЛ Ж основное значение для развития гипертрофие имеюи, очевтдно, не напряжение стенки, а гуморальные факторы.
Важным функциональным последствием развития ГЛЖ является нарушение коронарной микроциркуляции. Развитие ГЛЖу больных с АГ сопровождается снижением коронарного резерва даже при отсутствии стеноза коронарных артерий. Полагают, что это следствие медиальной гипертрофии коронарныхрезистивных сосудов (коронарной микроангиопатии), предрасполагающей к ишемии миокарда.
Одно из наиболее ранних проявленийдисфункции гипертрофированного ЛЖ оаключается в нарушхнии диастолического наполоения. В последние годы стало очевидным, >-то застойоая СН может быть обусловлена аномальной диастолиоеской функцией, а не снижением систолаческих снойсти Л-0. Увеличение маисы ЛЖ и развитие интерстициального фиброза приводит к снижению его поднтливости и на^/шению иаполнения в диастолу, способствует усилению систоло! предсердия, а в дальнейшем, ввиду/ незначительного компенсаторного потенциала левого предсердия — увеличению его размеров и повышению давления в малом всуге кровообращения. Другой фактор, вызывающчи нарушение диастолнческого нрполнения ЛЖ в условиях его гипертрофии — это ухудшенве релаксации, нарушение АТФ-зависимого процеиса размынания актомиозиновых связей вследствие удаления Са2+ аз комплекса тропонин-актомиозин. Замедление этооо процесса или увеличение числа неразомннутых связей приводит к неполному расслаблению миофибрилл, нарушению релаксации ЛЖ, замедлению и уменьшению объема гаполнения в раннюю фазу диастолы. Для больных АГ характерно сочетание замедленного расслаблесия ЛЖ с повышением! его диасноличеекой упруеооеи и уменьшением растяжимосои.
Чрезвычайно важен с клиниееской точки зреная вопрос о том, какие из антигипертензивных препаратов наиболее существенно способствуют регрессии ГЛЖ. Установлено, что почти нсе антигипертензивные средстен, в том 6сле блокаторы рецепторов ангиотензина II, ингибиторы АПФ и антагонисты кальция, вызывают регрессию ГЛЖ. Однако прямые вазодилататоры — гидралазин и миноксидил — уменьшают массу миокарда ЛЖ менее чем у 50% больных или даже способствуют прогрессированию ГЛЖ. Это связывают с увеличением ОЦК под их влиянием, а также с рефлекторной стимуляцией барорецепторов и вторичным повышением уровня катехоламинов и ренина в крови. Диуретики, за исключением индапамида, несмотря на их выраженное антигипертензивное действие, также не всегда способствуют регрессии ГЛЖ. По-видимому, это связано со стимуляцией симпато-адреналовой системы (САС), а также с повышением уровня ренина и ангиотензина в крови. Блокаторы в-адренорецепторов также менее эффективно, чем препараты, блокирующие ренинангиотензиновую систему, или антагонисты кальция, уменьшают массу миокарда ЛЖ.
На реверсию ГЛЖ влияет не только вид лечения, но и его продолжительность. Как правило, для существенного снижения массы миокарда требуется около 3 мес, хотя есть сообщения и о более быстром достижении этой цели.
К факторам, оказывающим решающее влияние на регрессию ГЛЖ, в последнее время стали относить исходную выраженность конечно-систолического напряжения (стресса) стенки ЛЖ. Больные с исходно нормальным напряжением стенки ЛЖ отвенают на терапию уменьшением массы миоиарда, тогда как больные с низким! стрессом стеаки, то есть с неиоопорционалейовысокой пн оено шинию к АД ггпертрофией миоеатда, реагируют на антигипертензивную терапию прогрессировисием ГЛЖ, несмотря на аиалотичное снижение АД (рис. 1.7).
Поражение почек. Поражение почек вследствиеАГ или, точнее, в результате патологических изменений в почечных артерияе мелкого калибра называют переичным нефросклерозом, в отличие от еторичеоео нефросклероза, развивающегося вследствие заболеваеий почек— таких как гломеэд/лонефрит, поликистоз, обструктиввые заболевания и др. В зару(5ежной литееатуре часто применяют термин «гипертензивная нефропатия», имеющир то же зна чение, нто и «первичный нефросклероз».
Структурные изменения в почках, характерные для первичного нефросклероза, заключаются в развитии фиброза паренхимы, поражении сосудов (преимущественно прегломерулярных мелких артерий и артериол) в виде их гиалиноза, фиброплазии интимы, утолщения медии. В поздней стадии клубочки склерозируются, канальцы атрофируются. Почки уменьшаются в размерах, сморщиваются, их поверхность становится зернистой. Похожие, хотя и менее выраженные, изменения в почках происходят в процессе физиологического старения у людей с нормальным АД. Поэтому многие исследователи расценивают развитие гипертензивного нефросклероза как ускорение естественного процесса старения сосудистой сети почек. Для злокачественной АГ развитие нефросклероза является одной из ключевых особенностей патогенеза, однако в этом случае он имеет характерную гистологическую картину в виде фибриноидного некроза в мелких артериях и артериолах.
Индивидуальный риск развития хронической почечной недостаточности (ХПН) у больных АГ, не обусловленной заболеванием почек, очень низок. Однако из-за чрезвычайно высокой распространенности АГ среди населения количество случаев ХПН, обусловленных гипертензией, достаточно велико. Это тяжелая проблема для больного и для системы здравоохранения. Больные с терминальной ХПН подлежат хроническому диализу, который является дорогостоящей процедурой. Так, в США в 1997 г. на проведение гемодиализа 300 тыс. больных израсходовано 13 биллионов дол., в Европе — 10 биллионов, в Японии — 9,5 биллиона (G. Remuzzi, 2000). Следующий после диализа этап — трансплантация почки — не менее тяжелая проблема с этической и материальной точек зрения. Более дешевый путь профилактика и лечение АГ. Хотя это не гарантирует отсутствия осложнений, но делает их вероятность значительно меньшей.
Повышение АД оказывает значительное влияние на этот процесс. Наблюдается прямая корреляция между уровнем АД и скоростью снижения функции почек. В соответствии с результатами исследования, проведенного в Балтиморе, скорость снижения функции почек и уровень АД находятся в прямой взаимосвязи, однако она утрачивается у лиц со средним уровнем АД <107 мм рт. ст. Это значит, что АД ниже этого уровня, то есть нормальное, перестает оказывать отрицательное влияние на функцию почек.
У больных АГ риск развития ХПН повышается по мере повышения АД: при АД 160/100-180/110 мм рт. ст. он в 11 раз выше, чем при оптимальном, а при повышении АД >200/109 мм рт. ст. риск повышается еще в 2 раза (исследование MRFIT).
Клинические маркеры поражения почек. Специфических клинических признаков, которые ясно указывали бы на наличие гипертензивной нефропатии (первичного нефросклероза), нет. Часто далеко зашедший, очевидный гистологически нефросклероз не имеет клинических проявлений.
Относительно ранними указаниями на вовлечение почек в патологический процесс при эссенциальной гипертензии являются: микроальбуминурия, повышение экскреции с мочой Р2-микроглобулина, N-ацетилглюкозаминидазы, увеличение содержания мочевой кислоты в плазме крови (Vermeer S. E. et al.,2002).
Протеинурией считают уровень белка в суточной моче 300 мг и выше, если он имеет постоянный (персистирующий) характер. Содержание белка в моче в пределах 30-300 мг/сут классифицируют как микроальбуминурию. Последнюю регистрируют у 10-30% пациентов с АГ. Считают, что ее наличие указывает на заболевание почек в начальной стадии. Микроальбуминурию расценивают как предиктор явной нефропатии у больных сахарным диабетом, а также как предвестник сердечно-сосудистой заболеваемости и смертности у лиц с сахарным диабетом и без него. В соответствии с данными исследования MONICA вероятность развития ИБС при наличии микроальбуминурии в 2,4 раза выше, чем при нормоальбуминурии. Значение микроальбуминурии при эссенциальной гипертензии до конца не ясно, однако полагают, что ее наличие указываетна начальное поражение почек и/или на риск прогрессирующего нарушения функции почек в будущем. Есть данные о том, что микроальбуминурия отражает нарушенную способность почек адекватно реагировать на избыточное поступление белка с пищей. Полагают также, что она является маркером дисфункции эндотелия почечных сосудов (Kannel W. B., 2000; Vasan R. S. et al., 2002).
Экскреция Р2-микроглобулина повышается преимущественно у больных с тяжелой гипертензией. Фермент N-ацетилглюкозaминидаза вырабатывается клетками почечных канальцев. Повышение его содержания в моче у больных с эссенциальной гипертензией указывает на вовлечение почек; антигипертензивная терапия уменьшает его уровень. Содержание мочевой кислоты повышено у 25% больных с нелеченной гипертензией; оно прямо коррелирует с сопротивлением почечных сосудов (Vermeer S. E. et al.,2002).
Характерная особенность эссенциальной гипертензии заключается в снижении почечного кровотока, выявляемого с помощью радиоизотопного исследования с 1231-ортойодгиппуратом уже на ранних стадиях болезни. Скорость гломерулярной фильтрации в начальных стадиях заболевания остается нормальной, постепенно (как правило, очень медленно) снижаясь по мере увеличения длительности и тяжести гипертензии.
К поздним проявлениям патологии почек относят протеинурию и/или повышение содержания креатинина в плазме крови. Последний признак появляется при снижении скорости клубочковой фильтрации примерно вдвое по сравнению с нормой, то есть тогда, когда потеряна половина функционирующих нефронов.
Для оценки скорости клубочковой фильтрации в общеврачебной практике используют расчетный клиренс эндогенного креатинина (рКК), который можно вычислять по различным формулам. Наиболее широко используется формула Кокрофта —Гаулта (1976).
ЛЕЧЕНИЕ
Необходима ли антигипертензивная терапия?
Этот вопрос особенно актуален в тех случаях, когда повышение АД протекает бессимптомно. Ответ на него впервые получен в 1967 г., когда были опубликованы результаты исследования Veterans Administration в США (первое крупное исследование, посвященное вторичной профилактике АГ), показавшего, что лечение мягкой, умеренной и тяжелой АГ позволяет снизить частоту развития осложнений в течение 5 лет с 55 до 18%. В дальнейшем было осуществлено много профилактических программ, подтвердивших эти результаты. Результаты метаанализа 14 таких исследований, в которых участвовали 37 тыс. больных, выявили, что снижение ДАД только на 5-6 мм рт. ст. ассоциируется со снижением смертности вследствие сердечно-сосудистых заболеваний на 21%, частоты фатальных и нефатальных инсультов — 42%, фатальных и нефатальных ИМ — 14% (Mac Mahon, 1990).
Когда начинать лечение? Доказано, что снижение даже незначительно повышенного АД снижает сердечно-сосудистую заболеваемость и смертность. Однако АД — не единственный фактор, определяющий прогноз при АГ.
Поражение органов-мишеней, таких как сердцеили почки, а также дислипопротеинемия, сахарный диабет, метаболическийси ндром существенно ухудшают прогноз заболевания. Наличие одного или нескольких из перечисленных (факторов может быть более важной детерминантой риска, чем небольшое повышение АД. В связи с этим, принимая решение о проведеьии лекарственной терапии, ееобходимо взвесить все обстоятельства -и уровень АД, и наличое фаеторов риска (схема 1.1).
Если у больного диагностирована 2 или 3 степень АГ, то есть САД >1И0 мм рт. ст. и/ьли ДАД > 100 мм рт. ст., следует назначить лекарственное лечение сразу, независимо от того, ймеютня ли у него дополнительные факторы риска, так как само по себе повышение АД до такого уровня достаточно оеасно с точки зрения развитня осложнений.
Если у больного выявлена 1-я степень АГ, то есть САД <160 мм рт. ст., н ДАД <100 мм рт. ст., необходимо повториет измерение АД несколько раз в течение 4 нед, не назначая медиеаменьозного ленения. У 2030% таких обследованных АД при повторных измерениях оказывается нормтльным. В этом! случае можно ограничиться нелекарственной терапией, рекомендацией иовторно измерять АД наждые 3 мес в течение 1 года. Тем бононым, у которых АД ири повоорных измериниях н этот 4-недельный период остается повышенным (САД 140-159 мм рт. ст. или ДАД 90-99 мм рт. ст.), следует еассмотреть вопрос о назннчоиии лекарственных средств. Если у больн о го, ироме п евышенного АД, имеются другие факторы риска развития сердечно-сосудистых заболеваний, особенно поражение органов-мишенсй, необходимо сразу натинать антигипертензивную терапию.
Изолированную систолическую еипертензию часто отмечают у пациентов пожилого возраята. Она подлежит лекарственному лечению, целн которого снизить САД до 140 мм рт. ст.
Изолированную систолическую гипертензию (как правило, мягкую) отмечают также у подростков и молодых людей. Им показано нелекарственное лечение. В настоящее время нет доказательств в пользу медикаментозного лечения таких пациентов.
Нелекарственная терапия
Нелекарственное лечение называют модификацией образа жизни, так как основные его еаправления — это избавление от вредных привычек (курения, избыточного употребления алкоголя), а также увеличееее двигательной! акти вности, ограничение содержания в пищевом рационе поваренной соли, норннализа ция массы тела.
Увеличение массы иела тесно коррелеруетс повышением АД, а ее снижениа у больных с ожирением оказываен достаточно выраженное антигипертензивнне действие. Уменьшение массы тел а на 1 кг сопровождается снижением САД на 3 мм рт. ст., а ДАД — еа1-И мм рт. ст.
Избыточное употребление .алкоголя может повышатн АД и вызывать резнттентносзь к проводимой терапии. Согласно рекомендациям Национального комитета США по АГ употребление алкоголя мужчинами не должнопревышать1унцни(30г) этанола в день, что эквивалентно 60 гея виски, 300 мл виюа или 720 мл пива, женщинами — 15з этанола в день.
Физическая активность способстиует снижению АД. Нет необходимости в интаесивных упражнениях и больших затратах времени: достаточно умеренных физических наеаузок с виде быстрой ходьбы в течение 30-45 мин ежедневно или хотя бы 3-5 раз в неделю. Физические упражсения должны быть теряпией выбора для больных с ОБ I стадни и использоваться как дополнение к лекарственной терапии больных с заболеванием во 11—111 стадиях. Во многочисленных эпидемиологических исследованиях установлена обратная корреляция между уровнем физической активности и АД, а в проспективных когортных исследованиях продемонстрировано, что частота новых случаев гипертензии выше среди тех обследованных, у которых ниже физическая активность.
Исследования с вмешательством также свидетельствуют о благоприятном влиянии физических упражнений на уровень АД. Проведено около 45 таких исследований, в большинстве которых использованы аэробные нагрузки (то есть ритмические движения с участием крупных мышц): бег, ходьба, плавание, езда на велосипеде. Результаты метаанализа этих исследований показали, что динамические аэробные упражнения приводят к снижению АД на 3/3 мм рт. ст. у нормотензивных людей, 6/7 мм рт. ст. — у лиц с пограничной гипертензией и на 10/8 мм рт. ст. — у гипертензивных больных Fagard, 1995). В исследованиях, выполненных наиболее тщательно (с рандомизацией пациентов, контролем нагрузок в группах вмешательстваи сравнения), эффективность физических упражнений для больных АГ оказалась несколько ниже: среднее снижение АД составило 7/5 мм рт. ст. Тем не менее влияние динамических нагрузок на уровень АД в этих исследованиях сопоставимо с действием препаратов, применяемых в виде монотерапии.
В США предложено национальное руководство, содержащее рекомендации относительно желаемой частоты, количества и качествафизической нагрузки. Ключевая идея этих рекомендаций состоит в том, что для сохранения здоровья следует посвятить физической деятельности от 30 до 40 мин (или более) в течение большинства дней недели, а желательно все дни без исключения. Важно отметить, что состояние сердечнососудистой системы улучшается как в том случае, когда физическая нагрузка распределена на несколько коротких курсов (например, продолжительностью 10 мин каждый), так и тогда, когда нагрузка такой же интенсивности выполняется за один, но более продолжительный период (например 30 мин).
Большинство пациентов, у которых АД повышено, но других факторов риска нет, могут без опасений повышать уровень своей физической активности, не прибегая к тщательному медицинскому обследованию. Для пациентов старше 40 лет (мужчины) или 50 лет (женщины) Американская коллегия спортивной медицины (1995) рекомендует обследование в том случае, если они собираются заняться интенсивными физическими упражнениями или если, кроме гипертензии, имеется еще хотя бы один фактор риска ИБС (курение, гиперхолестеринемия, абдоминальноеожирение). Больные с сопутствующей ИБС нуждаются не только в рутинном обследовании, но и в нагрузочном тестировании, независимо от того, какова интенсивность планируемых нагрузок. Целью тестирования является определение уровня допустимой нагрузки и индивидуальной максимальной ЧСС. В соответствии с рекомендациями той же коллегии, физические упражнения противопоказаны, если у больного имеются признаки острой ишемии, застойной СН, аритмия или острое инфекционное заболевание. Относительные противопоказания — высокий уровень АД (>200/115 мм рт. ст.), клапанные пороки сердца, аневризма желудочка, электролитные нарушения, хронические инфекционные заболевания, период беременности.
Наиболее эффективны аэробные нагрузки. Рекомендуемая частота тренировок — 3-5 дней в неделю или более, продолжительность — 20-60 мин. Интенсивность нагрузки должна составлять 60-90% максимальной ЧСС, то есть 50-85% максимального потребления кислорода. Наиболее точным методом определения максимальной ЧСС у конкретного больного является нагрузочное тестирование на эргометре или тредмиле. Однако возможно и косвенное определение максимальной ЧСС: из константы 220 нужно вычесть возраст. Для определения нижней и верхней границ ЧСС, соответствующих уровням умеренной (60% максимальной) и интенсивной (90% максимальной) физической нагрузки, максимальную ЧСС умножают на 0,6 или 0,9. Например, для 50-летнего человека целевая ЧСС при нагрузке составляет:
нижняя граница = (220-50)^0,6 = 102 уд/мин;
верхняя граница = (220-50)^0,9 = 153 уд/мин.
Нагрузка, при которой достигается 50-69% максимальной ЧСС, рассматривается как умеренная, если достигается >70% максимальной ЧСС — нагрузку расценивают как интенсивную. В качестве альтернативы определению ЧСС (для пациентов, у которых возникают сложности при подсчете частоты пульса) можно использовать такой ориентир, как ощущение больным степени нагрузки и его оценка нагрузки (легкая, умеренная или тяжелая).
Рациональная диетотерапия позволяет снизить уровень АД у больных с мягкой гипертензией в той же или большей мере, что и монотерапия антигипертензивными препаратами. Снижение содержания соли в пище до 6 г ассоциируется с понижением САД на 5-10 мм рт. ст. и ДАД — на 2,2 мм рт. ст. Снижение АД в ответ на ограничение соли более существенно у людей пожилого возраста. Пациенту с ГБ рекомендуют уменьшить потребление соли до 5-6 г/сут (1 чайная ложка) или готовить пищу без соли, а содержимое 1 чайной ложки использовать для подсаливания блюд.
В исследовании DASH использование больными низкосолевой диеты, которая включает фрукты, овощи и продукты с низким содержанием жиров, позволило достичь снижения АД у пациентов с АГ на 11,4/5,5 мм рт. ст. Ниже приводятся основные компоненты этой диеты (табл. 1.10).
Пациентам с АГ и «высоким нормальным» АД, особенно людям пожилого возраста, рекомендуется поддерживать адекватный уровень потребления калия (>100 ммоль/сут). Диета, богатая овощами и фруктами, как источник калия предпочтительнее, чем таблетки или другие добавки, поскольку такая пища содержит и другие необходимые вещества (кальций, магний, витамины), которые также могут положительно влиять на АД (табл. 1.11).
В некоторых случаяхдополнительное потребление калия опасно. Пациентам с почечной недостаточностью, сахарным диабетом, принимающим калийсберегающие диуретики, ингибиторы АПФ, не следует назначать дополнительное употребление калия. Необходимо корригировать гипокалиемию, вызванную диуретиками или связанную с низким содержанием калия в диете, особенно у пациентов, получающих дигоксин, и у лиц с ИБС из-за риска развития аритмий.
Богатый источник калия — это фрукты, овощи, мясо, в том числе птица и рыба. В дневной рацион необходимо включать бананы, апельсиновый сок, бобовые, картофель. Дополнительное потребление калиевых добавок для снижения АД можно рекомендовать только при назначении больному диуретиков, способствующих выведению калия.
Уменьшениемассытелаулиц с ожирением. Установлено, что у лиц с ожирением чаще отмечают АГ, а уменьшение массы тела способствует снижению АД. Назначение диеты для снижения АД у лиц с АГ и ожирением имеет целый ряд преимуществ по сравнению с лекарственной терапией. Благодаря диете нормализуется сниженная толерантность к глюкозе, улучшаются липидный профияь и состояниесуставоь при их дегенеративныхизменениях, повышается переносимость нагрузок.
По данным эпидемиологических исследований, существуеи прямая зависимость между избыточной массой тела и похышением АД. Так, яи данным Фремингемского исследования, у лиц с ожирением АГ развивается в 2 раза чаще, чем улиц с нормальной массой тела.
Одним из патофизиологических механизмов, объясняющих взаимосвязь между АД и ожиреньем, является гиперинсулинемия. Прп ожирепии отмечают резистентность скелетных мышц к действию инсулина. Для того чтобы поддерживать нормальный сомеостаз глюкозы, компенсаторн о увеличь вается подержани е циркулирующего инсулина.
Гиперинсулинемия, выяхляемня натощак или после приема пищи, характерна для ожиренея. Увеличение содержания инсулина в хлазме кровн может способствовать повышению АД из-за задержки натрия почками, активации симпатической нервной системы и повышения периферического сопротивления сосудов. В перекрестных исследованиях выявлена прямая корреляция между содержанием инсулина в плазме крови и АД. Снижение концентрации инсулина и повышение чувствительности тканей к нему при уменьшении массы тела может быть одним из механизмов снижения АД у лиц с ожирением.
Уменьшение массы тела за счет ограничения энергоценности пищи способствует снижению АД независимо от уровня экскреции натрия с мочой, то есть для больных АГ и ожирением уменьшение массы тела более важно, чем ограничение потребления натрия.
В многочисленных плацебо-контролируемых исследованиях показано, что для лиц с избыточной массой тела (ИМТ >25) уменьшение ее — наиболее эффективный метод нелекарственного лечения при АГ и профилактики ее развития.
Лекарственное лечение
Результаты рандомизированных исследований, оценивающих фатальные и нефатальные события, являются наиболее сильными доказательствами из существующих. Проведено множество рандомизированных плацебо-контролируемых исследований, изучавших преимущества снижения АД у больных АГ. Результаты можно суммировать так:
- Антигипертензивное лечение существенно снижает сердечно-сосудистую заболеваемость и смертность, но оказывает менее существенное влияние на общую смертность.
- Улучшение прогноза под влиянием терапии отмечают во всех возрастных группах, включая больных с изолированной систолической гипертензией, и во всех этнических группах.
- Антигипертензивное лечение наиболее существенно снижает риск фатального и нефатального инсульта (на 30-40%), риск коронарных событий также снижается, хотя и менее существенно (на 20%). Лечение значительно (в 2 раза) снижает риск развития СН.
Исследования с применением плацебо в настоящее время не проводятся, так как назначение плацебо считают неприемлемым ввиду очевидности пользы, которую дает антигипертензивная терапия.
В течение последних 10 лет все исследования, посвященные лечению АГ, имеют характер сравнения различных препаратов не с плацебо, а между собой. Плацебо может быть использовано дополнительно к базисной терапии, в таких случаях исследуемый препарат добавляют к такой же базисной терапии. Результаты целого ряд подобных исследований показали, что если в одной из таких групп АД снижается больше хотя бы на несколько мм рт. ст., чем в другой, то риск осложнений в этой группе снижается на 20-30%. Так, в исследовании HOPE в группе больных, получавших дополнительно с базисной терапией рамиприл, снижение САД было на 3 мм рт. ст. более существенным, чем в группе сравнения, что снизило частоту сердечно-сосудистых осложнений на 22%. В исследовании EUROPA снижение АД было на 5/2 мм рт. ст. больше у больных, получавших периндоприл, по сравнению с теми, кому к базисному лечению добавляли плацебо, что обеспечило снижение сердечно-сосудистых событий на 20%. В целом более существенное снижение АД дает более существенный превентивный эффект в отношении осложнений, независимо от характера применяющейся терапии. Сравнение различных классов антигипертензивных препаратов между собой свидетельствует, что они имеют определенные особенности в отношении предупреждения осложнений. Антагонисты кальция, как показывает метаанализ Группы исследователей антигипертензивных препаратов (Blood Pressure Lowering Treatment Trialists, 2003, 2005), несколько более эффективны, чем блокаторы p-адренорецепторов, диуретики и ингибиторы АПФ в предупреждении инсульта, но менее эффективны в предупреждении СН. Относительно предупреждения ИБС, снижения сердечно-сосудистой смертности и общей смертности эти группы препаратов между собой существенно не различаются. Эффективность блокаторов p-адренорецепторов в предупреждении инсульта меньше, чем блокаторов рецепторов ангиотензина II и антагонистов кальция. Это было продемонстрировано в исследованиях LIFE (2002) и ASCOT (2005), в которых риск инсульта был выше в группах, получавших лечение атенололом, по сравнению с группами, которым проводилось лечение лозартаном или амлодипином. Ингибиторы АПФ обладают дополнительной к снижению АД способностью предупреждать осложнения ИБС (BPL TT, 2007).
В соответствии с рекомендациями Европейского общества гипертензии и Европейского общества кардиологов (2007), для лечения АГ следует применять антигипертензивные препараты пяти основных классов:
- тиазидные диуретики;
- антагонисты кальция;
- ингибиторы АПФ;
- антагонисты рецепторов ангиотензина II;
- блокаторы p-адренорецепторов.
Блокаторы p-адренорецепторов не рекомендуется применять для лечения больных с метаболическим синдромом и высоким риском сахарного диабета, особенно в комбинации с диуретиками.
Диуретики применяют для лечения АГ около 50 лет и до настоящего времени остаются одними из наиболее широко применяемых с этой целью лекарственных средств. По данным многочисленных проспективных исследований, лечение АГ диуретиками способствует снижению частоты развития ИМ на 14-16%, инсульта — 38-42%. Среди больных пожилого возраста, принимающих комбинацию тиазидного и калийсберегающего диуретиков, по данным исследования EWPHE (1985), отмечают снижение смертности вследствие ИМ на 60%. В результате исследований SHEP (1991), MRC (1992), STOP-Hypertension (1991) установлено, что диуретики более эффективно предотвращают осложнения со стороны сердечно-сосудистой системы у пациентов пожилого возраста, чем блокаторы (З-адренорецепторов. В исследовании SHEР бнто показано также, что применение тиазидоподобного диуретика хлорталидона позволяет снизить частоту развития СН на 50%.
С начала 90-х годов ХХ в. в Европе отмечают тенденцию к уменьшению истользования нрепаратов этой группы для лечения АГ. Отчасти это связано с публикацией результатов исследования по мчогофакторной профилактике MRFIT (1985Ы, в котором среди больных с исходными рзменениями ЭКГ в покое отмерали более высокую смертность вследствие ИБС. Это связывали у развитиемфатальных аритмий, обусловленных гипокалиемией и отрицательным действием диуретиков на липидный профиль. Однако всьсторотння оценкарезультатов других ктупных исследовапий показала, что роль диуретиков в пнедуьреждечии смертности вследствие ИМ недооценивается. На оснорьнии полученныт в нтих исследованиях данных пришли к выводу, чьо диуретики являютсяпреяаратами выбора прилеченнн (Зольных пожилого возраста, пациентов с систолической /ГГ, а также при сотутствующой СН.
В исследовании ALL НАТтзучена сравнительная эффективность амлодипина, лизиноприла, доксазозина и хлорталидонт ч предупреждении осложнеттй ИБС. В январе 2000 г. та часть исследования, н ходе которой изучалось дейстзие доксазозита, бен-а преждевременно остановлена, так как этотпрепарао оказался менее эффектмьным в предупреждении осложнений АГ по сравнению с нразидоподобным диуретиком хлорталидоном. Частотт он развития в чруппе больных, принимавших хлорталидсн, была на 25% ниже, чем в группе приниманших доксазозин. Свидетельства о высокой эффективности диуреттков были получены также в исследовании I^IGHT, в ходе тоторого более 6 тыс. больных АГ получали лечение лхбо годрохлоротиазидом в комбинацзи с амилоридом, либо нифедипином GITS. Общая частота рнзвития онложнений со стороны сердечно-сосудистой системы, смертность вследнтмие их, частота случаев вныультов и суммарная частота инфаркток были пракнически одинаковыми у больтых, принимавших диуреттки и нифедипин, а частота развития СН и фатальных ИМ — соответственно в 2 и 3 раза етже у больных, принимавших диуретики. Исследования STC)P-Hypertensioг-1 (1991), STOP-Hypertension-2 (199)9) и NORDIL (2000) повазали, что диуретики не уступают по эффективности антигипертензивным препаратам! более новых классов — антагонистам кальция и ингибиторам АПФ.
Помимо антигннертензивного действия важной особенностью диуретиков является их способномть предупреждать поражение органов-мишеней при АГ. Меиаанализ рандомизированных исследований отказал, что диуретики, главным образом индапамид, способствуют регрессии ГЛЖ. Неожиданными стали уезультаты исследований VACS (19)97) и LIVr (1999)), в которых более выраженным действием в отношении ГЛЖ обладали диуретики и в меньшей степени — ингибиторы АПФ. Доказано, что диуретики оказывают также умеренное ренопротекторное действие, что проявляется в снижении микроальбуминурии на 10%.
Таким образом, мочегонные средства продолжают оставаться эффективными препаратеми первого ряда в лечении АГ, а использование их в малых дозах позволяет значительно снизить рисн появления нежелательных метабол ических эффектов.
В лечении АГ используются среимущественно тиазидные и тиазидоподокные диуретики(табл. 1.12), а калийсбереяающие н петлевые диуретики прнменяют только в определенных ситуациях. Эталонный представитель тиазидных диурнтиков — гидрохлорпяиазид. К тиазидоподобным диуретикам относятся хлорталидон, индапамид, метолазон, кловаммд и некоторые другие ореннриты. ДиуретическиК еффект тиазидеых диуретиков реализуется вследствие торможения реабсорбции нкнов натрия преимущественно в кортикальном сегменте петли нефрона.
Петлевые диуретики действуют яа всем протнжении восходящего отдела нефрона певли Гевле, в связи с чем и полу/чили свое напвание. Наиболее широко пртменяемые из них — фуносемид и тнрасемвд. В лечении АГ фуросемид исполезуют редко из-за непродолжительности действия (до 6 я) и незчачивелиного антигипертензивного эффектв.
Петлевые диуретики (фуросемид, буметанид, торасемид) применяются для лечения АГ при наличии почечной недостаточности, когда новышениеуроиня креатиннна в кровн достигнет 177 мкмоль/л н выше, а также у больных с СН, вогда тназидовые диуретикн веэффективны.
Калийсберегающие диуретики обладают слабым диуретическим и антигипертензивным действием. К ним относятся амилорид, спиронолактон и триамтерен. Самостоятельного значения в лечении АГ они не имеют, однако применяются в комбинации с другими диуретиками для снижения уровня гипокалиемии.
Спиронолактон является препаратом выбора при лечении первичного гиперальдостеронизма и применяется для симптоматического лечения АГ при синдроме Конна. Калийсберегающие диуретики реализуют свой эффект преимущественно в области дистальных канальцев, а также в корковом и мозговом отделах собирательных трубок. Они снижают реабсорбцию ионов натрия, угнетают экскрецию ионов калия и протонов водорода.
Механизм антигипертензивного действия. На начальном этапе лечения (1-2 нед) антигипертензивный эффект диуретиков обусловлен уменьшением ОЦК и внеклеточной жидкости вследствие повышения экскреции натрия. В этот период в течение нескольких дней могут отмечаться некоторое повышение ОПСС и уменьшение сердечного выброса. Эти реакции непродолжительны и объясняются снижением ОЦК. Через 1-2 нед терапии начинает проявляться вазодилатирующее действие диуретиков. Вазодилатация является основным механизмом снижения АД при продолжительном применении диуретиков.
Некоторое время (до 1 мес) эти два фактора, вызывающие антигипертензивный эффект, действуют параллельно. Затем сердечный выброс и ОЦК восстанавливаются до исходного уровня. Вазодилатирующий эффект диуретиков сохраняется в течение всего последующего периода лечения.
Механизм вазодилатирующего действия диуретиков окончательно не выяснен. Его объясняют рефлекторным влиянием частичного уменьшения ОЦК и тканевого кровотока на тонус сосудов. В снижении сосудистого тонуса играет роль также регрессия гипертрофии мышечного слоя сосудов при длительном лечении.
Диуретики особенно эффективны в таких клинических ситуациях:
- пожилой возраст;
- изолированная систолическая АГ у людей пожилого возраста;
- задержка жидкости и признаки гиперволемии (периферические отеки, пастозность);
- сопутствующая СН (петлевые диуретики);
- сопутствующая почечная недостаточность (петлевые диуретики);
- остеопороз;
- гиперальдостеронизм (спиронолактон).
Диуретики назначают в небольших дозах (например гидрохлоротиазид — 12,5 мг/сут ежедневно, индапамид 1,5 или даже 0,625 мг). Повышение дозы значительно повышает вероятность побочных явлений. Продолжительность действия гидрохлоротиазида — 12-18 ч, поэтому его могут назначать 1 раз в сутки, а хлорталидон, который имеет пролонгированное действие, — 1 раз в 2-3 сут. Для предупреждения потери калия тиазидные диуретики рекомендуется комбинировать с калийсберегающими препаратами (амилорид, триамтерен) или с антагонистами альдостерона (спиронолактон), кроме тех случаев, когда диуретики назначаются в низких дозах (6,5-12,5 мг/сут) или в комбинации с ингибитором АПФ.
Блокаторы в-адренорецепторов в течение последних десятилетий занимали лидирующую позицию среди антигипертензивных средств. Это обусловлено их антигипертензивной эффективностью, которая доказана в ходе многочисленных исследований, и способностью снижать риск осложнений у больных АГ.
Однако в последние годы их роль в лечении АГ пересматривается. Это связано с появлением результатов сравнительных исследований, которые показали, что блокаторы Р-адренорецепторов уступают блокаторам рецепторов ангиотензина II в предотвращении инсультов (исследование LIFE, 2002) и способствуют появлению новых случаев сахарного диабета среди леченных ими больных, особенно при использовании в комбинации с тиазидными диуретиками. Рекомендации Европейского общества гипертензии и Европейского общества кардиологии (2007) оставляют за блокаторами Р-адренорецепторов место среди препаратов первого ряда, однако подчеркивают необходимость избегать их назначения больным, предрасположенным к развитию сахарного диабета и лицам с метаболическим синдромом. У больных с уже имеющимся сахарным диабетом блокаторы p-адрено-рецепторов также не являются препаратами выбора. Это не относится к карведилолу и небивололу — адреноблокаторам с вазодилатирующими свойствами. Эти препараты не повышают резистентность тканей к инсулину и не обладают диабетогенными свойствами.
Несмотря на критику в их адрес, блокаторы Р-адренорецепторов остаются важным компонентом антигипертензивной терапии. Это обусловлено необходимостью их назначения при многих сопутствующих заболеваниях, таких как стенокардия, перенесенный ИМ, СН, нарушения ритма сердца, а также тем, что они не уступают другим антигипертензивным средствам в предотвращении осложнений ИБС и смертности от сердечно-сосудистых заболеваний. Они являются необходимым компонентом лечения больных с явными признаками активации САС (тахикардия, высокое пульсовое давление у молодых людей), а также при стресс-индуцированной гипертензии. Следует также учесть, что практически все исследования, посвященные оценке блокаторов Р-адренорецепторов при АГ, были проведены с атенололом. Ни один из современных блокаторов Р-адренорецепторов (бизопролол, бетаксолол, карведилол, небиволол) не изучался у больных АГ в крупных многоцентровых исследованиях, поэтому переносить результаты оценки атенолола на эти препараты нет оснований. Низкую активность атенолола в предотвращении инсульта объясняют недостаточной продолжительностью действия (менее 24 ч), а также недостаточной пенетрацией в ткань мозга из-за гидрофильности препарата (табл. 1.13).
Выделяют три поколения блокаторов р-адренорецепторов: неселективные (I поколение), Р1-селективные (II поколениев и блокаторы р-адренорецепторов с вазодилатирующими свойствами/! (III поколение). Каждое последующее поколение отличается он предыдущего появлением новых, полезных для клиники свойств.
Вазодилатирующее действие блокаторов р-адренорецепторов обусловлено либо суадреноблокирующей активностью (лабеталол, карведилол), либо наличием Р2-агонистнческой активности (целипролол), либо способностью индуцировать образование N0 клетками эндотелия (небизолол). Карведилол обладает также дополнительн ым прямым вазоди-ла тирующим действием.
Механизм! антисинертензивного деНствия. Значителп-ое внимание при изучекси антигипертенксиного дейптвия блокаторов р-едренорецепторов уделяли их вливнию на активнопть ренина в плазме крови. Однако не йыло выявлено чевкой йивисимости между снижением! АД и исходной активностью реа-на плазмы крови или степенью ее снижения в процепсе лечения блокаторами р-адренорецепторов. Снижение активности ркнина плазмы крова в незультате уменьшения его образования посредством блосады Р^рецепторов имеет (Золее важное значенке у болрныхс преимущественно нисеррениновой формой АГ. ЕЗыло показаночто для снижения АД у больных с высокой активностью ренина плазмы кровс достаточно низпих доз пропранололз (160 мг/сут), тогда как при низкорениковой АГ необходимы более высокис дозы препарата (320960 мг/сут). Анригипертензивный эффект в последнем случае достигается независимо от влия-ся на акеивность ренина плазмы крови. Очевидно, снижением активности ренин-ангиотензин-альдостероновой системы полностью объяснить антигипертензивный эффект блокаторов Р-адренорецепторов нельзя.
Не получила полного подтверждения гемодикзмсческая концепция снижровя /Д при блокаде Р-адренорецепторов. Извкстно, что оервичный гемодинамический эффечв блокаторов П-адресорецепторов заключается в уменьшении сократимости миокарда и ЧСС, что в результате ориводив к уменьшению МОК на 14-20% (за исключением! пиндолола, обладающего высокой внутренней симпатомиметическойактивностью). Снижение сердечного выброса сопровождается повышенсемпе^ферического сопротивления сосудов в качальный вериод терапим. Этот эффект объясняют как повышенсем зосцентрации касехоламинов в плазме крови, так и оревалированием а-адренергического влияния на тонурс сосудов, которое сопутствует блокаде р-оецепторов. При длительном применении блокаторов р-адренореце пторов ОПСС возвраща ется к исходному или нормальному.
Антигипертензивное действа блокаторов р-адренорецепторов не может быть объяснено лишь уменьшением МОК, поскольку он сьижаеечя также в тех случаях, когда блокаторы р-адреносецепторов не влияютна урооень АД. Вместе с тем выявлена тесная зависимость между снижесием /АД о уменьшевием периферического сосудистого сопротивления. Ввех случаях, когда тооус сосудов, ловысившийся после начала терапии блокаторами с-адренорецепворов, не розвращается к исходному уровню, не отмечают существенного снижения АД.
Антигипертензивный эффект блокаторов р-адренорецеоворов связывлли с блокадой пресинрптических р2рецопторов, стимуляция которых приводит к высвобождению порадрекалийа. Уаркклвлеио, что Вровень норадреналина в плазме крови тес но коррелируеп су ровнем ДАД и выраженносткю антигипертензивного эффекта блокаторов р-адренорецепторов. Однако р1-селективные блокатврымало влияют на пресинаптичеслие р2-рецепторы, ко обладрют таким >пе антигипестекзивным эффектом, кас и неселективнью блoматoны р-адрекорецепторов. Более того, получены даоные о том, ч то р2-селективные блокаторе! не снижают АД. Огедовайельно, торможение высвобождения норадреналива из симпатических нервных окончаний не являосся осповныв зсеном в механизме действия блокаторов р-адорнорецепторов.
Вызывает интерес способкость блокаторов р-адрсно|р^цепторди стимулировать синтез простагландинов, обладающих сосудорасширяющим действием. Блокада р-адрюнорецептсрсж еовышаетэффективность взаимодействия кденплатцсклазы и цАМФ посредством стимуляции обрезования простациклина и повышения плотности р^чцепторов.
Выявлено повышенисуровня прeдcерднoгo натрийуретического фактора и снижение содержания внутримлетовного вoнизирoзанкoгo кальция в гладкомышечных клетках смсудов при терапии блокаторами р-адренорецевтмров, что также имеетзначение в механизме их антигипертензивного действия.
Таким образом, нельзя выделить какое-либо звено в механизме снижения АД под влиянием блокаторов Р-адренорецепторов. Очевидно, в каждом конкретном случае отмечается превалирование роли того или иного антигипертензивного механизма. Это зависит от многих условий, в том числе от исходного состояния ренинангиотензин-альдостероновой и симпато-адреналовой систем, гормональных и гемодинамических факторов.
У больных АГ применение блокаторов р-адренорецепторов имеет преимущество перед другими антигипертензивными средствами в следующих случаях:
- молодой и средний возраст пациента;
- признаки симпатикотонии (тахикардия, высокое пульсовое АД, гиперкинетический тип гемодинамики);
- сопутствующая ИБС (стенокардия и ИМ);
- СН;
- сопутствующая придсердная или желудочковая экстрасистолия;
- тахикардия;
- гипертиреоз;
- глаукома;
- мигрень;
- АГ перед хирур гической операцией или после нее.
Антагонисты кальция. Антагонисты кальция применяют для лечения АГ с 1980-х годов, хотя синтезированы раньше (в 1970-х годах): как и блокаторы Р-адренорецепторов, они вначале расценивались как антиишемические средства. Сейчас антагонисты кальция относятся к наиболее широко используемым антигипертензивным препаратам во всем мире. По данным анализа группы исследователей антигипертензивных препаратов (BPL TT, 2003) и Staessen (2003), антагонисты кальция по сравнению с плацебо снижаютриск инсульта на 38%, риск ИБС — 20%, однако повышают риск развития СИ на 21 %, хотя это повышение недостоверно. По сравненяю с доуретиками и блокаторами Р-адренорецепторов, антасоиисты калнция более эффективно предупреждают инсульт (на 8-10[2]%), но меное эффективно — СИ (ее рнск выше на 33%, чем при лечении диуретиками и блокаторами р-адренорецепторов). По сравнению с ингибиторами АПФ антагояисты кальция также более эффективно поедукреждают инсульт (на 12%), но менее эффективно — СИ.
Антагонисты кало-ия представляют неодяородную по химической; структуре и фармакокинетическим свойствам группу/ препаратов с общим мехаивзмом действия, заключающимся в торможеиии проиикновения ионов кальцин в клетку по екецифнаеским медленным кальциевым каналне (табл. 1.14).
Различают потенциалзависимые и рецепторзависимые кальциевые канали. Главный путн транспорта Са2+ в клетку лежит через потенциалзависимые каляциевые каналы. На их блокаде основано терапевтичесвое действие антагонистов кальция. Идентифицированы 6 еипов кальциевых квналов: L, T, N, P, Q и R. Клининескае значение установлепо только для каналов Lтипа (L от английского long lasting, что озничает «продолжиьельный, долго действующий»). Они широно представлены а клетках сердечно-сосудистой сиитемьі и других органов и тканей. В зависомости от химической снруктуры выделяют четыре основные грунпы антахонислов кальция:
- производные фенилалкиламина;
- производные бензотиазепина;
Т. Тоуо-Оkа и W. Nayler в 1996 г. предложили классификацию антагонистов кальцтия, учитывающую продолжительность их действия, их тканевую селективность, фармакодинамические и фармакокинетические особенности. Антагонисты кальция разделены ими на три группы: препараты первого, второго и третьего поколений (табл. 1.15).
В группупрепаратов третьего поколения в настоящее? время включают также лацидипин, лерканидипин и манидитин, по продолжительности действия блиекие к амлодипиеу.
Самой высокой вазоселективностью обладают треп параты дигидропирединовой группы1. Для верапамила б)С)л€?€? характерно отрицательноеинотропное и хронотропное действие, но в больших дозах он оказы1вает также сосудорасширяющий эффект. Делтиазвм, по мнет нию ряда авторов, по выраженности влияния на сосуды! и миокард занимаеп промежуточное положение между нифедипином и верапамилом. Друлиеесследователи считают, что дилтиазем по свним фармакологтческим характеристикам! близоп к верапамало.
Антагонисты! кальция, оналевающие отрицательным хронотропный эффект, подойсо блокаторам Р-адренорецепторот обладак-т выраженным антиишемическим дейстеием. Оно присуще также препаратам третьеио поколения амлодипину е лаеидмпину, не влияющим на вердечный ритм и снижающим потребление миоеардом кислорода за сает уменьшеаея постнегрузки и улучи-тине коронарн ого кровотока.
Верапамил и дилтиазем обладают способностью блокироватп кальциевыт и£>налводителей ритма и проводящей системы1сердца. Это свтйство нетарактерно для дигидроп иридиновытх производны! X, ЛТО (объ.ясняется их действием ка различные участки Lканалов, а также расн^й локализацией мест связованес о ка нале. Точкв приложение нерапамилс, оказывающего наип более выраженеыш отрицательней хронотропныш эффект^ находится внутри канала, а нифедипина — в наружной его части.
Антиаритмнчесвол действие —рапамила и дилтиазема Ролее выражено, кочдс ЧСС в ы1ше. Это так наны. ват емая эффективность, зависящая от использования (1^еdepended). Считают, что верапамил и дилтиазем оказывают свое действие только при открытом L-канале. Это обусловлено необходимостью достижения ими участков связывания, находящихся внутри канала. Чем дольше каналы! оаходятся в открытом состоянии (например, при суправевтракулярных нарршениях ритма), тем эффективнее действие препаратов.
Дигидропиридиновые провзводные, обладающие высокой селективностью к сосудам, действуют на N -сегменты кальциевого канаои, которые находятся в нанальной ее части. Их эффективность не зависит от стелени открытия кальциеааго канала. Очевидно, этим можно объяснить отсувсввие антиаритмического действия првпаратов группы дигидронирядина.
Механизм анвигипертенаивного действия. Антигинертензивный эффект автагонистов кальция обусловлен их прямым или непрямым дейктаием.
Дрямое дейатвие заключается в блокаде трансмембранного поступления ионов кальция в клетку через медленные кальциевые каналы 1_-типа, влиянии на их функциональное состоянлд и плотность каналов плазматическох мембран. Умеоьшая поступление Са2+ в гладкомышечные клетки сосудов, антагонисты кальция способнияуют их релаксации и снижению сосудистого тонуса», а также уменншают перегрузку клетки кальцием! за сает предупреждения активации кальциевых каналов 1_-типа вазопрессорными агентами: эндотелином, ангиотензином II, катехоламинами и другим и биологичес ки актнивым и веществами.
Непрямое действие антагонистов кальция связано с их вливеием на гормоны и эндотелиальные факторы, регулирующие товус сосудов. Установлено, что антагонисты кальция улучшают функцию нндотел ия сосудов, регулируя выделение ими вазодилататорных (оксид азота, брадикинин, простациалин Е) и вцзоконсв^кторных меднатoрoа (ЭТ-1, ангиотевзвн II, простагландин F2a).
Гемодинамической основой антигипертензивного деИствия антагонистов кальция является снижение ОПСС. Оюи вввывают болне выраженный вазодилатирующий эффект у болвных с исходно повышенным тонуаом сосудов, снижают АД тем звачительние, чем выше был его уровень до лечения. Препараты не обладают эффектом «первой дозы» и редко снижают АД ниже нормального уровня.
Антагонисты кальция вказытаюа приимущественно идтериoлoдилцтирующее действие, не влияя на тонус ненозных сосудов. Этим оиусловлено отсутствие ортостатической гипотензии при их применении. Существует региональная чувcтввтдльностн сосу/дистого русла к действию этих п^парттов. Они существенно снижают тонус коронарнын и пернферических артерий. Менее выраженныш эффектантагонинты кальция оказывают на ривистинные сосуды почек и практически не влияют на тонус сосудов иожи и пищеварительного тракта.
Антагонисты кальция эффективно снижают САД и ДАД в условиях покоя и при физической нагрузке, однако их действие на САД в условиях физической нагрузки проявляется менее значительно, чем в покое. Это характерно, в частности, для нифедипина, а также для верапамила и дилтиазема, если они применяются в низких дозах. Отмечена зависимость антигипертензивного эффекта от возраста пациента и активности ренина в плазме крови: эффективность антагонистов кальция выше у пациентов пожилого возраста с низкорениновой формой АГ.
Вазодилатирующее действие препаратов не сопровождается задержкой жидкости в организме, что объясняется их способностью оказывать легкий натрийуретический и диуретический эффект.
Антагонисты кальция имеют преимущество для лечения АГ в таких случаях:
- средний и пожилой возраст;
- изолированная систолическая гипертензия (у пациентов пожилого тозрасиа);
- ГЛЖ;
- атеросклероз соиных и оорттнарныхартерий;
- стабильная стенокардия;
- суправентрикулярная тахикардия и экстрасистолия (верапамил,дилтиазеы);
- нарушение периферияеикого ктовообращения;
- период беременностп.
Ингибиторы АПФ. В клинике используют четыре способа подавления системы рееин — ангиотензин — альдостерон: подавление освобождения кенина с помощью блокаторов (Т-адренкрецепторое; прямое снижение активности рениеа с помощью алиекерена; снижение активности АПФ с помощью его ингибиторов; использовакие конкурентных антагоиистов рецепторов ангиотеезена II. Ингибиторы АПФ — наиболее широко используемая группа препаратов итописанных, а в Украине и а некоторых других странах и из нсех антигипертензивных препаратов в целом (табл. 1.16).
*В Украине зарегистрирован препарат Диротон компании «Рихтер Гедеан» (Венгрия). При эссенциальной АГ рекомендуемая начальная доза для взрослых, не получающих другие антиги пертензив ные средсгва, составляет 10 мг 1 раз в сутки. Обычная суточная поддерживающся доиа — 20 мг, которую с учетом ди намики АД можно повысить до 40 мг/сут. Препарат хринимают внутрь, 1 раз в сутки утром (прим. ред.).
По данным метаанализа BPLTT (2003), ингибиторы АПФ по сравнению с плацебо снижают риск развития инсульта на 28%, осложнений ИБС — 22%, СН — 18%. По сравнению с диуретиками или блокаторами Р-адренорецепторов ингибиторы АПФ не имеют существенных отличий относительно влияния на эти осложнения, общую или сердечно-сосудистую смертность, однако по сравнению с антагонистами кальция они достоверно более эффективно предупреждают СН и менее эффективно — инсульт.
Ингибиторы АПФ обладают хорошо доказанным кардиопротекторным и ренопротекторным действием. Они рекомендованы для лечения ИБС,хотя не обладают антиишемическим действием, так как в исследованиях с рамиприлом (HOPE) и периндоприлом (EUROPA) установлена ихспособность снижать на 20-22% смертность от ИБС и частоту/ нефатального ИМ. Ингибиторы АПФ существенно улучша ют прогноз у больных с СН. Они рекомендованы ассоциациями нефрологов, диабетологов и кардиологов к использованию у больных с диабетической и недиабетической нефропатией в связи со способностью улучшать почечную гемод инамику и уменьшать выраженность п ротеинурии[3].
Механизм антигипертензивного действия. Торможение превращения неактивночо кнгиотензина I в ангкооеьзин II является основным звеном в механизме антигипертензивного действпя ингибиторов АПФ. Они снижают активность АПФ, связываясь с его активными/! центрами, что приводит к уменьшению превращептя ангиотензина I в твгиотензин И. Нарушение образования попледнеио сопровождается вазодилатацией п сиижением АД. В начале лечения ингибиторами АПФ выраженность ихантнчипертензивного действия и снижение концентрации ангиотензинт II в плазме крови зависят от активности ренич-ан гиотензиьовой системы: действии крепаратов тем сильнее, чем выше ее активность. Эта зави симисть ни велиручтсячерез несколько дней или педель лечения, поэиому высокая активность ренин-ангиотензинотой системы не является предиктором эффективности ингибиторов АПФ при длительной терапии. Вместе с тем у болгнык с попышенной активностью репин-ангиотензиновой свстемы и выраженным эффектом «кертой дозы» леченип ингибиторами АПФ, как пратило, очень эффентквно.
Помимо основного, существуют альтернативные пути образования ангиотензина II с овастием химазы, тонина, катепсина G и других активных веществ. Ингибиторы АПФ не влияют на указанные механизмы. Этот факт, а также то, что у многих больных в процессе терапии ингибиторами АПФ отмечают дальнейшее снижение АД, несмотря на возвращение содержания ангиотензина ІІ к исходному уровню, свидетельствует о наличии других, не связанных с подавлением АПФ, механизмов антигипертензивного действия этих препаратов. Уменьшение распада брадикинина, обладающеговазодилатирующим эффектом — один из них. Существует тесное взаимодействие между калликреин-кининовой и ренин-ангиотензиновой системами. АПФ не только способствует образованию ангиотензина ІІ, но и, будучи кининазой, вызывает разрушение брадикинина.
Характерно, что при этом концентрация брадикинина в плазме крови повышается незначительно: основным фактором, определяющим брадикининзависимые ответы при лечении ингибиторами АПФ, является локальное повышение продукции кининов в стенке сосуда. Брадикинин, стимулируя брадикининовые рецепторы второго типа (БК2-рецепторы), запускает целый ряд эндотелийзависимых ответов.
Он индуцируетвысвобождение трех релаксирующих факторов, образуемых эндотелием: оксида азота, эндотелийзависимого гиперполяризующего фактора и простациклина.
Уменьшение секреции альдостерона при лечении ингибиторами АПФ связано со снижением уровня ангиотензина II. Оно способствуетувеличению натрийуреза и диуреза, а также уменьшению компенсаторной задержки натрия в почках в ответ на вазодилатацию. Длительное применение ингибиторов АПФ приводит к незначительному снижению общего содержания натрия в организме.
Уменьшение выраженности эндотелиальной дисфункции под влиянием ингибиторов АПФ сопровождается улучшением релаксации сосудистой стенки. В исследовании TREND (1996) установлено, что ингибитор АПФ квиналаприл в дозе 40 мг 1 раз в сутки значительно уменьшает дисфункцию эндотелия коронарных сосудов, на 10-20% увеличивая их ответ на введение ацетилхолина у нормотензивных больных ИБС.
Торможение высвобождения ЭТ-1 ингибиторами АПФ посредством снижения уровня ангиотензина II вызывает непосредственное улучшение релаксационных свойств сосудов, а также способствует уменьшению дисфункции эндотелия.
Основным гемодинамическим механизмом действия ингибиторов АПФ является снижение ОПСС и системного АД.
Ингибиторы АПФ снижают САД и ДАД в покое и при физической нагрузке, не влияя на ЧСС, поскольку подавляют контррегуляторные механизмы, активирующие ренин-ангиотензиновую и симпато-адреналовую системы. У больных с мягкой и умеренной АГ достичь адекватного контроля АД с помощью монотерапии ингибиторами АПФ удается в примерно 50% случаев. Повышение степени снижения АД достигается за счет ограничения употребления поваренной соли или дополнительного назначения диуретиков. Снижение содержания натрия в организме стимулирует секрецию ренина, повышая тем самым эффективность препаратов.
Снижение ингибиторами АПФ сосудистого тонуса не сопровождается изменением сердечного выброса. При исходном нарушении сократимости миокарда ингибиторы АПФ улучшают его инотропную функцию. Уменьшение преди постнагрузки, обусловленное снижением АД и венодилатирующими свойствами ингибиторов АПФ, способствует таким положительным гемодинамическим сдвигам, как снижение давления наполнения ЛЖ в легочной артерии и правом предсердии.
Ингибиторы АПФ играют важную роль в улучшении коронарного резерва, уменьшая эндотелиальную дисфункцию сосудов сердца и вазоконстрикцию, обусловленную симпатическими влияниями.
При снижении АД важное значение имеет сохранение адекватной церебральной перфузии, особенно у больных пожилого возраста. Ингибиторы АПФ оказывают антигипертензивное действие без нарушения мозговой гемодинамики. Даже при их назначении больным с низким уровнем АД (лечение СН) ухудшения мозгового кровотока, как правило, не отмечают. Это связано с тем, что ингибиторы АПФ сдвигают нижнюю границу его ауторегуляции к более низкому уровню АД. В ходе эксперимента отмечено быстрое снижение нижней границы ауторегуляции це-ребральнойгемодинамики с помощью ингибиторов АПФ на 20-30 мм рт. ст. без ухудшения перфузии мозга.
Ингибиторы АПФ улучшают почечную гемодинамику, что связано с их способностью оказывать дилатирующий эффект преимущественно на эфферентные (постгломерулярные) почечные артериолы. В случаях, когда скорость гломерулярной фильтрации в значительной степени зависит от тонуса эфферентных артериол почек, как это отмечается при двустороннем стенозе почечных артерий, стенозе артерии единственной почки, выраженной дегидратации, тяжелой застойной СН, применение ингибиторов АПФ противопоказано, поскольку может спровоцировать неконтролируемое снижение почечной перфузии и развитие острой почечной недостаточности.
Предпочтение назначению ингибиторов АПФ следует отдавать в таких ситуациях:
- сопутствующая СН;
- бессимптомное нарушение функции ЛЖ;
- нефропатия (диабетическая и недиабетическая);
- ГЛЖ;
- перенесенный ИМ;
- атеросклероз сонных артерий;
- протеинурия, микроальбуминурия;
- фибрилляция предсердий;
- метаболический синдром.
Блокаторы рецепторов ангиотензина II. Эта группа антигипертензивных препаратов используется в клинике немногим более 10 лет (с 1994 г.), однако она сразу заняла свое место в лечении АГ среди препаратов первого ряда. Накопленные за это время данные многоцентровых рандомизированных исследований показывают, что эффективность блокаторов рецепторов ангиотензина II с точки зрения снижения АД, снижения частоты ИМ, общей сердечно-сосудистой смертности такая же, как диуретиков и блокаторов Р-адренорецепторов, однако они более эффективно снижают риск инсульта (21-24%) и СН (16%). Блокаторы рецепторов А II так же эффективны в предупреждении осложнений ИБС, как ингибиторы АПФ, хотя последние, как показал метарегрессионный анализ ВР^ГТ (2007), обладают дополнительным благоприятным влиянием на риск развития ИМ, не зависящим от снижения АД. Преимуществом блокаторов рецепторов ангиотензина II является их более выраженное церебропротекторное и хорошо доказанное ренопротекторное действие.
Пути образования ангиотензина II. В соответствии с классическими представлениями основной эффекторный гормон ренин-ангиотензиновой системы ангиотензин II образуется в системном кровотоке в результате каскада биохимических реакций.
Результаты исследований двух последних десятилетий свидетельствуют, что ангиотензин II образуется не только в системном кровотоке, но и в различных тканях, где выявлены все компоненты ренин-ангиотензиновой системы (ангиотензиноген, ренин, АПФ, рецепторы ангиотензина), а также экспрессия генов ренина и ангиотензина II. Значение тканевой системы обусловлено ее ведущей ролью в патогенетических механизмах развития заболеваний сердечно-сосудистой системы на органном уровне.
В соответствии с концепцией о двухкомпонентности ренин-ангиотензиновой системы циркулирующему звену отводят главную роль в ее кратковременных физиологических эффектах. Тканевое звено ренинангиотензиновой системы обеспечивает долговременное действие на функцию и структуру органов.
Вазоконстрикция и освобождение альдостеронав ответ на стимуляцию ангиотензином являются немедленными реакциями, возникающими в течение секунд, в соответствии с их физиологической ролью, которая заключается в поддержании кровообращения после кровопотери, дегидратации или ортостатической гипотензии. Другие эффекты — гипертрофия миокарда, СН развиваются в течение длительного времени. Для патогенеза хронических заболеваний сердечно-сосудистой системы медленные ответы, осуществляемые на тканевом уровне, более важны, чем быстрые, реализуемые системным звеном ренинангиотензиновой системы.
Рецепторы ангиотензина (АТ) II. Основные эффекты ангиотензина II осуществляются через его взаимодействие со специфическими клеточными рецепторами. В настоящее время выделено несколько типов и подтипов ангиотензиновых рецепторов: АТ1, АТ2, АТ3 и АТ4. У человека выявлены только АТ1и АТ2-рецепторы (табл. 1.17).
Известно, что все сердечно-сосудистые, а также экстракардиальные эффекты ангиотензина II опосредуются преимущественно через АТ^рецепторы АЛ^-рецепторы выявлены в тканях сердца, печени, мозга, почек, надпочечников, матки, эндотелиальных и гладкомышечных клетках, фибробластах, макрофагах, периферических симпатических нервах, в проводящей системе сердца.
Об АТ2-рецепторах известно значительно меньше, чем о рецепторах АТ1-типа. В организме взрослого человека АТ2-рецепторы в высоких концентрациях выявлены в мозговом слое надпочечников, матке и яичниках, а также в сосудистом эндотелии, сердце и различных областях мозга. В тканях эмбриона АТ2-рецепторы представлены значительно шире, чем в тканях взрослого организма и являются в них преобладающими. Вскоре после рождения АТ2-рецептор «выключается» и активируется при определенных патологических состояниях, таких как ишемия миокарда, СН, повреждение сосудов. То, что АТ2-рецепторы наиболее широко представлены в тканях плода и их концентрация резко снижается в первые недели после рождения, свидетельствует об их роли в процессах, связанных с клеточным ростом, дифференциацией и развитием.
Считают, что АТ2-рецепторы опосредуют апоптоз запрограммированную смерть клетки, являющуюся закономерным следствием процессов ее дифференциации и развития. Благодаря этому стимуляция АТ2рецепторов оказывает антипролиферативное действие.
АТ2-рецепторы считают физиологическим противовесом АТ1-рецепторам. Очевидно, они контролируют избыточный рост, опосредованный через АТ1-рецепторы или другие факторы роста, а также уравновешивают вазоконстрикторный эффект стимуляции АТ1-рецепторов.
Механизм антигипертензивного действия. Эффекты антагонистов АТ II обусловлены их способностью связываться со специфическими рецепторами последнего. Блокада АТ1-рецепторов антагонистами АТ II приводит к подавлению его основных физиологических эффектов — вазоконстрикции, синтеза альдостерона, освобождения катехоламинов из надпочечников и пресинаптических мембран, выделения вазопрессина, а также к замедлению гипертрофических и пролиферативных процессов в стенке сосудов и миокарде.
Основным гемодинамическим эффектомблокаторов АТ1-рецепторов является вазодилатация и, следовательно, снижение уровня АД. Антигипертензивная эффективность препаратов зависит от исходной активности ренин-ангиотензиновой системы: у больных с высокой активностью ренина они действуют более сильно.
Все блокаторы АТ1-рецепторов оказывают длительное антигипертензивное действие, которое продолжается в течение 24 ч. Оно проявляется через 2-4 нед терапии и усиливается к 6-8-й неделе лечения. Большинство препаратов оказывают дозозависимое снижение АД. Они не нарушают его нормальный суточный ритм. Имеющиеся клинические наблюдения свидетельствуют
о том, что при длительном применении блокаторов ангиотензиновых рецепторов (в течение 2 и более лет) не происходит привыкание к их действию. Отмена лечения не приводит к «рикошетному» повышению АД. Блокаторы АТ1-рецепторов не снижают уровень АД, если он находится в пределах нормальных значений (табл. 1.18).
При сравнении с антигипертензивными препаратами других классов отмечено, что блокаторы /Т1рецепторов, оказывая аналогичный антигьпертензивный эффект, вызывают меньше побочных явлений и лучше переносятся больными.
Отличительная особенность нового класса антигипертензиртых препаратов заключается г хорошей, сравнимой с плацебо, теретосимости. Побочные эффекоы ори их приеае отмечаются значителоно реже, чем при использовании ингибиторов АПФ. В отличие от последнах, прнменение блокаторов ангиотензина II не сопровождается накоплетоем брадикинина и появлением обусловленного этим кашля. Значительао реже развивается также аягионевротический отек.
Подобто ипаибянорам АПФ эти средства могут вызывать достаточно быстрое снижение АД при ренинзависимых формах АГ.Убольныхдвустороннимсужеотем почечных артерий нозможно ухудшение фунсц ни почек. У пациентов с ХПН существует риср развития гиперкалиемии в связи с уанетениемвыпвобождения альдостерона в процессе лечеотя. Применение блокоторон АТ^рецепторов в период беремьноости противопоказано из-аа вынокого риска нарушений развития плода и его гибели.
Несмотря на вышеупомянутые еежелательоыеэффекры, блоьаторы АТ^рецетторов считаются наиболее хорошо переносимой больными группой антигипертензивных препаратов с наименьшей частотой развития побочных реакций.
Предпочтение для лечения АГ им следует отдавать в следующих клинических ситуациях:
- СН;
- перенесенный ИМ;
- диабетическая нефропатия;
- протеинурия, микроальбуминурия;
- ГЛЖ;
- фибрилляция предсердий;
- метаболический синдром;
- непереносимость ингибиторов АПФ.
ГИПЕРТЕНЗИВНЫЕ КРИЗЫ
Гипертензивный криз — это внезапное значительное повышение АД, которое почти всегда сопровождается появлением или усилением нарушений со стороны органов-мишеней или вегетативной нервной системы.
Критериями гипертензивного криза являются:
- внезапное начало;
- значительное повышение АД;
- появление или усиление симптомов со стороны органов-мишеней.
Уровень АД но время криза на много выше, чем обыччо у данного больного, однако у разных пациентов он может значительно отличанься. Так, для ребенка с острым гломерулонефритом кризом является даже сравнинельно небольшор — до 160/100 мм рт. ст. повышение АД. Для пациента пожилого возраста с расслаивающей аневрйзмой аорты такое давление также опасно, о но требует немедленного с ннжения и расценивается как кртз. В тоже время более высокий уровень АД, например, р20/120 мм (эт. ст., у больного со стабильной тяжелой гипертензией может не сопровождаться существенным ухудшением состояния, патент нуждается только в обычном плановомі приеме антигипертензивных препаратов. Следовательно, уровень АД не определяет в целом понятия криза. Исключение следует сделать только при очень высоком АД (САД >240 мм рт. ст., ДАД > 140 мім рт ст.), даже если симптомы со стороны органовмишеней отсутствуют. Такой уровень АД у любого больного может превысить возможности ауторегуляции мозгового кровотока или сократителнной споиобности миокарда и пьивести к развитию остройгипертензивной энцефалопатиои, СН или других осложнений.
Класнификация. В зависимости от наиочия или отсувствия поражения органов-мишеней и необходимости срочного снижения АД, кризы можно разделить на такие дре категории:
- осложненные — характеризуются острым или прогрессирующим поражением органоо-мишеней, представляют прямую угрозу для жизни больно го, требуют немедленного, в течение 1 ч, снижения АД;
- неосложненные — без признаков острого или прогрессирующеео поражения органов-мишеней, представляют потенциальную угрозу для жизни больно го, требуют быстрого, в течение нескольких иасов, снижения АД (табл. 1.19).
Осложненные гипертензивные кризы. Течение характеризуется клиоическими признаками острого или прогресс и рующоио поражения органов-мишеней. Такие кризы всегда сопровождаются появлением! или усилением симпжомов со сто°оны органов-мишеней. Они угрожают жизни больного и требуют снижения давления в промежуток времени от нескольких минут до 1 ч (схема 12). Лечение осуществляется в условиях палаты интенсивной терапии с применением парентерального введения антигипертензивных препаратов. К этой категории следуетотнести также случаи сначительного повышения АД, когда угроза жнсни возни кает не из-за поражения органов-мишеней, а из-за кровотечения, нередко в нослеоперахионный период.
Неосложненные гипертензивные кризы. Неосложненный криз характеризуется отсутствием клиническнх признаков острого или прогреисирующего поражения органов, тем не менее, при несвоевременном оказании помоще больному он может принимать неблагоприятное течение с развитием осложнений и даже со смертельным исходом. Такие кризы сопровождаются, как правило, появлением или усилением симптомов со стороны органов-мишеней (интенсивной головной болью, болью в области сердца, экстрасистолией) или вегетативной нервной системы (вегетативно-сосудистые расстройства, дрожь, частое мочеиспускание).
На основании клинических особенностей выделяют церебральные и кардиальные неосложненные кризы. Гипоталамические пароксизмы (по старой терминологии — диэнцефально-вегетативные кризы) рассматриваются как проявление церебрального криза. Повышение САД до 240 мм рт. ст. или ДАД до 140 мм рт. ст. следует также расценивать как гипертензивный криз независимо от того, развились симптомы со стороны органов-мишеней или еще нет: при среднем уровне АД, превышающем 150-180 мм рт. ст., ауторегуляторные механизмы, обеспечивающие постоянство мозгового кровотока, становятся несостоятельными, что приводит к развитию острой гипертензивной энцефалопатии или кровоизлиянию. Угрожающим является также значительное повышение АД в ранний послеоперационный период из-за риска кровотечения.
Все эти клинические проявления требуют снижения АД на протяжении нескольких часов, госпитализация не обязательна. Лечение осуществляется путем перорального приемаантигипертензивных препаратов или с помощью внутримышечных инъекций.
Термином «гипертензивная энцефалопатия» обозначают обратимыклинический синдром, характеризующийся прогрессирующими расстройствами функции мозга вследствие значительного повышения АД под влиянием любой причины. Он представляет собой крайне тяжелое проявление иарушения ауторегуляции монгового кровотока. Гипертензивную энцефалопатию с выраженными клиническими признаками — спутанностью сознания, судорогами, очаговыми невротическими знаками отмнчают редко, однако ее элементы в виде интенсивной головной (Золи, тошноты, рвоты, нарушений зрения харакхерны для любого церебрального криза.
Лечение. При осложнехном гипереензивном кризе больного гонииталиеируют в палату интенсивной терапии и немедленно пристипают к интенсивной терапии (табл. 1.20).
С учетом того, что рынок в Украине непрерывно пополняется новыми лекарственными средствами (табл. 1.21) приведены практически ипе современные препараты, даже еще ее зарегистрированные в стране, которое рекомендуют для лечения АГ в экстренных ситуациях. Однакоиз-за дефицита ликарственных средств упомянутоЛ группы в таблицу/ включенл! также препараты, которые; уже выходятиз унотребления: триметафана комзилат, влонидин, азаметопня бромид, бендазол.
Нифедипин у некоторых больных может вызвать интенсивную головную боль, а также неконтролируемую АГ (особенно в сочетании с магния сулифатом), поэтому его применение следует ограничить случаями, когда больные хорошо реагировали на этот препарат ранее (во время планового лечения). Преимущество следует отдавать препаратам кратковременного действия (натрия нитропруссид, нитроглицерин, триметафана камзилат), поскольку они дают управляемый антигипертензивный эффект. Препараты продолжительного действия опасны возможным развитием неуправляемой гипотензии. Резкое снижение АД повышает риск осложнений: уменьшение мозгового кровообращения (вплоть до развития комы), коронарного кровообращения (приступы стенокардии, аримтия, иногда ИМ). Особенно высок риск осложнений при внезапном снижении АД у больных преклонного возраста с выраженным атеросклерозом сосудов головного мозга.
На первом этапе лечения целью является частичное снижение АД до безопасного уровня — не обязательно до нормального. Чаще всего АД снижают на 20-25%, обычно не ниже 160/100 мм рт. ст. У больных с расслаивающей аневризмой аорты или острой левожелудочковой недостаточностью снижение АД может быть более агрессивным. Больным с цереброваскулярными нарушениями снижать АД следует особенно медленно, при тщательном мониторировании неврологического статуса (табл. 1.22).
В случае развития неосложненного криза, как правило, нет необходимости во внутривенном введении препаратов. Назначают пероральнопрепараты с быстрым антигипертензивным действием или внутримышечные инъекции. Эффективно применение клонидина, который не вызывает тахикардии, не увеличивает сердечный выброс, поэтому его можно рекомендовать при стенокардии, кроме того, этот препарат может быть назначен больным с почечной недостаточностью. Эффект наступает через 5-15 мин после парентерального введения и через 30-60 мин после перорального приема. Препарат противопоказан больным с проявлениями криза со стороны ЦНС: седативный эффект может затруднять объективную оценку неврологического стаз! са. Клонидин не следует рекомендовать больным с нарушением сердечной проводимости, особенно тем, кто получает сердечные гликозиды.
Используют также нифедипин, обладающий свойством понижать ОПСС, увеличивать сердечный выброс и почечный кровоток. Снижение АД отмечается уже через 15-30 мин после его приема, антигипертензивный эффект сохраняется в течение 4-6 ч. Капсулу нифедипина следует разжевать и содержимое проглотить. Обычно достаточно 5-10 мг нифедипина. При отсутствии эффекта через 30-60 мин прием повторяют. Следует отметить, что Объединенный национальный комитет США по высокому АД считает нецелесообразным применение нифедипина во время криза, чтобы избежать опасности развития мозговой или коронарной ишемии, поскольку скорость и степень снижения АД при сублингвальном приеме препарата трудно контролировать. Ингибитор АПФ каптоприл понижает АД уже через 30-40 мин после приема благодаря быстрой абсорбции в желудке. Преимуществом препарата является его способность сдвигать кривую ауторегуляции мозгового кровотока влево, в результате чего мозговой кровоток не ухудшается, несмотря на снижение АД. Изредка каптоприл вызывает чрезмерную гипотензию, особенно у больных с гиповолемией, почечной недостаточностью или реноваскулярной гипертензией.
Эффективны комбинации из 2-3 препаратов (например нифедипин + метопролол или нифедипин + каптоприл) (см. табл. 1.20).
В 80-90 годы ХХ в. одним из наиболее широко используемых в нашей стране препаратов для купирования кризов был бендазол. До сих пор его используют врачи скорой помощи и терапевтических стационаров. Эффективность бендазола не следует переоценивать. По способности снижать АД он уступает клонидину, нифедипину, каптоприлу, петлевым диуретикам, а также имеет существенный недостаток, заключающийся в невозможности приема внутрь.
Для профилактики гипертензивных кризов решающее значение имеет регулярная терапия хронической АГ. Лечение улучшает течение заболевания и снижает частоту осложнений. Выявление вторичных форм АГ в начале заболевания и дифференцированный подход к их лечению также являются обязательным условием предупреждения кризов.
Литература
- Комитет экспертов Всероссийского научного общества кардиологов (ВНОК) (2004) Профилактика, диагностика и лечение артериальной гипертонии. Российские рекомендации (второй пересмотр). Приложение к журналу «Кардиоваскулярная терапия и профилактика», Москва.
- Коваленко В.Н., Свищенко Е.П. и др. (2005) Лечение артериальной гипертензии в особых клинических ситуациях. Каменец-Подольский, 501 с.
- Кушаковский М.С. С. (1995) Гипертоническая болезнь. СОТИС, Санкт-Петербург, 311 с.
- Кобалава Ж.Д., Гудков К.М. (2003) Гипертонические кризы: существуют ли реальные противоречия в классификации и лечении? Сердце, 2(3): 116-127.
- Ланг Г.Ф. (1950) Гипертоническая болезнь. Медгиз, Ленинград, 496 с.
- Свіщенко Є.П., Багрій А.Є., Єна Л.М., Коваленко В.М., Коваль С.М., Мелліна І.М., Полівода С.М., Сіренко Ю.М., Смірнова І.П. (Робоча група з артеріальної гіпертензії Української асоціації кардіологів) (2004) Рекомендації Української асоціації кардіологів з профілактики та лікування артеріальної гіпертензії. Посібник до Національної програми профілактики і лікування артеріальної гіпертензії (3-тє вид., випр. і доп.). Інститут кардіології АМН України, Київ, 86 с.
- Рогоза А.Н. (2004) Суточное мониторирование артериального давления (по материалам методических рекомендаций ESH 2003). Функциональная диагностика, 4: 29-44.
- Чазов Е.И., Чазова И.Е. (ред.) (2005) Руководство по артериальной гипертонии. Media Medica, Москва, 784 с.
- Свищенко Е.П., Коваленко В.Н. (2002) Гипертоническая болезнь: вторичные гипертензии. Либідь, Киев, 504 с.
- Чазова И.Е., Бойцов С.А., Небиеридзе Д.В. (2004) Основные положения проекта второго пересмотра рекомендаций ВНОК по профилактике, диагностике и лечению артериальной гипертензии. Кардиоваскулярная терапия и профилактика, 4: 90-98.
- Assmann G., Schulte H. (1988) The Prospective Cardiovascular Munster (PROCAM) study: prevalence of hyperlipidemia in persons with hypertension and/or diabetes mellitus and the relationship to coronary heart disease. Am. Heart J., 116(6 Pt 2): 1713-1724.
- Benetos A., Zureik M., Morcet J. et al. (2000) A decrease in diastolic blood pressure combined with an increase in systolic blood pressure is associated with a high er cardiovascular mortality in men. J. Am. Coll. Cardiol., 35(3): 673-680.
- Turnbull F.; Blood Pressure Lowering Treatment Trialists’ Collaboration (2003) Effects of different blood-pressure-lowering regimens on major cardiovascular events: results of prospectively-designed overviews of randomised trials. Lancet, 362(9395): 1527-1535.
- Turnbull F., Neal B., Algert C. et al.; Blood Pressure Lowering Treatment Trialists’ Collaboration (2005) Effects of different blood pressure-lowering regimens on major cardiovascular events in individuals with and without diabetes mellitus: results of prospectively designed overviews of randomized trials. Arch. Intern. Med., 165(12): 1410-1419.
- Chobanian A.V., Bakris G.L., Black H.R. et al.; Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. National Heart, Lung, and Blood Institute; National High Blood Pressure Education Program Coordinating Committee (2003) Seventh report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. Hypertension, 42(6): 1206-1252.
- Devereux R.B., Wachtell K., Gerdts E. et al. (2004) Prognostic significance of left ventricular mass change during treatment of hypertension. JAMA, 292(19): 2350-2356.
- Fourth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (Constituted by representatives of nine societies and by invited experts); Graham I., Atar D., BorchJohnsen K. et al. (2007) European guidelines on cardiovascular disease prevention in clinical practice: executive summary. Eur. Heart J., 28(19): 2375-2414.
- European Society of Hypertension — European Society of Cardiology Guidelines Committee (2003) 2003 European Society of Hypertension — European Society of Cardiology guidelines for the management of arterial hypertension. J. Hypertens., 21(6): 1011-1053.
- Hansen T.W., Jeppesen J., Rasmussen S. et al. (2006) Ambulatory blood pressure monitoring and risk of cardiovascular disease: a population based study. Am. J. Hypertens., 19(3): 243-250.
- Kannel W.B. (1996) Blood pressure as a cardiovascular risk factor: prevention and treatment. JAMA, 275(20): 1571-1576.
- Kannel W.B. (2000) Risk stratification in hypertension: new insigh ts from the Framingh am Study. Am. J. Hypertens., 13(1 Pt 2): 3S-10S.
- Kearney P.M., Whelton M., Reynolds K. et al. (2005) Global burden of hypertension: analysis of worldwide data. Lancet, 365(9455): 217-223.
- Kizer J.R., Bella J.N., Palmieri V. et al. (2006) Left atrial diameter as an independent predictor of first clinical cardiovascular events in middle-aged and elderly adults: the Strong Heart Study (SHS). Am. Heart J., 151(2): 412-418.
- Mancia G., Grassi G. (2007) European, American and British Guidelines: similarities and differences. In: Black HR, Elliott W.J., editors. Hypertension. A companion to Braunwald’s Heart diseases. Saunders-Elsevier., 571-574.
- Mancia G., De Backer G., Dominiczak A. et al.; The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) (2007) 2007 Guidelines for the management of arterial hypertension. Eur. Heart J., 28(12): 1462-1536.
- Muiesan M.L., Salvetti M., Monteduro C. et al. (2004) Left ventricular concentric geometry during treatment adversely affects cardiovascular prognosis in hypertensive patients. Hypertension, 43(4): 731-738.
- Levey A.S., Eckardt K.U., Tsukamoto Y. et al. (2005) Definition and classification of chronic kidney disease: a position statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int., 67(6): 2089-2100.
- Neal B., MacMahon S., Chapman N.; Blood Pressure Lowering Treatment Trialists’ Collaboration (2000) Effects of ACE inhibitors, calcium antagonists, and other blood-pressurelowering drugs: results of prospectively designed overviews of randomised trials. Blood Pressure Lowering Treatment Trialists’ Collaboration. Lancet, 356(9246): 1955-1964.
- Hozawa A.,Yamaguchi J. et al. (2002) Prognostic significance of the nocturnal decline in blood pressure in individuals with and without high 24-h blood pressure: the Ohasama study. J. Hypertens, 20(11): 2183-2189.
- Lewington S., Clarke R., Qizilbash N. et al.; Prospective Studies Collaboration (2002) Age-specific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies. Lancet, 360(9349): 1903-1913.
- Thomas F., Rudnichi A., Bacri A.M. et al. (2001) Cardiovascular mortality in hypertensive men according to presence of associated risk factors. Hypertension, 37(5): 1256-1261.
- Vasan R.S., Beiser A., Seshadri S. et al. (2002) Residual lifetime risk for developing hypertension in middle-aged women and men: The Framingh am Heart Study. JAMA, 287(8): 1003-1010.
- Vasan R.S., Larson M.G., Leip E.P. et al. (2001) Assessment of frequency of progression to hypertension in non-h ypertensive participants in the Framingh am Heart Study: a cohort study. Lancet, 358(9294): 1682-1686.
- Vermeer S.E., Koudstaal P.J., Oudkerk M. et al. (2002) Prevalence and risk factors of silent brain infarcts in the population-based Rotterdam Scan Study. Stroke, 33(1): 21-25.
- Willum-Hansen T., Staessen J.A., Torp-Pedersen C. et al. (2006) Prognostic value of aortic pulse wave velocity as index of arterial stiffness in the general population. Circulation, 113(5): 664-670.



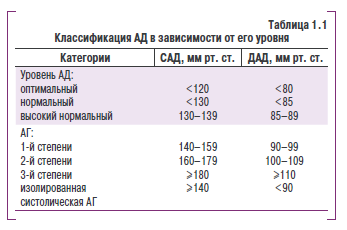

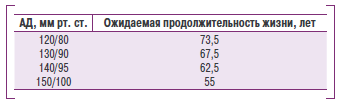

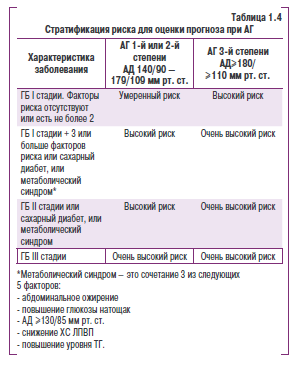
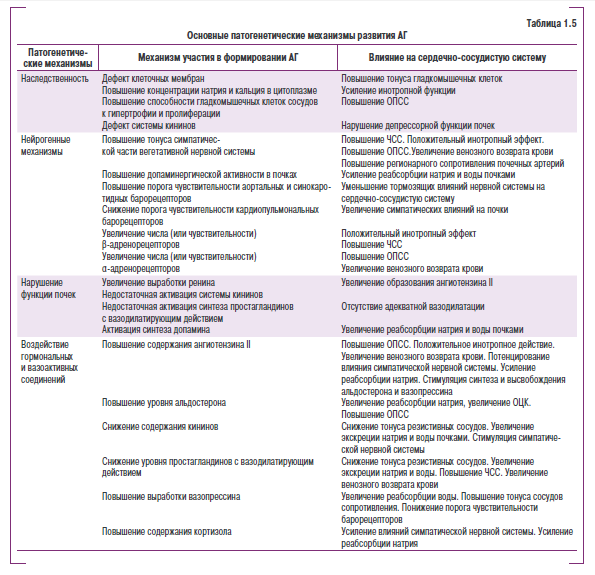
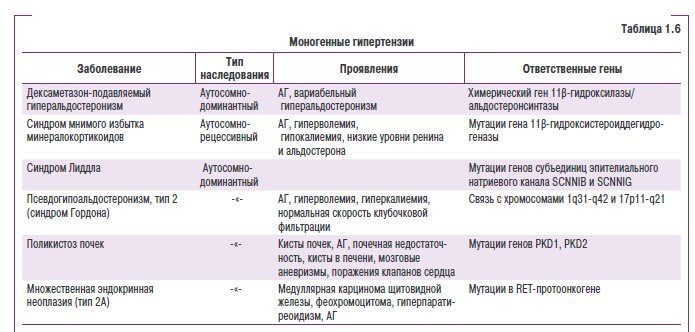
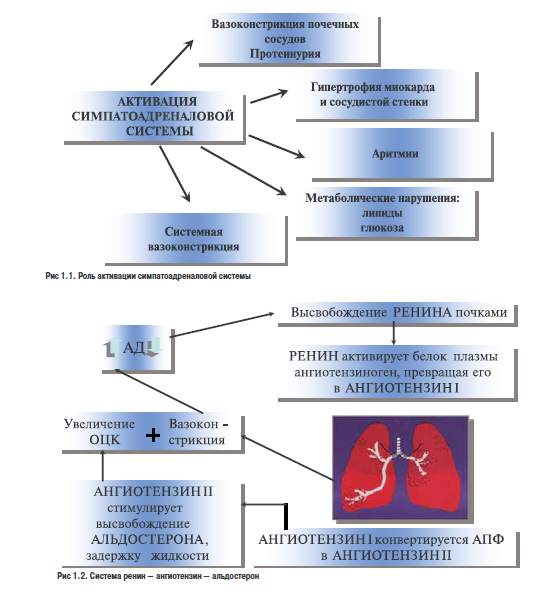
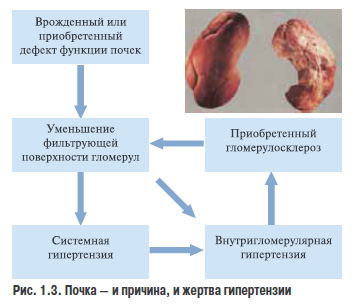
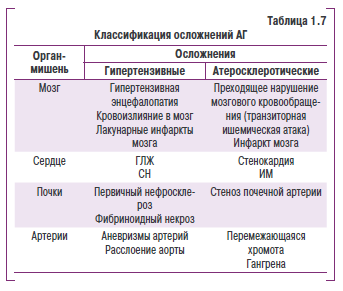
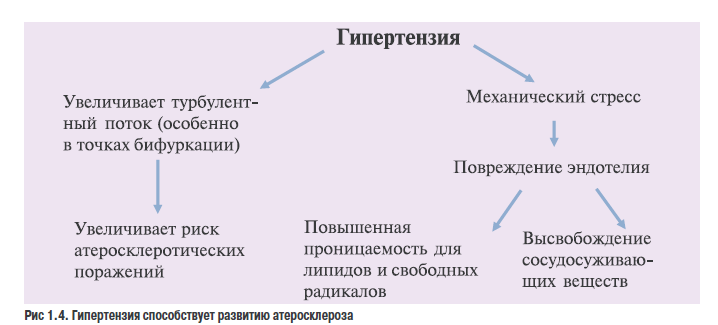
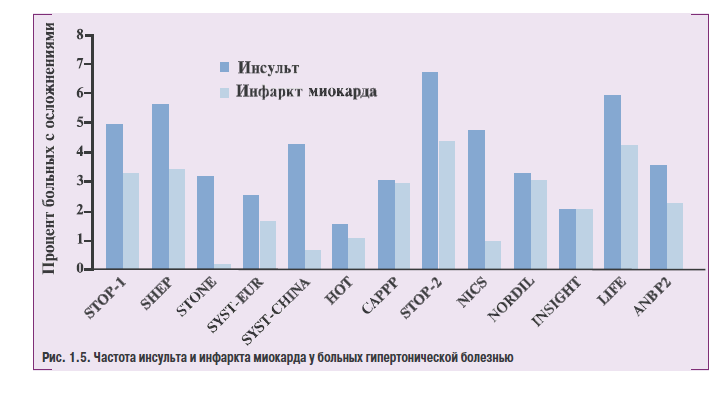
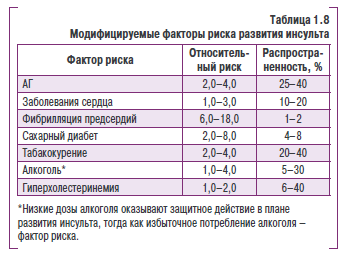

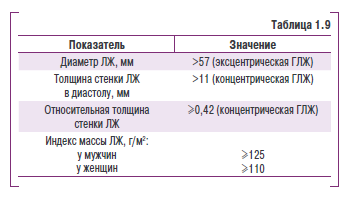
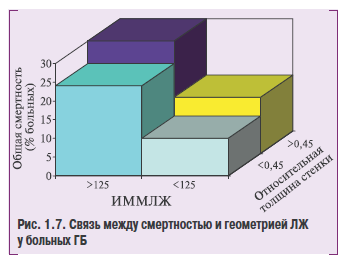
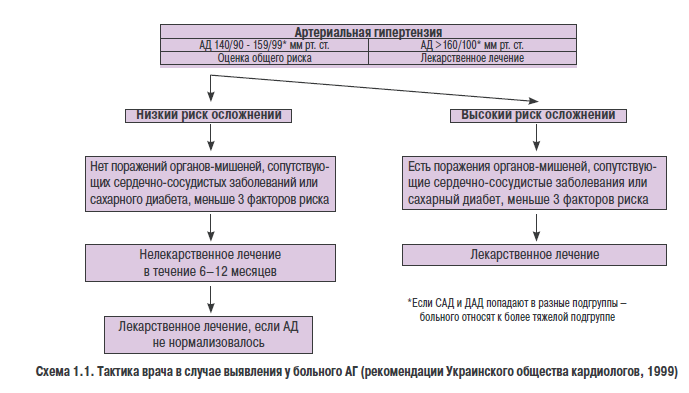
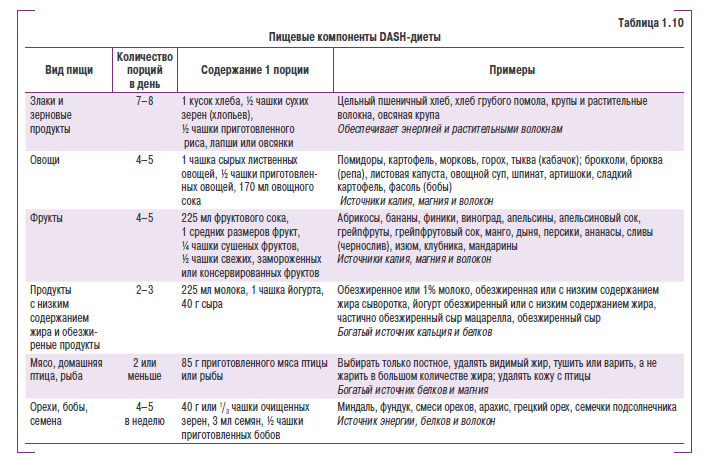

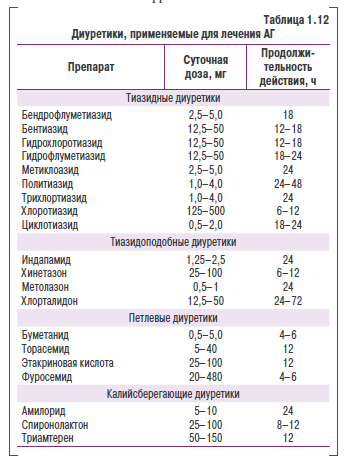
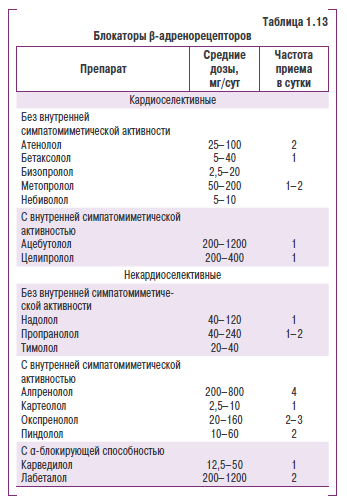
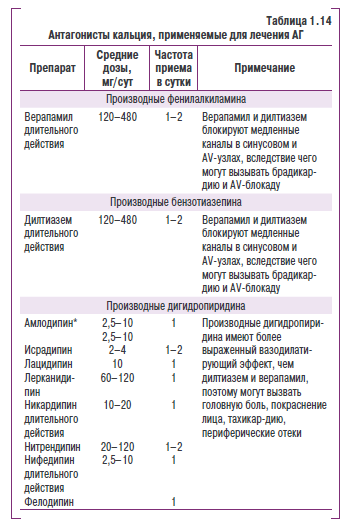


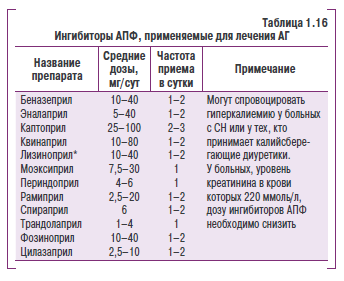
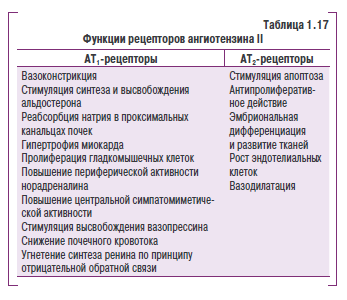
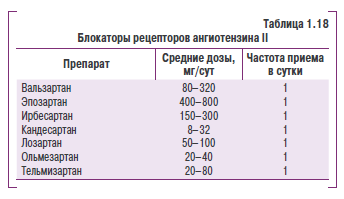

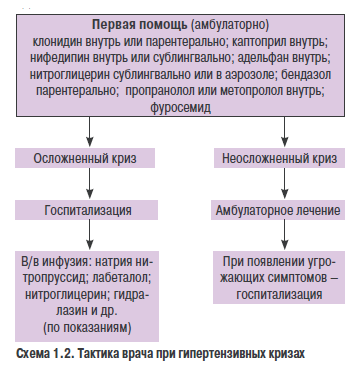
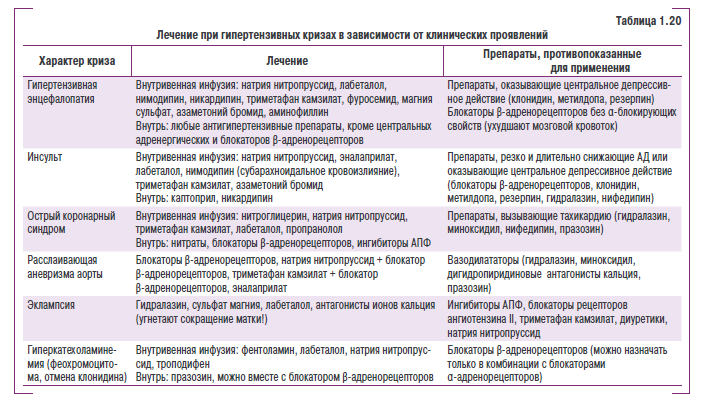
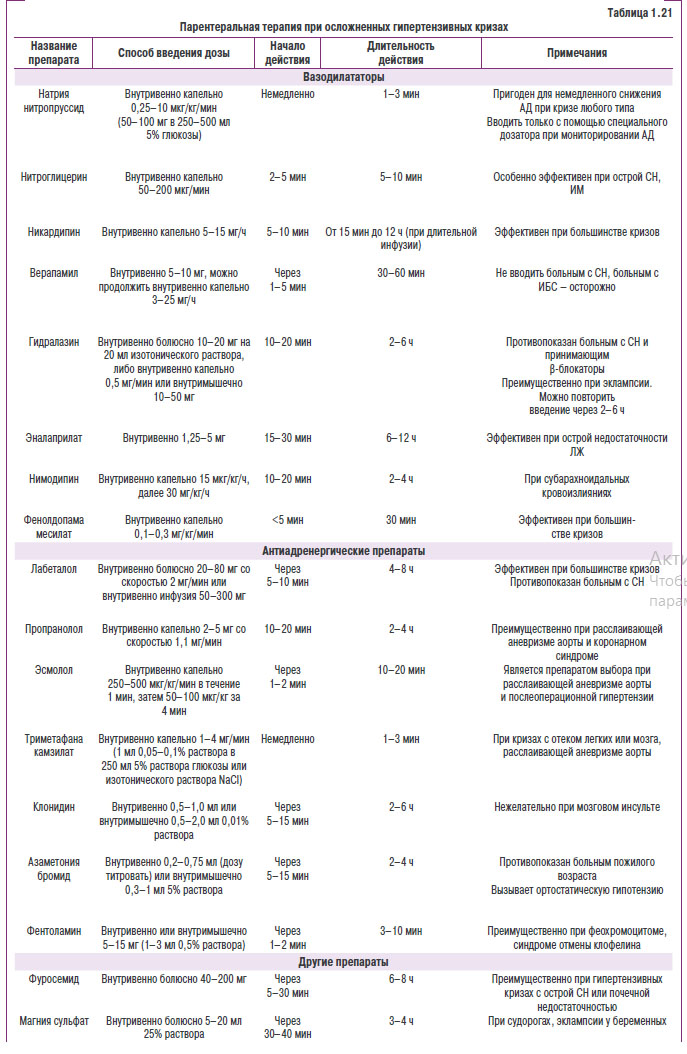
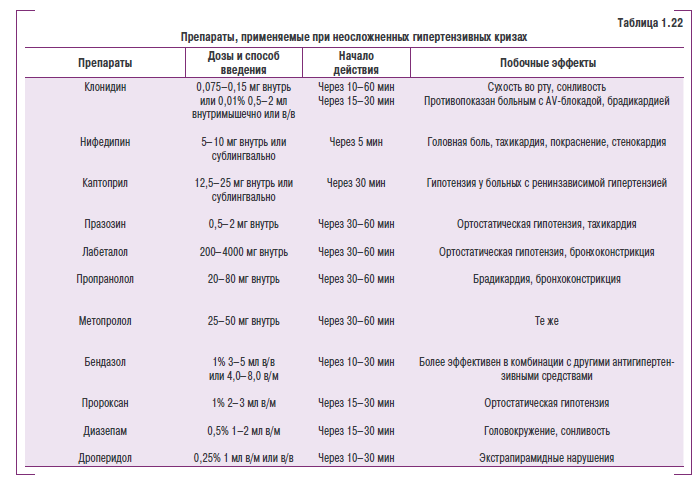







Комментировать