Особенности развития инсулинорезистентности и гиперинсулинемии при акромегалии. Влияние различных видов терапии на углеводный обмен при акромегалии.
Триголосова И.В., Древаль А.В.
Различные нарушения углеводного обмена (НУО) являются частыми осложнениями акромегалии, их распространенность достигает 10–80% [1–3]. В структуре всех НУО распространенность сахарного диабета (СД) составляет 19–56%, ранних НУО (РНУО) – 16–46%, что в 3–4 раза превышает популяционную распространенность [4–8]. Подобные результаты были получены в исследовании, проведенном в 2010–2012 гг. в Московской области (МО). В нем было обнаружено, что распространенность СД составила 52,6%, а РНУО – 25,8%, что в 4 и в 1,3 раза соответственно превышало распространенность СД 2-го типа и РНУО в случайной выборке взрослого населения МО (рис. 1) [9].
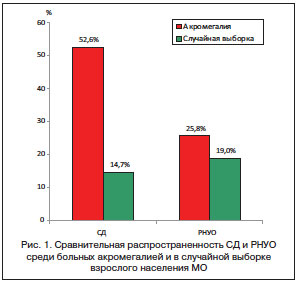
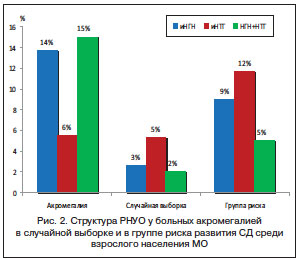
При детальной оценке распространенности различных видов РНУО (изолированной нарушенной гликемии натощак (иНГН), изолированной нарушенной толерантности к глюкозе (иНТГ)) и СД в исследовании М. Stelmachowska-Banas et al. было обнаружено, что СД встречался в 20% случаев акромегалии, в 19% – НГН, в 15% – НТГ [10]. В работе А. Espinosa de los Monteros НУО наблюдались у 72% пациентов, в структуре которых НГН составила 9%, НТГ – 36%, СД – 32% [11]. По результатам исследования структуры распространенности РНУО в МО, полученным в 2012 г., было выявлено, что распространенность иНГН и комбинации НГН и НТГ (НГН+НТГ) составила 14 и 15% соответственно, а иНТГ наблюдалась более чем в 2 раза реже (6%). Данные закономерности распространенности отличаются от распространенности различных форм РНУО в случайной выборке населения МО и в группе риска развития СД 2-го типа, где распространенность иНТГ в 1,6 и 1,3 раза выше соответственно, чем иНГН, и в 2,5 и 2,4 раза выше соответственно, чем НГН+НТГ (рис. 2) [3].
Можно выделить 2 класса факторов риска развития СД при акромегалии: общепопуляционные (возраст, женский пол, наличие артериальной гипертензии, отягощенный анамнез по СД 2-го типа) [2, 8, 9, 12] и специфические для акромегалии (длительность и активность заболевания, проводимое лечение) [9, 13, 14]. По данным, основанным на исследовании факторов риска развития СД у 97 больных акромегалией в МО, возраст, индекс массы тела и инсулиноподобный ростовой фактор-1 (ИРФ-1) были независимыми предикторами развития СД [13].
Итак, распространенность СД и РНУО при акромегалии существенно выше, чем в популяции. Знание закономерностей распространенности вторичных НУО при акромегалии в зависимости от пола, возраста, длительности течения болезни и лечения аналогами соматостатина (АСС), сравнение с популяционными данными позволяют составить более детальное представление об особенностях, связанных с вторичным характером НУО, и механизмах их развития.
Особенности развития инсулинорезистентности и гиперинсулинемии при акромегалии
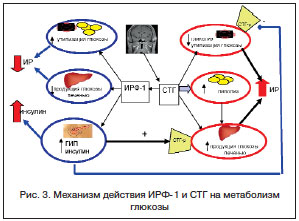
Противоположное действие соматотропного гормона (СТГ) и ИРФ-1 на основные пути метаболизма глюкозы обеспечивает гетерогенность механизмов развития вторичного СД и СД 2-го типа. В жировой ткани СТГ стимулирует липолиз, что ведет, с одной стороны, к увеличению липотоксичности, с другой стороны, к повышению количества субстратов для глюконеогенеза и, соответственно, увеличению продукции глюкозы печенью. В мышечной ткани СТГ снижает элиминацию глюкозы и гликолиз [15]. Интересно, что данные нарушения уже наблюдаются у больных акромегалией с нормальной толерантностью к глюкозе [16, 17]. В противоположность СТГ, ИРФ-1, стимулируя активность гибридных ИРФ-1 / инсулиновых рецепторов, снижает липолиз, мышечную и печеночную инсулинорезистентность (ИР), а также стимулирует секрецию инсулина (рис. 3) [18, 19]. Более того, описано, что введение ИРФ-1 больным с контролируемой акромегалией ведет к снижению ИР и уровня глюкозы, что связано, по всей вероятности, с антагонистическим действием ИРФ-1 на рецепторы к СТГ [20].
Для больных с активной акромегалией в условиях гиперсекреции СТГ более характерна выраженная ИР по сравнению с больными, находящимися в состоянии ремиссии [21], или с популяционной группой [6, 22]. Тем не менее исследований, подтверждающих прямую взаимосвязь между активностью заболевания и ИР, немного [23–25]. В недавно опубликованной работе Niculescu-2013 было показано, что ИРФ-1 в большей степени, чем СТГ коррелирует с индексами ИР и инсулиночувствительности (ИЧ) (НОМА, Matsuda, QUICKI) [24]. С учетом патофизиологических эффектов ИРФ-1 (стимуляция элиминации глюкозы, секреции инсулина) данные результаты, по всей вероятности, могут быть объяснены конкурирующим ингибированием рецепторов инсулина в условиях супрафизиологической секреции ИРФ-1 [26]. C другой стороны, еще в 1967 г. было показано, что у больных с активной стадией акромегалии, не страдающих диабетом, секреция инсулина повышается в ответ на углеводную нагрузку, причем степень стимуляции секреции инсулина при углеводной нагрузке прямо пропорциональна активности заболевания [27]. В дальнейшем в многочисленных исследованиях было показано, что у больных с активной стадией акромегалии наблюдается как повышение уровня инсулина натощак, так и увеличение инсулинемии в ходе перорального глюкозотолерантного теста (ПГТТ) [28].
Таким образом, при акромегалии ИР, вызванная гиперсекрецией СТГ, в определенной степени компенсируется повышением секреции инсулина, обусловленной гиперсекрецией ИРФ-1. Этим можно объяснить умеренные, легко компенсируемые НУО при СД, возникающие у больных акромегалией, и иногда – его обратное развитие после хирургического удаления опухоли гипофиза [28].
Влияние различных видов терапии на углеводный обмен при акромегалии
Различные виды терапии могут по-разному влиять на углеводный обмен при акромегалии [29]. Описано, что на фоне хирургического лечения наблюдается снижение ИР [19, 28, 30], что зачастую ведет к нормализации углеводного обмена. В исследовании, проведенном среди 10 больных с впервые выявленной акромегалией в МО в 2014 г., было выявлено, что из 7 больных с НУО (2 – СД и 5 – РНУО) 6 больных достигли нормогликемии через 6 мес. после проведения хирургического лечения и лишь у 1 больного сохранялись РНУО [28]. Причем при обследовании данных больных в течение 6 мес. наиболее выраженные изменения показателей ИЧ отмечались в течение первых 3-х мес. наблюдения, что диктует необходимость своевременного контроля уровня гликемии и проведения ПГТТ через 3 мес. после хирургического лечения акромегалии.
Необходимо отметить, что наиболее внимательно и часто следует контролировать уровень гликемии у больных акромегалией, находившихся на терапии сахароснижающими препаратами до проведения хирургического лечения, в связи с возможностью развития гипогликемии, связанной как со снижением ИР, и, соответственно, усилением их сахароснижающего действия, так и с возможным развитием вторичной надпочечниковой недостаточности после проведенного хирургического лечения.
В случае невозможности или неэффективности хирургического лечения для медикаментозной терапии акромегалии в настоящее время применяются 2 типа препаратов, снижающих активность заболевания: АСС пролонгированного действия (октреотид и пасиреотид) и блокатор рецепторов СТГ – пегвисомант.
Механизм действия АСС заключается в активации соматостатиновых рецепторов (sst), причем октреотид стимулирует преимущественно активность sst 2-го типа (sst2), а пасиреотид – преимущественно sst 5-го типа (sst5).
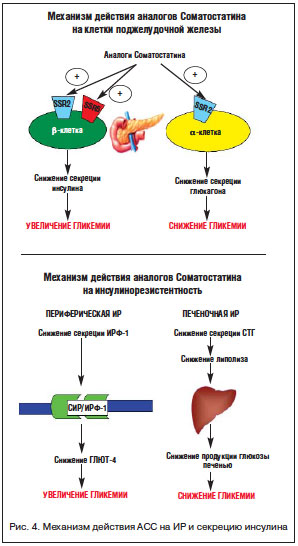
Недавно было выяснено, что как на α-, так и на β–клетках поджелудочной железы также есть sst, причем на β-клетках – 2 (sst2) и 5 (sst5) типов, а на α-клетках – sst2. Действие АСС на клетки поджелудочной железы разнонаправлено: активация sst β-клеток обеспечивает снижение секреции инсулина, а активация sst α-клеток – снижение секреции глюкагона [31, 32]. Также АСС действуют на ИР. Снижение секреции ИРФ-1 на фоне терапии АСС ведет к уменьшению активности гибридного рецептора ИРФ-1 / инсулина в периферических тканях, снижению количества транспортеров глюкозы 4 (ГЛЮТ–4) и увеличению гликемии. С другой стороны, снижение секреции СТГ обеспечивает замедление липолитических процессов, что ведет к уменьшению продукции глюкозы печенью (рис. 4).
В ряде клинических исследований также было обнаружено, что АСС уменьшают ИР, но при этом ведут к снижению секреции инсулина, что в некоторых случаях может приводить к ухудшению углеводного обмена при акромегалии [13, 28, 33–36]. В одном из последних исследований, посвященных данной проблеме, было продемонстрировано повышение уровней глюкозы плазмы натощак (ГПН), гликированного гемоглобина (HbA1c), гликемии в ходе ПГТТ, несмотря на снижение ИР на фоне терапии АСС. Важно отметить, что в данном исследовании было обнаружено повышение уровня ИЧ (QUICKI и Matsuda индексов) и снижение уровня инсулина плазмы натощак (ИПН) и инсулинемии в ходе ПГТТ. Данные изменения наблюдались у всех больных, независимо от состояния активности заболевания. Интересно, что количество больных с нормогликемией было в 2 раза больше в группе больных с неконтролируемой акромегалией на фоне терапии АСС, чем в группе больных, достигших ремиссии заболевания [13]. В другом исследовании, проведенном в 2003 г., при оценке гликемии у больных акромегалией с отсутствием НУО в ходе ПГТТ были обнаружены увеличение показателей гликемии через 120 мин после перорального введения глюкозы и повышение уровня HbA1c. Более того, была выявлена зависимость между ухудшением показателей глюкозы в ходе ПГТТ и снижением уровня инсулина, особенно в течение первых 30 мин теста [14].
В исследовании, проведенном в 2013 г. в ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского» среди больных акромегалией без ранее выявленного СД и РНУО, было обнаружено, что у больных с впервые выявленной акромегалией уровень инсулинемии как натощак, так и в ходе ПГТТ был наибольшим; у больных, перенесших хирургическое лечение, пик секреции инсулина наблюдался на 60-й мин ПГТТ, а у больных, получающих терапию АСС, уровень ИПН был самый низкий, и практически отсутствовала первая фаза секреции инсулина (рис. 5).
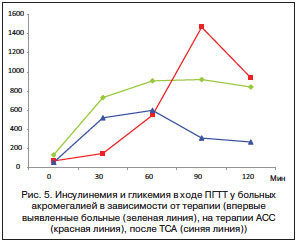
Причем частота развития различных НУО у больных акромегалией, контролируемой на фоне терапии октреотидом, достигала 90%, в то время как среди больных, достигших ремиссии после хирургического лечения акромегалии, не превышала 20% [37]. При оценке динамики состояния углеводного обмена, проведенной среди 10 больных с впервые выявленной акромегалией, было выявлено, что из 9 пациентов с нормогликемией у 2 больных развились РНУО через 3 мес. терапии АСС, и у 1 больного СД трансформировался в РНУО через 6 мес. терапии АСС [28].
Несмотря на то, что в некоторых работах было подтверждено негативное действие АСС на углеводный обмен при акромегалии [28, 30, 34], метаанализ 31 исследования, проведенного с 1987 по 2008 г., включающего 690 больных, показал, что терапия октреотидом ведет к снижению секреции инсулина, но при этом значимых изменений уровня ГПН и HbA1c не происходит [33]. При оценке динамики распространенности НУО среди больных акромегалией, получающих терапию АСС, было обнаружено, что у 25% больных отмечалось улучшение состояния углеводного обмена, у 46% изменений не произошло и у 29% наблюдалось прогрессирование НУО [33].
При сравнительном исследовании влияния октреотида и пасиреотида на углеводный обмен у 358 больных акромегалией было выявлено, что ухудшение углеводного обмена чаще наблюдалось на фоне терапии пасиреотидом (57,3 и 21,7% соответственно) [38]. В настоящее время проводятся мультицентровые исследования причин ухудшения состояния углеводного обмена на фоне терапии пасиреотидом. По предварительным данным, выраженный диабетогенный эффект пасиреотида объясняется стимуляцией sst5 поджелудочной железы, незначительной стимуляцией sst2, что ведет к более значимому снижению секреции инсулина, и отсутствием подавления секреции глюкагона [39].
Пегвисомант, препарат, блокирующий рецепторы к СТГ, улучшает состояние углеводного обмена у больных акромегалией в связи со снижением ИР и отсутствием подавляющего действия на секрецию инсулина [40, 41]. Интересно отметить, что добавление пегвисоманта к терапии АСС ведет к стабилизации показателей гликемии, нарушенной на фоне монотерапии АСС, к дальнейшему улучшению показателей компенсации углеводного обмена при отмене АСС и переводу больных на монотерапию пегвисомантом.
Итак, с учетом высокой распространенности вторичного СД и РНУО при акромегалии, а также особенностей патогенеза НУО становится очевидной необходимость разработки специфических подходов к профилактике и лечению вторичного СД при этом заболевании. Правильно подобранное лечение акромегалии и успешная коррекция углеводного обмена с учетом проводимой специфической терапии акромегалии – залог снижения риска сердечно-сосудистых катастроф, что, возможно, положительно отразится на показателях смертности пациентов с акромегалией.
Литература
1. Holdaway I.M., Rajasoorya C. Epidemiology of acromegaly // Pituitary. 1999 Jun. Vol. 2 (1). Р. 29–41.
2. Colao A., Ferone D., Marzullo P., Lombardi G. Systemic complications of acromegaly: epidemiology, pathogenesis, and management // Endocr Rev. 2004. Vol. 25. Р. 102–152.
3. Древаль А.В., Триголосова И.В., Виноградова А.В., Тишенина Р.С., Мисникова И.В., Губкина В.А., Ковалева Ю.А., Барсуков И.А. Распространенность ранних нарушений углеводного обмена среди больных акромегалией // Проблемы эндокринологии. 2012. № 6. С. 3–7.
4. International Diabetes Federation. IDF Diabetes Atlas. Sixth Edition revision. 2014. Р. 6.
5. Biering H., Knappe G., Gerl H., Lochs H. Prevalence of diabetes in acromegaly and Cushing syndrome // Acta Med Austriaca. 2000. Vol. 27. Р. 27–31.
6. Kasayama S., Otsuki M., Takagi M., Saito H., Sumitani S., Kouhara H., Koga M., Saitoh Y., Ohnishi T., Arita N. Impaired betacell function in the presence of reduced insulin sensitivity determines glucose tolerance status in acromegalic patients // Clin Endocrinol (Oxf). 2000. Vol. 52. Р. 549–555.
7. Gierach M., Gierach J., Pujanek M., Skowrońska A., Rutkowska E., Junik R. Aberrations in carbohydrate metabolism in patients with diagnosed acromegaly, hospitalized in the Endocrinology and Diabetology Department of Collegium Medicum University of Nicolaus Copernicus in Bydgoszcz in the years 2001-2009 // Endokrynol Pol. 2010 May-Jun. Vol. 61 (3). Р. 260–263.
8. Kreze A., Kreze-Spirova E., Mikulecky M. Risk factors for glucose intolerance in active acromegaly // Braz J Med Biol Res. 2001. Vol. 34. Р. 1429–1433.
9. Dreval A.V., Trigolosova I.V., Wolffenbuttel B.H.R. et al. Prevalence of carbohydrate metabolism disorders in patients with acromegaly // Endocrine Connection. 2014. Vol. 3 (93). Р. 1–6.
10. Stelmachowska-Banaś M., Zdunowski P., Zgliczyński W. Abnormalities in glucose homeostasis in acromegaly. Does the prevalence of glucose intolerance depend on the level of activity of the disease and the duration of the symptoms? // Endokrynol Pol. 2009. Vol. 60 (1). Р. 20–24.
11. Espinosa-de-los-Monteros A., Gonza ́lez B., Vargas G., Sosa E., Mercado M. Clinical and biochemical characteristics of acromegalic patients with different abnormalities in glucose metabolism // Pituitary. 2011. Vol. 14. P. 231–235.
12. Fieffe S., Morange I., Petrossians P., Chanson P., Rohmer V., Cortet C., Borson-Chazot F., Brue T., Delemer B. Diabetes in acromegaly, prevalence, risk factors, and evolution: data from the French Acromegaly Registry // Eur J Endocrinol. 2011 Jun. Vol. 164 (6). Р. 877–884.
13. Urbani C., Sardella C., Calevro A., Rossi G., Scattina I., Lombardi M., Lupi I., Manetti L., Martino E., Bogazzi F. Effects of medical therapies for acromegaly on glucose metabolism // Eur J Endocrinol. 2013 Jun 7. Vol. 169 (1). Р. 99–108.
14. Biagetti B., Obiols G., Valladares S., Arnez L., Dalama B., Mesa J. Abnormalities of carbohydrate metabolism in acromegaly // Med Clin (Barc); 2013 Nov 16. Vol. 141 (10). Р. 442–446.
15. Moller N., Jorgensen J.O.L. Effects of growth hormone on glucose, lipid, and protein metabolism in human subjects // Endocrine Reviews. 2009. Vol. 30 (2). Р. 152–177.
16. Foss M.C., Saad M.J., Paccola G.M. et al. Peripheral glucose metabolism in acromegaly // J Clin Endocrinol Metab. 1991. Vol. 72. Р. 1048–1053.
17. Muggeo M., Saviolakis G.A., Businaro V. et al. Insulin receptor on monocytes from patients with acromegaly and fasting hyperglycemia // J Clin Endocrinol Metab. 1983. Vol. 56. Р. 733–738.
18. Pratipanawatr T. Thongchai Pratipanawatr, Wilailak Pratipanawatr, Clifford Rosen et al. Effect of IGF-I on FFA and glucose metabolism in control and type 2 diabetic subjects // AJP. 2002. Vol. 282. No. 6. Р. 1360–1368.
19. Benyoucef S., Surinya K.H., Hadaschik D., Siddle K. Characterization of insulin/IGF hybrid receptors: contributions of the insulin receptor L2 and Fn1 domains and the alternatively spliced exon 11 sequence to ligand binding and receptor activation // Biochem J. 2007. Vol. 403. Р. 603–613.
20. O’Connell T., Clemmons D.R. IGF-I/IGF-binding protein-3 combination improves insulin resistance by GH-dependent and independent mechanisms // J Clin Endocrinol Metab. 2002. Vol. 87. Р. 4356–4360.
21. Moller N., Schmitz O., Joorgensen J.O., Astrup J., Bak J.F., Christensen S.E., Alberti K.G., Weeke J. Basal- and insulinstimulated substrate metabolism in patients with active acromegaly before and after adenomectomy // J Clin Endocrinol Metab. 1992. Vol. 74. Р. 1012–1019.
22. Coculescu M., Niculescu D., Lichiardopol R., Purice M. Insulin resistance and insulin secretion in non-diabetic acromegalic patients // Exp Clin Endocrinol Diabetes. 2007. Vol. 115. Р. 308–316.
23. Hopkins K.D., Holdaway I.M. Insulin secretion and insulinlike growth factor-I levels in active and controlled acromegaly // Clin Endocrinol (Oxf). 1992. Vol. 36. Р. 53–57.
24. Niculescu D., Purice М., Coculescu М. Insulin-like growth factor-I correlates more closely than growth hormone with insulin resistance and glucose intolerance in patients with acromegaly // Pituitary. 2013. Vol. 16. Р. 168–174.
25. Puder J.J., Nilavar S., Post K.D., Freda P.U. Relationship between disease-related morbidity and biochemical markers of activity in patients with acromegaly // J Clin Endocrinol Metab. 2005. Vol. 90. Р. 1972–1978.
26. Guler H.P., Zapf J., Froesch E.R. Short-term metabolic effects of recombinant human insulin-like growth factor I in healthy adults // N Engl J Med. 1987. Vol. 317. Р. 137–140.
27. Luft R., Cerasi E., Hamberger C.A. Studies on the pathogenesis of diabetes in acromegaly // Acta Endocrinol (Copenh). 1967. Vol. 56. Р. 593–607.
28. Древаль А.В., Триголосова И.В., Виноградова А.В. Механизмы развития нарушений углеводного обмена при акромегалии в зависимости от лечения // Проблемы эндокринологии. 2015 (в печати).
29. Pereira A.M., Biermasz N.R., Roelfsema F., Romijn J.A. Pharmacologic therapies for acromegaly. A review of their effects on glucose metabolism and insulin resistance // Treat Endocrinol. 2005. Vol. 4. Р. 43–53.
30. Ronchi C.L., Varca V., Beck-Peccoz P., Orsi E., Donadio F., Baccarelli A., Giavoli C., Ferrante E., Lania A., Spada A., Arosio M. Comparison between six-year therapy with long-acting somatostatin analogs and successful surgery in acromegaly: effects on cardiovascular risk factors // J Clin Endocrinol Metab. 2006. Vol. 91. Р. 121–128.
31. Zambre Y., Ling Z., Chen M.C., Hou X., Woon C.W. et al. Inhibition of human pancreatic islet insulin release by receptor-selective somatostatin analogs directed to somatostatin receptor subtype 5 // Biochem Pharmacol. 1999. Vol. 57 (10). Р. 1159–1164.
32. Singh V., Brendel M.D., Zacharias S., Mergler S., Jahr H. et al. Characterization of somatostatin receptor subtype-specific regulation of insulin and glucagon secretion: an in vitro study on isolated human pancreatic islets // J Clin Endocrinol Metab. 2007. Vol. 92 (2). Р. 673–680.
33. Mazziotti G., Floriani I., Bonadonna S., Giustina A. et al. Effects of somatostatin analogs on glucose homeostasis: a meta-analysis of acromegaly studies // J Clin Endocrinol Metab. 2009. Vol. 94. Р. 1500–1508.
34. Steffin B.A. et al. 12-month, prospective, cross-sectional study in patients with acromegaly receiving Lanreotide-Autogel. Either 60mg/month or 120mg/month // Eur J Endocrin. 2006. Vol. 155. Р. 73–78.
35. Parkinson C., Drake W.M., Roberts M.E., Meeran K., Besser G.M., Trainer P.J. A comparison of the effects of pegvisomant and octreotide on glucose, insulin, gastrin, cholecystokinin, and glucose metabolism in acromegaly // European Journal of Endocrinology. 2013. Vol. 107. Р. 169.
36. Ronchi C., Epaminonda P., Cappiello V., Beck-Peccoz P., Arosio M. Effects of two different somatostatin analogs on glucose tolerance in acromegaly // Journal of Endocrinological Investigation. 2002. Vol. 25. Р. 502–507.
37. Древаль А.В., Триголосова И.В., Виноградова А.В., Иловайская И.А., Тишенина Р.С. Особенности нарушений углеводного обмена при акромегалии в зависимости от проводимого лечения // Ожирение и метаболизм. 2013. № 4. С. 21–25.
38. Colao A., Bronstein M.D., Freda P. Pasireotide Versus Octreotide in Acromegaly: A Head-to-Head Superiority Study // JCEM. March 2014. Vol. 99. Issue 3.
39. Schmid H.A., Brueggen J. Effects of somatostatin analogs on glucose homeostasis in rats // J Endocrinol. 2012. Vol. 212. Р. 49–60.
40. Jørgensen J.O.L., Feldt-Rasmussen U., Frystyk J., Chen J.-W., Kristensen L.O., Hagen C., Ørskov H. Cotreatment of acromegaly with a somatostatin analog and a growth hormone receptor antagonist // J Clin Endocrinol Metab. 2005. Vol. 90. Р. 5627–5631.
41. Barkan A.L., Burman P., Clemmons D.R., Drake W.M., Gagel R.F., Harris P.E., Trainer P.J., van der Lely A.J., Vance M.L. Glucose homeostasis and safety in patients with acromegaly converted from long-acting octreotide to pegvisomant // J Clin Endocrinol Metab. 2005. Vol. 90. Р. 5684–5691.
Источник: Журнал РМЖ №8 «Эндокринология», май 2015




Комментировать