Гончар И.А., Нечипуренко Н.И., Фролов А.В., Бельская М.И., Прудывус И.С., Недзьведь Г.К., Гуль Л.М.
Республиканский научно-практический центр неврологии и нейрохирургии, Минск, Беларусь, Республиканский научно-практический центр «Кардиология», Минск, Беларусь, Республиканский научно-практический центр онкологии и медицинской радиологии им. Н.Н. Александрова, Минск, Беларусь
Резюме. Цель исследования – определение прогностической значимости энтропии вариабельности сердечного ритма (ВСР) в отношении функционального исхода острого частичного инсульта в каротидном бассейне (ЧИКБ) при фибрилляции предсердий (ФП). Проспективное когортное исследование включало 99 пациентов с острым ЧИКБ при ФП; средний возраст 71,7±9,3 года. Использовался программно-технический комплекс «Бриз М» со временем записи ЭКГ 5 минут. Для анализа состояния кардиоритма применяли временные и нелинейные параметры ВСР: ApEn15 (m=2, r=0,15 SDNN), ApEn20 (m=1, r=0,2 SDNN) и mApEn20 (m=2, r=0,15 MeanRR). Оценка по модифицированной шкале Рэнкина (МШР) на момент выписки < 4 баллов соответствовала удовлетворительному функциональному исходу,?? 4 баллов – неудовлетворительному. Установлена прогностическая значимость определения ApEn в отношении клинического исхода ЧИКБ при ФП в остром периоде заболевания. Неудовлетворительный функциональный исход острого периода каротидного инсульта характеризовался высокими значениями как аппроксимированной энтропии сердечного ритма ApEn15 (р=0,021), так и частоты сердечных сокращений (р=0,037). У пациентов с оценкой 4–6 баллов МШР наблюдалось снижение минимальной длительности кардиоинтервалов (р=0,014), медианы и моды RR (р=0,034 и р=0,040 соответственно). Показано, что повышение хаотичности кардиоритма в условиях дизрегуляции церебрального кровотока при ФП ассоциировано с сохранением тяжелых инвалидизирующих нарушений на момент выписки из стационара.
Ключевые слова: вариабельность сердечного ритма, инфаркт мозга, нелинейный анализ, фибрилляция предсердий, энтропия.
Медицинские новости. – 2015. – №1. – С. 41–46.
Нарушение сердечного ритма по типу постоянной или пароксизмальной фибрилляции предсердий (ФП) признано одной из основных причин возникновения острого ишемического нарушения мозгового кровообращения (ОНМК) [15]. Данный вид аритмии увеличивает риск смерти от системных и церебральных эмболических осложнений в 1,5–1,9 раза по сравнению со здоровыми лицами сопоставимого возраста [16].
Автономная нервная система, представленная симпатическим и парасимпатическим отделами, играет важную роль в регулировании ритмических сокращений сердца. Исследования вегетативной регуляции по данным вариабельности сердечного ритма (ВСР) до недавнего времени выполнялись лишь на популяциях пациентов с сохранным синусовым ритмом, при этом ускользает из внимания значительное количество обследованных.
В условиях реальной клинической практики большинство пациентов с острым инфарктом головного мозга (ИГМ) имеют на электрокардиограмме (ЭКГ) признаки кардиальной аритмии, представленные постоянной или пароксизмальной ФП, наджелудочковой и желудочковой экстрасистолией, эпизодами мономорфной и полиморфной желудочковой тахикардии [11]. Стремительное развитие компьютерных технологий обработки последовательных временных рядов биосигналов, к которым относятся и записи следующих друг за другом кардиоциклов, позволили дополнить рутинные методы анализа ВСР новыми нелинейными параметрами.
В РНПЦ неврологии и нейрохирургии на протяжении последних 8 лет проводятся исследования вегетативной дизрегуляции сердца при цереброваскулярной патологии с применением нелинейного показателя хаотичности кардиоритма – аппроксимированной энтропии (ApEn). Было установлено, что депривация ВСР в остром периоде ИГМ сопровождается снижением энтропии синусового ритма, что, в свою очередь, ассоциировано с прогрессирующим клиническим течением инсульта, неблагоприятным клиническим исходом и худшей выживаемостью пациентов [3–6]. Однако для кардионеврологов оставалось неизвестным, существует ли клинически значимая взаимосвязь хаотичности сердечных сокращений сердца при ФП с функциональным исходом инсульта, что и явилось основой проведенного исследования.
Цель исследования – определение прогностической значимости энтропии вариабельности сердечного ритма в отношении функционального исхода острого частичного инсульта в каротидном бассейне (ЧИКБ) при ФП.
Материалы и методы
В проспективное когортное исследование были включены 99 пациентов с частичным инсультом в каротидном бассейне (ЧИКБ) ишемической этиологии, развившимся на фоне постоянной либо пароксизмальной фибрилляции предсердий (ФП). Госпитализация пациентов осуществлялась в острейшем периоде ОНМК в неврологическое отделение №1 Больницы скорой медицинской помощи г. Минска. Возраст обследованных от 41 до 91 года; средний возраст 71,7±9,3 года.
У всех пациентов с ЧИКБ при ФП для верификации диагноза проведено клиническое, электрокардиографическое и нейровизуализационное обследование (компьютерная и/или магнитно-резонансная томография головного мозга). Диагностику постоянной либо пароксизмальной ФП осуществляли на основании утвержденных Национальными рекомендациями критериев [7].
В специально разработанной регистрационной форме указывали демографические данные, факторы риска инсульта, результаты клинического обследования. Клинический вариант ИГМ, соответствующий частичному инсульту в каротидном бассейне, выделяли в соответствии с критериями Оксфордского объединенного регистра инсульта [17]. Тяжесть инсульта оценивали по шкале инсульта Национальных институтов здравоохранения (NIHSS) [2] на момент поступления в инсультное отделение и через 10–12 суток. Выраженность вызванных инсультом функциональных нарушений оценивали с помощью модифицированной шкалы Рэнкина (МШР) [2]. Функциональный исход острого периода ЧИКБ считали удовлетворительным (благоприятным) при полном или частичном восстановлении способностей пациентов к передвижению и самообслуживанию, соответствующем оценке по МШР 0–3 балла. Неудовлетворительный исход лечения – сохранение выраженных инвалидизирующих нарушений, потребность в постороннем уходе или смерть пациента – соответствовал диапазону 4–6 баллов МШР.
Помимо 12-канальной рутинной ЭКГ, всем пациентам проведена регистрация 5-минутной кардиоинтервалограммы с помощью цифрового электрокардиографа «Интекард» с программой «Бриз М» (Интекард, Беларусь). Первое исследование ВСР выполняли в максимально короткие сроки после развития ИГМ (в среднем на 3 {1; 4} сутки от начала инсульта), повторное – перед выпиской из стационара (10 {8; 14} сутки). Зарегистрированная последовательность RR-интервалов включала не менее 300 сердечных циклов.
Определяли следующие временные показатели ВСР: SDNN (мс) – среднее квадратичное отклонение интервалов RR; RMSSD (мс) – корень квадратный из суммы квадратов разностей смежных RR-интервалов; NN50 – количество пар последовательных кардиоинтервалов, различающихся более чем на 50 мс; pNN50 (%) – процент NN50 от общего количества интервалов RR; MaxRR (мс) – максимальная длительность интервалов RR; MinRR (мс) – минимальная длительность интервалов RR; ЧСС – частота сердечных сокращений в минуту. Спектральные параметры не использовали ввиду их несостоятельности при нестационарных процессах [13].
Для анализа характера изменчивости сердечного ритма при ФП применяли нелинейный показатель аппроксимированной энтропии ApEn, который отражает отношение порядка и хаоса в сложных саморегулирующихся системах [25]. Величина энтропии зависит от уровня дисперсии ВСР и однородности временных серий кардиоинтервалов [12]. Математический алгоритм расчета аппроксимированной энтропии был опубликован нами ранее [6, 13]. В ходе работы использованы три варианта вычисления аппроксимированной энтропии:
– ApEn15 (m=2, r=0,15 SDNN), где m – размерность вектора, реконструированного из входной последовательности RR, в данном случае m=2; r – порог сравнения RR-интервалов, определяемый величиной среднего квадратичного отклонения (SDNN) входной RRi последовательности;
– ApEn20 (m=1, r=0,2 SDNN) – аналогичный показатель, вычисленный по методу S. Pinkus [25], с использованием среднего квадратичного отклонения кардиоинтервалов (SDNN);
– mApEn20 (m=2, r=0,15 MeanRR) – модифицированная приблизительная энтропия, при расчете которой порог сравнения кардиоинтервалов (r) зависит от разности текущего (RRi) и предыдущего (RRi-1) значений кардиоинтервалов.
Пациентам с ИГМ при ФП назначали унифицированную антитромботическую, антиаритмическую, гипотензивную, нейропротективную, симптоматическую терапию [4, 7].
Критерии исключения из исследования: наличие внутримозговых гематом, черепно-мозговых травм, сопутствующих опухолевых и инфекционных заболеваний центральной нервной системы, проведение тромболитической терапии.
Статистический анализ. При соответствии распределения изучаемого количественного параметра распределению Гаусса данные представляли в виде среднего арифметического значения и стандартного отклонения; в противном случае – в виде медианы и квартилей. Для установления предикторов развития варианта функционального исхода ЧИКБ при ФП на момент выписки для двух групп применяли: для качественных данных – точный критерий Фишера; для количественных – тест Манна–Уитни. Для сравнения качественных данных, которые можно представить в виде таблиц сопряженности 2X2, применяли двусторонний точный тест Фишера. Для сравнения качественных стратифицированных данных, которые можно представить в виде k-таблиц сопряженности 2X2, применяли тест Кохрейна– Мантеля – Ханцеля. Различия считали достоверными при уровне значимости р < 0,05.
Результаты и обсуждение
Когорта проспективно обследованных пациентов с ЧИКБ при ФП включала 35 (35,4%) мужчин и 64 (64,5%) женщины. Прогрессирующее течение инсульта, сопровождающееся нарастанием в течение первой недели лечения очаговой и общемозговой неврологической симптоматики на 2 и более балла шкалы NIHSS, зафиксировано у 16 (16,2%) пациентов, регрессирующее – у 83 (83,8%) чел. За время пребывания в инсультном стационаре скончались 8 (8,1%) из 99 пациентов с ЧИКБ при ФП.
Группы обследованных с различными вариантами клинического исхода ЧИКБ не имели статистически значимых различий по количеству лиц с пароксизмальной и хронической формами ФП (табл. 1). Так, среди пациентов с неблагоприятным функциональным исходом ОНМК (n=31) пароксизмальная ФП диагностирована в 9 (29%) случаях, постоянная – в 22 (71%). При благоприятном исходе ишемического инсульта (n=68) пароксизмальная форма ФП зарегистрирована в 28 (41,2%) наблюдениях, хроническая – в 40 (58,8%); р = 0,272 при сопоставлении данных с группой неблагоприятного результата лечения.
Таблица 1. Клинические характеристики пациентов в зависимости от функционального исхода ЧИКБ при ФП на момент выписки (n = 99)
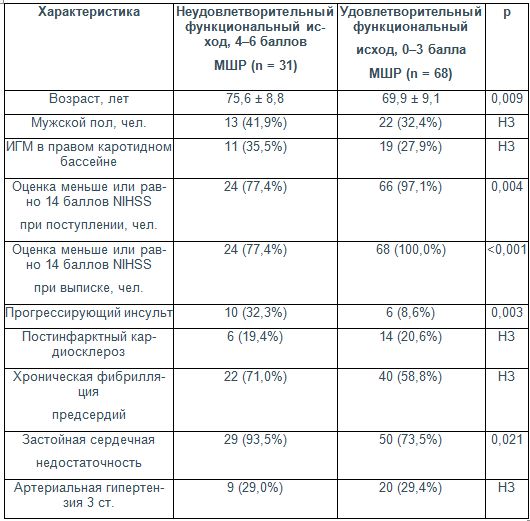
П р и м е ч а н и е : Данные представлены в виде: n (%), среднее значение ± стандартное отклонение, медиана {нижний квартиль; верхний квартиль}. ИГМ – инфаркт головного мозга; МШР – модифицированная шкала Рэнкина; NIHSS – шкала инсульта Национальных институтов здравоохранения; НЗ – различия статистически незначимы.
Неудовлетворительный функциональный исход ЧИКБ был ассоциирован с такими клиническими характеристиками, как выраженный неврологический дефицит при поступлении в стационар (р=0,004), прогрессирующее течение инсульта с нарастанием очаговых и общемозговых нарушений (р=0,003), застойная сердечная недостаточность (р=0,021). Возраст пациентов с оценкой 4–6 баллов МШР также достоверно превышал аналогичный показатель лиц с удовлетворительным исходом лечения (0–3 балла МШР): 75,6±8,8 и 69,9±9,1 года соответственно; р=0,009 (см. табл. 1).
В табл. 2 отражены линейные и нелинейные показатели ВСР, зарегистрированные в острейшем периоде ЧИКБ при ФП у пациентов с неудовлетворительным и удовлетворительным функциональным исходом инсульта (n=99). Неудовлетворительный функциональный исход острого периода инсульта, соответствующий тяжелой инвалидизации, характеризовался высокими значениями аппроксимированной энтропии сердечного ритма ApEn15 по сравнению с группой лиц с благоприятным исходом заболевания: 1,13 {1,03; 1,16} и 1,06 {0,93; 1,13} соответственно; р =0,021. Необходимо отметить, что в группе пациентов с неудовлетворительным результатом лечения значения нелинейных показателей энтропии ApEn20 (m=1, r=0,20 SDNN) и mApEn также превышали соответствующие показатели кардиоритма пациентов с хорошим функциональным восстановлением, однако указанные различия не достигали степени статистической значимости.
Таблица 2. Показатели ВСР пациентов с ЧИКБ при ФП в острейшем периоде инсульта (n=99)
| Показатель ВСР | Группа наблюдения | р | |
| Неудовлетворительный функциональный исход, 4-6 баллов МШР (n=31) | Удовлетворительный функциональный исход, 0-3 балла МШР (n=68) | ||
| Нелинейные показатели ВСР | |||
| mApEn | 0,67 {0,18; 0,79} | 0,64 {0,02; 0,90} | НЗ |
| ApEn15 (m=2, r=0,15 SDNN) | 1,13 {1,03; 1,16} | 1,06 {0,93; 1,13} | 0,021 |
| ApEn20 (m=1, r=0,20 SDNN) | 1,96 {1,80; 2,05} | 1,86 {1,41; 2,04} | НЗ |
| Временные показатели ВСР | |||
| Min RR, мс | 390 {372; 480} | 489 {390; 671} | 0,014 |
| Max RR, мс | 1184 {942; 1422} | 1178 {934; 1396} | НЗ |
| Mediana RR, мс | 689 {583; 782} | 801 {623; 944} | 0,034 |
| SDNN, мс | 123 {84; 171} | 105 {68; 164} | НЗ |
| RMSSD, мс | 165 {114; 200} | 136 {52; 227} | НЗ |
| NN50 | 144 {110; 179} | 125 {10; 170} | НЗ |
| pNN50, % | 37 {26; 38} | 29 {3; 39} | НЗ |
| Moda RR, мс | 640 {510; 730} | 760 {583; 900} | 0,040 |
| ЧСС, в минуту | 87 {77; 103} | 75 {63; 96} | 0,037 |
П р и м е ч а н и е : Данные представлены в виде медианы {нижний квартиль; верхний квартиль}. НЗ – различия статистически незначимы.
Частота сердечного ритма при МШР 4–6 баллов достигала 87 {77; 103} сокращений в минуту, при МШР 0–3 балла – лишь 75 {63; 96}; р=0,037. Кроме того, группа пациентов с оценкой 4–6 баллов МШР демонстрировала статистически значимое снижение временных параметров ВСР: минимальной длительности кардиоинтервалов (390 {372; 480} и 489 {390; 671} мс соответственно; р=0,014), медианы (689 {583; 782} и 801 {623; 944} мс соответственно; р=0,034) и моды длительности кардиоинтервалов (640 {510; 730} и 760 {583; 900} мс соответственно; р=0,040).
Сопоставлены значения квартилей ApEn15, зарегистрированной при первом измерении ВСР, с функциональным исходом инсульта. У 3 (10,0%) из 30 пациентов, имеющих оценку 4–6 баллов МШР на момент выписки, значение энтропии соответствовало первому квартилю, у 27 (90,0%) чел. – диапазону Q2–Q4. В случае благоприятного клинического исхода лечения распределение ApEn15 выглядело иначе. Так, у 21 (31,8%) чел. значения энтропии соответствовали Q1, у 45 (68,2%) – диапазону Q2–Q4, т.е. демонстрировали статистически значимые различия с подгруппой прогрессирующего течения инсульта: ОШ=4,20; 95% ДИ: 1,14–15,42; р=0,022.
Проведен анализ вероятности сохранения грубых инвалидизирующих нарушений для пациентов, у которых значения аппроксимированной энтропии были разделены дихотомически с использованием медианы (Q2) значений ApEn15 при первой регистрации ВСР. Методом оценки общего отношения шансов Мантеля–Хенцеля установлено, что у лиц с высоким значением аппроксимированной энтропии (Q3–Q4) вероятность неудовлетворительного функционального исхода лечения возрастает в два с половиной раза по сравнению с пациентами, имеющими низкие значения энтропии (Q1–Q2): ОШ=2,26; 95% ДИ: 1,05–6,60; р=0,036.
У пациентов с ЧИКБ при ФП низкое значение ApEn15, не превышающее Q1, снижало вероятность тяжелой функциональной недостаточности в 5 раз по сравнению с высоким значением ApEn15, соответствующим Q4 показателя: ОШ=0,22; 95% ДИ: 0,05–0,97; р=0,036.
Параметры ВСР, измеренные в динамике острого периода инсульта, также демонстрировали статистически значимые различия в группах лиц с удовлетворительным и неудовлетворительным функциональным восстановлением (табл. 3). В табл. 3 представлены показатели ВСР, имеющие достоверные различия в подгруппах лиц с различным функциональным исходом острого периода инсульта. При второй регистрации ВСР для пациентов с тяжелой инвалидизацией было характерно сокращение минимальной длительности кардиоинтервалов Min RR (р=0,044), медианы длительности кардиоинтервалов Median RR (р=0,044), моды длительности кардиоинтервалов Moda RR (р =0,020) и, соответственно, увеличение частоты сердечных сокращений (р=0,040). Традиционная мера вариабельности сердечного ритма – среднее квадратичное отклонение кардиоинтервалов – SDNN не продемонстрировало диагностической значимости при выделении предикторов неудовлетворительного функционального исхода ИГМ.
Таблица 3. Показатели ВСР пациентов с ЧИКБ при ФП при выписке (n=33)
| оказатель ВСР | Группа наблюдения | р | |
| Неудовлетворительный функциональный исход, 4–6 баллов МШР (n=8) | Удовлетворительный функциональный исход, 0–3 балла МШР (n=25) | ||
| Min RR, мс | 350 {289; 466} | 512 {422; 581} | 0,044 |
| Mediana RR, мс | 592 {454; 887} | 822 {756; 932} | 0,044 |
| Moda RR, мс | 485 {410; 800} | 740 {685; 920} | 0,020 |
| ЧСС, в минуту | 102 {68; 133} | 73 {65; 80} | 0,040 |
П р и м е ч а н и е : Данные представлены в виде медианы {нижний квартиль; верхний квартиль}.
Исследования ВСР, основанные на применении временных и спектральных показателей для анализа синусового ритма сердца, традиционно рассматривают весь ансамбль кардиоцеребральных взаимодействий с позиции симпато-парасимпатического баланса [4, 8, 24]. Преобладание симпатической иннервации, выраженное снижение активности парасимпатического тонуса вегетативной нервной системы при инсульте сопровождается уменьшением значений базовых параметров вариабельности сердечного ритма: среднеквадратического отклонения (SDNN), корня квадратного суммы квадратов разностей стандартного отклонения кардиоритма (rMSSD), высокочастотной составляющей спектра (HF). Взаимосвязь симпатикотонии с ослаблением парасимпатической модуляции синусового ритма сердца при ИГМ была неоднократно продемонстрирована в работах зарубежных, а позже и отечественных авторов [3, 8, 10, 11, 22, 23]. Снижение показателя суммарной вегетативной активности SDNN по данным холтеровского мониторирования ЭКГ ниже 70 мс является независимым фактором риска развития сердечно-сосудистых осложнений, увеличивая вероятность их развития в 2,6 раза в постинсультном периоде [14]. И, наоборот, легкая неврологическая симптоматика острого ишемического инсульта, благоприятный функциональный исход заболевания, в свою очередь, характеризуются снижением активности симпатической нервной системы с одновременным усилением вагусных парасимпатических влияний [10, 11].
Несмотря на разработку современных терапевтических и хирургических алгоритмов лечения ФП, патогенез возникновения пароксизмальной и хронической форм аритмии продолжает оставаться предметом научных дискуссий [1, 7, 9, 20]. ФП проявляется хаотичным возбуждением отдельных групп мышечных волокон одного или обоих предсердий, что вызывает полный асинхронизм желудочковых сокращений [9].
В результате исследования сосудисто-тромбоцитарного и плазменного гемостаза у пациентов с инфарктом мозга при ФП, застойной сердечной недостаточности, гипомобильности показано функционирование каскада сложных тромбоэмболических механизмов, связанных с эндотелиальной дисфункцией, застоем крови в левом предсердии, гиперкоагуляцией [7]. Внедрение в клиническую работу новых оральных антикоагулянтов из групп прямых ингибиторов тромбина (дабигатран) и фактора Хa (ривароксабан) для предотвращения первичных и повторных тромбоэмболических цереброваскулярных осложнений должно принципиально улучшить результаты лечения пациентов, вынужденных воздержаться от приема варфарина [20, 21].
Электрокардиографические исследования лежат в основе выделения вагусной, адренергической, алкогольной и смешанной форм пароксизмальной ФП, требующих дифференцированного подхода в назначении противорецидивной антиаритмической терапии [7]. Анализ кардиоинтервалографических параметров используют в прогнозировании рецидивов ФП после аортокоронарного шунтирования, электроимпульсной терапии. Таким образом, нейровегетативные воздействия на сердечно-сосудистую систему играют непосредственную роль в развитии пароксизмальной и постоянной форм ФП [1, 9, 20].
Методы диагностики автономного дисбаланса у пациентов с мерцательной аритмией приобретают прогностическое значение в остром и восстановительном периодах ИГМ. Ранее были опубликованы результаты ВСР-анализа 318 пациентов с ИГМ на фоне синусового ритма сердца (n=204), пароксизмальной (n=43) и постоянной ФП (n=71). Впервые были рассчитаны значения нелинейных показателей ApEn15, ApEn20 и mApEn, имевших достоверные различия у обследованных из вышеперечисленных групп. Так, значение ApEn15 у пациентов с некардиогенным ИГМ составило 0,008 {0,001; 0,028}, с ИГМ при пароксизмальной ФП – 0,017 {0,004; 0,230} и в случае ИГМ на фоне хронической ФП – 0,830 {0,728; 0,940}; р<0,001 [5, 6, 18].
Математический алгоритм расчета аппроксимированной энтропии временных рядов данных был разработан профессором Массачусетского технологического университета (США) S.M. Pincus в 1991 г. [25]. Данный алгоритм был с успехом реализован в 1996 г. в исследованиях S.M. Oppenheimer и соавт. [24], выполнивших сопоставление кардиоинтервалометричеcких данных 6 пациентов с инсультом с показателями ЭКГ 17 здоровых добровольцев. Было обнаружено снижение ApEn сердечного ритма при локализации очага ишемического инсульта в коре левого островка мозга – высшего вегетативного центра автономной нервной системы человека. S.M. Oppenheimer и соавт. [24] впервые показали смещение вегетативного управления кардиоритма в зону симпатической модуляции в остром периоде инфаркта мозга, что многократно подтверждалось впоследствии в исследованиях других авторов [4, 8, 10, 11, 22, 23].
В настоящее время существуют различные методики расчета энтропии временных рядов биологических сигналов, включающие аппроксимированную энтропию (ApEn), простую энтропию (SamEn), мультишкальную энтропию (MSE), также модифицированную энтропию (mApEn), алгоритм расчета которой создан отечественными авторами [6, 13]. Показатели энтропии характеризуют сложность организации временных серий RR-интервалов, позволяя оценить в количественном выражении регулярность и предсказуемость повторяющихся данных [25], либо, как в случае с ФП, – хаотичность сокращений сердца. Высокие значения ApEn при ФП демонстрируют увеличение сложной организации фазовых портретов сердечного ритма и низкую предсказуемость повторяющихся процессов [13].
В работах А. Флейшмана и А.Фролова показано, что аппроксимированная энтропия ВСР имеет низкие значения у пациентов с ишемической болезнью сердца, когда сердечный ритм становится «ригидным», а сердце теряет способность быстро адаптироваться к измененным условиям внешней среды [12, 13]. Депривация хаотичности сердечных сокращений наблюдается при артериальной гипертензии, застойной сердечной недостаточности, сахарном диабете, а также при трансплантации сердца, когда сердечная мышца находится в условиях хирургической денервации [13].
В 2014 г. S.C. Tang с соавт. [26] представили результаты холтеровского анализа ВСР у 77 пациентов с ИГМ при постоянной ФП и 150 лиц с ИГМ без ФП. Для оценки сложности кардиоритма был применен показатель мультишкальной энтропии (MSE), величина которого составила у пациентов с ИГМ и синусовым ритмом 25,8±0,3, а у здоровых лиц 32,3±4,3; р<0,001. Тайванские исследователи показали взаимосвязь снижения сложности кардиоритма у пациентов с некардиоэмболическим инсультом с функциональным исходом ИГМ через 3 месяца [26]. При этом величина MSE достигала значения 30,0±5,2 при оценке по МШР 0–2 балла и лишь 22,9±8,4 при оценке МШР 3–6 баллов {ОШ=1,18 (95% ДИ: 1,08–1,28); р<0,001}. Данные исследования [26] согласуются с результатами, полученными нами в 2010 г. при анализе хаотичности ВСР у 218 пациентов с некардиогенным ИГМ, изложенными в патенте на изобретение [3]. В 2013 г. мы опубликовали результаты оценки ВСР у пациентов с отдельно выделенным клиническим вариантом инсульта, характеризующимся относительной «мягкостью» неврологических проявлений – частичным инсультом в каротидном бассейне на фоне синусового ритма сердца [5]. Проведенное исследование продемонстрировало прогностическую значимость нелинейного параметра ВСР – энтропии сердечного ритма, наряду с временными и спектральными характеристиками в отношении клинического исхода ЧИКБ в остром периоде заболевания. Регулярный и предсказуемый тип сердечного ритма, характеризующийся низкими значениями аппроксимированной энтропии, ассоциирован с летальным исходом в остром периоде ОНМК, прогрессирующим клиническим течением ИГМ и сохранением грубых инвалидизирующих нарушений на момент выписки из стационара. S.C. Tang с соавт. [26], обследовав значительную когорту пациентов с ИГМ при ФП, не смогли обнаружить взаимосвязь нейровегетативной модуляции с биологическими конечными точками исследования. Это подтверждает приоритет нашей работы, показавшей на примере пациентов с ЧИКБ при ФП клинически значимые ассоциации возрастания хаотичности сердечного ритма с тяжестью инвалидизирующих последствий ишемического ОНМК.
После опубликования наших результатов, впервые показавших взаимосвязь нелинейных параметров аппроксимированной энтропии у пациентов с некардиоэмболическим инсультом с функциональным исходом ОНМК [3, 5], в журнале «Hypertension» было представлено исследование B. Graff с соавт. [19], также продемонстрировавшее прогностическую роль показателей простой (SampEn) и аппроксимированной (ApEn) энтропии при инсульте. Данная работа была выполнена на анализе линейных и нелинейных показателей ВСР, полученных путем краткосрочных записей ЭКГ у 75 пациентов с ИГМ на фоне синусового ритма.
Полученные в настоящем исследовании данные подтверждают мнение А.Н. Флейшмана [12], первого российского ученого, который в конце 1990-х годов начал применять методы нелинейной динамики в области клинического анализа ВСР, о том, что оценка нелинейных изменений вариабельности кардиоритма дает возможность идентифицировать скрытые динамические паттерны, соответствующие конкретным физиологическим или патофизиологическим процессам. Проспективное когортное наблюдение 99 пациентов с острым инсультом дало возможность обнаружить ранее неизвестную взаимосвязь аппроксимированной энтропии сердечного ритма пациентов с ЧИКБ при ФП с биологической конечной точкой исследования – тяжестью функциональных неврологических нарушений, выраженностью постинсультной инвалидизации.
При анализе показателей ВСР у пациентов с инсультом на фоне ФП было показано, что нарушения автономной модуляции кардиоритма в условиях дизрегуляции церебрального кровотока ассоциированы с сохранением тяжелых инвалидизирующих нарушений на момент выписки из стационара (??4 баллов МШР). Выявлено статистически значимое повышение нелинейного показателя приблизительной энтропии сердечного ритма ApEn15 (m=2, r=0,15 SDNN) у пациентов с неблагоприятным функциональным исходом ЧИКБ при ФП.
Выводы
- Проведенное исследование продемонстрировало прогностическую значимость определения аппроксимированной энтропии вариабельности кардиоритма в отношении клинического исхода парциального инсульта в бассейне сонных артерий при ФП в остром периоде заболевания, информация о чем в ранее проведенных исследованиях отечественных и зарубежных авторов отсутствовала.
- Неудовлетворительный функциональный исход острого периода каротидного инсульта, соответствующий тяжелой инвалидизации, характеризовался высокими значениями как аппроксимированной энтропии сердечного ритма ApEn15 (р=0,021), так и частоты сердечных сокращений (р=0,037). У пациентов с оценкой 4–6 баллов МШР наблюдалось статистически значимое снижение минимальной длительности кар-диоинтервалов (р=0,014), медианы и моды RR (р=0,034 и р=0,040 соответственно).
- При анализе показателей ВСР у 99 пациентов с ЧИКБ при ФП впервые показано, что повышение хаотичности кардиоритма в условиях дизрегуляции церебрального кровотока ассоциировано с сохранением тяжелых инвалидизирующих нарушений на момент выписки из стационара.
Л И Т Е Р А Т У Р А
- Абрамова А.А. Вариабельность сердечного ритма у больных рецидивирующей формой фибрилляции предсердий: автореф. дис. …канд. мед. наук. – М., 2009. – 20 с.
- Белова А.Н. Шкалы, тесты и опросники в неврологии и нейрохирургии. – М., 2004. – С.224–225.
- Гончар И.А. Способ прогнозирования клинического течения некардиоэмболического ишемического инсульта на его ранней стадии: пат. 17226 С2 Респ. Беларусь МПК (2013), А 61В 5/00, А 61В 5/02; заявитель «РНПЦ неврологии и нейрохирургии» МЗ РБ. – № а20101345; заявл. 2010.09.16.
- Гончар И.А., Недзьведь Г.К., Фролов А.В. и др. Применение клинических и кардиоинтервалометрических предикторов для предупреждения прогрессирования инфаркта мозга: Инструкция по применению №150–1110 от 17.02.2011 / И.А. Гончар [и др.]. – Минск, 2011. – 16 с.
- Гончар И.А., Нечипуренко Н.И., Фролов А.В. и др. // Актуальные проблемы неврологии и нейрохирургии: сб. науч. тр. Вып. 16 / под ред. С.А.Лихачева. – Минск, 2013. – С.68–78.
- Гончар И.А., Фролов А.В., Гуль Л.М. // Актуальные проблемы неврологии и нейрохирургии: сб. науч. тр. Вып. 14 / под ред. С.А.Лихачева. – Минск, 2011. – С.43–54.
- Мрочек А.Г. и др. Диагностика и лечение фибрилляции предсердий: Национальные рекомендации. – Минск, 2010. – 84 с.
- 8. Смычек В.Б., Галиновская Г.Н., Усова Н.Н. // Междунар. неврол. журн. – 2013. – Т.4, №50. – С.76–81.
- Снежицкий В.А. и др. Вариабельность ритма сердца: применение в кардиологии: монография / под общ. ред. В.А.Снежицкого. – Гродно: ГрГМУ, 2010.– 212 с.
- Сулина З.А., Фонякин А.В. и др. Кардионеврология: Справочное руководство с обзором клинических исследований / под ред. З.А.Суслиной, А.В.Фонякина. – М., 2011. – 264 с.
- Сулина З.А., Фонякин А.В., Гераскина Л.А. и др. Практическая кардионеврологи. – М., 2010. – 304 с.
- Флейшман А.Н. Вариабельность ритма сердца и медленные колебания гемодинамики: нелинейные феномены в клинической практике. – 2-е изд., испр. и доп. – Новосибирск, 2009. – 194 с.
- Фролов А.В. Контроль механизмов адаптации сердечной деятельности в клинике и спорте. – Минск, 2011. – 216 с.
- Шандалин В.А. Прогностические факторы сердечно-сосудистых осложнений после ишемического инсульта: автореф. дис. …канд. мед. наук. – М., 2013. – 26 с.
- Alan S.G., Mozaffarian D., Roger V.L. et al. // Circulation. – 2013. – Vol.127. – P.6–245.
- Alcaraz R. A., Rieta J.J. // Nonlinear Analysis-real World Applications. – 2010. – Vol.11 (2). – P.1026–1035.
- Bamford J., Sandercock P., Dennis M. et al. // Lancet. – 1991. – Vol.337. – P.1521–1526.
- Gontschar I., Frolov A., Gul L. et al. // Neurologijos seminarai. – 2009. – N13, Priedas N 1 (6th Baltic Congress of Neurology (BALCONE) May, 2009, Vilnius: Final Program and Abstract Book). – S.51.
- Graff B., Gasecki D., Rojek A.// J. Hypertens.– 2013. – Vol.31 (8). – P.1629–1636.
- Ground M., Jauss M., Hammann G. et al. // Stroke.– 2013. – Vol.44. – P.3357–3364.
- Kernan W.N., Ovbiagele B., Black H.R. et al. // Stroke. –2014. – Vol.45. – P.2160–2236.
- Korperlain J.T., Sotaniemi K.A., Mäkikallio A. et al. // Stroke. – 1999. – Vol.30. – P.1008–1013.
- Mäkikallio A.M., Mäkikallio T.N., Korperlainen J.T. et al. // Neurology. – 2004. – Vol.62. – P.1822–1826.
- Oppenheimer S.M., Kedem G., Martin W.M. // Clin. Autonom. Research. – 1996. – Vol.6. – P.131–140.
- Pincus S.M. // Proc. Natl. Acad. Sci. USA. – 1991. – N88. – P.2297–2301.
- Tang S.C., Jen H.I., Lin Y.H. et al. // JNNP. – 2014. – Online First: 21.07.2014 / doi: 10.1136/jnnp-2014-308389.
Медицинские новости. – 2015. – №1. – С. 41-46.
Читайте также: Исследование клинической эффективности Рамиприла-СЗ при лечении гипертонической болезни на фоне ИБС, сахарного диабета, патологии почек









Комментировать