Бактериальный вагиноз: Этиология, патогенез, клиническая картина, диагностика и лечение. Применение иммунных препаратов солкотриховак и солкоуровак.
О.Л. Антонова, Д.А. Бессонов
Бактериальный вагиноз
Бактериальный вагиноз (БВ) — ранее известный как неспецифический вагинит или коринебактерильный вагинит, гарднерел-лезный или анаэробный вагинит — часто встречающееся состояние у женщин репродуктивного возраста, которое не является заболеванием, передающимся половым путем, но может быть связано с сексуальной активностью. По данным различных авторов, БВ выявляют у 1035% женщин.
Бактериальный вагиноз — это дисбактериоз вагинальной экосистемы, при котором лактобациллярная флора замещается анаэробными микробами. Бактериальный вагиноз может приводить к воспалительным процессам органов малого таза, а также ассоциируется с увеличением частоты передачи ВИЧ-инфекции.
У беременных женщин бактериальный вагиноз может быть причиной хориоамнионита, преждевременного разрыва плодных оболочек, преждевременных родов, послеродового эндометрита.
Этиология
До настоящего времени в значительной мере изучен и обозначен спектр так называемых БВассоциированных микроорганизмов. К ним относят: Gardnerella vaginalis, Prevotella bivial disiens, Bacteroides urealyticus, Prevotella corporis, Bacteroidiss levii, Fuso-bacterium nucleatum, представители рода Mobilincus, Peptostrepto-coccus, Ureaplasma ureallyticum, Mycoplasma hominis.
При БВ состав бактериального микробиоценоза увеличивается на несколько порядков, достигая 1010-1011 КОЕ/мл (массивное количество), при этом количество лактобактерий резко снижается (менее 30% от общего числа). При этом доминируют условно-патогенные микроорганизмы, и в большей степени — облигатно-ана-эробные виды.
Бактериальный вагиноз описан впервые в 1895 г. Doderlein и Krorig. Эти исследователи определили, что в развитии этого заболевания огромную роль играет анаэробная флора. В ранних исследованиях отмечалось, что грамположительные микроорганизмы доминируют среди нормальной вагинальной флоры. Позднее они стали известны как лактобациллы, которые исчезают и замещаются маленькими коккобациллами в случаях, когда женщина отмечает патологические изменения влагалищных выделений. В 1913 г. Куртис идентифицировал подвижные анаэробные бактерии, способствующие появлению таких выделений. К сожалению, работы этих исследователей не были восприняты. Состояния с патологическими влагалищными выделениями долгое время связывали с наличием трихомониаза, гонореи, неспецифического кольпита. Такая установка существовала до 1955 г., когда Gardner и Dukes установили, что причиной таких выделений можно считать сами бактерии влагалища. Это состояние стали описывать как вагинит, обусловленный Haemophilus vaginalis. Было обнаружено, что микроорганизм, названный Haemophilus vaginalis, не требует гемина или коэнзимов, необходимых для жизнедеятельности представителя рода Haemophilus. В 1963 г. микроорганизмы Haemophilus vaginalis были переименованы на Corynebacterium vaginalis. Дальнейшие изучения показали недостаток арабинозы в клеточной стенке микроорганизмов, классифицирующий род Corynebacterium. В 1980 г. Greenwood и Pickett выделили новый род Gardnerella и G. vaginalis как единственный типовой представитель этого рода.
Совсем недавно установлено, что обнаружение этого микроорганизма еще не характеризует состояние болезни. У пациенток с бактериальным вагинозом отмечается массивный рост анаэробной флоры, которая занимает доминирующее положение в экосистеме влагалища. Название синдрома изменилось на «анаэробный вагинит».
Чаще всего с БВ ассоциируют с Gardnerella vaginalis и Mobilincus.
Gardnerella vaginalis (ранее назывались Haemophilus vaginalis, затем Corynebacterium vaginalis), как наиболее частый этиологический агент бактериального вагиноза у женщин, — это полиморфная грамотрицательная, неподвижная коккобациллярная бактерия. Является факультативным анаэробом, ферментируется до уксусной кислоты, как конечного продукта, и не продуцирует цитохромоксидазу или каталазу. G. vaginalis не имеет капсулы, поэтому легко инактивируется при неблагоприятных воздействиях, обладает слабой иммуногенностью, не опсонируется антителами, не поддается фагоцитозу, не может ассоциироваться с макрофагами; не вызывает острой воспалительной реакции. G. vaginalis является представителем нормальной микрофлоры, и макроорганизм с ней не борется как с чужеродным инфекционным агентом. Однако при усиленной пролиферации G. vaginalis, на фоне снижения числа лактобактерий, она приобретает патогенные свойства.
Mobiluncus, выявленные в 1984 г. и описанные Куртисом, определяются у половины пациенток с БВ. Представители рода Mobilincus — неспорообразующие, подвижные, облигатно-анаэробные бактерии, грамнегативны, хотя строение стенки клеток, как и у гарднерелл, напоминает таковую у грамположительных бактерий, оксидаз- и каталазнегативны. Mobilincus mulieris длиннее (3-7 нм), чем Mobilincus curtisii (1,5 нм). Mobilincus curtisii устойчивы in vitro к нитроимидазольным агентам, тогда как Mobilincus mulieris чувствителен к ним, расщепляются аминопептидазами и декарбоксилазами и могут продуцировать триметиленамин при недостаточном содержании ферментов влагалища, обусловливающих симптомы этого состояния.
Mycoplasma hominis — присутствует у 24-75% женщин с БВ и у 13-22% без него.
Анаэробные бактерии — Bacteroides, Peptostreptococcus, Prevo-tellabivial, Prevotella corporis, Fusobacterium, Porphyromonas spp.
Патогенез
Существующие теории описывают бактериальный вагиноз не как инфекционное состояние, а изменение симбиотических взаимоотношений бактериальной флоры, включающей усиленный рост анаэробов. Термин «вагиноз» обозначает, что нет воспалительной реакции и количество лейкоцитов при этом во влагалище не увеличивается.
В норме экосистема влагалища достаточно сложна и легко изменяема. Многие факторы, в том числе и гормональные изменения в течение нормального менструального цикла, могут приводить к нарушениям взаимоотношений экосистемы влагалищного сообщества.
Факторы риска развития БВ: большое количество половых партнеров; ВМС.
БВ характеризуется замещением нормальной доминирующей пероксидобразующей лактофлоры анаэробной. При этом снижается количество перекиси водорода, действующей токсично в отношении Gardnerella, Mycoplasma и анаэробов. Влагалищный редокс-потенциал увеличивается от 100 до 200 ммоль, благодаря чему обеспечивается отличная среда для выживания анаэробов. При этом наблюдается пролиферация представителей рода
Porphy-romonas, Bacteroides, Gardnerella vaginalis, Micoplasma и Mobilun-cus, которые продуцируют катаболические ферменты и более специфические аминопептидазы, расщепляющие протеин и декарбоксилазные энзимы до аминов. Такой амин, как триметиламин, образующийся при декарбоксилировании, может первично отвечать за появление характерного «рыбьего» запаха, рН влагалища возрастает выше 4,5 за счет алкализации аминов.
Главный клинический симптом БВ — обильные, гомогенные, иногда пенистые выделения; объясняются продукцией фермента сиалидазы (вырабатываемым G. Vaginalis) или близкими к аналогичному ферменту некоторых патогенных бактерий. Пенистость обусловлена С02, образующимся при ферментации гиппурата глюкозы в уксусную кислоту. Реакция экзотермична, поэтому у больных иногда отмечаются зуд и жжение влагалища.
Клиника
Основной симптом БВ — обильные выделения с неприятным запахом, увеличивающиеся после половых сношений или при менструации. Около 50% женщин жалуются на зуд и жжение, а также неприятные ощущуения при половом акте. Однако более половины женщин с бактериальным вагинозом не имеют субъективных жалоб, поэтому для выявления БВ должны применяться объективные методы диагностики.
Диагностика
Лучшими критериями для постановки диагноза бактериального вагиноза, по данным CDC (Американский центр контроля по заболеваемости), является наличие 3-х из 4-х критериев Амсела:
- Обильные гомогенные выделения;
- рН влагалища > 4,4;
- «рыбий» запах при добавлении 10% -ного раствора КОН к влагалищным выделениям;
- обнаружение «ключевых» клеток во влагалищных мазках.
Влагалищные выделения — наличие обильных, гомогенных, имеющих запах рыбы выделений, прилипающих к стенке влагалища.
При бактериальном вагинозе рН влагалищной среды смещается в сторону щелочной реакции (рН >4,5).
Аминовый тест. При добавлении одной или двух капель 10%-ного раствора КОН к влагалищным выделениям возникает «рыбий» запах (аминовый запах).
Микроскопическое исследование направлено на выявление «ключевых» клеток как отличительного признака БВ. «Ключевые клетки» — это слущенные клетки вагинального эпителия, покрытые бактериями. Эта единственная характеристика может определять бактериальный вагиноз в 95% случаев.
Окрашивание мазков по Граму является объективным, проверенным методом с чувствительностью 62-100% и информативностью 76-100%. Этот метод позволяет дать оценку состояния микробиоценоза влагалища: количественно оценить общую микробную обсе-мененность вагинального биотопа, обозначить преимущество или отсутствие тех или иных бактериальных видов, установить наличие воспалительной реакции (количество лейкоцитов, фагоцитоз и его завершенность) и оценить состояние эпителиальных клеток, обозначить присутствие«ключевых» клеток.
В последнее время в российской и отечественной литературе указывается на использование для диагностики БВ таких методов как ПЦР, метод флюоресцирующих антител для определения ваги-нитассоциированных бактерий, газожидкостная хромотография для определения уровня янтарной кислоты, хромотография аминов. Однако эти методы диагностики являются трудоемкими и дорогостоящими, поэтому не могут быть широко использованы в повседневной практике.
Бактериальный вагиноз в акушерстве Бактериальные вагинозы наблюдаются у 20% беременных женщин. Предположение о том, что бактериальные вагинозы могут быть причиной осложнения беременности, главным образом основывалось на исследованиях по методу «случайконтроль», в которых более высокий уровень колонизации бактерий обнаруживается среди женщин с неблагоприятными исходами беременности по сравнению с теми, у которых беременность заканчивалась без осложнений.
Данные акушерского и эпидемиологического анамнеза, результаты микробиологического и патофизиологического исследования показали, что возникновение БВ обусловливает преждевременный разрыв околоплодных оболочек и преждевременные роды. Анаэробные бактерии выделяют фермент фосфолипазу, который, в свою очередь, способствует выделению арахидоновой кислоты и выработку простагландинов, это приводит к угрозе прерывания или развитию родовой деятельности на любом сроке беременности.
В эксперименте микроорганизмы, вызывающие БВ, вырабатывают различные ферменты, в том числе протеолитические (коллагеназу), которые способствуют проникновению бактерий в околоплодные оболочки и нарушению их целостности.
Одновременно происходит внутриутробное инфицирование плода при аспирации и заглатывании им инфицированных околоплодных вод. Проведенные в последние годы микробиологические и эпидемиологические исследования свидетельствуют о четкой связи между БВ и клиническими проявлениями интраамниальной инфекции с гистологически подтвержденным хориоамнионитом.
Частота послеродового эндометрита в 10 раз выше у пациенток с БВ по сравнению со здоровыми родильницами. В послеродовом периоде во влагалищной секреции преобладают анаэробы, к третьему дню после родов их число увеличивается в сотни раз в норме. У женщин с БВ количество анаэробов в несколько сотен раз выше, что и объясняет частоту возникновения у них послеродовых осложнений.
Лечение
Наиболее эффективными препаратами в лечении БВ признаны: метронидазол, клиндамицин, 2-ный% крем клиндамицина местно.
Стандартным этиотропным методом терапии БВ на 1-м этапе является использование препаратов, активных в отношении анаэробов (метронидазол, клиндамицин). Метронидазол относится к группе антибактериальных препаратов, которые содержат имида-зольное кольцо, применяется по 500 мг 2 раза в день в течение 7 дней, эффективность такой терапии составляет от 80 до 95% .
Есть данные, что пероральное применение 2 г метронидазола однократно также высокоэффективно, как и 5-7-дневные курсы (в 80-90% случаев). Однако столь большую дозу метронидазола можно применять лишь у ограниченного контингента женщин, не отягощенных сопутствующей патологией. Кроме того, метронидазол противопоказан при беременности. Достаточно высокая эффективность (90,8%) местного применения метронидазола в виде вагинальных свечей типа «Флагил» и другие.
Клиндамицина хлоргидрат имеет высокую антибактериальную активность и легко абсорбируется в кишечнике. Применяется по 300 мг 2 раза в день в течение 7 дней. Хотя более оправдано его интравагинальное применение в виде 2% -ного крема клиндамицина фосфата («Далацин») — аппликации 5,0 — 1 раз в сутки в течение 3-х дней. Механизм его действия связан с подавлением синтеза белка в микробной клетке за счет взаимодействия с 50% субедини-цами рибосом. Он оказывает бактериостатическое действие; в более высоких концентрациях в отношении некоторых микроорганизмов — бактерицидное. Препарат активен в отношении микроорганизмов, вызывающих бактериальный вагиноз: Gardnerella vaginalis, Mobiluncus spp., Bacteroides spp., Mycoplasma hominis, peptostreptococcus spp., и не активен в отношении Trihomonas vaginalis и Candida albicans.
При беременности в I триместре применение препарата возможно только при наличии несомненных показаний, во II и III триместрах гестации использование крема не ограничено. Эффективность такой терапии — 92-94%. При этом резко появляются побочные явления, такие как диарея, тошнота, рвота, головная боль, боль в животе, активизация грибковых инфекций. Влагалищный путь лечения БВ является лучшим из-за меньшей вероятности побочных реакций, а также возможности лечения беременных и женщин в период лактации.
Среди наиболее частых осложнений при использовании выше-обозначенных препаратов следует отметить кандидозный вагинит — у 6-16% . Для быстрого восстановления нормальной бактериальной микрофлоры влагалища и создания иммунитета успешно применяются эубиотики (ацилакт, бифиформ, бифидумбактерин, вагилак, гикофлор и др.) в виде интравагинальных тампонов или свечей.
С целью быстрого восстановления нормального уровня лакто-бактерий и предупреждения развития рецидивов у небеременных хорошо себя зарекомендовали иммунные препараты солкотрихо-вак и солкоуровак. Это вакцина из инактивированных штаммов лактобактерий, что позволяет снизить частоту рецидивов с 33,3 до 5,9%.
Вместе с тем при всех перечисленных выше методах лечения выявляется большое количество рецидивов, возникающих в разные сроки после лечения. Повторные БВ возникают приблизительно в 30% случаев в течение 3-х месяцев, у 70-80% пациенток — в течение 9 месяцев после завершения лечения.
Для местного лечение с успехом используют тержинан — комбинированный препарат, который благодаря своему многокомпонентному составу, является высокоэффективным средством. В его состав входят следующие вещества: тернидазол (200 мг), неомици-на сульфат (100 000 ЕД), преднизолон (3 мг). Тернидазол подавляет анаэробную инфекцию и Gardnerella vaginalis: неомицина сульфат — антибиотик широкого спектра действия, который эффективен в отношении ряда грамположительных (стафилококки, пневмококки и др.) и грамотрицательных (полиморфные бактерии, протей, синегнойная палочка) микроорганизмов; нистатин — противогрибковый препарат. Кортикостероидный компонент — преднизолон — является противоаллергическим средством, который оказывает местное противовоспалительное, иммуносупрессивное, антиэкссудативное действие, уменьшает зуд и снижает проницаемость капилляров. Противовоспалительные свойства тержинана усиливаются еще и за счет таких природных антисептиков, как масла гвоздики и герани, которые также входят в состав препарата. Эксципиент таблеток позволяет обеспечить целостность слизистой оболочки влагалища и физиологический уровень рН. Препарат может быть использован при беременности, накануне родов и в послеродовом периоде.
Для лечения бактериального вагиноза применяются также вагинальные таблетки флуомизин (деквалиния хлорид) фирмы «Меdinova» (Швейцария), которые обладают бактерицидным действием против грамположительных, грамотрицательных бактерий, грибов и простейших (Trichomonas vaginalis) и противовоспалительным эффектом. Содержание лактозы в таблетке флуомизина способствует размножению лактофлоры. Рекомендуется принимать по одной таблетке в день на протяжении 6 дней. Клинический эффект наступает через 24-72 часа. Нет сведений о резистентности микроорганизмов к деквалинию хлорида. Преимуществом данного препарата является возможность его применения при беременности и лактации.
Для восстановления флоры влагалища после антибиотикоте-рапии (как системной, так и местной) можно использовать препараты, содержащие лактобациллы — гинофлор («Medinova», Швейцария). Терапевтический эффект гинофлора заключается в восстановлении вагинальной флоры путем введения экзогенных лактобацилл и улучшение состояния вагинального эпителия путем введения экзогенного эстриола в минимальной дозе. Препарат принимают по 1-2 таблетки в день на протяжении 612 дней. Гинофлор можно использовать во время беременности и лактации.
Выводы
- Бактериальный вагиноз выявляют у 10-35% сексуально активных женщин.
- Бактериальный вагиноз — это дисбактериоз вагинальной экосистемы, при котором лактобациллярная флора замещается анаэробными микробами.
- Бактериальный вагиноз может приводить к воспалительным процессам органов малого таза, а также ассоциируется с увеличением частоты передачи ВИЧ-инфекции.
- У беременных женщин бактериальный вагиноз может быть причиной хориоамнионита, преждевременного разрыва плодных оболочек, преждевременных родов, послеродового эндометрита.
- Бактериальный вагиноз — дисбиотическое состояние, которое не является заболеванием, передающимся половым путем, но может быть причиной различных осложнений у женщин репродуктивного возраста.
- При БВ снижается количество лактобактерий (менее 30% от общего числа), доминируют условно-патогенные микроорганизмы и в большей степени — облигатно-анаэробные виды в концентрации 1010-1011 КОЕ/мл.
- При БВ нет воспалительной реакции и количество лейкоцитов не увеличивается, но характерны обильные гомогенные выделения, наличие «ключевых клеток», появление «рыбьего» запаха влагалищной среды после добавления 10%-ного раствора КОН и смещение рН влагалищного содержимого в щелочную сторону.
- Наиболее эффективными препаратами в лечении БВ признаны метронидазол, клиндамицин, 2%-ный крем клиндамицина (местно).
Генитальный кандидоз
Генитальный кандидоз — грибковое заболевание слизистых оболочек и кожи мочеполовых органов, вызываемое дрожжеподобными грибами рода Candida. Генитальные кандидозы широко распространены, протекают хронически и склонны к рецидивам. Приблизительно 75% женщин переносят в течение своей жизни по крайней мере один эпизод вульвовагинального кандидоза и у 40-50% из них развивается по крайней мере один рецидив. Генитальный кандидоз наиболее часто регистрируется в странах с жарким климатом и низкими санитарно-гигиеническими условиями.
Частота вульвовагинального кандидоза среди беременных составляет 118-120 случаев на 100 000 беременных женщин. Особое значение эта проблема приобретает в период гестации из-за возможного риска поражения плода. Беременные и родильницы с вагинальным кандидозом могут быть источником как внутриутробного, так и постнатального инфицирования новорожденных. За последние 20 лет частота кандидоза среди доношенных новорожденных возросла с 1,9 до 15,6% .
Этиология
85-90% высеваемой грибковой флоры при генитальном кандидозе принадлежит Candida albicans. Среди других представителей рода Candida встречаются Candida globrata и С. tropicalis, причем симптомы кандидоза они дают редко и проявляются, в основном, после антибактериального лечения. Кандидоз, вызванный С. krusei, tropicalis и globrata, в основном является внутрибольничной, нозокомиальной инфекцией.
Грибы рода Candida относятся к условнопатогенным микроорганизмам. Кроме сапорфитирования в окружающей среде на субстратах живой и неживой природы, они довольно часто выделяются с поверхности кожных покровов и слизистых оболочек человека. Это одноклеточные микроорганизмы, которые склоны к деморфизму. Молодые клетки имеют круглую или яйцевидную форму; зрелые — удлиненную или округлую. Истинного мицелия грибы не имеют, а образуют псевдомицелий. Нити его отличаются от истинного мицелия тем, что не имеют общей оболочки и перегородок, а состоят из тонких клеток. В местах прикрепления пседомицелия дрожжеподобные грибы обладают способностью отпочковывать бластоспоры, которые располагаются группами. Бластоспоры способны к размножению и распространению, но как фенотипичная форма ассоциированы с асимптомной колонизацией влагалища. Зрелая форма, напротив, продуцирует нити мицелия и определяется у женщин с симптомами кандидоза.
Подтверждено, что в ходе инвазии бластоспоры дрожжеподобных грибов кандида трансформируются в псевдомицелий.
Дрожжеподобные грибы являются аэробами. Оптимальная температура роста — 25-28 °С; патогенные для человека виды хорошо растут при 37 С, оптимум рН — 5,8-6,5, но грибы способны расти при кислых значениях среды (рН — 2,5-3,0). Грибы рода кандида имеют тропизм к тканям, богатым гликогеном. Установлено, что Candida albicans стимулирует выработку в организме человека различных антител — комплементсвязывающих и флюоресцирующих агглютинов.
Патогенез
Патогенез урогенитального кандидоза довольно сложен и недостаточно изучен. Важная роль в патогенезе этого заболевания отводится состоянию макроорганизма, его восприимчивости к дрожжеподобным грибам и возможности защитноадаптационных механизмов макроорганизма. Факторы, способствующие увеличению вагинальной колонизации Candida:
Экзогенные: механическая и химическая травма (в т. ч. частые половые сношения, ношение синтетического нижнего белья); повышенная влажность и температура окружающей среды; антибактериальная терапия; терапия кортикостероидами; терапия цитостатиками; прием оральных контрацептивов;
прием антидиабетических препаратов; патогенность и вирулентность дрожжеподобного гриба.
Эндогенные: беременность;
приобретенная или врожденная иммунная недостаточность;
нарушение обмена веществ (углеводного, белкового, жирового); гиповитаминозы; заболевания ЖКТ;
общие тяжелые заболевания, ослабляющие защитные свойства организма.
В развитии кандидоза различают следующие этапы: прикрепление (адгезию) грибов к поверхности слизистой оболочки с ее колонизацией; внедрение (инвазию) в эпителий; преодоление эпителиального барьера слизистой оболочки; попадание в соединительную ткань собственной пластинки; преодоление тканевых и клеточных защитных механизмов; проникновение в сосуды; гематогенная диссеминация с поражением различных органов и систем.
Фактор, способствующий колонизации Candida, — адгезивная способность эпителиальных клеток влагалища. Candida albicans в гораздо большей степени, чем все другие виды, обладает этой способностью.
Зрелые формы Candida обладают выраженной вирулентностью, которая определяется наличием различных протеиназ и других экскретируемых ферментов (фосфолипазы, гиалуронидаза, гемолитический фактор некоторых видов С. albicans и другие ферменты, патогенетическое значение которых пока точно не установлено). Действие этих литических ферментов направлено прежде всего на усиление адгезивной и пенетрационной способности грибов к различным тканям и субстратам организма, на достаточно активное сопротивление факторам защитной реакции организма на грибковую инфекцию. Есть сведения об участии протеиназ и фосфолипаз в модуляции иммунного ответа. Повреждение слизистой приводит к покраснению, десквамации или эксфолиации эпителиальных клеток влагалища.
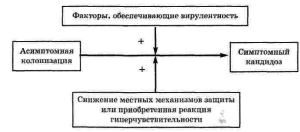
При вагинальном кандидозе инфекционный процесс чаще всего локализуется в поверхностных слоях эпителия влагалища. На этом уровне инфекция может персистировать длительное время ввиду возникновения динамического равновесия между грибами, которые не могут проникнуть в более глубокие слои слизистой оболочки, и макроорганизмом, сдерживающим такую возможность, но не способным полностью элиминировать возбудитель. Нарушение этого равновесия приводит либо к обострению заболевания, либо к выздоровлению или ремиссии. Механизм перехода непатогенных форм в патогенные можно изобразить схематично (рис.13.6).
Клиника
У женщин наиболее часто урогенитальный кандидоз локализуется в области наружных половых органов и влагалища.
Кандидозный вульвит — поражение дрожжеподобными грибами больших и малых половых губ, клитора, преддверия влагалища. У некоторых больных кандидозный вульвит распространяется на кожу пахово-бедренных складок и перианальной области.
Кандидозный вагинит — микотическое поражение не только слизистых влагалища, но и влагалищной части шейки матки.
Кандидозный вагинит и вульвит без поражения мочевыводящих путей характеризуется следующими симптомами: увеличение количества отделяемого из влагалища;
белые, «творожистые» выделения; зуд, жжение или раздражение в области наружных половых органов; усиление зуда в тепле (после сна или ванны); усиление зуда и болезненных ощущений после полового сношения.
В настоящее время не существует общепринятой клинической классификации урогенитального кандидоза.
По степени тяжести выделяют следующие клинические формы кандидозного вагинита: колонизация влагалища (кандидоносительство);
латентный вагинальный кандидоз; кандидозный вульвовагинит (легкая, средняя и тяжелая степень); персистирующий вагинальный кандидоз; рецидивирующий вагинальный кандидоз; хронический рецидивирующий кандидоз.
Редко Candida выделяются у пременопаузальных женщин, женщин в менопаузе
Под кандидоносителъством понимают полное отсутствие клинических проявлений при постоянном обнаружении в нативном препарате почкующихся клеток дрожжеподобного гриба и псевдомицелия в биологических средах.
Латентный вагинальный кандидоз — наличие одного эпизода клинического проявления кандидозного вагинита при отсутствии жалоб и клинических проявлений, при постоянном обнаружении в нативном препарате почкующихся клеток дрожжеподобного гриба и псевдомицелия в биологических средах.
Кандидозный вульвовагинит.
Легкая степень: жалобы на зуд и жжение, чаще в предменструальный период; отсутствие клиники вагинита; в нативном препарате определяются бластоспоры;
в биологических средах определяется культура.
Средняя степень:
жалобы на зуд и жжение, чаще в предменструальный период;
наличие клиники вагинита;
в нативном препарате определяются бластоспоры и/или псевдомицелии, неспецифическая флора, увеличение числа лейкоцитов;
в биологических средах определяется культура.
Тяжелая степень: жалобы на зуд, чаще в предменструальный
период; наличие клиники вагинита; в нативном препарате определяются псевдомицелии, увеличенное количество лейкоцитов;
в биологических средах определяется культура.
Персистирующий вагинальный кандидоз — несмотря на проводимое антимикотическое лечение персистирует вагинальный кандидоз.
Рецидивирующий вагинальный кандидоз — наступление рецидива спустя 4-12 недель после лечения.
Хронический рецидивирующий вагинальный кандидоз — после антимикотического лечения рецидив повторяется 4 раза в год.
Урогенитальный кандидоз при беременности
Высокая частота возникновения кандидоза в период гестации обусловлена рядом факторов: изменениями гормонального баланса; накоплением гликогена в эпителиальных клетках влагалища; иммуносупрессивным действием высокого уровня прогестерона и присутствием в сыворотке крови фактора иммуносупрессии, связанного с глобулинами. Уровень клинических атак повышается в III триместре беременности. Выделение Candida увеличивается в последней трети беременности, составляя, по данным различных авторов, 29,3-46-86%. Возрастание половых гормонов при беременности обеспечивает высокое содержание гликогена в эпителиальных клетках влагалища, что в свою очередь ведет к накоплению СО2 для роста и созревания Candida.
У беременных женщин кандидозный процесс чаще локализуется в области наружных половых органов и влагалища и характеризуется появлением белых с молочными бляшками вагинальных выделений с зудом и жжением в области наружных половых органов.
Врожденный и неонатальный кандидоз
Частота патологических состояний, обусловленных грибами рода Candida, неуклонно возрастает, начиная с конца 70-х годов XX в., и в настоящее время достигает 15-30% в общей этиологической структуре болезней новорожденных и детей первых месяцев жизни. Причем в 40-60% случаев кандидоз остается нераспознанным или поздно диагностированным заболеванием, что значительно усугубляет его прогноз. В ряде случаев отсутствие своевременной диагностики кандидоза становится причиной летального исхода.
К факторам риска развития кандидоза у новорожденных детей относятся:
- Кандидоз органов мочеполовой системы матери, особенно в последнем триместре беременности.
- Сахарный диабет во время беременности.
- Недоношенность.
- Наличие критических ситуаций (реанимация, ИВЛ более 5 дней, катетеризация центральных сосудов более 5-7 дней, парентеральное питание более 7 дней, полостные оперативные вмешательства и др.).
- Повторные (свыше 3-х) курсы антибактериальной терапии, особенно сочетанной, и интенсивная иммуносупрессивная терапия.
- Нейтропении и другие нарушения иммунитета (первичные и вторичные).
- Повышенная пролиферация грибов в кишечнике, т. е. кандидоносительство.
Первые два фактора играют большую роль в возникновении кандидоза, развивающегося в первые 2-3 недели жизни, особенно у доношенных новорожденных. Четвертая и пятая группа факторов риска имеет особое значение у недоношенных новорожденных; два последних фактора могут способствовать развитию инфекции во всех случаях.
При развитии кандидоза у новорожденных выделяются два его варианта: врожденный и постнатальный.
Под врожденным кандидозом следует понимать кандидоз, развившийся вследствие анте- или интранатального воздействия. Возможны следующие механизмы проникновения грибов к плоду:
через околоплодные воды, вследствие преждевременного разрыва плодных оболочек; через околоплодные воды, вследствие субклинического и самозаживляющего повреждения плодных оболочек; пенетрация гриба рода Candida через неповрежденные плодные оболочки.
При антенатальном воздействии клиническая картина патологических состояний проявляется либо сразу после рождения, либо в первые 3 дня после рождения. При попадании грибов рода Candida в амниотические воды происходит инфицирование кожи, пуповины, бронхов и желудочно-кишечного тракта плода (см. фото).
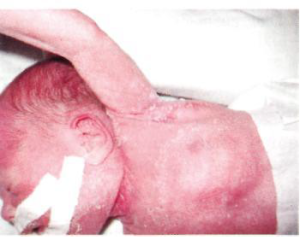
Следует отметить, что кандидозная инфекция, приобретенная внутриутробно, с клиническими проявлениями у новорожденного — явление редкое.
При интранатальном воздействии клиническая картина проявляется на 4-7-й день жизни при условии, что ребенку не проводится ИВЛ или другие манипуляции, способствующие быстрому и массивному постнатальному инфицированию.
Постнатальное инфицирование кандидоза реализуется после 8-10-го дня жизни при отсутствии провоцирующих факторов, или раньше — при массивном экзогенном инфицировании (нозокомиальный кандидоз). В возрасте более 2-3-х недель кандидоз может развиваться как в результате активации эндогенной флоры при воздействии провоцирующих факторов у кандидоносителей, так и при массивном экзогенном осеменении.
Диагностика
При диагностике кандидозного вульвовагинита необходимо учитывать, что грибы рода Candida являются представителем нормальной микрофлоры влагалища и могут не проявлять своих патогенных свойств. Поэтому выявление Candida при бактериоскопическом обследовании влагалища не говорит о наличии заболевания. Целесообразно учитывать наличие в нативном препарате вегетирующих форм дрожжеподобных грибов и обильный рост культуры (>103 КОЕ/мл).
Лабораторная диагностика кандидоза включает микроскопическое исследование нативного материала, посев материала из патологического очага на грибы. Некоторые авторы указывают на широкое использование в повседневной практике серологических, газохроматографических методов и определение генома ДНК методом ПЦР. Однако последние методы могут быть использованы в качестве скрининга, поскольку позволяют дифференцировать вегетирующие формы дрожжеподобных грибов и количество колоний культуры.
Материалом для исследования у женщины являются выделения из заднего свода влагалища или из пораженного участка слизистой наружных половых органов.
Материалом для исследования у новорожденного являются поврежденная кожа, слизистые оболочки и кал.
Лечение генитального кандидоза
Лечение больных с грибковыми заболеваниями (в частности, генитального кандидоза) должно быть комплексным и основано на принципах курсовой терапии. В него необходимо включить:
- Воздействие на этиологичекий фактор с помощью антимико-тических средств.
- Устранение или ослабление действия патогенных факторов.
- Уменьшение выраженности аллергии и аутоаллергии.
- Повышение специфической и неспецифической иммунологической реактивности организма.
Показания к проведению лечения:
- клинические признаки генитального кандидоза;
- выявление Candida spp. в исследуемом материале при микроскопии (псевдомицелий или почкующиеся клетки) или посев материала из пораженных участков слизистых оболочек.
Лечение острого кандидозного вульвовагинита может быть проведено с помощью препаратов местного действия (клотримазол, изоконазол, миконазол, эконазол, натамицин, леворин ) в течение 7-14 дней, а также применяют пероральные азолы (флуконазол — 150 мг однократно; итраконазол — по 200 мг два раза в сутки один день или 200 мг в сутки в течение трех дней; кетоконазол — по 200 мг два раза в сутки в течение 5-10 дней).
При эффективном лечении исчезновение клинических признаков кандидозного вульвовагинита происходит в течение 48-72 часов после начала лечения, эрадикация возбудителя — через 4-7 дней.
Устойчивость С. albicans, основного возбудителя острого кандидозного вульвовагинита, к азольным антимикотикам встречается редко. Если вульвовагинит обусловлен С. glabrata, С. krusei и другими видами, малочувствительными к азольным антимикотикам, показано применение полиеновых препаратов местного действия в течение 14 дней.
Наиболее частым возбудителем хронического рецидивирующего кандидозного вульвовагинита также является чувствительный к азолам С. albicans. При обострении хронического рецидивирующего кандидозного вульвовагинита, после устранения или снижения выраженности факторов риска, показано применение азольных антимикотиков для перорального приема или препаратов местного действия в течение 7-14 суток.
После достижения ремиссии возможно проведение противоре-цидивной поддерживающей терапии в течение б месяцев. В качестве поддерживающего лечения могут применяться флуконазол (150 мг перорально еженедельно), кетоконазол (100 мг ежедневно), итраконазол (100 мг через день) или ежедневное использование азольных препаратов местного действия.
Продолжительность лечения. Критерии завершения лечения: исчезновение клинических признаков. Продолжительность лечения острого кандидозного вульвовагинита — от 1 до 14 суток, в зависимости от применяемого антимикотика; при хроническом рецидивирующем варианте инфекции обычно требуется длительная поддерживающая терапия.
Лечение вагинального кандидоза при беременности
Лечение вагинального кандидоза во время беременности сопряжено с известными сложностями, связанными с решением вопроса о соотношении пользы того или иного медикаментозного препарата и риска воздействия на плод. Вместе с тем следует отметить, что вагинальный кандидоз часто сопровождается кишечным кандидозом. Поэтому лечение следует начинать с санации ротоглотки и желудочно-кишечного тракта, который может является основным эндогенным резервуаром дрожжеподобных грибов.
Препаратом, получившим широкое распространение в течение нескольких десятилетий, был полиеновый антибиотик нистатин, который относится по своей химической структуре к тетраенам. Нистатин препятствует массивному размножению кандид на слизистой оболочке желудочно-кишечного тракта, однако крайне важно знать, что биодоступность этого препарата не превышает 3-5%, т. е. нистатин не всасывается при приеме внутрь и, следовательно, не способен воздействовать на клетки грибов, находящиеся вне просвета кишечника. Одним из оптимальных вариантов является применение нистатина в виде вагинальных свечей по 100 000 ЕД на ночь в течение двух недель в сочетании с пероральным приемом до 2 млн ЕД в сутки.
При острой форме или первичном эпизоде вагинального кандидоза во время беременности, которая способствует рецидивирующему течению заболевания, для достижения пролонгированной ремиссии целесообразно комбинированное применение антимикотических препаратов. К таким препаратам относится полижинакс.
Полижинакс представляет собой препарат, представленный в форме гинекологической капсулы, которая содержит:
- два бактерицидных антибиотика: неомицин и полимиксин В. Неомицин является антибиотиком широкого спектра действия. Он активен в отношении большинства грамположительных и грамотрицательных кокков, грамположительных бацилл, таких как ко-ринебактерии, Staphylococcus aureus, M. tuberculosis, Enterococcus faecium и грамотрицательных бацилл, таких как Е. coli, Entero-bacter aerogenes, Haemophilus influenzae, Klebsiella pneumoniae, Proteus vulgaris.
Полимиксин представляет собой антибиотик полипептидной природы, который является активным в основном в отношении грамотрицательных бактерий, таких как Pseudomonas, за исключением Proteus и Neiserria. Кроме того, этот препарат является активным in vitro в отношении микоплазм (Ureaplasma ure-alyticum);
- нистатин — противогрибковый препарат, имеющий фунги-цидное и фунгистатичное действие, и является активным в отношении к дрожжеиодобным грибам Candida, Histoplasma, Coccidioides, Cryptocoques;
- деметикон (диметилполисилоксан) — является поверхностным активным веществом. Он выстилает поверхность слизистой оболочки влагалища в виде пленки и способствует проникновению антибактериальных препаратов в каждую ее складку.
В последние годы широкое распространение получил пимафуцин. Активной субстанцией препарата является натамицин, относящийся к полиеновым антибиотикам группы макролидов. Пимафуцин оказывает фунгицидное действие, так как нарушает целостность и функцию дрожжевых грибов, взаимодействуя со стеролами их клеточных мембран. Важно отметить, что в процессе лечения резистентность к препарату не развивается.
Преимуществом пимафуцина является разнообразие форм выпуска, поскольку клинический эффект противомикробного препарата местного действия находится в тесной зависимости от его лекарственной формы. Кроме того, это позволяет проводить комплексное лечение супружеских пар. Так, супруг может использовать пимафуцин в виде крема (30 г в тюбике) или в виде комбинированного препарата «Пимафукорт», состоящего из натамицина, сульфата пеомицина и гидрокортизона и выпускаемого в виде крема (15 г в тубах) и мази (15 г в тубах).
Натамицин, входящий в состав пимафуцина, не всасывается в системный кровоток при любом способе применения. Кроме того, пимафуцин не токсичен и не оказывает тератогенного воздействия на плод, может применяться как на протяжении всего периода беременности, так и в период лактации. При комплексном применении пимафуцина в виде кишечно-растворимых таблеток (по 100 мг) и вагинальных свечей (по 100 мг) и при одновременном использовании препарата мужем частота рецидивов заболевания снижается.
Обычная схема приема: по 1 вагинальной свече 1 раз в сутки в течение 6-9 дней с одновременным назначением кишечно-растворимых таблеток (по 1 таблетке 2-4 раза в сутки в течение 10-20 дней). Длительность приема таблеток должна превышать длительность курса лечения свечами на 7-10 дней. Следует отметить, что лечение преследует две цели: удаление очагов инфекции и восстановление нормальной микрофлоры. С этой целью после проведения основной терапии и, в случае отсутствия грибов при контрольном исследовании мазков по Граму, назначают свечи с ацилактом, ациполом или лактобактерином в течение 10-14 дней.
Тержинан — препарат первого выбора для лечения бактериальных, грибковых и паразитарных вагинитов и кольпитов. В его состав входят: тернидазол (200 мг), неомицина сульфат (100 000 ЕД), нистатин (100 000 ЕД), преднизолон (3 мг). Тернидазол обладает подавляющим действием на анаэробную инфекцию и Gardnerella vaginalis, неомицина сульфат — на полиморфные бактерии (кишечная палочка, протей, синегнойная палочка), нистатин — на грибы, преднизолон оказывает противоаллергическое действие. Интравагинальный способ введения тержинана хорош тем, что многослойный плоский эпителий влагалища обладает минимальной всасывающей способностью, что исключает повреждающее действие лекарственного вещества на плод. Данное положение подтверждается исследованиями Американского центра генетических исследований, в которых установлено, что при применении per os 1 г метронидазола через 2 часа в крови пациенток обнаруживается 100% вводимой дозы. При вагинальном применении — только 2% . Тержинан особенно эффективен у беременных с отягощенным аллергическим анамнезом, т. к. вульвовагинит, имея аллергическую природу, хорошо поддается действию преднизолона.
Для местного лечения кандидоза можно использовать вагинальные таблетки флуомизин, а для восстановления флоры влагалища после антибиотикотерапии можно использовать препараты, содержащие лактобациллы (Гинофлор). Гинофлор можно использовать во время беременности и лактации.
Препарат назначают следующим образом: по одной вагинальной таблетке перед сном. Продолжительность непрерывного лечения — 10 дней. В случаях сопутствующего подтвержденного микоза продолжительность лечения увеличивают до 20 дней. Перед введением во влагалище таблетку смачивают в воде 20-30 С и вводят глубоко во влагалище на всю ночь.
Учитывая снижение иммунореактивности организма, особенно при рецидивирующем течении заболевания, целесообразны инфузии человеческого иммуноглобулина — по 25 мл трижды через день или внутримышечные инъекции имунофана — по 1,0 мл каждые 2 дня (на курс — 10 инъекций). Методом выбора является применение комплексного иммуноглобулинового препарата в виде свечей. С целью нормализации интерферонового статуса и повышения механизмов внутриклеточной защиты показано назначение виферона в свечах — по 500 000 ME дважды в день в течение 10 дней. Определенные сложности представляет лечение при кандидоноси-тельстве, при котором имеет место периодическая манифестация клинических проявлений заболевания и возрастает риск вертикальной передачи дрожжеподобных грибов от матери к плоду. Применение пимафуцина в комбинации с противогрибковыми препаратами из группы имидазолов (клотримазол, гинодактарин, гинодактанол, гинопеварил, гинотравоген) приводит к синергическому эффекту, что особенно актуально при рецидивирующих формах вагинального кандидоза и кандидоносительстве. При этом следует отметить, что назначение препаратов группы имидазолов в период беременности нежелательно.
Одновременное лечение партнера, даже при отсутствии клинических проявлений заболевания, повышает эффективность терапии. Учитывая частые закономерные рецидивы вагинального кандидоза во время беременности, необходимы повторные курсы лечения в целях предупреждения внутриутробного инфицирования плода.
Лечение кандидоза у новорожденныхЛечение кандидоза кожи Локализованная форма кандидоза кожи
Местная терапия противогрибковыми мазями: клотримазол, изоконазол (травоген), кетоконазол (низорал), натамицин (пимафуцин).
В случаях затяжного течения (более 10-14 дней) — назначение системного антимикотика флуконазола (дифлюкан внутрь в суспензии или капсулах, форкан, медофлюкон). Суточная доза — 5-8 мг/кг массы тела однократно в сутки. Длительность курса определяется клинической картиной. Препарат отменяют через 1-2 дня после исчезновения клинических проявлений. Флуконазол назначают в виде монотерапии или в сочетании с местными антимикотиками.
Распространенный кандидоз кожи
Флуконазол (дифлюкан в суспензии или капсулах, форкан, медофлюкон). Суточная доза — 8-10 мг/кг массы тела однократно в сутки. Длительность курса определяется клинической картиной. Флуконазол назначают в сочетании с местными антимикотиками.
Кандидоз видимых слизистых оболочек Локализованный кандидоз слизистой полости рта
Обработка пораженных участков слизистой оболочки 0,1% -ным раствором гексорала или 2% -ным раствором бикарбоната натрия 2-3 раза в сутки.
При рецидивировании — назначение внутрь флуконазола (дифлюкан в виде суспензии или в капсулах, форкан, медофлюкон). Суточная доза — 5-8 мг/кг массы тела однократно в сутки.
В амбулаторных условиях или в стационаре у новорожденных без дополнительных факторов риска возможно применение нистатина. Доза — 75 000100 000 ЕД/кг в сутки в 3-4 приема.
Распространенный кандидоз слизистой оболочки полости рта
Флуконазол внутрь (дифлюкан в виде суспензии или в капсулах, форкан, медофлюкон) в суточной дозе 8-10 мг/кг массы тела однократно в сутки. В амбулаторных условиях и в стационаре у новорожденных без дополнительных факторов развития кандидоза возможно применение нистатина внутрь из расчета 75 000-100 000 ЕД/кг в сутки в 3-4 приема.
Местное лечение слизистых — орошение 0,1% ным раствором гексорала или 2% -ным раствором бикарбоната натрия.
Кандидоз видимых слизистых оболочек мочеполовых органов
Местная терапия антимикотическими кремами: 1%ный клот-римазол, 1%-ный травоген.
Системный кандидоз
Кандидоз желудочно-кишечного тракта
При изолированном и нетяжелом кандидозе ЖКТ возможно использование флуконазола и нистатина. Флуконазол (дифлюкан, форкан, медофлюкон) назначается внутрь в суточной дозе 8-10 мг/кг массы тела однократно в сутки.
Нистатин — 75 000-100 000 ЕД/кг в сутки в 3-4 приема.
Длительность курса терапии определяется клинической картиной, но не менее 10-14 дней. У детей группы риска, при тяжелом кандидозе ЖКТ, при кандидозе ЖКТ в сочетании с кандидозом кожи и/или слизистых показано назначение флуконазола внутрь или внутривенно (при тяжелой степени поражения). Возможно использование ступенчатой терапии: в течение первых 3-5 дней внутривенное введение флуконазола (дифлюкана), затем перевод на введение препарата внутрь в той же дозе, Суточная доза — 8-10 мг/кг массы тела однократно в сутки.
Длительность курса терапии определяется клинической картиной, но не менее 10-14 дней.
Одновременно проводится коррекция нарушений микрофлоры кишечника назначением, по соответствующим показаниям, преби-отиков и пробиотиков.
Кандидоз дыхательной и мочеполовой систем
Лечение следует начинать с назначения флуконазола (дифлюкан) внутрь или внутривенно (в зависимости от тяжести заболевания). Суточная доза — 10-12 мг/кг массы тела однократно в сутки. При использовании ступенчатой терапии длительность внутривенного введения препарата может составлять от 7 до 14 дней. Общий курс терапии — не менее 2-х недель.
При неэффективности терапии флуконазолом в течение 5-7 дней, а также при процессе, обусловленном грибами С. krusei и др. видами грибов, резистентных к флуконазолу, показано назначение амфотерицина В или амбизома.
Амфотерицин В вводится внутривенно капельно, однократно в сутки, 1 раз в 2-3 дня. При тяжелом заболевании — ежедневно.
Начальная доза амфотерицина В составляет 100 ЕД/кг массы тела. При необходимости (тяжелое системное поражение органов) доза препарата постепенно увеличивается ее повышением на 50-100 ЕД/кг/сутки до 250-500 ЕД/кг/сутки.
Амбизом является менее токсичной формой амфотерицина В. Он показан у пациентов с выраженной почечной недостаточностью и нарушением функции печени. Амбизом вводится внутривенно капельно. Суточная доза препарата составляет 1-3 мг/кг в зависимости от тяжести заболевания.
Длительность курса лечения амфотерицином В (амбизомом) определяется клиническими проявлениями заболевания, но составляет не менее 2-х недель.
Висцеральный и генерализованный кандидоз Кандидоз центральной нервной системы
Лечение кандидоза ЦНС основано на назначении флуконазола (дифлюкана). Препарат назначают внутривенно в суточной дозе 12-15 мг/кг массы тела однократно в сутки. Внутривенное введение препарата продолжается 10-14 дней, затем переходят на введение препарата внутрь в той же дозе. Длительность курса терапии определяется клинической картиной и результатами исследования ликвора.
При неэффективности терапии дифлюканом в течение 7-10 дней, при патологическом состоянии, вызванном устойчивыми к флуконазолу штаммами Candida, показано назначение амфо-терицина В (внутривенно и интратекально). Амфотерицин В вводится внутривенно капельно 1 раз в 2-3 дня в зависимости от переносимости препарата.
Начальная доза для амфотерицина В составляет
100 ЕД/кг массы тела, затем ее повышают на 50100 ЕД/кг/сутки и доводят до 500-1000 ЕД/кг/сутки. Препарат разводят в 5%-ном растворе глюкозы и вводят капельно со скоростью 0,2-0,4 мг/кг/час.
Амфотерицин В в незначительном количестве проходит через гематоэнцефалический барьер. В связи с этим при кандидозе ЦНС внутривенное введение препарата сочетают с интратекальным введением (во время люмбальной, цистернальной или вентрику-лярной пункций). Разовая доза для интратекального введения составляет 125-250 ЕД (или 0,025-0,1 мг).
Для снижения токсического эффекта амфотерицина В возможно сочетанное использование флуконазола с амфотерицином В, последний при этом назначается в меньшей дозе.
Другие проявления висцерального кандидоза и генерализованный кандидоз
Показано назначение флуконазола (дифлюкана). Препарат вводится внутривенно в суточной дозе 15 мг/кг массы тела однократно в сутки. Курс составляет не менее 14-28 дней, при необходимости после этого возможен переход на применение препарата внутрь.
При неэффективности терапии флуконазолом в течение 7-10 дней, при заболеваниях, вызванных резистентными к флуконазолу штаммами грибов, показано назначение амфотерицина В или амбизома.
Начальная доза амфотерицина В составляет 100 ЕД/кг массы тела, затем ее повышают на 50-100 ЕД/кг/сутки и доводят до 500-1000 ЕД/кг/сутки. Препарат вводят внутривенно капельно в 5% -ном растворе глюкозы.
Амбизом показан пациентам с выраженной почечной и печеночной недостаточностью. Препарат вводят внутривенно, ежедневно. Суточная доза составляет 1-3 мг/кг (до 5 мг/кг) в зависимости от тяжести заболевания.
Антимикотическая терапия должна сочетаться с инфузионной и другой патогенетической терапией.


Профилактика кандидоза у новорожденных
Проведение профилактики показано в следующих случаях:
- длительное и особенно комбинированное применение антибактериальной терапии (более 2-3-х недель);
- длительное проведение парентерального питания (более 7 дней); длительное проведение ИВЛ (более 5 дней); катетеризация центральных сосудов (более 5-7 дней);
- при проведении хирургических вмешательств; при нейтропении (число нейтрофилов < 1,5 х109/л).
С целью профилактики показано назначение внутрь флуконазола из расчета 5-8 мг/кг массы тела в сутки.
При проведении длительной антибактериальной терапии в амбулаторных условиях, особенно при назначении полусинтетических пенициллинов и цефалоспоринов, возможно использование как препаратов флуконазола (дифлюкан, форкан, медофлюкон) из расчета 5-8 мг/кг массы тела в сутки, так и нистатина из расчета 75 000-100 000 ЕД/кг в сутки в 3-4 приема. Длительность профилактического курса определяется длительностью антибактериальной терапии.
К профилактике кандидоза новорожденных относятся также мероприятия по санации беременных женщин.
Выводы
- Генитальный кандидоз — грибковое заболевание слизистых оболочек и кожи мочеполовых органов, вызываемое дрожжеподобными грибами рода Candida.
- Беременные и родильницы с вагинальным кандидозом могут быть источником как внутриутробного, так и постнатального инфицирования новорожденных.
- За последние 20 лет частота кандидоза среди доношенных новорожденных возросла с 1,9 до 15,6% .
- Грибы рода Candida относятся к условнопатогенным микроорганизмам.
- Важная роль в патогенезе генитального кандидоза отводится состоянию макроорганизма, его восприимчивости к дрожжеподобным грибам и возможности защитноадаптационных механизмов макроорганизма.
- Кандидоз имеет характерные симптомы: зуд, жжение, покраснение слизистой, может приводить к осложнениям течения беременности, родов, периода новорожденности.
- При развитии кандидоза у новорожденных выделяются два его варианта: врожденный и постнатальный.
- Для диагностики кандидоза целесообразно учитывать наличие в нативном препарате вегетирующих форм дрожжеподобных грибов и обильный рост культуры (> 103 КОЕ/мл).
- Материалом для исследования у женщины являются выделения из заднего свода влагалища или из пораженного участка слизистой наружных половых органов.
- Материалом для исследования у новорожденного являются поврежденная кожа, слизистые оболочки и кал.
- Лечение больных с кандидозными поражениями должно быть комплексным и включать в себя: воздействие на этиологический фактор с помощью антимикотических средств; устранение или ослабление действия патогенных факторов; уменьшение выраженности аллергии и аутоаллергии.
ЛИТЕРАТУРА
- Айзятулова Е.М. Діагностика та лікування гормональних порушень у жінок з безплідністю, які перенесли хламідійну інфекцію: Автореф. дис. … канд. мед. наук. — Харків, 2001 — 20 с
- Адаскевич В.П. Заболевания, передаваемые половым путем. — 2 изд., испр. и доп. — Витебск: Изд-во Витебского медицинского института, 1997. — 310 с.
- Аковбян ВА., Борисенко К.К. и др. Современная терапия болезней, передаваемых половым путем: Тез. докл. VII Рос. съезда дерматологов-венерологов. — Казань, 1996. — Ч.
- — 126 с.
- Антонова О.Л. Рання діагностика та профілактика невиношування вагітності на фоні урогенітальних інфекцій та дизбіозів піхви / Автореф. дис. … канд. мед. наук. — К., 2003. — 20 с
- Антоньев АА., Баткаев ЭА. и др. К вопросу о диагностике и лечении урогенитального хламидиоза / Диагностика, терапия и профилактика заболеваний, передающихся половым путем. — Свердловск, 1988. — С.120128.
- Баннікова Т.В. Профілактика і лікування запальних захворювань генітального тракту у жінок фертильного віку, які мешкають у промисловому регіоні / Автореф. дис. … канд. мед. наук. — Одеса, 2000. — 20 с
- Вдовиченко Ю.П., Щербинская Е.С. Клиникоиммунологические аспекты хламидийной и цитомегаловирусной инфекции в акушерской практике // Здоровье женщины. — 2001. — № 1. — С. 21-26.
- Врожденные, перинатальные и неонатальные инфекции/ Пер. с англ.; Под ред. А. Гриноу, Дж. Осборна, Ш. Сезерленд. — М.: Медицина, 2000. — 288 с.
- Гомберг МА., Есаулова И.Н., Гладкова Н.С. Распространенность хламидийной и уреаплазменной инфекции среди женщин детородного возраста с воспалительными заболеваниями тазовых органов // Вестник дерматологии. — 1988. — № 9. — С. 37-39. Гриноу Анна, Осборн Джон, Сазэленд Шина. Врожденные перинатальные и неонатальные инфекции. — М.: Медицина, 2000. —340 с.
- Громыко AM. Эпидемия заболеваний, передаваемых половым путем, в странах Восточной Европы // ЗППП. — 1996. — № 6. — С. 22-25.
- Диденко Л.В., Коломейцева А. Г., Скрипниченко Н. Я., Лисяна Г. А. и др. Коррекция микробиоценоза половых путей у беременных с лейомиомами с использованием тержинана // Репродуктивное здоровье женщины. — 2003. — №2. — С. 17-22.
- Дмитриев ГА., Сючь Н.И., Латыпова М. Ф. и др. Лабораторная диагностика урогенитального трихомониаза // ИППП. — 2001. — № 6. — С. 22-25. ДюдюнАД., Полион Н.Н., Казачинская А.Т. Комплексное лечение тор-пидных форм урогенитального трихомониаза // Здоровье женщины. — 2005. — № 1 (21). — С. 168-170.
- Іванюта СО. Тиберал в подоланні резистентності при лікуванні трихо-моніаза у жінок //Здоровье женщины. — 2005. — № 2 (22). — С. 87-88.
- Иотенко БА. Профілактика і лікування звичного невиношування вагітності на фоні урогенітальної хламідійної інфекції: Автореф. дис. канд. мед. наук. — К., 1995. — 20 с
- Адаскевич В.П. Инфекции, передаваемые половым путем: Руководство для врачей. — М.: Медкнига, 1999. — 248 с.
- Жунусов Г.Б.. Каральник Б.В., Бондарь Н.Р. и др. Методы лабораторной диагностики гонореи по определению антигенсвязывающих лимфоцитов // Вестник дерматологии и венерологии. — 2001. — № 5. — С, 49-51.
- Кисина В.И. Урогенитальный трихомониаз: проблемы и пути их решения // ИППП. — 2001. — № 6. — С. 14-17.
- Краснополъский В.И. Патология влагалища и шейки матки. — М.: Медицина, 1997. — С.105-111. Кунцевич Л.Д., Мишанова В.Р., Жукова Г.И. Неовир в комплексной терапии гонококковой инфекции у женщин // Вестник дерматологии и венерологии. — 2002. — № 6. — С. 39-41.
- Лактобациллы в акушерстве и педиатрии / Под ред. В.Е. Радзинско-го. — Ашгабат, 1994. — 102 с.
- Лысенко О.В., Петрова Ю.Л. Некоторые аспекты антибактериальной терапии хламидийной инфекции: Тез. докл. VII Рос. съезда дерматол.-ве-нерол. — Казань, 1996. — 434с.
- Мавров И.И. Нарушение репродуктивной функции у больных гени-тальным хламидиозом и уреаплазмозом // Вестник дерматологии и венерологии. — 1991. — № 11. — С. 72-75.
- Савичева А.М., Чхартишвили и др. Применение джозамицина (виль-прафена) при лечении генитальной хламидийной инфекции у беременных женщин // ИППП. — 1999. — № 4. — С. 35-37.
- Севастьянова Т.В. Діагностика, перебіг та лікування генітального хла-мідіозу у жінок з урахуванням імунного статусу: Автореф. дис. … канд. мед. наук. — К., 2001. — 20 с
- Современные вопросы инфектологии в акушерстве и гинекологии / Под ред. проф. В.К. Чайки: Учеб. пособие. — Донецк,1998. — С. 36-47. Мавров 1,1., Бєлозорова О.П., Тацькая Л.С. та ін. Уніфікація лабораторних методів дослідження: Посібник для лікарів-лаборантів. — Харків: Факт, 2000. — 120 с.
- Цинзерпина ВА., Мельникова Б.Ф. Перинатальные инфекции (вопросы патогенеза, морфологической диагностики и клиники морфологических сопоставлений): Практическое руководство. — СПб.: ЭЛБИ, 2002.
- Akira S., Takeda К., KaishoT. Toll-like receptors: critical proteins linking innate and acquired immunity // Nat. — 2001. — Vol. 2. — P.675-680.
- BabovicVuksanovic D., Snow K., Ten R.M. Mannose-binding lectin (MBL) deficiency.Variant alleles in a midwestern population of the United States // Ann Allergy Asthma Immunol. — 1999. — N 82. — P. 134-138.
- Babula , Lazdane G„ Kroica J. et al. Relation between recurrent vulvovaginal candidiasis, vaginal concentrations of mannose-binding lectin, and a mannose-binding lectin gene polymorphism in Latvian Women // Clin. Infect. Dis. — 2003. — N 37. — P. 733-737.
- Bartlett J.G., Moon N.E., Goldstein P.R. et al. Cervical and vaginal bacterial flora: ecologic niches in the female lower genital tract /,/ Am. J. Obstet. Gynecol. — 1978. — N 130. — P. 653-658.
- Bowden F.J., Garnett G.P. Why is Trichomonas vaginalis ignored? // Sex. Inf. — 1999. — Vol. 75 (6). — P. 368-372.
- Breloer M., Dorner В., More S.H. et al. Heat shock proteins as danger signals: eukaryotic Hsp60 enhances and accelerates antigenspecific IFN-gamma production in T cells // Eur. J. Immunol. — 2001. — N 31. — P. 2051-2059.
- Carson H.M., LaPoint P.G., Monif G.R.G. Interrelationships within the bacterial flora of the female genital tract // Infect. Obstet. Gynecol. — 1997. — N 5. — P. 301-305.
- Centers for Disease Control and Prevention. 2002 Guidelines for treatment of sexually transmitted diseases — MMWR. — 1998. —Vol. 51 (RR-6).1200-1202.
- Chaisilwattana P., Monif G.R.G. In vitro ability of the group В streptococci to inhibit grampositive and gram-variable constituents of the bacterial flora of the female genital tract // Infect. Obstet. Gynecol. — 1995. — N3. — P. 91-94.
- Cole A.M., Gam T. Human antimicrobial peptides: analysis and application // Techn/ques. — 2000. — Vol. 29. — P. 822-831.
- Congenital and Perinatal Infections: Prevention, Diagnosis and Treatment / Mari-Louise Newell. — Cambridge University Press, 2000. — 343 p.
- Danders G.G.G. Treatment of sexually transmitted diseases in pregnant women // Drugs. — 2000. — Vol. 59. — P. 480-484.
- Draper D.L., Landers D.V., Krohn MA. et al. Levels of vaginal secretory leukocyte protease inhibitor are decreased in women with lower reproductive tract infections // Am. J. Obstet. Gynecol. — 2000. — N 183. — P. 1243-1248.
- Edwards R.K., Clark P., Duff P. Intrapartum antibiotic prophylaxis Positive predictive value of antenatal group В streptococciv cultures and antibiotic susceptibility of clinical isolates // Obstet. — 2002. — N 100. — P.540-545.
- Edwards R.K., Clark P., Sistrom C.L., Duff P. Intrapartum antibiotic prophylaxis I: relative effects of recommended antibiotics on gramnegative pathogens // Obstet. — 2002. — N 100. — P. 534-538.
- Francis J. Bowden, Geoffery P. Garnett. Trichomonas vaginalis epidemiology: parameterising and analyzing a model of treatment inventions // Sex. Inf. — 2000. — Vol.— P. 248-256.
- Gopplerud СР., Ohm M.J., Galask R.P. Anaerobic and aerobic flora of the cervix during pregnancy and the puerperium // Am. J. Obstet. — 1976. — N 126. — P. 858-863.
- Gorbach S.L. Menda K.B. Thadepalli H., Keith L. Anaerobic microflora of the cervix of healthy women // Am. J. Obstet. — 1973. — N 117. — P.1053-1059.
- Gorbach S.L. Probiotics and gastrointestinal health // Am. J. Gastroenterol. — 2000. — N 95 (Suppl). — P. 2-8.
- Gigante J., Hickson G.B., Entman S.S., Oquist N.L. Universal screening for group В streptococcus: Recommendations and obstetricians’ practice decisions /7 Obstet. — 1995. — N 85. — P. 440-444.
- Hancock R.E.W. Cationic peptides: effectors in innate immunity and novel antimicrobials // Lancet. — 2001. — N 1. — P. 156-64.
- Infectious Diseases in Obstetric and Gynecologic / Gilles R.G. Monif David A. Baker. — 2004. — 760 p.
- Jejeebhoy, S.J., MA. Koenig, and C. Elias (eds). Reproductive Tract Infections and Other Gynaecological Disorder: A Multi-Disciplinary Research Approach. — Cambridge: Cambridge University Press, 2003.— 207 p.
- Larsen В., Monif G.R.G. Understanding the bacterial flora of the female genital tract // Clin.Infect. Dis. — 2001. — N 32. — P. 69-79.
- Mestecky J., Russell M.W. Induction of mucosal immune responses in the human genital tract // FEMS Immunol. Microbiol. — 2000. — N27. —P. 351-5.
- Obstetric and Gynecologic Infectious Disease/ Joseph G. Pastorek. — New York: Raven Press, 1993. — 798 p.
- Rchorova R.N., Anderson D.J. Differential expression of immuno-biologi-cal mediators by immortalized human cervical and vaginal epithelial cells // Biol. — 1999. — N 60. — P. 508-514.
- Van Dyck E., Meheus A. Z., Plot P. Laboratory diagnosis of sexually transmitted diseases. —WHO (Geneva), 1999. — 135 p.







Комментировать