Оценка эффективности комплексной профилактики диабетической остеопатии у пациентов молодого возраста с сахарным диабетом 1-го типа. Результаты проведенных исследований.
Шепелькевич А.П., Холодова Е. А., Кравчук В.Г. , Жалейка Е.В., Богомазова Е.В., Тол- качев Ю.В.
Белорусский государственный медицинский университет Республиканский центр медицинской реабили- тации 1-я городская клиническая больница г. Минска Республиканская клиническая больница медицинской реабилитации
Изучение особенностей формирования, диагностики и разработки лечебно-профилактических мероприятий при вторичных формах остеопороза, в том числе обусловленных эндокринопатиями, по мнению экспертов ВОЗ, входит в приоритетные научные направления в области остеопороза [1].
Наиболее социально-значимые исходы остеопороза – переломы шейки бедра и позвоночника [2–6]. Резуль- таты эпидемиологических исследований последних лет свидетельствуют о высоком риске переломов осево- го скелета у пациентов с сахарным диабетом (СД) 1-го типа [4, 7–14].
Одним из доказанных предикторов остеопоротических переломов является низкая костная плотность [1, 4, 15–18]. Исследования последних лет свидетельствуют о снижении минеральной плотности кости (МПК) бо- лее чем у 50% пациентов с сахарным диабетом 1-го типа [19–26]. Разработка комплексных мероприятий по профилактике потерь костной массы у пациентов с СД 1-го типа – актуальная задача современной диабетологии [1, 4, 24–26].
Цель исследования – оценка эффективности комплексной профилактики диабетической остеопатии у па- циентов молодого возраста с сахарным диабетом 1-го типа.
Материалы и методы
Клиническое рандомизированное проспективное исследование проводилось на базе кабинета остеопороза отделения эндокринологии УЗ «Республиканская больница медицинской реабилитации», УЗ «1-я городская клиническая больница» г. Минска, ГУ «Республиканский центр медицинской реабилитации и бальнеолече- ния». В ходе исследования проводилась оценка эффективности комплексной профилактики диабетической остеопатии у 55 пациентов молодого возраста с са 1-го типа.
Критерии исключения из исследования: мужчины старше 45 лет; женщины в возрасте старше 40 лет; жен- щины в менопаузе; наличие выраженных стадий хронических осложнений сахарного диабета 1-го типа (диабетическая нефропатия с наличием хронической почечной недостаточности, проведение программного гемодиализа, перитонеального диализа; нейропатическая форма синдрома диабетической стопы с остеоарт- ропатией); наличие заболеваний и синдромов, ассоциированных со снижением минеральной плотности кости; прием препаратов, оказывающих влияние на состояние костного метаболизма; женщины в период беременности, лактации.
Проведено комплексное клиническое обследование пациентов с оценкой антропометрических данных (рост, вес, индекс массы тела – ИМТ), анкетирование (оценка питания, наличие нежелательных явлений). В ходе оценки суточного потребления кальция и витамина D с продуктами питания пациент совместно с врачом- исследователем заполнял индивидуальный вопросник «Обследование состояния питания населения Респу- блики Беларусь» (согласно Приложению 2 к приказу Министерства здравоохранения Республики Беларусь от 13 декабря 2000 г. № 580-А), учитывающий прием продуктов питания в течение последних трех суток. Количественный и качественный состав продуктов питания оценивался согласно альбому порций продуктов и блюд.
Биохимический анализ крови (мочевина, креатинин, общий белок, холестерин, триглицериды, общая щелоч- ная фосфатаза (ЩФ), кальций общий (Са общий), фосфор неорганический (Р неорг.) выполнялся на автома- тическом многоканальном биохимическом анализаторе HITACHI 911 производства «Roche Diagnostics» (Ге- рмания) с использованием реагентов «Cormay» (Польша).
Определение скорости клубочковой фильтрации (СКФ) проводилось по формуле MDRD (the Modification of Diet in Renal Disease) для мужчин и женщин [27].
Оценка компенсации углеводного обмена проводилась на основании данных гликированного гемоглобина (НвА1с). Исследование показателей НвА1с выполнялось методом высокоэффективной жидкостной хромато- графии на автоматизированном анализаторе D10 для количественного исследования фракций гемоглобина А1с, А2 и F (США).
Уровни ионизированного кальция (Са2+), оценивались на анализаторе электролитов AVL9180 производства «Roche Diagnostics» (Германия) с использованием реагентов «Roche Diagnostics».
С целью изучения скорости костного обмена оценивались уровни биохимических маркеров костного метабо- лизма: N-MID остеокальцин, СТX (бета-КроссЛапс) методом иммуноферментного электрохемилюминесцентного анализа на иммуноферментной системе MODULAR E 170 производства «Roсhe Diagnostics» с использованием реагентов «Roсhe Diagnostics».
Исследования проводились на базе клинической диагностической лаборатории Республиканского центра медицинской реабилитации и бальнеолечения.
Состояние минеральной плотности кости оценивалось методом двойной рентгеновской абсорбциометрии осевого скелета на денситометре «Sophos L-XRA» (Франция) в области позвоночника (LII–LIV) и шейки бедра. Исследовались показатели минеральной плотности кости (BMD-bone mineral density), г/см2; Z-критерий (Z- score); Т-критерий (Т-score), %. С целью количественной оценки состояния МПК использовались критерии ISCD, 2007 [1, 2].
Статистическую обработку результатов проводили в программе STATISTICA 6.0. Меры центральной тенден- ции и рассеяния данных рассчитывали при помощи методов описательной статистики; количественные па- раметры в зависимости от вида распределения представлены в виде среднего значения (m) и среднего ква- дратического отклонения (SD), либо в виде медианы (Me) и интерквартильного размаха (LQ–UQ). Анализ со- ответствия вида распределения признаков закону нормального распределения проводили с использованием критерия Шапиро–Уилка; при p<0,05 распределение признака считали отличающимся от нормального. Кри- тическим уровнем при проверке статистических гипотез принят p<0,05. Для анализа различий подгрупп, вы- деленных по качественным клинико-диагностическим признакам, использовались непараметрические мето- ды Манна–Уитни, Вилкоксона, Фридмана (ANOVA) и Кендала. Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение
Клиническая характеристика обследованных пациентов с СД 1-го типа, включенных в исследование, представлена в табл. 1.
Таблица 1. Клиническая характеристика пациентов с СД 1-го типа, включенных в исследование
Параметр | Пациенты с СД 1 типа, n=55, m+SD или
Me [LQ–UQ] | Критерий
Шапиро–Уилка,
p1 |
| Возраст, лет | 26 [24–29] | <0,001 |
| Соотношение мужчин и женщин | 10/17 | |
| Рост, м | 1,67 [1,62–1,75] | <0,001 |
| Масса тела, кг | 63 [58–69] | <0,001 |
| ИМТ, кг/м2 | 22,14 [20,55–24,38] | <0,001 |
| Суточное потребление Са, мг/сут | 516 [420–603] | 0,006 |
| Суточное потребление витамина | ||
D, мкг/сут3,2 [2,45–4,23]
0,02
Длительность СД 1-го типа, лет11 [6–14]
0,42
Возраст манифестации СД 1-го типа, лет16 [12–23]
<0,001
Креатинин, мкмоль/л89,47±15,11
0,08
НвА1с,%8,26±0,44
0,23
СКФ, мл/мин81,77 ±31,92
0,22
Са общий, ммоль/л2,22 ±0,11
0,43
Са2++, моль/л1,02 [0,98–1,04]
0,009
Р неорг., ммоль/л1,29 ±0,15
0,51
ЩФ, ЕД/л110,06 ±29,14
0,12
Остеокальцин, нг/мл15,36 [13,23–28,45]
<0,001
бета-СТХ, нг/мл564,25 [542,21–583,14]
<0,001
МПК (LII-LIV): г/см2
Z-критерий
МПК (ШБ): г/см2
Z-критерий
0,98±0,088
–1,02±0,71
0,78 [0,7–0,86]
–1,15 ±1,1
0,42
0,09
<0,001
0,52
Потребление кальция с продуктами питания, по результатам анкетирования, в среднем составило 516 мг/сут, что вдвое ниже рекомендуемых норм потребления кальция для лиц в возрасте до 50 лет [2,4]. Средний показатель потребления витамина D с продуктами питания составил 3,2 мкг при необходимом 5 мкг в сутки [2,4].
Пациенты, включенные в исследование, в ходе первого визита подписывали информированное согласие на участие в исследовании; заполняли индивидуальный вопросник «Обследование состояния питания населения Республики Беларусь»; проходили индивидуальное обучение по вопросам профилактики диабетической остеопатии, включавшее определение возможных причин развития костно-мышечных осложнений диабета, рекомендации по оптимизации инсулинотерапии, самоконтролю, рациональному питанию, комплексу физических упражнений.
С целью оценки эффективности комплексной программы профилактики костных потерь пациенты с СД 1-го типа, включенные в исследование, в ходе рандомизации были разделены на две подгруппы, сопоставимые по возрасту, полу, длительности заболевания, состоянию минеральной плотности кости осевого скелета (табл. 2).
Таблица 2. Клиническая характеристика выделенных подгрупп пациентов с СД 1-го типа
Параметр | I подгруппа, n=28 Me [LQ–UQ | II подгруппа, n=27
Me [LQ–UQ] | U тест
Манна–Уитни |
| Клинико-анамнестические параметры | |||
| Возраст, лет | 27,5 [25–31,5] | 24 [23–28] | 0,09 |
| Соотношение мужчин и | |||
женщин
9/19
10/17
Рост, м1,67 [1,61–1,79]1,67 [1,62–1,7]
0,45
Масса тела, кг63 [57–72,5]63 [58–67]
0,66
ИМТ, кг/м221,78 [20,37–24,17]22,39 [20,55–24,46]
0,87
Суточное потребление Са,
мг/сут525 [428–630]465 [365–560]
0,09
Суточное потребление
витамина D, мкг/сут3,45 [2,5–4,94]2,86 [2,35–3,6]
0,23
Длительность СД 1-го типа, лет11 [8–16]
8 [5–12]
0,08
Возраст манифестации
СД 1-го типа, лет16 [12–23]16,5 [13–23,5]
0,79
Лабораторные параметры | |||
| НвА1с,% | 8,4 [7,96–8,46] | 8,26 [7,96–8,45] | 0,63 |
| СКФ, мл/мин | 91,08 [67,16–115] | 68,3 [43,4–115] | 0,77 |
| Креатинин, мкмоль/л | 89,0 [79–100] | 90,5 [76–103] | 0,92 |
| Са общий, ммоль/л | 2,21 [2,13–2,29] | 2,23 [2,15–2,31] | 0,61 |
| Са2++, моль/л | 1,01 [0,97–1,04] | 1,02 [0,98–1,04] | 0,58 |
| Р неорг., моль/л | 1,3 [1,21–1,34] | 1,29 [1,21–1,39] | 0,78 |
| ЩФ, ЕД/л | 110,5 [86–132] | 107 [89–126] | 0,98 |
| Остеокальцин, нг/мл | 15,8 [13,23–25,56] | 15,23 [13,24–29,56] | 0,61 |
| бета-СТХ, нг/мл | 562,24 [523,32–586,54] | 564,53 [546,28–580,15] | 0,46 |
| Инструментальные параметры | |||
| МПК (LII-LIV): | |||
г/см2
Z-критерий
0,97 [0,91–1,01]
–1,06 [–1,46/–0,88]
0,97 [0,94–1,04]
–1,16 [–1,33/–0,59]
0,48
0,57МПК (ШБ):
г/см2
Z-критерий
0,77 [0,71–0,86]
–1,23 [–1,89/–0,21]
0,79 [0,7–0,87]
–1,21 [–1,71/–0,65]
0,52
0,91
Пациентам I подгруппы дополнительно давались пояснения по режиму приема комбинированного препарата карбоната кальция (500 мг/сут) и холекальциферола (витамин D – 400 МЕ/сут) в течение 12 месяцев.
Во время 2-го и 3-го визитов пациенты заполняли индивидуальный вопросник «Обследование состояния питания населения Республики Беларусь» и анкету по оценке наличия нежелательных явлений.
Кроме того, в качестве контрольных параметров для оценки эффективности профилактических мероприятий в обеих подгруппах исследовались: состояние минеральной плотности кости осевого скелета (LII-LIV и шейки бедра) через 12 месяцев; лабораторные показатели: содержание Са общего, Са ионизированного, Р неорганического, ЩФ общей, остеокальцина, -СТХ ( -КроссЛапс) через 6 и 12 месяцев наблюдения.
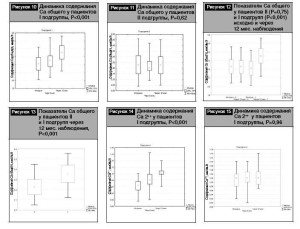
Динамика показателей потребления кальция и витамина D с продуктами питания у пациентов I и II подгрупп с СД 1-го типа через 6 и 12 месяцев представлена на рис. 1–4.
Полученные данные свидетельствуют об увеличении суточного потребления продуктов, содержащих каль- ций и витамин D, в обеих выделенных подгруппах через 6 и 12 месяцев, однако оно ниже рекомендуемых для лиц молодого возраста норм.
Кроме того, при проведении сравнительного анализа суточного потребления кальция (500,0 [410,0–600,0] vs 530,0 [440,0–645,0], Р=0,13) и витамина D (3,6 [3,0–4,0] vs 3,65 [2,9–5,05], P=0,69) между показателями I и II подгрупп через 12 месяцев наблюдения достоверных различий не выявлено (рис. 5, 6).
Таким образом, результаты оценки суточного потребления кальция и витамина D с продуктами питания свидетельствуют о его повышении в ходе исследования, не достигающем, однако, рекомендуемых для лиц молодого возраста норм.
Анализ нежелательных явлений. В ходе второго визита жаловались на диспепсию два пациента, на запоры – один из I подгруппы. Во II подгруппе отмечены жалобы на диспепсию у одного пациента, на запоры – у двух, на метеоризм – у одного пациента. В ходе третьего визита жаловались на диспепсию один пациент (во вре- мя второго визита данные жалобы отсутствовали) из I подгруппы и на метеоризм – один пациент из II подг- руппы. Ни один из пациентов досрочно не вышел из исследования.
Полученные результаты анкетирования наличия нежелательных явлений подтверждают хорошую перено- симость комбинированного лекарственного средства карбоната кальция 500 мг и холекальциферола 400 МЕ у пациентов с СД 1-го типа.
Динамика показателей минеральной плотности кости осевого скелета (на основании критерия Вилкоксона) у пациентов выделенных подгрупп с сахарным диабетом 1-го типа представлена на рис. 7, 8.
Отмечено повышение показателя минеральной плотности кости в области позвоночника (LII-LIV, 0,97 [0,91–1,01] vs 1 [0,97–1,1], Р<0,001) у пациентов I подгруппы, а во II подгруппе выявлено снижение данного показателя в динамике (0,97 [0,94–1,04] vs 0,97 [0,94–1,02], Р=0,006). Данные минеральной плотности кости в обла- сти шейки бедра исходно и через 12 месяцев наблюдения не имели достоверных различий как в I, так и во II подгруппе пациентов.
При сравнении показателей минеральной плотности кости осевого скелета I и II подгрупп через 12 месяцев наблюдения выявлены достоверно более низкие показатели в области позвоночника (LII-LIV) у пациентов II подгруппы (1,0 [0,97–1,1] vs 0,97 [0,94–1,02], Р=0,043) (рис. 9).
Таким образом, результаты динамического наблюдения параметров МПК осевого скелета свидетельствуют об увеличении костной массы в области позвоночника у пациентов молодого возраста с сахарным диабетом 1-го типа и начальной стадией снижения костной плотности, выполнявших комплекс немедикаментозных профилактических мероприятий и принимавших комбинированное лекарственное средство карбонат кальция 500 мг и 400 МЕ витамина D3 (холекальциферола) в сутки в течение 12 месяцев. В то же время отмечена недостаточная эффективность немедикаментозных методов профилактики для предотвращения потерь кос- тной плотности у пациентов молодого возраста с СД 1-го типа.
Динамика показателей фосфорно-кальциевого обмена и костных маркеров представлена в табл. 3.
Таблица 3. Динамика показателей фосфорно-кальциевого обмена и костных маркерову пациентов выделенных подгрупп
| Параметр | Исходно | Через 6 мес | Через 12 мес | ||||||
Подгруппа I, | Подгруппа II, | Р1 | Подгруппа I, | Подгруппа II, | Р2 | Подгруппа I, | Подгруппа II, | Р3 | |
| n=28 | n=27 | n=28 | n=27 | n=28 | n=27 | ||||
Са об- щий,
моль/л | 2,21 |
[2,13–
2,29]2,23
[2,15–
2,31]0,612,25
[2,17–
2,31
2,2
[2,18–
2,26]
0,162,36
[2,27–
2,44]2,23
[2,15–
2,3]
<0,001
Са2++,
ммоль/л
1,01
[0,97–
1,04]1,02
[0,98–
1,04]0,58
1,05
[1,02–
1,1]
1,02
[1–
1,05]
0,01
1,1
[1,1–
1,12]
1,02
[0,99–
1,05]<0,001Р неорг., моль/л
1,3
[1,21–
1,34]
1,29
[1,21–
1,39]0,651,29
[1,18–
1,32]
1,3
[1,23–
1,36]
0,391,29
[1,22–
1,32]1,31
[1,24–
1,37]0,49ЩФ, ЕД/л110,5
[86–
132,0]107,0
[89,0–
126,0]0,98112,5
[90,0–
136,0]102,5
[90,0–
120,0]0,58112,5
[89,0–
132,0]
110
[90,0–
121,0]
0,85Остео-
кальцин, нг/мл
15,8
[13,23–
25,56]
15,23
[13,24–
29,56]0,6116,88
[14,61–
27,33]14,35
[12,56–
28,45]0,8316,29
[13,22–
25,84]14,9
[13,0–
29,12]0,82бета- СТХ, нг/мл562,24
[523,32–
586,54]564,53
[546,48–
580,15]0,46544,56
[520,23–
576,18]568,78
[540,36–
581,34]0,06536,96
[517,74–
566,52]565,87
[543,4–
577,23]0,02
P1 – достоверность различий параметров I и II подгрупп исходно
P2 – достоверность различий параметров I и II подгрупп через 6 мес.
P3 – достоверность различий параметров I и II подгрупп через 12 мес.
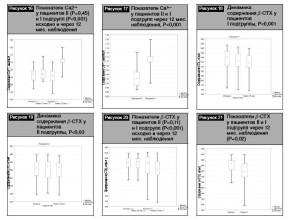
На рис. 10, 11 отражена динамика содержания Са общего у пациентов I и II подгрупп.
На рис. 12 представлены результаты сравнения содержания Са общего у пациентов I и II подгрупп исходно и через 12 месяцев наблюдения. Полученные данные свидетельствуют о наличии достоверного повышения уровня Са общего у пациентов I подгруппы (2,36 [2,27–2,44] vs 2,23 [2,15–2,3], Р<0,001).
На рис. 13 приведены результаты сравнительного анализа содержания Са общего у пациентов I и II подгрупп через 12 месяцев наблюдения, которые свидетельствуют о наличии более высокого уровня данного показателя в I подгруппе (2,36 [2,27–2,44] vs 2,23 [2,15–2,3], Р<0,001).
Аналогичные тенденции выявлены при оценке динамики содержания Са ионизированного у обследованных пациентов (рис. 14–17):
Данные динамического изменения содержания маркера костной резорбции бета-СТХ у пациентов I и II подг- рупп представлены на рис. 18, 19.
Сравнительный анализ показателей содержания бета-СТХ у пациентов I и II подгрупп исходно и через 12 мес наблюдения выявил наличие достоверного снижения у пациентов I подгруппы (536,96 [517,74-566,52] vs 565,87 [543,4-577,23], Р<0,001) (рис. 20). Кроме того, отмечено наличие более низкого содержания бета-СТХ у пациентов I подгруппы через 12 месяцев наблюдения в сравнении с пациентами II подгруппы (536,96 [517,74-566,52] vs 565,87 [543,4-577,23], Р=0,02) (бета-СТХ рис. 21):
Таким образом, полученные результаты свидетельствуют о повышении содержания Са общего и ионизиро- ванного, а также о снижении содержания бета-СТХ у пациентов I подгруппы, выполнявших комплексную профилактику, включавшую немедикаментозные и медикаментозные мероприятия. У пациентов II подгруппы содержание Са общего и ионизированного, бета-СТХ не отличалось от исходных данных.
Результаты проведенного проспективного клинического исследования свидетельствуют об эффективности комплексной профилактики диабетической остеопатии, включавшей выполнение немедикаментозных меро- приятий и применение комбинированного лекарственного средства карбонат кальция 500 мг и витамин D3 (холекальциферол) 400 МЕ в сутки в течение 12 месяцев, у пациентов молодого возраста с СД 1-го типа и начальной стадией снижения костной плотности. Эффективность комплексной профилактики диабетической остеопатии подтверждена результатами динамического наблюдения параметров МПК осевого скелета, сви- детельствующими о повышении костной массы в области позвоночника; лабораторных параметров – выяв- лено повышение содержания кальция общего и ионизированного, а также снижение содержания маркера костной резорбции бета-СТХ. В то же время отмечена недостаточная эффективность немедикаментозных методов профилактики для предотвращения потерь костной плотности у пациентов молодого возраста с СД 1-го типа.
Л И Т Е Р А Т У Р А
1. Kanis, J.A. Assessment of osteoporosis at the primary health-care level / J.A. Kanis on behalf of the World Health Organization Scientific Group – University of Sheffield, United Kindom, 2007. – 287 p.
2. Клинические рекомендации. Остеопороз. Диагностика, профилактика и лечение /Л.И. Беневоленская [и др.]; под общ. ред. Л.И. Беневоленской, О.М. Лесняк. – М.: ГЭОТАР-Медиа, 2009. – 272 с.
3. Руденко, Э.В. Остеопороз. Диагностика, лечение и профилактика / Э.В. Руденко. – Минск, “Белорусская наука”, 2001. – 153 с.
4. Холодова, Е.А. Эндокринные остеопатии: особенности патогенеза, диагностики и лечения: Практ. рук. для врачей / Е.А. Холодова, А.П. Шепелькевич, З.В. Забаровская – Минск: Белпринт, 2006. — 88 с.
5. Некрасова, М.Р. Предикторы развития остеопении при сахарном диабете 1 типа /М.Р. Некрасова, Л.А. Су- плотова // Сахарный диабет. – 2006. – № 1. – С. 58 –61.
6. The Living Skeleton / Edit. C.Roux. – Wolters Kluwer Health France, 2007. – 113 p.
7. Strotmeyer, E.S. Middle-aged premenopausal women with type 1 diabetes have lower bone mineral density and calcaneal quantitative ultrasound than nondiabetic women / Elsa S. Strotmeyer [et al.] // Diabetes Care. – 2006. – Vol.29, №2. – P. 306 –311.
8. Некрасова, М.Р. Предикторы развития остеопении при сахарном диабете 1 типа /М.Р. Некрасова, Л.А. Су- плотова // Сахарный диабет. – 2006. – № 1. – С. 58 –61.
9. Kemink, S.A. Osteopenia in insulin-dependent diabetes mellitus; prevalence and aspects of pathophysiology / S.A. Kemink [et al.] // J. Endocrinol. Invest. – 2000. – Vol.23, №5 – P. 295 –303.
10. Alexopoulou, O. Bone density and markers of bone remodeling in type 1 male diabetic patients / O. Alexopoulou [et al.] // Diabetes Metab. – 2006. – Vol.32, №5, Pt. 1 – P.453 –458.
11. Nicodemus, K.K. Type 1 and type 2 diabetes and incident hip fractures in postmenopausal women / K.K. Nicodemus, A.R. Folsom // Diabetes Care. – 2001. – Vol.24, №7. – P.1192 –1197.
12. Miao, J. Elevated Hip Fracture Risk Type 1 Diabetes Patients // J. Miao [et al.] // Diabetes Care. – 2005. – №28. – P. 2850 –2855.
13. Brown, S.A. Osteoporosis: an under-appreciated complication of diabetes / Sue A. Brown, Julie L. Sharpless // Clin. Diabetes. – 2004. – № 22. – P.10 –20.
14. Белых, О.А. Состояние кальций-фосфорного обмена у больных сахарным диабетом 1 типа / О.А. Белых, Е.А. Кочеткова // Остеопороз и остеопатии. – 2005. – № 1. – С. 12 –15.
15. Kemmis, K. Diabetes and osteporotic fractures / K. Kemmis, D. Stuber // The Diabetes Educator. – 2005. – Vol.31, № 2. – P. 187 –196.
16. Jehke, P.M. Serum level of insulin-like growth factor sustem components and relationship to bone metabolism in type 1 and type 2 diabetes mellitus patient / P.M. Jehke [et al.]// J. Endocrinol. – 1998. – Vol.159. – P. 297 –306.
17. Valerio, G. The lumbar bone mineral density is affected by long-term poor metabolic control in adolescents with type 1 diabetes mellitus / G.Valerio [et al.] // Horm. Res. – 2002. – Vol.58. – P. 266 –272.
18. Ivers, R.Q. Diabetes and risk of fracture: the Blue Montains Eye Study / R.Q. Ivers [et al.] // Diabetes Care. –2001. – Vol.24. – P.1198 –1203.
19. Gunczker, P. Decreased bone mineral density and bone formation markers shortly after diagnosis of clinical type 1 diabetes mellitus / P. Gunczker [et al.] // J. Pediatr. Endocrinol. Metab. – 2001. – Vol. 14. – P. 525 –528.
20. Lunt, H. A popopulation-based study of bone mineral density in women with longstanding type 1 (insulin dependent) diabetes / H. Lunt [et al.] // Diabetes Res. Clin. Pract. – 1998. – Vol.40. – P.31 –38.
21. Chau, D.L. Osteoporosis and diabetes /Diane L. Chau, Steven V. Edelman// Clin. Diabetes. – 2002. – Vol.20, № 3. – P. 153 –157.
22. Marshall, D. Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures / D. Marshall, O. Johnell, H. Wedel // BMJ – 1996. – Vol.312. – P. 1254 –1259.
23. Rakic, V. Bone mineral density and its determinants in diabetes: the Fremantle Diabetes Study / V. Ragic [et al.] // Diabetologia. – 2006. – № 49. – P. 863 –871.
24. Hamilton, E.J. Prevalence and predictors of osteopenia and osteoporosis in adults with Type 1 diabetes / E.J. Hamilton [et al.] // Diabetic Medicine. – 2008. – Vol. 26, Is.1. – P. 45 – 52.
25. Danielson, K.K. Poor glycemic control is associated with low BMD detected in premenopausal women with type 1 diabetes / K.K. Danielson // Osteoporosis International. – 2008 . – Vol. 19.
26. Vestergaard, P. Discrepancies in bone mineral density and fracture risk in patients with type 1 and type 2 diabetes — a meta-analysis / P. Vestergaard // Osteoporosis International. – 2007. – Vol.18, № 4. – P. 427 –444.
27. Stevens, L.A., Levey, A.S. Frequently Asked Questions about GFR estimates /L.A. Stevens, A.S. Levey//National Kidney Foundation, 2007.





Комментировать