Г. И. Максимяк, В. Е. Жильчук, А. В. Жильчук, Ю.В. Чишкевич, Ю. И. Кудрявец,
М. В. Глянько, А. Н. Николаєнко
Ровенский обласной онкологический диспансер, Ровно;
ИЭПОР им. Р. Е. Кавецкого НАН Украины, Киев;
ООО «Эрбис», Киев
За последние годы увеличился рост заболеваемости колоректальным раком (КРР) во многих странах мира, в том числе и в Украине – 34,9 случаев на 100 тыс. населения [1, 2]. Почти у каждого третьего онкологического больного регистрируется метастатическое поражение печени независимо от первичной локализации, метастазы в печень выявляют примерно у половины больных раком толстой кишки.
Основным методом лечения онкобольных с нерезектабельным метастатическим процесом остается паллиативная химиотерапия (ХТ) [3]. Сегодня в практической онкологии широко применяют иммуномодулирующие препараты с целью восстановления угнетенного в результате цитостатической терапии иммунитета, направленные на повышение способности организма больного переносить агрессивное противоопухолевое лечение.
Перспективным в этом отношении является использование препарата Эрбисол® Ультрафарм (ООО «Эрбис», Киев, Украина), который представляет собой низкомолекулярный комплекс природных органических соединений негормонального происхождения, полученных из животной эмбриональной ткани. Фармакологические свойства и активность препарата предопределены содержанием в нем специфических гликопептидов, которые активируют иммунную систему на поиск и ликвидацию патологических изменений в органах и тканях. Основной иммуномодулирующий эффект препарата проявляется за счет активации макрофагов, ответственных за репарацию поврежденных клеток и возобновление функциональной активности органов и тканей, а также NK-клеток и Т-киллеров, которые обладают высоким потенциалом в уничтожении аномальных клеток, тем самым обеспечивают противоопухолевую защиту организма [4]. Эрбисол® Ультрафарм у больных с иммунодепрессией Т-клеточного иммунитета, который часто наблюдается при онкозаболеваниях, способствует нормализации уровня Т-лимфоцитов, Т-хелперов, цитотоксических Т-лимфоцитов; уменьшает количество и активацию В-лимфоцитов; способствует усилению продукции интерлейкинов 1, 2, 12, фактора некроза опухоли, интерферонов (a, b, g) и подавляет продукцию интерлейкинов 4 и 10 [5]. Как метаболический антимутаген Эрбисол® Ультрафарм способствует предупреждению возникновения изменений в геноме человека и обеспечивает его стабильность [6].
Материал и методы исследования.
Изучение эффективности применения препарата Эрбисол® Ультрафарм на фоне длительной химиотерапии (ХТ) проведено в исследовании, в которое были включены 111 пациентов (60 женщин и 51 мужчина в возрасте от 30 до 75 лет) с КРР (Т2-3N0-2М1 по системе ТNM) и метастатическим поражением печени ІІ-ІІІ стадии по классификации Gennari. Всем больным было проведено хирургическое лечение (удаление первичной опухоли ободочной или прямой кишки). Пациенты разделены на 2 группы:
Контрольная — 54 больных, которым проводилась инфузионная терапия по схеме: кальция фолинат (лейковорин) 500 мг/м2/сут. в 250 мл 0,9% раствора натрия хлорида в/в капельно в течение 120 мин., двухчасовая инфузия еженедельно в течение 6-ти недель; 5-фторурацил 600 мг/м2/сут. в/в в течение 1-2 мин. через час после введения лейковорина, еженедельно в течение 6-ти недель (схема Roswell-Park). Очередные курсы лечения проводили через 8 недель, затем 8 недель перерыва и начинали следующий курс. Всего 6 курсов.
Основная — 57 больных, которым на фоне ХТ проведен курс лечения Эрбисол® Ультрафармом циклами — в/м 2 раза в день по 4 мл (2 ампулы) утром и вечером в течение 5 дней с интервалом 2 дня, во время которых препарат вводят в/м 1 раз в день вечером по 2 мл. В начале и в конце лечения препарат назначали в/м 1 раз в день по 2 мл вечером в течение 3-х дней. 1 курс 8 циклов (6 циклов комплексно с ХТ + 2 цикла после ХТ).
Обследование пациентов (клинико-лабораторное, сонографическое, эндоскопическое, рентгенологическое, включая УЗИ и КТ органов брюшной полости) проводилось до начала лечения и через каждые 28-30 дней от начала ХТ до проведения очередного курса ХТ в течение 12 месяцев. В работе представлены статистически обработанные данные до начала лечения (1 визит), за три дня до 6 курса ХТ (2 визит, через 6 мес.) и после последнего курса иммунотерапии (3 визит, через 12 мес.). Выживаемость больных определяли по методу Каплана-Мейера. С целью расширения представлений о кинетике выживания использовали медиану выживаемости, как показателя времени, в течение которого выживает половина больных исследуемых групп. Общее состояние больных оценивали по шкале Карновского.
Результаты исследования.
Всем больным были проведены курсы ХТ в полном объеме, токсичность цитостатика (5-фторурацила) не выходила за пределы общеизвестных проявлений его побочного действия на другие органы и системы.
Анализ динамики ЧСС, САД, ДАД) не выявил существенных отклонений от нормы и различий между группами больных в процессе лечения. Нормализация повышенной температуры тела наблюдалась у больных основной группы через 6 месяцев, в контрольной группе сохранялась повышенной и через 12 мес.
В процессе лечения отклонения от нормы в показателях общего анализа крови чаще выявлялись у больных контрольной группы (количество эритроцитов, лейкоцитов, нейрофилов, СОЭ, гемоглобин). В основной группе данная тенденция имела менее выраженный характер, что свидетельствует о хорошей переносимости ХТ при использовании Эрбисол® Ультрафарма и его положительном влиянии на показатели кроветворной системы. Прием препарата Эрбисол® Ультрафарм уменьшал скорость падения уровня гемоглобина и количества лейкоцитов, в то время как у пациентов контрольной группы отмечено достоверное снижение этих показателей по сравнению не только с данными до лечения, но и больными основной группы (табл. 1).
Таблица 1 – Показатели общего анализа крови в динамике лечения (М±m)
| Показатель | Группы | 1 визит | 2 визит | 3 визит |
| Гемоглобин, г/л | контрольная | 130,1±1,4 | 119,8±1,6 *Ϫ | 109,2±1,4 *Ϫ |
| основная | 134,3±2,3 | 125,8±2,1* | 119,4±2,3 * | |
| Лейкоциты, (х109/л) | контрольная | 6,7±0,3 | 5,5±0,4 * | 4,3±0,4 * |
| основная | 6,3±0,2 | 5,6±0,3 | 5,1±0,2 * |
р<0,05 по сравнению с данными до лечения (*) и основной группы (Ϫ)
Биохимический анализ крови показал, что в процессе лечения у пациентов основной группы в отличие от контрольной уровень креатинина оставался стабильным, что свидетельствует о положительном влиянии исследуемого препарата на функцию почек, а отсутствие существенных изменений при сравнении других показателей указывает на отсутствие токсического воздействия и детоксикационном эффекте Эрбисол® Ультрафарма, применяемого на фоне базовой терапии. Отмечено достоверное снижение уровня билирубина в конце исследования по сравнению с первоначальным средним уровнем у больных основной группы.
Таблица 2 — Результаты биохимического анализа крови в динамике лечения (М±m)
| Показатель | Группы | 1 визит | 2 визит | 3 визит |
| Общий белок, г/л | контрольная | 68,1±1,2 | 68,6±1,2 | 68,2±1,5 |
| основная | 76,2±1,3 | 74,7±1,2 | 74,1±1,4 | |
| АСТ, ммоль/ч ∙ л | контрольная | 27,3±0,6 | 27,2±0,8 | 27,1±0,8 |
| основная | 28,0±1,2 | 27,7±0,7 | 27,8±1,0 | |
| АЛТ, ммоль/ч ∙ л | контрольная | 29,7±2,2 | 28,5±1,1 | 28,9±1,2 |
| основная | 29,8±1,9 | 27,5±1,3 | 28,0±1,5 | |
| Креатинин, ммоль/л | контрольная | 68,1±1,4 | 80,5±2,6* | 79,7±2,8* |
| основная | 90,5±3,2 | 86,1±2,1 | 87,2±2,4 | |
| Билирубин, мкмоль/л | контрольная | 17,9±0,8 | 14,6±1,7 | 15,9±1,0 |
| основная | 17,5±0,8 | 15,4±1,2 | 14,2±0,9* | |
| Глюкоза, ммоль/л | контрольная | 4,4±0,3 | 4,7±0,2 | 4,9±0,3 |
| основная | 4,4±0,2 | 4,5±0,1 | 4,6±0,2 |
р<0,05 по сравнению с данными до лечения (*)
Согласно результатам УЗИ и КТ у всех онкобольных наблюдались явления гепатомегалии (печень выступала на 8-12 см из-под реберной дуги). По окончании лечения зафиксировано уменьшение размеров печени — у 23 (40,3 %) пациентов основной и 7 (13,0 %) контрольной групп; объем поражения паренхимы у пациентов контрольной группы увеличился с 24,8±3,2% до 34,8±5,0%, у пациентов основной – снизился с 38,7±5,2% до 21,0±7,0%. У больных, получавших Эрбисол® Ультрафарм, соотношение здоровой и пораженной ткани печени менялось в сторону увеличения здоровой. После окончания лечения все больные с КРР были распределены по градациям предварительной оценки эффективности с учетом изменения суммы опухолевых образований наибольших диаметров (табл. 3).
Таблица 3 – Клинический эффект у больных КРР с метастазами в печень
| Критерии эффективности | Контрольная группа | Основная группа |
| частичная ремиссия, n (%) | 7 (13,0) Ϫ | 23 (40,3) |
| прогрессирование, n (%) | 37 (68,5) Ϫ | 7 (12,3) |
| стабилизация, n (%) | 10 (18,5) Ϫ | 27 (47,4) |
| длительность стабилизации, мес. (M±m) | 7,60±0,20 Ϫ | 9,51±0,31 |
| длительность клинического эффекта, мес. (M±m) | 8,92±0,15 Ϫ | 9,49±0,14 |
| продолжительность жизни, мес. (M±m) | 8,14±0,23 Ϫ | 11,08±0,12 |
р<0,05 по сравнению с данными основной группы (Ϫ)
У большинства пациентов контрольной группы (68,5%) наблюдалось дальнейшее прогрессирование онкологического процесса за счет увеличения размеров отдельных узлов и/или количества метастазов. Применение Эрбисол® Ультрафарма позволило получить положительный эффект у больных с IV стадией распространения процесса, у которых симптомы заболевания были наиболее выраженные. С учетом пациентов со стабилизацией опухолевого процесса эффективным лечение было признано у 87,7% пациентов основной группы и 31,5% контрольной (p<0,05). У пациентов основной группы отмечены также более длительные периоды стабилизации и частичного или полного клинического эффекта, увеличение продолжительности жизни. На момент окончания исследования в контрольной группе выжило 34 (63,0%) пациента, в основной – 51 (89,5%) (рис. 1).
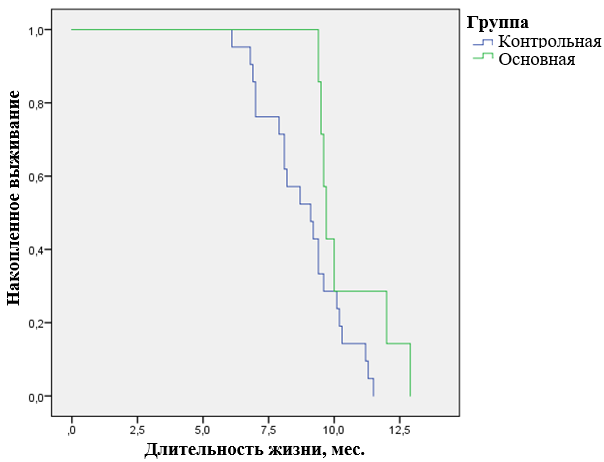
Использование препарата Эрбисол® Ультрафарм способствовало позитивной динамике субъективных симптомов, которая наблюдалась уже через 5-7 дней после начала курса иммунотерапии и достигала максимума после его окончания. При оценке общего состояния пациентов после завершения ХТ было установлено достоверное снижение индекса Карновского с 68,3% до 53,8% в контрольной группе по сравнению с данными до лечения; в основной группе больных – только незначительное (с 69,1% до 67,6%) (табл. 4). У большинства больных контрольной группы (61,8%) индекс Карновского снизился до 50-40 %, в основной группе такая функциональная активность отмечалась только у 4 (7,9%) пациентов.
Таблица 4 – Характеристика общего состояния больных КРР с метастазами в печень в динамике лечения (по шкале Карновского), n (%)
| % | Контрольная группа | Основная группа | ||
| до лечения (n=54) | после лечения (n=34) | до лечения (n=57) | после лечения (n=51) | |
| 100 | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| 90 | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| 80 | 14 (25,9) | 0 (0) | 20 (35,1) | 16 (31,4) |
| 70 | 17 (31,5) | 1 (2,9) | 12 (21,0) | 12 (23,5) |
| 60 | 23 (42,6) | 12 (35,3) | 25 (43,9) | 19 (37,2) |
| 50 | 0 (0) | 20 (58,9) | 0 (0) | 3 (5,9) |
| 40 | 0 (0) | 1 (2,9) | 0 (0) | 1 (2,0) |
| М±m | 68,3±4,1 | 53,8±3,2 *Ϫ | 69,1±3,3 | 67,6±2,7 |
р < 0,05 по сравнению с данными до лечения (*) и основной группы (Ϫ)
Применение Эрбисол® Ультрафарма способствовало улучшению качества жизни больных (отсутствие тошноты, рвоты, выпадения волос и других токсических проявлений лечения) и позволило значительно уменьшить негативные последствия ХТ у больных основной группы, наблюдалось также снижение воспалительных реакций и боли, уменьшение диспептических явлений, чем у больных контрольной группы. В основной группе пациентов частота проявления побочных реакций на фоне ХТ была меньше (41,2 %), чем в контрольной группе (91,2 %).
Выводы:
- Включение препарата Эрбисол® Ультрафарм в базисную терапию онкологических больных существенно уменьшало проявления синдрома интоксикации после проведенной ХТ (у 41,2% больных основной группы против 91,2% — в контрольной), приводило к снижению уровней активности АЛТ, билирубина; способствовало уменьшению выраженности субъективных жалоб, снижению негативного побочного воздействия противоопухолевой цитотоксической терапии.
- Эрбисол® Ультрафарм является не только препаратом сопровождения, снижающим частоту проявления побочных реакций, вызванных ХТ, но и активным участником противоопухолевой терапии, повышающим эффективность лечения на фоне базисной терапии у 87,7% больных основной группы против 31,5% у больных контрольной (p<0,05), при этом на момент окончания исследования выживаемость пациентов основной группы составила 89,5%, контрольной — 63,0%;
- Эрбисол® Ультрафарм обеспечивал сохранение качества жизни в процессе лечения у больных основной группы, проявляющееся в незначительном снижении индекса Карновского с 69,1% до 67,6%, тогда как в контрольной группе происходило достоверное его снижение с 68,3% до 53,8%. Снижение индекса активности до 50-40% отмечено только у 7,9% пациентов основной группы и у большинства (61,8%) пациентов контрольной группы, получавших только базисную терапию.
- Результаты проведенного исследования позволяют рекомендовать препарат ЭРБИСОЛ® УЛЬТРАфарм для медицинского применения в комплексном лечении больных коллоректальным раком с метастатическим поражением печени.
Литература.
- Напалков Н.П. Демографический процесс и злокачественные новообразования / Н. П. Напалков // Материалы ІІІ съезда онкологов и радиологов СНГ. – Минск, 2004. – – С. 15-24.
- Сучасні закономірності епідеміології колоректального раку в Донецькій області та Україні / Г. В. Бондар, Ю. В. Думанский, С. В. Грищенко, В. И. Агарков // Новоутворення. – 2002. – № 3-4. – С. 13-18.
- Ад’ювантна інтрапортальна хіміотерапія колоректального раку / А. В. Борота, Н. В. Бондаренко, А. Ю. Кияшко, А. А. Борота // Новоутворення. – 2007. – № 1. – С. 103-108.
- Николаенко А.Н. Концептуальные подходы в разработке высокоэффективных лекарственных препаратов нового поколения класса «ЭРБИСОЛ» / А. Н. Николаенко // Фармакологічний вісник. – 1998. – № 6. – С. 69-74.
- Влияние препаратов класса ЭРБИСОЛ на продукцию цитокинов и экспрессию поверхностных маркеров клеток крови у здоровых доноров и онкологических пациентов / А. Н. Николаенко, Д. А. Базыка, Г. Н. Дранник [и др.] // Евразийский онкологический журнал. – 2016. – № 4 (1). – С. 79-89.
- Болтіна І. В. Вивчення активності препарату ЕРБІСОЛ® УЛЬТРАфарм в тесті на індукцію аберацій хромосом в культурі лімфоцитів периферичної крові людини in vitro з метаболічною активацією та без неї / І. В. Болтіна, О. М. Ніколаєнко // Ліки. – 2004. – № 5-6. – С. 111-118.














Комментировать