С.І. Жук, С.Б. Чечуга, Т.В. Пехньо, М.В. Пехньо
Вінницький національний медичний університет ім. М.І. Пирогова Національна медична академія післядипломної освіти ім. П.Л. Шупика Центр матері і дитини (м. Вінниця)
Пологовий будинок №2 (м. Київ)
Акушерські кровотечі є однією з провідних причин материнської смертності і в її структурі складають: в чистому вигляді — 20-25 %, як конкуруюча причина — 42 %, як фонова — до 78 %. Показник акушерських кровотеч коливається від 3 до 8 % від загального числа пологів. При цьому 2—4 % випадків кровотеч пов’язані з гіпотонією матки в послідовому і після- пологовому періодах, близько 1 % виникає при передчасному відшаруванні нормально розміщеної плаценти і передлежанні плаценти. В той же час в структурі масивних кровотеч спостерігається інша картина. Окремо взята гіпотонія матки практично ніколи не є причиною масивної крововтрати. Масивні кровотечі обумовлені рядом інших причин і найчастіше їхньою комбінацією. В останній час відзначається виразна тенденція до зниження числа кровотеч в послідовому і післяпологовому періодах на тлі збільшення відсотка кровотеч, пов’язаних з передчасним відшаруванням нормально розміщеної плаценти або її передлежанням: вони становлять 45 % [1].
Особливо необхідно виділити варіант низького прикріплення плаценти. Він найчастіше діагностується в різних термінах вагітності і характеризується розташуванням плаценти в нижньому сегменті матки нижче 7 см від внутрішнього вічка без його перекривання. У зв’язку з міграцією плаценти або її розростанням вид передлежання може змінюватися зі збільшенням строку гестації. До факторів, які сприяють передлежанню, відносяться морфологічні, запально—дегенеративні зміни ендометрію і нервово-м’язового апарату матки у жінок з обтяженим акушерським анамнезом. Серед жінок, у яких виявлено передлежання плаценти, переважають повторнородящі в анамнезі яких мали місце: невиношування, запальні захворювання, внутрішньоматкові втручання, ускладнення в післяпологовому і послідовому періодах при попередніх пологах. Однак порушення плацентації зустрічаються і під час першої вагітності у зв’язку зі зниженням протеолітичних властивостей зиготи [7]. Основною причиною розвитку кровотечі при патологічно низькій плацентації є розрив частини спіральних артерій і вен за рахунок зсуву базального шару ендометрію разом із м’язами стінки матки в області нижнього сегменту відносно шару ендометрію, який відривається і пов’язаний з тканинами плаценти. Плацента ж за своєю будовою не має можливості змінювати розміри і рухатися слідом за внутрішніми шарами міометрію. Це відбувається з початком пологової діяльності внаслідок обов’язкових структурних змін, а самезначної зміни плацентарної площадки і зсуву м’язів матки в області нижнього сегменту. Кровотеча може виникнути й під час вагітності, коли під впливом виділеного плацентою прогестерону і хоріогоніну гладком’язові клітини тканин нижнього сегменту розслаблюються і стають настільки розтяжними, що нижній сегмент перестає виконувати функцію міцної стінки. Будь—яке підвищення тиску в області нижнього сегменту (багатоводдя, сегментарне скорочення матки, тиск передлежачої частини, одиночне скорочення матки) призводить до його розтягнення відносно плаценти. Поява внаслідок цього навіть невеликої травми судини призводить до гематоми, яка відшаровує хоріальну тканину, інтенсивної продукції простагландинів і, в зв’язку з цим, перейм з посиленням кровотечі [3].
Не менш актуальною в наш час є проблема передчасного відшарування нормально розміщеної плаценти під час вагітності або в І—ІІ періодах пологів. Найімовірнішу групу ризику представляють вагітні з тривалою прееклампсією, або зі швидко зростаючою тяжкістю прееклампсії. В 36,5 % випадків передчасне відшарування нормально розміщеної плаценти супроводжується прееклампсією різного ступеня виразності. На тлі синдрому «шокової плаценти» при передчасному відшаруванні виникають порушення в мікроциркуляторному відділі судинного басейну плаценти і матки. Різко зростає можливість потрапляння до кровоплину амніотичної рідини, що запускає розвиток синдрому дисемінованого внутрішньосудинного згортання (ДВЗ). Факторами, що сприяють виникненню гострої форми ДВЗ— синдрому, є матково—плацентарна апоплексія, ушкодження ендотелію судин на значному проміжку, потрапляння тромбопластичних тканинних субстанцій до материнського кровоплину [7].
Загальноприйнятою в Україні є тактика ведення пацієнток з матковою кровотечею на тлі передлежання плаценти, передчасного відшарування нормально розміщеної плаценти, яка залежить, насамперед, від обсягу крововтрати, стану плода і жінки, строку вагітності. При невеликій крововтраті, відсутності пологової діяльності до 34 тижнів вагітності можливе динамічне спостереження за станом пацієнтки і плода. Раннє і комплексне лікування спрямоване на зупинку кровотечі, нормалізацію гемодинаміки і профілактику респіраторного дистресу (РДС) плода, дозволяє пролонгувати вагітність і попередити репродуктивні втрати.
У випадку прогресуючої кровотечі, що супроводжується геморагічним шоком, дистресом плода, незалежно від строку вагітності, показане термінове розродження. Однак на тлі передлежання плаценти і передчасного відшарування нормально розташованої плаценти небезпека масивної крововтрати після вдалого розродження не зникає. Причинами гіпотонії матки в ранньому післяпологовому періоді при зазначених патологічних станах є блокада скорочувального білка матки продуктами дегідратації фібриногену при порушеннях гемостазу.
Таким чином, акушерські кровотечі практично завжди відбуваються на тлі порушення гемокоагуляційних властивостей крові. Вже при порівняно невеликій крововтраті (15—20 % ОЦК) нерідко констатується двофазність змін в системі гемостазу. Не тривала фаза гіперкоагуляції змінюється фазою гіпокоагуляції.
Як відомо, гемостаз — це комплекс захисно—пристосувальних фізіологічних процесів, що забезпечують рідкий стан крові, зупинку кровотечі, відновлення цілісності судинної стінки. Основними компонентами, що забезпечують гемостаз, є судинна стінка, тромбоцити, система коагуляції і системафібринолізу. На початку кровотечі, за рахунок адгезії та агрегації, тромбоцити нівелюють дефект у судинній стінці. При цьому вивільняються активні аміни (АДФ, тромбоксан А2, серотонін, фактор Віллебранда), які в свою чергу викликають подальшу аглютинацію кров’яних пластинок, відбувається вазоконстрикція і каскадно активуються фактори згортання крові, випадають перші нитки фібрину. Сутність коагуляції полягає в послідовній активації факторів згортання, що призводить до розщеплення фібриногену і перетворення його в нерозчинний фібрин. Перешкоджають процесу згортання спеціальні протеїни — природні антикоагулянти, які зв’язують й інактивуюють ензими коагуляційного каскаду, тим самим, локалізуючи згортання в місці ушкодження і попереджуючи поширення місцевого процесу в системний. Фібриноліз являє собою процес розщеплення фібринового згустку, в результаті якого відбувається відновлення просвіту судин. Він відбиває складну реакцію між компонентами плазмінової системи організму і фібрином [2]. Головним ферментом, відповідальним за протеолітичну деградацію фібрину до розчинних фрагментів невеликих розмірів, є плазмін. Плазмін утвориться з плазміногену під дією активаторів плазміногену тканинного та урокіназного типів. Утворення плазміну починається тоді, коли синтезований в печінці плазміноген і активатор плазміногену приєднується до фібрину. Активатор плазміногену тканинного типу відіграє більшу роль в утворенні плазміну, ніж активатор урокіназного типу, оскільки відрізняється більшою спорідненістю до фібрину. Обидва активатори плазміногену перебувають в крові в комплексі зі специфічними і неспецифічними інгібіторами, серед яких найбільше значення має інгібітор активатора плазміногену типу I (ІАП—I). ІАП—I, як і активатори плазміногену, синтезується ендотеліальними клітинами. Припускають, що активатор плазміногену тканинного типу, як і ІАП—I, вивільняються неушкодженим ендотелієм навколо фібринового тромбу під дією тромбіну, але при цьому відбувається інактивація ІАП-I активованим протеїном С, який утвориться на мембрані ендотеліальних клітин під дією комплексу тромбомодулін—тромбін [4].
Таким чином, з огляду на основні ланки патогенезу маткової кровотечі при різних видах передлежання плаценти й передчасного відшарування нормально розміщеної плаценти, симптоматична гемостатична терапія не втрачає своєї актуальності і повинна бути спрямована на корекцію порушень гемостазу в різних термінах вагітності, а також у післяпологовому періоді.
На сьогоднішній день існує досить велика кількість гемостатичних засобів, вибір яких при лікуванні акушерських кровотеч визначається виразністю кровотечі, шляхом введення препарату, часом початку гемостатичної дії, побічними ефектами та ін. Однак вони не завжди є ефективними і доступними.
У зв’язку з цим, ми вивчили клінічні особливості ефективності використання сучасного гемостатика групи антифібринолітиків «Тугіна» у жінок з матковими кровотечами на тлі передлежання плаценти і передчасного часткового відшарування нормально розміщеної плаценти в різних термінах вагітності. Препарат застосовували також і під час кесарського розтину при перевищенні фізіологічної крововтрати на тлі загальноприйнятої терапії.
Матеріали і методи дослідження
До дослідження було включено 32 жінки з матковою кровотечею при передлежанні плаценти, передчасному відшаруванні нормально розміщеної плаценти на тлі прееклампсії, а також з гіпотонічною кровотечею в ранньому післяпологовому періоді і кесарському розтині, яким з гемостатичною метою застосовували препарат «Тугіна».
«Тугіна» (транексамова кислота) — антигеморагічний засіб групи антифібринолітиків, який специфічно пригнічує активацію плазміногену (профібринолізину) і його перетворення в плазмін (фібринолізин), тим самим нейтралізує фібринолітичну активність в ендометрії. Володіє місцевою і системною гемостатичною дією при кровотечах, пов’язаних з підвищенням фібринолізу. Крім того, за рахунок пригнічення утворення кінінів і інших активних пептидів, що беруть участь в алергійних і запальних реакціях,«Тугіна» має протизапальний ефект.
Основними перевагами препарату є: швидкий початок дії через 10—15 хвилин, відсутність комплексного впливу на згортаючу систему крові, більш тривалий період напіввиведення порівняно з іншими препаратами, подвійний механізм антифібринолітичної дії (конкурентно пригнічує активатор плазміногену і зв’язує плазмін), пригнічує надлишковий кініногенез, виступаючи, таким чином, як анальгетик периферичної дії.
Препарат призначали в дозі 15 мг/кг маси тіла в ізотонічному розчині натрію хлориду внутрівенно крапельно зі швидкістю 1 мл/хв однократно.
Результати досліджень і їхнє обговорення
Середній вік пацієнток становив 20—35 років.
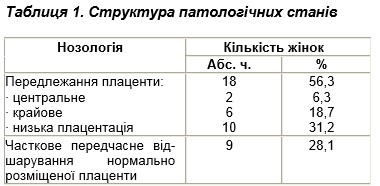
В структурі причин виникнення маткових кровотеч переважало передлежання плаценти — 18 (56,3 %) вагітних, а саме низька плацентація в 10 (31,2 %) випадках, центральне передлежання плаценти діагностовано в 2 (6,3 %) вагітних, крайове передлежання — в 6 (18,7 %). Часткове передчасне відшарування нормально розміщеної плаценти спостерігалося в 9 (28,1 %) пацієнток (табл. 1).
У 8 (32,1 %) жінок діагностована прееклампсія: в 5 (20 %) вагітних із частковим відшаруванням нормально розміщеної плаценти і в 3 (12,1 %) з передлежанням плаценти (в 1 вагітної крайове передлежання, в 2 — низька плацентація). В 6 випадках діагностована прееклампсія легкого ступеня важкості, в 2 — середнього ступеня.
Строк вагітності пацієнток з матковою кровотечею становив 24—32 тижні. У всіх жінок обсяг крововтрати не перевищував 250 мл, були відсутні симптоми дистресу плода, геморагічного шоку, ДВЗ—синдрому, що дозволяло нам пролонгувати вагітність. З гемостатичною метою, а також для корекції гемостазу зазначеній групі жінок внутрівенно крапельно застосовувався препарат «Тугіна» за раніше зазначеною схемою. В жодної з пацієнток, пролікованих транексамовою кислотою, не спостерігався рецидив кровотечі під час вагітності. Всім вагітним проводилося кардіомоніторне і ультразвукове дослідження в динаміці з метою динамічного контролю стану плода. До досліджуваної групи ми включили 5 жінок з гіпотонічною кровотечею в ранньому післяпологовому періоді, що склало 15,5 % від загального числа спостережуваних пацієнток. В 3 з 5 жінок протягом вагітності діагностована низька плацентація, 1 пацієнтка в 27 тижнів вагітності стаціонарно спостерігалася з приводу часткового відшарування нормально розміщеної плаценти. Всім жінкам з ранньою післяпологовою кровотечею з гемостатичною метою застосовувався препарат «Тугіна» в дозі 15 мг/кг маси тіла в ізотонічному розчині натрію хлориду внутрівенно крапельно зі швидкістю введення 1 мл/хв однократно. Через 10 хвилин після початку введення препарату спостерігалося значне зменшення обсягу кровотечі.
Препарат «Тугіна» добре переноситься, у 5 (15,5 %) пацієнток спостерігалася незначна нудота і діарея.
Результат проведеного дослідження застосування препарату «Тугіна» при акушерських кровотечах довів високу ефективність останнього. Корекція гемостазу зазначеним препаратом дозволяє пролонгувати вагітність при маткових кровотечах на тлі передлежання плаценти і передчасного відшарування нормально розміщеної плаценти за рахунок інактивації плазміногену і зв’язування плазміну, в результаті чого сповільнюється руйнування фібринових згустків, фібриногену та інших протеїнів плазми крові, включаючи V і VIII фактори згортання крові. Успішним було його застосування і при гіпотонічних кровотечах, і під час кесарського розтину.
Подальше дослідження застосування транексамової кислоти у вигляді препарату «Тугіна» в акушерській практиці триває, про що буде повідомлено в наступних публікаціях.
Висновки
Препарат транексамової кислоти «Тугіна» є ефективним засобом при лікуванні акушерських кровотеч на тлі передлежання плаценти і передчасного відшарування нормально розміщеної плаценти в різні гестаційні терміни. Пригнічуючи протеолітичну активність плазміну і перетворення плазміногену вплазмін, зумовлене активаторами плазміногену, препарат «Тугіна» сприяє корекції порушень гемостазу, тим самим, здійснюючи гемостатичний ефект, що дозволяє пролонгувати вагітність і запобігти репродуктивним втратам.
Препарат «Тугіна» зменшує крововтрату при гіпотонії матки в ранньому післяпологовому періоді та є можливою альтернативою оперативним втручанням.
Проведені нами дослідження дозволяють зробити висновок про високу клінічну ефективність препарату «Тугіна» і рекомендувати його до застосування в акушерській практиці.
Література
Баранов И.И. Современные принципы лечения акушерских кровотечений // Вестник Российс- кой ассоциации акушеров-гинекологов. — 1999. —№2. — С. 24-27.
Яглов В.В. Маточные кровотечения и гемостаз // Репродуктивное здоровье женщины. — 2007. — Т. 9, №6. — С. 54-58.
Сидельникова В.М. Современные принципы терапии кровотечений в первом и втором три- местрах беременности // Журнал акушерства и женских болезней. — 2007. — Вып. 2, Т. LVI. — С. 46-49.
Юдаева Л.С., Макацария А.Д. Профилактика и коррекция тромбогеморрагических осложнений во время беременности и при кесаревом сечении у больных с врожденными заболеваниями соединительной ткани // Акушерство и гинеко- логия. — 2006.- №6. — С. 20 24.
Svanberg L., Astedt B., Nilsson I. Преждевре- менная отслойка плаценты — лечение антифибринолитиком транексамовой кислотой. // Acta Obstet Gynecol Scand. — 1980. — Vol. 59(2). — Р. 135-139.
Серов В.Н., Стрижаков А.Н., Маркин С.А. Руководство по практическому акушерству. — Москва: МИА,1997. -157 с.









Комментировать