Проблема образований яичников у женщин. Подробное описание.
Е.Н. НОСЕНКО, д.м.н., доцент, Научно-исследовательский институт медицинских проблем семьи, Донецкий национальный медицинский университет им. М. Горького
Проблема образований яичников у женщин, заинтересованных в реализации репродуктивной функции, в Украине стоит очень остро, особенно в промышленных районах, таких как Донецкая область. Частота выявляемости впервые в жизни новообразований яичников у девочек-подростков на 10 000 населения соответствующего возраста в Донецкой области в 2,09 раза превышает таковую по Украине, а у женщин работоспособного возраста — в 1,28 раза. Обращает на себя внимание увеличение количества оперативных вмешательств у девочек и девочек-подростков на 23,5 %.
Яичник по своей природе и роли в жизнедеятельности женского организма является уникальным органом. Многокомпонентное строение гонад, сочетание структур самых разных функциональных направлений обусловливают широчайший спектр гистологических форм новообразований этого органа, которые по своему разнообразию занимают среди опухолей других органов человека одно из первых мест. Большинство из них доброкачественные, на их долю приходится до 75–87 % всех объемных образований этого органа. Согласно Международной гистологической классификации Всемирной организации здравоохранения (ВОЗ) (1977) к доброкачественным образованиям яичников относятся истинные опухоли и опухолевидные процессы, такие как:
1. Эпителиальные опухоли:
а) серозные (цистаденома и папиллярная цистаденома, поверхностная папиллома, аденофиброма и цистаденофиброма);
б) муцинозные (цистаденома, аденофиброма и цистаденофиброма);
в) эндометриоидные (аденома, цистаденома, аденофиброма и цистаденофиброма);
г) светлоклеточные или мезонефроидные (аденофиброма);
д) опухоли Бреннера (доброкачественные);
е) смешанные эпителиальные опухоли (доброкачественные).
2. Опухоли стромы полового тяжа: текома, фиброма.
3. Герминогенные опухоли: зрелые тератомы (солидные, кистозные).
4. Опухолевидные процессы яичников:
а) лютеомы беременности;
б) гиперплазия стромы яичника и гипертекоз;
в) массивный отек яичника;
г) одиночные фолликулярная киста и киста желтого тела;
д) множественные фолликулярные кисты (поликистоз яичников);
е) множественные лютеинизированные фолликулярные кисты и/или кисты желтого тела;
ж) эндометриоз;
з) поверхностные эпителиальные кисты, включения (герминальные кисты, включения);
и) простые кисты;
к) воспалительные процессы;
л) параовариальные кисты.
Согласно пересмотренной Международной гистологической классификации ВОЗ (1999) к доброкачественным образованиям яичников относятся такие истинные опухоли и опухолевидные процессы, как:
1. Поверхностные эпителиально-стромальные опухоли:
1.1. Серозные опухоли.
1.1.1. Доброкачественные (цистаденома, поверхностная папиллома, аденофиброма).
1.2. Муцинозные опухоли, эндоцервикальноподобный и кишечный типы.
1.2.1. Доброкачественные (цистаденома и цистаденофиброма).
1.3. Эндометриоидные опухоли (с чешуйчатой дифференциацией и без таковой).
1.3.1. Доброкачественные (цистаденома, аденофиброма).
1.4. Чистые клеточные опухоли.
1.4.1. Доброкачественные (цистаденома, аденофиброма).
1.5. Переходные клеточные опухоли.
1.5.1. Опухоли Бреннера (доброкачественные).
1.6. Чешуйчатые клеточные опухоли.
1.8. Смешанные эпителиальные опухоли.
1.8.1. Доброкачественные.
2. Опухоли стромы полового тяжа.
2.1.2. Опухоли текомо-фиброзной группы.
2.1.2.1. Текома.
2.1.2.1.1. Типичная.
2.1.2.1.2. Лютеинизированная.
3. Опухоли герминальных клеток.
3.6. Тератомы.
3.6.2. Зрелые.
3.6.2.1. Солидные.
3.6.2.2. Кистозные (дермоидные кисты).
3.6.2.3. С вторичными опухолями.
3.6.2.4. Фетоподобные (гомункулюс).
3.6.3. Монодермальные.
3.6.3.1. Струма яичника.
6. Опухоли сети яичника.
6.1. Аденома и цистаденома.
14. Опухолевидные процессы.
14.1. Одиночная фолликулярная киста.
14.2. Болезнь поликистозных яичников.
14.3. Стромальный гипертекоз.
14.4. Массивный отек.
14.5. Фиброматоз.
14.6. Лютеома беременности.
14.7. Лютеиновая гиперактивность.
14.8. Большая одиночная фолликулярная киста беременности.
14.9. Эндометриоз.
14.10. Воспалительные поражения.
В приведенных классификациях перечислены доброкачественные образования яичников, которые имеют как солидную, так и кистозную структуру, а также включены двусторонние опухолевидные гиперандрогенные и воспалительные поражения яичников.
Мы считаем целесообразным выделить из приведенных гистологических классификаций группу доброкачественных кистозных образований яичников (ДКОЯ) в связи со следующим:
— ДКОЯ являются достаточно распространенной патологией среди женщин — до 15 % чревосечений в гинекологических отделениях выполняются непосредственно по этой причине;
— при ДКОЯ возможно проведение органосохраняющего лечения, что приобретает особенно большое значение в группе женщин репродуктивного возраста;
— ДКОЯ — это показание для оказания оперативной помощи с использованием лапароскопического доступа;
— лечение функциональных кист яичников у женщин репродуктивного возраста возможно осуществлять медикаментозными способами и проведением трансвагинального иглового аспирационного дренирования.
ДКОЯ включают кистозные доброкачественные опухоли яичников, или кистомы (серозная цистаденома, муцинозная цистаденома, зрелая кистозная тератома), и кистозные опухолевидные образования яичников, или кисты (фолликулярная киста, киста желтого тела, эндометриоидная киста, простая киста, или киста без эпителиальной выстилки, параовариальная киста).
По Международной статистической классификации болезней Х пересмотра выделяют:
D27 — доброкачественные новообразования яичников
N80.1 — эндометриоз яичника
N83.0 — фолликулярная киста яичника
Киста граафова фолликула
Геморрагическая фолликулярная киста яичника
N83.1 — киста желтого тела
Геморрагическая киста желтого тела
N83.2 — другие и неуточненные кисты яичников
Ретенционная киста яичника
Простая киста яичника
Q50.5 — эмбриональная киста широкой связки
Киста эпоофорона
Параовариальная киста
Эпителиальные кистомы яичников в гистогенетическом отношении рассматриваются как опухоли парамезонефроидного целомического (мюллерова) происхождения (K.M. Feely et al., 2001). Хотя яичник возникает не из мюллерова канала, источник этих опухолей, а именно поверхностный эпителий, происходит из целомического эпителия (H. Okamura et al., 2001). Плюрипотентный целомический эпителий половых складок у эмбриона дает начало мюллеровым (парамезонефральным) протокам, из которых развивается эндоцервикальный, эндометриальный и трубный эпителий. Об этом свидетельствуют и наблюдения, в которых одна и та же опухоль представлена компонентами серозной и муцинозной, реже серозной, муцинозной и эндометриоидной опухолей (смешанные, или полиморфные опухоли).
Серозные цистаденомы имеют стенку, образованную из слоя соединительной ткани и цилиндрического или кубического эпителия типа трубного с разной функциональной активностью
Муцинозные цистаденомы имеют стенку, образованную из слоя соединительной ткани различной плотности и цилиндрического эпителия со светлой цитоплазмой, которая вмещает муцин, и с темными гиперхромными ядрами. Этот вид кистом разделяется на два типа: выстеленные эпителием эндоцервикального типа и эпителием кишечного типа. Преобладает эндоцервикальный тип выстилки — 94 % случаев, тогда как муцинозные цистаденомы с выстилкой кишечного типа встречаются лишь в 6 % случаев.
Тератомы рассматриваются как приобретенные неопластические заболевания, и фамильные случаи в литературе практически отсутствуют. Зрелые кистозные тератомы представлены организмоидными образованиями в 5,88 %, органоидными — в 11,76 %, гистиоидными — в 82,35 % случаев. Тканевый и органный состав зрелых кистозных тератом разный: эктодерма (эпидермис; кожа с ее производными в виде сальных, потовых желез, волос; нервная ткань (нейроглия, мозжечок); органы дыхания (ткани трахеи, бронха, слизистой полости носа); органы пищеварения (зубы, слюнные железы, гладкомышечная ткань, покрытая кишечным эпителием); щитовидная железа; кости и хрящи. Большинство гистиоидных зрелых кистозных тератом представлено дермоидными кистомами (70,59 %). Бугор, который оказывается на участке дермоидной кистомы, обращенной к непораженной опухолью части яичника, представляет собой тело зрелой кистозной тератомы и наблюдается в 58,82 % случаев. В 23,53 % случаев он является однородным, в 11,76 % представлен хрящевой и костной тканью, в 17,65 % характеризуется наличием полостей, заполненных жиром и волосами. В 5,88 % случаев в ткани бугра наблюдаются зубы.
Функциональные кисты яичников возникают из физиологических структур яичника. Важнейшей их чертой в значительном количестве случаев является транзиторный характер существования
Считается, что фолликулярные кисты развиваются в результате кистозной трансформации антральных фолликулов. Формальным признаком перехода физиологического по своей сути процесса кистозной трансформации антрального фолликула в патологическую фолликулярную кисту служит размер кистозного образования. Фолликулярные кисты имеют размеры свыше 2 см. По мнению Н.Д. Селезневой и соавт. (1982), к формированию фолликулярных кист ведет персистенция неразорвавшегося доминантного фолликула, в полости которого накапливается фолликулярная жидкость. Стенка кисты содержит гранулезные клетки и текаклетки. При достижении кистой больших размеров и соответственно при ее длительной персистенции (2–3 месяца) клетки, выстилающие стенку кисты, могут слущиваться или подвергаться процессу гиалинизации. Фолликулярные кисты обычно исчезают на протяжении 2–4 месяцев за счет резорбции их содержимого. Стенки спавшейся кисты подвергаются облитерации с превращением в фиброзные (гиалиновые) атретические тела (Т.В. Полякова, 2002).
По данным литературы, такие функциональные кисты, как кисты желтого тела, образуются вследствие нарушений кровообращения и лимфооттока в желтом теле, что приводит к накоплению жидкости в просвете последнего (Н.А. Краевский, 1993). Лютеиновые и текалютеиновые клетки располагаются в стенке кисты в виде пластов или отдельных групп, причем во всех случаях гистологически можно определить стадию развития желтого тела (пролиферация, васкуляризация, расцвет, дистрофия и обратное развитие). Обратное развитие лютеиновой кисты, как и желтого тела, продолжается не менее 2 месяцев, заканчивается формированием белого тела яичника, являющегося гиалиновым образованием (Н.А. Краевский, 1993; Т.В. Полякова, 2002).
Параовариальные кисты в соответствии с Международной классификацией болезней Х пересмотра отнесены к порокам развития в раздел эмбриональных кист широкой связки матки. У женщин фертильного возраста эпителиоциты канальцев параовариума обладают секреторной активностью, что проявляется появлением пеноподобного содержимого в просвете канальцев и наличием секреторных гранул в цитоплазме эпителиоцитов. У новорожденных и в постменопаузальном периоде подобные явления не отмечены. В связи с этим не исключается, что появление параовариальных кист, возможно, связано с повышенной функциональной активностью и гиперплазией эпителия канальцев параовариума, что сопровождается фибромаскуляризацией подлежащей стромы (Ю.В. Ефименко, 2004; K. Kishimoto et al., 2002; G.G. Long, 2002).
В группе кист яичников особое место занимают эндометриоидные кисты вследствие максимального приближения их свойств к истинным опухолям (H. Steed et al., 2004). Наиболее общепринятой является теория происхождения эндометриоидных кист путем метастатического приживления частиц жизнеспособной ткани эутопического эндометрия (эксфолиатов) во время ретроградной менструации (C. Wellberry, 1999; C.P. Crum,
1999; R.S. Schenken, 1999, и др.). Другие возможные маршруты метастатического происхождения включают транспорт частиц эндометриальной ткани в яичник через кровеносные, лимфатические сосуды или ятрогенно во время оперативных вмешательств или игловой биопсии (D. Sarma, 2004; C.M. Hartigan et al., 2005; P. Cervini et al., 2005).
Вторая теория гистогенеза эндометриоидных кист
— это теория метапластической дифференцировки серозных поверхностей (целомического эпителия) или остатков ткани мюллерового протока (R.K. Yantiss et al.,2000; P. Nikolaidis et al., 2005).
Третья современная теория гистогенеза эндометриоидных кист — индукционная, которая является комбинацией первых двух. Она свидетельствует о том, что эндометрий продуцирует субстанции, индуцирующие формирование эндометриоидной ткани из недифференцированной мезенхимы. Эти субстанции не идентифицированы, но исследование на животных показало образование эндометриальных желез (но не стромы) при проведении экспериментов для проверки этой теории (P.J. Woodward et al., 2001).
Кисты без эпителиальной выстилки, или простые кисты, — большая группа кист яичников с разным гистогенезом. По нашему мнению, по своей сути эти кисты являются конечным этапом развития и существования некоторых эндометриоидных, фолликулярных кист, кист желтого тела, серозных цистаденом, параовариальных кист. Потеря эпителиальной выстилки в результате слущивания или атрофии, частого склерозирования или гиалинизации подлежащих слоев не дает возможности при морфологическом исследовании точно указать на гистогенез этих кист.
Согласно проведенным нами эпидемиологическим исследованиям в Донецкой области, частота прооперированных с кистами превышает таковую с кистомами в 2,92 раза, то есть в структуре ДКОЯ 74,49 % составляют кисты яичников, 25,51 % — кистомы. Среди прооперированных кистом яичников чаще всего наблюдаются серозные цистаденомы (44,1 %), зрелые кистозные тератомы (21,9 %), муцинозные цистаденомы (8,55 %), а среди кист яичиков — фолликулярные кисты (41,3 %), кисты желтого тела (25,4 %), кисты без эпителиальной выстилки (14,9 %), эндометриоидные кисты (11,8 %), параовариальные кисты (6,6 %).
Непосредственно в отделении эндохирургической гинекологии Донецкого регионального центра охраны материнства и детства с 1995 по 2005 гг. было прооперировано 2282 женщины с ДКОЯ, из которых в 74,2 % случаев встречались кисты и в 25,8 % — кистомы яичников в различных сочетаниях. В спектре прооперированных лапароскопическим доступом кист яичников чаще всего встречались фолликулярные кисты (27,8 %), кисты желтого тела (26,5 %), эндометриоидные кисты (23,4 %), параовариальные кисты (19,2 %), кисты без эпителиальной выстилки (8,3 %), а из кистом яичников — зрелые кистозные тератомы (64,5 %), серозные цистаденомы (17,0 %), муцинозные цистаденомы (15,3 %).
При обследовании 11 013 девочек и девочек-подростков, которые находились на лечении в отделении детской и подростковой гинекологии Донецкого регионального центра охраны материнства и детства с 1999 по 2005 гг., у 8,76 % пациенток выявлены ДКОЯ, среди которых 89,53 % случаев составили кисты и 10,47 % — кистомы яичников. Из всех разновидностей ДКОЯ у девочек чаще всего встречались кисты желтого тела (57,99 % пациенток), что совпадает с данными Т.В. Поляковой (2002). В группе с кистами яичников у 85,28 % пациенток с функциональными кистами наступила редукция образований на фоне этиопатогенетической терапии, а 14,72% девочек и девочек-подростков были прооперированы с использованием лапароскопического доступа.
Основой успешного лечения и реабилитации любого заболевания является изучение его этиоморфопатогенеза. Анализ литературы показывает, что опухоли человека генетически детерминированы, а их формирование и прогрессирование — многостадийный процесс, который базируется как на наследственных факторах, так и на многочисленных генетических альтерациях и аберрациях.
Есть исследования, указывающие на связь развития овариального опухолевого процесса с таким характерным генетическим маркером, как группа крови. По данным В.И. Кулакова и др. (2005), при обследовании женщин с ДКОЯ установлено, что чаще всего среди них встречались группы 0(І) и А(ІІ). В нашем исследовании выявлено, что распределение групп крови и резус-принадлежности у прооперированных пациенток с ДКОЯ не отличалось от такового в контроле и в популяции, то есть связи между группой крови, резус-принадлежностью и склонностью к ДКОЯ не существует.
По данным В.Е. Радзинского, А.О. Духиной (2004), у ближайших родственников 11,4 % обследованных пациенток с ДКОЯ в анамнезе имеют место злокачественные новообразования. В нашем исследовании злокачественные новообразования гениталий встречались у 1,63 % матерей и 0,67 % сестер пациенток с кистами и у 3,05 % матерей и 0,88 % сестер пациенток с кистомами яичников. Доброкачественные опухолевые заболевания гениталий также наблюдались чаще у матерей, чем у сестер пациенток с ДКОЯ. Частота заболеваемости ДКОЯ у матерей пациенток с кистами (13,00 %) превышала таковую у матерей пациенток с кистомами (8,07 %) в 1,61 раза. 26,33 % матерей женщин с кистомами и 21,01 % — с кистами имели лейомиому матки. Из наследственной экстрагенитальной патологии чаще всего встречался сахарный диабет, который наблюдался у 15,32 % родственников пациенток с кистами и у 12,67 % — с кистомами. Чаще всего сахарный диабет встречался у родственников женщин с эндометриоидными кистами (18,44 %).
Опираясь на данные анализа литературы, можно предположить, что в основе гистогенеза кистом яичников лежат нарушения трансдукционного контроля, регуляции клеточного цикла и апоптоза в дизонтогенетических структурах в яичнике, связанных по происхождению с мезонефросом.
О выраженных клеточных изменениях в кистомах яичников свидетельствуют результаты проведенных нами иммуногистохимических и лектиногистохимических исследований.
Универсальным молекулярным механизмом, который лежит в основе взаимосвязи и функционирования всех живых систем — от вирусов до человека — является специфическое лектин-углеводное распознавание. Лектины — это группа белков неиммунного происхождения, которые обладают общим свойством распознавать и обратно и избирательно связывать углеводы и углеводные детерминанты комплексов углеводов с гликоконъюгатами, такими как гликопротеины, протеогликаны/гликозаминогликаны и гликолипиды, без изменений их ковалентной структуры. Этот класс протеинов является посредником важных процессов адгезии и коммуникации как внутри, так и за пределами клеток.
Лектины проявляют максимальное сродство к олигосахаридам строго определенной структуры, что предоставляет им преимущество при идентификации нераспознаваемых по другим морфои гистогенетическим признакам клеточных элементов. Считается перспективным применение меченых лектинов в изучении изменений клеточных мембран и структуры секреторных гликоконъюгатов при патологических процессах, в том числе при опухолевом росте, потому что множество ассоциируемых с опухолями антигенов являются биополимерами, вмещающими углеводы.
Допускается, что диффузное оседание лектинов на плазмолемме в доброкачественной опухоли является одним из признаков ее возможной малигнизации. Усиление сродства к лектинам может быть обусловлено уменьшением степени межклеточной связи опухолевых клеток и выявлением углеводных детерминант внешнего слоя цитолеммы, что делает возможным проникновение лектинов внутрь клетки и оседание их на соответствующих углеводных фрагментах цитозоля. Увеличение количества рецепторов объясняют незавершенностью окончательного гликозилирования рецепторов лектинов в связи с нарушением метаболизма в опухолевой клетке. Рост пролиферативной активности опухолей сопровождается повышением количества рецепторов лектинов в клетках.
По полученным нами данным, накопление лектиновых рецепторов в зрелых кистозных тератомах зависело от гистогенеза этих образований и было гетерогенным. Выявлена экспрессия рецепторов LABA и MLE (от умеренной до высокой) в эпидермисе дермоидных кистом. В сальных железах, а также в просвете и апикальном крае потовых желез, хондроцитов, бронхиального и кишечного эпителия зрелых кистозных тератом отмечалось умеренное содержание рецепторов SNA. В сальных железах встречалась также слабая и умеренная экспрессия рецепторов HPA, WGA SBA. Отмечалось умеренное накопление рецепторов HPA и РNA в сосудах и бронхиальном эпителии, РNA — в клетках щитовидной железы.
Характерным для серозных и муцинозных цистаденом было накопление в их клетках в отличие от кист рецепторов PNA, WGA, SBI. Наибольшим среди рецепторов гликоконъюгатов в эпителии некоторых серозных цистаденом было содержание рецепторов PNA и WGA. Папиллярные серозные цистаденомы отличались умеренным накоплением в цитоплазме эпителия сосочков SBI, MLE и WGA. Муцинозные цистаденомы отличались от других ДКОЯ наибольшим накоплением гликоконъюгатов в эпителиальной выстилке. Наиболее интенсивной и равномерной в муцинозных цистаденомах была экспрессия рецепторов SNA и SBI. Также отмечалась мозаичная интенсивная экспрессия рецепторов PNA, WGA, LABA, LCA, HPA.
Появление рецепторов PNA, SBI, HPA в клетках серозных и муцинозных цистаденом было обусловлено нарушением процессов окончательного гликозилирования углеводсодержащих биополимеров, а именно отсутствием маскировки терминальных остатков D-галактозы сиаловой кислотой. Отмеченные нарушения окончательного гликозилирования рецепторов лектинов в серозных и муцинозных цистаденомах — это проявление резко сниженной общей способности опухолевых клеток продуцировать гликопротеины и гликолипиды с полностью синтезированной олигосахаридной цепочкой.
Гиперсиализация эпителиальных клеток серозных и муцинозных цистаденом, сопровождающаяся накоплением рецепторов WGA и SNA, свидетельствует о снижении дифференциации клеток. Опухолевые клетки с гиперсиализованной поверхностью также не распознаются системой мононуклеарных фагоцитов.
Обычно в гиперсиализованных клетках отсутствует накопление фукоконъюгатов. Нами выявлено, что характерной чертой клеток муцинозных цистаденом было одновременное наличие фукои сиалоконъюгатов.
Мозаичность экспрессии рецепторов можно объяснить образованием локальной скученности рецепторов в определенных участках плазмолеммы в результате изменения молекулярно-пространственной структуры гликоконъюгатов поверхности плазмолеммы опухолевых клеток и роста подвижности мембранных рецепторов лектинов, то есть кэппинг-феноменом. Совокупность перечисленного состава и свойств поверхностных гликоконъюгатов обусловливает отсутствие контактного торможения пролиферации — кардинального признака истинных опухолевых клеток.
В клеточной адгезии важную роль играют также фуколиганды мембранных гликоконъюгатов. В нашем исследовании зрелые кистозные тератомы имели высокое или умеренное содержание рецепторов фуколектина LABA, тогда как серозные и муцинозные цистаденомы — от отсутствия до слабого содержания, что свидетельствует о нарастании свойств неоплазии в этих цистаденомах. Снижение прочности поверхностных гликоконъюгатов, синтезируемых опухолевыми клетками, способствовало предотвращению их элиминации клетками иммунной системы.
Одним из важных регуляторов клеточного цикла, а также пролиферации клеток является PCNA — ядерный фактор пролиферации (Proliferating Cell Nuclear Antigen), который представляет собой кофактор ДНК δ-полимеразы и имеет массу 36 кДа. Он играет важную роль в синтезе ДНК и инициации клеточной пролиферации, синтезируется в поздней фазе G1 и S клеточного цикла и таким образом коррелирует с клеточным размножением. PCNA найден при иммуногистохимической обработке парафиновых секций нормальных и малигнизированных тканей молочной железы, желудка, поджелудочной железы, предстательной железы, яичников. В регуляции активности PCNA играют роль факторы роста и другие стимуляторы пролиферации. Выявлено, что в яичниках коров в растущих антральных фолликулах идет накопление PCNA-позитивных клеток, а следовательно, пролиферативная активность гранулезных клеток выше в базальных отделах, чем в апикальных, и клеточная пролиферативная активность в гранулезе и theca interna может уменьшаться при индукции фолликулярных кист. Изучение активности PCNA в стенках образований может способствовать определению пролиферативной активности отдельных видов ДКОЯ. О высокой пролиферативной активности кистом яичников свидетельствовало выявление нами PCNA-реактивных клеток в прооперированных нами серозных цистаденомах в 33,33 % и муцинозных цистаденомах в 27,77 % случаев.
Эпидемиологические исследования указывают на взаимосвязь между овариальными опухолями и половыми гормонами. А . Kurjak et al. (1998) выявили, что 84 % доброкачественных и злокачественных овариальных опухолей продуцируют рецепторы андрогенов, 74,19 % — эстрогенов и 41,16 % — прогестерона. Все доброкачественные опухоли показывают преимущественно ядерную иммунореактивность для всех трех типов рецепторов. P.R. Lindgren et al. (2004) сообщают о наличии симультанной экспрессии рецепторов эстрогенов-α, эстрогенов-β и рецепторов прогестерона в эпителиальных клетках всех гистопатологических типов доброкачественных опухолей. Исключение составляют муцинозные цистаденомы, в которых наблюдается экспрессия рецепторов эстрогенов-β, а продукция рецепторов эстрогенов-α и рецепторов прогестерона отсутствует.
При исследовании нами стероидрецепторного аппарата ДКОЯ показано, что в зрелых кистозных тератомах отсутствовала экспрессия стероидных рецепторов. В серозных цистаденомах в 40 % случаев регистрировались рецепторы эстрогенов, прогесторона и андрогенов. У пациенток с муцинозными цистаденомами в 70 % случаев выявлена мозаичная экспрессия рецепторов эстрогенов, прогестерона и андрогенов.
В кистах яичников имеют место аналогичные таковым в кистомах, но менее выраженные нарушения трансдукционного контроля, регуляции клеточного цикла и апоптоза. По нашему мнению, хотя фолликулярные кисты и кисты желтого тела развиваются из функциональных структур яичника, таких как антральные фолликулы и желтые тела, нельзя сводить этот процесс просто к механическому — ретенции функциональных образований вследствие нарушенного кровообращения, лимфооттока и накопления жидкости в просвете последних. Выявленные нами клеточный полиморфизм, нарушение ферментативной активности, утрата рецепции к половым стероидным гормонам и накопление в апикальном крае и цитоплазме клеток персистирующих функциональных кист рецепторов лектинов LABA, HPA, SNA указывают на возможное их развитие из функциональных структур яичника с генетическими аберрациями или альтерациями. На это косвенно указывает и то, что в яичниках с кистами достаточно часто встречаются примордиальные фолликулы с деформированными, дистрофизированными яйцеклетками — возможный источник развития фолликулярных кист и кист желтого тела. Очень важным является то, что степень клеточных нарушений в разных функциональных кистах яичников различна. Одни из них могут самостоятельно регрессировать, не утратили рецепторов к гормонам и отвечают на гормональное лечение, другие длительное время персистируют, утратили стероидные рецепторы и нечувствительны к гормонотерапии.
Прооперированные нами фолликулярные кисты, кисты желтого тела с персистенцией свыше двух месяцев характеризовались отсутствием или незначительными следами рецепторов эстрогенов, прогестерона и андрогенов. То есть на сегодня можно говорить о гормоночувствительных и гормонорезистентных функциональных кистах яичников.
Особое место среди опухолевидных образований яичников занимают параовариальные и эндометриоидные кисты.
Параовариальные кисты являются пороком развития с отсутствием в 50 % или с низким содержанием в 50 % случаев стероидных рецепторов в эпителиальной выстилке и поэтому не отвечают на гормональную терапию.
Эндометриоидные кисты яичников развиваются как из дизонтогенетических структур в яичнике, так и в результате приживления жизнеспособных эндометриальных эксфолиатов. Проведенная иммуногистохимическая оценка экспрессии ядерных рецепторов половых гормонов яичников показала, что в эндометриоидных кистах наблюдаются следы экспрессии ядерных рецепторов к эстрогенам в 60 % случаев и от высокой и умеренной экспрессии до следов — в 40 %, отсутствие ядерных рецепторов прогестерона, низкая экспрессия рецепторов андрогенов — в 50 % случаев. О высоком пролиферативном потенциале эндометриоидных кист свидетельствовало наличие PCNA-реактивных клеток в эпителиальной выстилке и подлежащей строме в 58,82 % случаев. Эндометриоидные кисты не отвечают на гормональную терапию и требуют только проведения оперативного лечения.
Следует подчеркнуть, что все кисты яичников отличало высокое или умеренное содержание в клетках фуколектина LABA, что свидетельствовало о сохранении клеточной адгезии по сравнению с кистомами.
Результаты проведенных исследований показали, что в инициации и росте ДКОЯ играют роль половое созревание, перенесенные вирусные инфекции, воспалительные заболевания придатков матки, нарушения гомеостаза в основных регуляторных системах организма — нейроиммунноэндокринной, свободнорадикального окисления и антиоксидантной защиты.
Анализ возрастного распределения юных пациенток выявил, что резкое увеличение частоты возникновения ДКОЯ приходится на 13–14 лет — период начала менструаций. Пик заболеваемости (22,2 %) соответствовал возрасту 17 лет, то есть периоду завершения формирования репродуктивной системы, что подтверждает мысль о периоде полового созревания как одном из важных факторов инициации роста ДКОЯ. Именно в этот период доминируют изменения в системе «гипоталамус — гипофиз — яичники» с выраженной активацией завершающего звена этой системы — яичников, что может привести к активации дизонтогенетических структур в яичнике и появлению объемных образований яичников в детском и пубертатном возрасте.
Состав обследованных клинических групп в зависимости от социального статуса женщин практически достоверно не отличался. В большинстве групп с ДКОЯ подавляющей когортой были служащие (от 36,99 до 56,67 %), значительная часть которых имела высшее образование. Следовательно, период формирования и становления овуляторной и репродуктивной функции у них сопровождался повышенным нервно-психическим напряжением. Но отсутствие различий с контрольной группой не дает возможности подтвердить мысль, что профессия, связанная с нервно-психическим перенапряжением, играет роль в развитии каких-либо форм ДКОЯ.
На инициацию ДКОЯ не оказывает влияния возраст начала половой жизни, так как в обследованных нами группах он не имел достоверных отличий с контролем.
12,10 % кист и 22,33 % кистом выявлялись у женщин, еще не имевших половых отношений.
Изучение инфектологического анамнеза показало, что каждая вторая пациентка с ДКОЯ перенесла ветряную оспу, каждая седьмая — паротит. Высокая частота перенесенных в детском возрасте вирусных инфекций, при которых в воспалительный процесс могут вовлекаться половые железы, свидетельствует, что опухолевый процесс в яичниках развивается на неблагоприятном преморбидном фоне, который формируется еще до начала менархе и полового созревания, что может приводить к патологическим изменениям гомеостаза в основных регуляторных системах организма и способствовать нарушениям репродукции.
62,12 % женщин с кистами и 33,11 % с кистомами указывали на перенесенный в анамнезе острый или хронический аднексит. Урогенитальные инфекции встречались в анамнезе у 41,01 % больных с кистами и 31,33 % с кистомами. На фоне воспалительных заболеваний гениталий возникают различные патологические изменения в эндокринной, иммунной, нервной и других системах женского организма, что может способствовать возникновению клеточных изменений и опухолевому росту.
Исследование экспрессии гонадотропинов в раннюю фолликулиновую фазу менструального цикла показало, что при кистах концентрация сывороточного ЛГ превышала норму в 51,09 % случаев, а при кистомах — в 80,15 %; содержание ФСГ при кистах было ниже нормы в 11,43 % и выше — в 6,52 % случаев, а при кистомах соответственно в 4,58 и 6,87 % случаев; уровень ПРЛ при кистах регистрировался ниже нормы у 3,80 % и выше — у 16,85 % пациенток, а при кистомах соответственно у 3,05 и 9,92 %.
Средний уровень сывороточного ЛГ превышал таковой в контроле при кистах в 2,21 раза, а при КДОЯ — в 2,77 раза; ФСГ соответственно в 1,24 раза, а при кистомах — в 1,27 раза; уровень ПРЛ в сыворотке крови при кистах яичников, кистомах и в контроле не имел достоверных отличий, но достоверно превышал таковой в контроле при эндометриоидных кистах в 1,27 раза, при кистах желтого тела — в 1,67 раза и был ниже в 1,22 раза при фолликулярных кистах.
Уровни половых гормонов в раннюю фолликулиновую фазу в сыворотке периферической крови больных с ДКОЯ либо находились в пределах нормативных значений, либо превышали их. Так, в группе с кистами уровень Э2 был выше нормативных значений у 59,24 % пациенток, прогестерона — у 24,24 %, тестостерона — у 36,96 %, андростендиона — у 52,17 %, а с кистомами соответственно у 36,64; 36,64; 67,94 и 57,25 %. Средняя концентрация Э2 в сыворотке крови превышала таковую в контроле при кистах в 3,17 раза, а при кистомах в 4,18 раза; прогестерона — в 2,41 и 1,75 раза; тестостерона — в 3,47 и 7,84 раза; андростендиона — в 1,69 и 1,79 раза. Один из механизмов повышения прогестерона в фолликулиновую фазу, возможно, связан с высокой концентрацией ФНО-α, который в недифференцированных овариальных клетках подавляет стероидогенез, а в дифференцированных стимулирует синтез прогестерона.
На развитие ДКОЯ на фоне гиперандрогении смешанного генеза указывали повышенные относительно нормы уровни дегидроэпиандростерона у 6,52 % пациенток с кистами и у 21,37 % с кистомами яичников. Средняя концентрация дегидроэпиандростерона в сыворотке крови превышала таковую в контроле при кистах в 1,36 и при кистомах — в 1,77 раза. Концентрация кортизола была ниже нормы у 19,57 % пациенток с кистами и 33,59 % с кистомами, а выше — лишь у 11,96 % больных с кистами, в основном за счет превышения показателей нормы у 60,61 % пациенток с кистами желтого тела. Средний уровень кортизола при кистах яичников достоверно не отличался от такового в контроле, а при кистомах был меньше в 1,56 раза.
О том, что ДКОЯ развиваются на фоне овариальной гиперандрогении, свидетельствовали и данные морфологических исследований. По их результатам, в яичниках с доброкачественными кистозными образованиями (ДКО) были выражены гиперандрогенные опухолевидные процессы — поликистоз, гиперплазия функционально активной текаткани и стромальный текоматоз.
О наличии поликистозной трансформации таких яичников свидетельствовало преобладание в гистосрезах яичников с ДКО увеличенного количества атретических тел в результате процессов торможения регрессивной трансформации антральных фолликулов яичников на фоне повышенного уровня ЛГ и соотношения ЛГ/ФСГ. Атретические тела встречалась при кистах и кистомах чаще по сравнению с контрольной группой в 1,23 раза. Количество кистозных форм атретических тел при кистах и кистомах яичников превышало таковое по сравнению с контролем соответственно в 2,12 и в 2,53 раза, фиброзных — в 2,86 и 2,20 раза, фиброзно-кистозных — в 3,74 и 3,60 раза. В контрольной группе соответственно в 1,95 и 1,32 раза чаще, чем при кистах и кистомах, встречались лютеинизированные атретические тела — прототип желтого тела.
Строма яичника является важной интерстициальной гормонпродуцирующей тканью яичников и представлена веретеноклеточной текатканью, мультипотентной по своим морфологическим и функциональным свойствам, что наиболее ярко проявляется в патологических условиях. Функциональные свойства клеток овариальной стромы выражаются, с одной стороны, в синтезе коллагена, с другой — в продукции стероидных гормонов, среди которых основным является андростендион, в меньшей степени — тестостерон. Исследование стромы яичников с ДКО показало, что при кистах и кистомах яичников наблюдалась выраженная гиперплазия текаткани в корковом слое соответственно у 29,67 и 32,00 % женщин, в мозговом слое — у 26,37 и у 32,00 %. Очаги стромального текоматоза в контроле были представлены единичными клетками или имели небольшие размеры, тогда как при кистомах существенно отличались и достигали размеров от 1 до 6 полей зрения микроскопа как в корковом, так и в мозговом слое. Наиболее выраженный стромальный текоматоз наблюдался среди кист при эндометриоидных и фолликулярных кистах, а при кистомах — при муцинозных цистаденомах.
При ДКОЯ наблюдается снижение продукции печенью стероидсвязывающего глобулина, что сопровождается уменьшением его концентрации в сыворотке крови ниже нормативных показателей у 28,80 % пациенток с кистами, у 31,30 % — с кистомами и уменьшением по сравнению с контрольными показателями соответственно в 1,61 и 1,62 раза.
Средний уровень инсулина сыворотки периферической крови при кистах был выше такового в контроле в 1,18, при кистомах — в 1,54 раза, а глюкозы — ниже контрольных значений в 1,08 раза как при кистах, так и при кистомах.
Уровень ТТГ превышал нормативные показатели у 14,67 % больных с кистами яичников и у 18,32 % с кистомами. Уровень Т3 был ниже нормы у 21,20 % больных с кистами и у 23,66 % с кистомами, Т4 — соответственно у 14,67 и 11,45 %. Средняя концентрация ТТГ в сыворотке крови превышала таковую в контроле при кистах в 2,54 раза, а при кистомах — в 2,80 раза, при этом средняя концентрация Т3 была ниже таковой в контроле соответственно в 1,36 и 1,38 раза, а содержание Т4 — в 1,39 и 1,48 раза.
Анализ коэффициентов соотношения гормонов сыворотки периферической крови указывает на наличие эндокринного дисбаланса при ДКОЯ: нарушение соотношения гонадотропинов с увеличением коэффициента ЛГ/ФСГ в 2,08 раза при кистах и в 2,30 при кистомах, баланса стероидных гормонов с повышением коэффициентов Э2/П в 1,87 при кистах и в 1,56 раза при кистомах, Э2/АС — соответственно в 2,27 и 2,75 раза, Э2/ ДГЭАС — в 2,63 и 3 раза. Коэффициент соотношения инсулин/глюкоза был выше, чем в контроле, при кистах в 1,33 раза, при кистомах — в 1,77. Наибольший индекс ЛГ/ФСГ отмечался при кистах желтого тела; Э2/П — при эндометриоидных кистах, Э2/Т и Э2/АС — при кистах без эпителиальной выстилки, Э2/ДГЕАС — при муцинозных цистаденомах, инсулин/глюкоза — при зрелых кистозных тератомах и серозных цистаденомах.
При проведении корреляционного анализа не выявлено взаимосвязи между уровнем каких-либо гормонов в сыворотке периферической крови и размерами ДКОЯ. В то же время установлена достоверная обратная корреляция между нарастанием пролиферативных свойств кистозных образований яичников и уровнями кортизола, а также прямые корреляционные зависимости между нарастанием пролиферативных свойств кистозных образований яичников и содержанием в сыворотке периферической крови ЛГ, тестостерона, дегидроэпиандростерона, инсулина, ТТГ.
При разных гистоструктурных формах ДКОЯ развиваются особые проявления гормонального дисбаланса, выраженные больше всего у пациенток с кистами — при кистах желтого тела, с кистомами — при муцинозных цистаденомах. Наименьшие сдвиги уровней гормонов наблюдаются при параовариальных кистах. Повышение в сыворотке периферической крови в фолликулиновую фазу менструального цикла уровней таких гормонов, как ЛГ, Э2, тестостерон, андростендион, дегидроэпиандростерон, ТТГ, наиболее выражено при кистомах, а прогестерона и инсулина — при кистах яичников.
У каждой десятой женщины с ДКОЯ в нашем исследовании была медикаментозная аллергия, а у каждой девятой с кистами и каждой седьмой с кистомами — пищевая, что свидетельствует о нарушении иммунной реактивности. По мнению В.И. Кулакова и соавт. (2005), этот фактор является одним из важных в силу того, что все процессы, которые осуществляются в организме (дифференцировка тканей, нормальный и патологический гистогенез, аллергические состояния и аутоиммунные процессы, доброкачественные и злокачественные процессы и т.д.), напрямую или косвенно связаны с иммунными механизмами. Нарушения иммунной реактивности могут приводить к накоплению опухолевых клеток и препятствовать их своевременной элиминации.
Поддержка гомеостаза иммунной системой осуществляется с помощью высокомобильных клеточных элементов, гуморальных факторов и системы иммуноцитокинов. Кисты и кистомы яичников развиваются на фоне иммунного дисбаланса, который проявляется достоверным повышением в периферической крови количества эозинофилов соответственно в 1,97 и 1,93 раза; перераспределением субпопуляционного состава лимфоцитов со снижением относительного содержания CD3+ по сравнению с контролем в 1,55 и 1,70 раза, CD4+ — в 1,18 и 1,21, CD8+ — в 1,14 и 1,11, CD16+ — в 1,23 и 1,18, CD22+ — в 1,13 и 1,17 раза, повышением уровня CD25+ при кистомах в 1,43 раза; дисиммуноглобулинемией — снижением уровня IgG в 1,19 и 1,14, повышением уровней IgА в 1,22 и 1,34, IgМ — в 1,22 и 1,27 и IgE — в 1,62 и 1,49 раза; снижением активности комплемента в 1,27 и 1,20 и повышением уровня ЦИК в 1,74 и 2,08 раза; повышением уровней антифосфолипидных антител в 9,40 и в 7,12 раза. При разных гистоструктурных формах ДКОЯ формируются особые проявления иммунного дисбаланса, наиболее выраженные среди кист при эндометриоидных, наименее — при параовариальных, а среди кистом — наиболее при муцинозных цистаденомах, наименее — при зрелых кистозных тератомах.
Увеличение размеров ДКОЯ происходило на фоне усиления иммунного дисбаланса. Рост кист положительно коррелировал с содержанием в периферической крови ЦИК, суммарных антифосфолипидных антител, отрицательно — с относительным содержанием палочкоядерных нейтрофилов, эозинофилов. Размеры кистом увеличивались на фоне нарастания относительного содержания активированных Т-лимфоцитов, уровня IgА и IgE, ЦИК, суммарных антифосфолипидных антител и уменьшения в периферической крови общей численности лейкоцитов, относительного содержания моноцитов, лимфоцитов, натуральных киллерных клеток, зрелых В-лимфоцитов, уровня IgG. Нарастание пролиферативных свойств ДКОЯ положительно коррелировало с содержанием в сыворотке периферической крови содержания активированных Т-лимфоцитов, IgА, ЦИК и отрицательно — с уровнем Т-лимфоцитов.
Регуляция ответа клеток иммунной системы осуществляется с помощью большого количества цитокинов — медиаторов межклеточного взаимодействия, оказывающих аутои паракринное действие на сами клетки-продуценты и на соседние иммунокомпетентные клетки. В отличие от гормональной регуляции, осуществляющей действие дистантно на большой спектр клеток организма, цитокиновая регуляция реализуется локально, в местах организации иммунной защиты (очаги воспаления, региональные лимфатические узлы, участки опухолевого роста и т.д.). Однако при генерализации пролиферативных, аутоиммунных процессов возможна гиперпродукция цитокинов и их избыточное появление в кровотоке. В исследованиях по изучению роли цитокинов при злокачественных овариальных образованиях наибольшее внимание уделяется таким цитокинам, как интерферон (ИФН), интерлейкин-2 (ИЛ-2), интерлейкин-4 (ИЛ-4) и фактор некроза опухоли α(ФНО-α).
Многообразие эффектов ИФН (иммуномодулирующий, антипролиферативный и др.) указывает на широкие контрольно-регуляторные функции этого медиатора иммунной системы, направленные в целом на сохранение гомеостаза. ИНФ-α Con1 при овариальных раках супрессирует опухолевую пролиферацию в результате индукции апоптоза, блокировки клеточного цикла и ингибиции опухолевого ангиогенеза.
Ключевым медиатором апоптоза и супрессором роста в овариальных опухолевых клетках является ФНОα-зависимый апоптозиндуцирующий лиганд Apo2L. ИНФ-β является более потенциальным индуктором активности этого лиганда по сравнению с ИФН-α2. Кроме того, ИНФ-β повышает активность и экспрессию инозитолгексакифосфаткиназы-2. Ее повышенная экспрессия может приводить к конвертации ИФН-α2-резистентных опухолевых клеток в клетки, готовые поддаться апоптозу в ответ на действие ИФН-α2. ИФН-γ имеет прямые антипролиферативные свойства при овариальных опухолях в результате индукции апоптоза путем активации каспаз, а также усиления экспрессии генов, усиливающих дифференциацию клеток, — icb-1α и icb-1β мРНК. Продукция ИФН-γ регистрируется в лимфоцитах, инфильтрирующих овариальные опухоли, при этом повышенная экспрессия ИФН-γ коррелирует с улучшенными клиническими результатами у больных раком яичников. ИФН-γ селективно индуцирует высвобождение и экспрессию 75 кДа рецептора ФНО.
ИЛ-2 синтезируется и секретируется антиген или митогенстимулированными Т-лимфоцитами. Его действие ограничивается антигенактивированными Т-клетками и натуральными киллерами. ИЛ-2 опосредует свои биологические действия путем связывания с ИЛ-2-рецепторами, которые транзиторно экспрессируются антигенактивированными Т-клетками и непрерывно — натуральными киллерами. Поэтому повышенный уровень растворимых ИЛ-2-рецепторов может служить индикатором активированной иммунной системы. ИЛ-2 способствует экспрессии Eas-лиганда, активирующего апоптоз через Eas, экспрессируемый в большей степени на антигенактивированных CD4+-клетках. ИЛ-2 имеет противоопухолевую активность в отношении разнообразных опухолевых клеток, поскольку поддерживает быстрое увеличение и расширение клона Т-клеток, специфически атакующих некоторые типы опухолей, в том числе противоопухолевую активность перитонеальных макрофагов-киллеров при опухолях яичников, в результате активации в них ИНФ-γ и липополисахаридной реакции. При овариальных карциномах наблюдается значительно повышенный уровень продукции ИЛ-2 Т-клетками.
ИЛ-4 является плейотропным фактором роста и дифференцирования Ви Тклеток. Он регулирует дифференцирование наивных Th0-клеток в Th2-клетки; способствует пролиферации антигенактивированных В-клеток; регулирует дозревание дендритных клеток; управляет переключением экспрессии В-клетками классов иммуноглобулинов IgG1 в IgE-классы; повышает продукцию фибробластами разных тканей человека коллагена и других молекул внешнего клеточного матрикса; регулирует синтез ИФН; индуцирует дифференцирование миофибробластов; действует на разные клетки опухолевых тканей. Выявлена резко повышенная экспрессия мРНК и внутриклеточный синтез ИЛ-4 наряду с ИЛ-10 в периферических лимфоцитах при эндометриозе. Увеличенная продукция ИЛ-4 регистрируется в лимфоцитах, инфильтрирующих овариальные опухоли. В 60 % случаев овариального рака в тканевых образцах регистрируется высокая плотность экспрессии рецепторов ИЛ-4, тогда как в нормальной овариальной ткани экспрессия рецепторов ИЛ-4 отсутствует или достаточно низкая.
ФНО-α вовлечен в регуляцию нормальной овариальной функции. Иммунореактивный ФНО-α был выявлен в ооцитах и гранулезных клетках растущих и атретических антральных фолликулов крыс и человека, в субпопуляции человеческих текаклеток. Локально ФНО-α секретируется лютеиновыми клетками и, возможно, овариальными макрофагами и лимфоцитами. Исследования показали, что ФНО-α играет важную роль в развитии фолликулов и желтого тела, в модуляции стероидогенеза гранулезой и текаклетками. ФНО-α ингибирует ЛГ-стимулируемую продукцию андрогенов снижением количества рецепторов к ЛГ, а также уменьшает продукцию цАМФ, активность протеинкиназы А. ФНО-α стимулирует митотическую активность текаклеток увеличением пропорции активно делящихся клеток и увеличением числа стероидогенно активных клеток. ФНО-α является активным регулятором апоптоза овариальных клеток в норме и при опухолевом росте. Суперэкспрессия ФНО-α и сниженная продукция ФНО-рецепторов в эндометриоидных имплантатах свидетельствуют о вовлечении системы ФНО в патогенез эндометриоза. При изучении экспрессии рецепторов ФНО-зависимого лиганда, индуцирующего апоптоз, была выявлена позитивная экспрессия DR5и DcR1рецепторов в 83,3 % доброкачественных овариальных опухолей и 68,8 % овариальных раков. Позитивная экспрессия DcR2-рецепторов была найдена только в нормальных яичниках и доброкачественных опухолях. Полученные данные свидетельствуют, что экспрессия разных рецепторов ФНО-зависимого лиганда, индуцирующего апоптоз, возможно, играет важную роль в регуляции апоптоза в опухолях яичников, особенно это касается DcR2-рецепторов.
Исследование цитокинов сыворотки периферической крови обследованных нами пациенток с кистами яичников выявило увеличение сывороточного уровня ИЛ-2 выше нормативных показателей в 75,54 % случаев, ИЛ-4 — в 46,74 %, ИФН-γ — в 23,91 % и ФНО-α — в 59,24 % случаев, а среди больных с кистомами — соответственно в 87,02; 74,05; 25,95 и 87,02 % случаев.
Выявлено, что уровни ИЛ-2, ИЛ-4, ИФН-γ и ФНО-α значительно варьировали при всех гистотипах ДКОЯ. Минимальные и максимальные концентрации цитокинов при одном и том же гистотипе ДКОЯ могли отличаться более чем в 200 раз. Но общей тенденцией было нарастание уровня цитокинов в соответствии с ростом пролиферативного потенциала образований яичников. Нарастание пролиферативного потенциала при ДКОЯ достоверно сопровождалось увеличением концентраций таких цитокинов, как ИЛ-2 и ФНО-α.
Как обнаружено нами, наиболее существенные сдвиги среди регуляторных систем организма при ДКОЯ наблюдались в системе свободнорадикального окисления (СРО) и антиоксидантной защиты (АОЗ).
СРО и образование активных форм кислорода, известных как прооксиданты, в организме следует рассматривать как существующий и обязательный элемент процесса жизнедеятельности. Окислительные процессы с участием активных форм кислорода являются неотъемлемым атрибутом существования высших форм живых организмов, неэнтропийное состояние которых поддерживается путем снижения электронной упорядоченности молекулярного кислорода в результате его восстановления. Еще И.И. Мечников в 1882 году писал, что с биологической точки зрения опухолевый процесс — регресс, движение в сторону менее организованной биологической формы существования, примитивной, но более стойкой организации. Поскольку в опухолевых клетках превалирует брожение, филогенетически более древний процесс по сравнению с окислением, то существует мнение, что опухоль представляет собой возвращение к более ранней эволюционной степени — к одноклеточному существованию, при этом более поздний и менее глубоко укоренившийся регуляторный механизм теряется. Поскольку опухоль развивается в высокоорганизованной стационарной системе организма, то правомочно провести параллель между опухолевым процессом и явлениями атавизма. Следовательно, опухоль — атавистическая бластогенетическая структура, которая потеряла в процессе эволюции свое приспособительное значение и переродилась в извращенную реакцию.
В соответствии с кислородно-перекисной концепцией онкогенеза Б.Н. Лю, Е.М. Шайхутдинова (1991) стойкое прооксидантное состояние и избыточный уровень ПОЛ создают в клетке канцерогенную ситуацию, которая ведет к нарушениям в ней структуры и/или функции ключевых ферментов, мембран и органелл.
Современные исследования свидетельствуют, что мишенями активных форм кислорода и других свободных радикалов являются нуклеиновые кислоты, белки, липиды, так как они легко взаимодействуют с полиненасыщенными жирными кислотными остатками, сульфгидрильными группами и аминогруппами полипептидов, двойными связками различных биологических молекул. Проявление этих реакций — изменения в генетическом аппарате клеток, структуре и функции клеточных мембран, нарушения регуляторных процессов организма.
Опухолевыми клетками образуются тканевые токсины (или ноксины), которые не привносятся извне и не являются продуктами распада. Биологическая активность ноксинов является ключом в выяснении патогенетических механизмов опухолевой интоксикации, которые могут быть представлены как цепь взаимосвязанных нарушений на разных уровнях интеграции — системном, органном, клеточном и молекулярном.
В генезе опухолевой интоксикации представлены связанные друг с другом звенья: увеличение количества токсических продуктов, которые образуются в норме, но в незначительном количестве; образование ноксинов — производных опухолевых клеток; общее угнетение механизмов естественной резистентности, способности к детоксикации. Токсины влияют на процессы перекисного окисления липидов. Продукты перекисного окисления липидов нарушают тканевое дыхание, являются сильными ингибиторами окислительного фосфорилирования, что приводит к нарушению синтеза АТФ в клетке. Снижение при этом активности изоцитратдегидрогеназы, малатдегидрогеназы и сопряженное с этим нарушение окисления изолимонной и яблочной кислоты в цикле Кребса приводят в конечном счете к снижению количества АТФ и сдвигу окислительных процессов в сторону гликолиза. Интенсификация перекисного окисления липидов выступает как механизм нарушения фосфолипидного слоя мембран с потерей их барьерной функции, что усиливает мембранную патологию.
При кистах и кистомах яичников осуществляется накопление продуктов СРО: концентрация диеновых конъюгат ненасыщенных жирных кислот в плазме крови была выше нормы у пациенток с эндометриоидными кистами в 100 % случаев, с параовариальными кистами — в 12,50 %, с кистами желтого тела — в 54,55%, с фолликулярными кистами — в 48,84 %, с кистами без эпителиальной выстилки — в 30,77 %, со зрелыми кистозными тератомами — в 69,77 %, с серозными цистаденомами — в 85,37 %, с муцинозными цистаденомами — в 95,74 % случаев; содержание малонового диальдегида в эритроцитах крови превышало нормативные показатели у больных с эндометриоидными кистами в 100 % случаев, с параовариальными кистами — в 28,13 %, с кистами желтого тела — в 96,97 %, с фолликулярными кистами — в 86,05 %, с кистами без эпителиальной выстилки — в 82,05 %, со зрелыми кистозными тератомами — в 95,35 %, с серозными цистаденомами — в 100 % и с муцинозными цистаденомами — в 100 % случаев; перекисный гемолиз эритроцитов превышал норму у 10,81 % пациенток с эндометриоидными кистами, у 9,09 % — с кистами желтого тела, у 4,65 % — с фолликулярными кистами, у 7,69 % — с кистами без эпителиальной выстилки, у 6,98 % — со зрелыми кистозными тератомами, у 14,63 % — с серозными цистаденомами, у 17,02 % — с муцинозными цистаденомами. Соответственно уровень диеновых конъюгат в плазме крови превышал показатели контроля в 1,23; 1,35 и 1,84 раза, перекисного гемолиза эритроцитов — в 1,25 раза и при кистомах — в 1,42.
Избыточное накопление продуктов СРО приводило к истощению резервов АОС. Так, уровень общей антиокислительной активности плазмы крови был ниже нормы у 46,74 % пациенток с кистами, в том числе у 78,38 % — с эндометриоидными кистами, у 60,61 % — с кистами желтого тела, у 51,16 % — с фолликулярными кистами, у 38,46 % — с кистами без эпителиальной выстилки, а при кистомах — у 58,02 % больных, включая 25,58 % женщин со зрелыми кистозными тератомами, 73,17 % — с серозными цистаденомами, 74,47 % — с муцинозными цистаденомами. Снижение активности каталазы плазмы крови относительно нормативных показателей наблюдалось лишь у 4,35 % больных с кистами: у 13,51 % — с эндометриоидными кистами, у 3,03 % — с кистами желтого тела, у 2,33 % — с фолликулярными кистами, у 2,56 % — с кистами без эпителиальной выстилки. Уменьшение активности супероксиддисмутазы плазмы крови относительно нормативных показателей регистрировалось у 2,72 % больных с кистами (5,41 % — с эндометриоидными, 6,06 % — с кистами желтого тела, 2,33 % — с фолликулярными кистами) и у 14,50 % пациенток с кистомами (13,95 % — со зрелыми кистозными тератомами, 12,20 % — с серозными цистадено мами, 17,02 % — с муцинозными цистаденомами). При этом уровень общей антиокислительной активности плазмы крови и некоторых ферментных компонентов АОС у женщин с кистами и кистомами в раннюю фолликулиновую фазу был сниженным относительно аналогичных показателей контрольной группы: общей антиокислительной активности плазмы крови соответственно в 1,12 и 1,14 раза, каталазы — в 1,07 и 1,15, супероксид-дисмутазы — в 1,14 и 1,28 раза.
Интересные данные получены при изучении неферментных элементов антиоксидантной защиты у женщин с ДКОЯ. При кистах и кистомах наблюдали снижение средних концентраций ретинола соответственно в 1,06 и 1,15 раза, токоферола-α — в 1,06 и 1,13 раза по сравнению с контролем. Но смещение концентраций витаминных антиоксидантов при разных гистоструктурных типах ДКОЯ в сыворотке крови ниже нормативных показателей было единичным. Так, уменьшение концентрации ретинола ниже нормы у пациенток с кистами наблюдалось лишь у 13,51 % пациенток с эндометриоидными кистами, а с кистомами — лишь у 4,65 % со зрелыми кистозными тератомами. Смещение уровней токоферола-α за пределы нормативных показателей при различных гистоструктурных типах ДКОЯ не наблюдалось.
Уменьшение уровня церулоплазмина в сыворотке крови при кистах яичников ниже нормы наблюдалось у 27,17 % больных: у 37,84 % — с эндометриоидным, 18,75 % — с параовариальными, 39,39 % — с кистами желтого тела, 37,21 % — с фолликулярными кистами, 2,56 % — с кистами без эпителиальной выстилки. Отмечалось снижение концентрации церулоплазмина по сравнению с контролем при кистах в 1,04 раза и кистомах — в 1,08 раза.
При определении индексов баланса систем СРО и антиоксидантной защиты организма выявлено, что при ДКОЯ имел место выраженный дисбаланс между указанными системами с накоплением первичных и вторичных продуктов окисления и снижением содержания в крови ферментных и неферментных антиоксидантов, причем при кистомах более выраженный, чем при кистах яичников.
Снижение иммунной реактивности, накопление продуктов СРО и ослабление АОС, а также продукция клетками ДКОЯ ноксинов приводили к развитию при этой патологии в организме женщин выраженной эндогенной интоксикации, о чем свидетельствовали результаты полученных данных об увеличении в сыворотке крови концентраций МСМ 238, МСМ 254, МСМ 260 и МСМ 280.
Концентрация МСМ 238 была выше нормы у 65,22 % пациенток с кистами: у 89,19 % — с эндометриоидными кистами, у 6,25 % — с параовариальными, у 75,76 % — с кистами желтого тела, у 69,77 % — с фолликулярными кистами, у 76,92 % — с кистами без эпителиальной выстилки, а при кистомах — у 82,44 % больных: у 76,74 %— со зрелыми кистозными тератомами, у 82,93 % — с серозными цистаденомами, у 87,23 % — с муцинозными цистаденомами.
Уровень МСМ 254 превышал норму у 64,13 % пациенток с кистами, в том числе: у 72,97 % — с эндометриоидными кистами, 3,13 % — с параовариальными кистами, 75,76 % — с кистами желтого тела, 81,40 % — с фолликулярными кистами, 76,92 % — с кистами без эпителиальной выстилки, а при кистомах — у 61,07 % больных: у 53,49 % — со зрелыми кистозными тератомами, 63,41 % — с серозными цистаденомами, 65,96 % — с муцинозными цистаденомами.
Содержание МСМ 260 было выше нормы у 44,57% пациенток с кистами, в том числе: у 48,65 % — с эндометриоидными кистами, 9,38 % — с параовариальными, 33,33 % — с кистами желтого тела, 88,37 % — с фолликулярными кистами, 30,77 % — с кистами без эпителиальной выстилки, а при кистомах — у 33,59 % женщин: у 27,91 % — со зрелыми кистозными тератомами, 39,02 % — с серозными цистаденомами, 34,04 % — с муцинозными цистаденомами.
Концентрация МСМ 280 была выше нормы у 66,85 % пациенток с кистами, в том числе: у 94,59 % — с эндометриоидными, 9,38 % — с параовариальными, 75,76% — с кистами желтого тела, 95,35 % — с фолликулярными кистами, 48,72 % — с кистами без эпителиальной выстилки, а при кистомах — у 71,76 % больных: у 65,12% — со зрелыми кистозными тератомами, 63,41 % — с серозными цистаденомами, 85,11 % — с муцинозными цистаденомами.
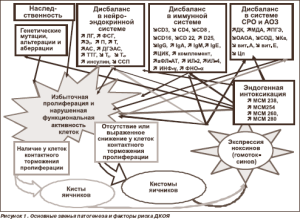
Таким образом, в патогенезе образований яичников важную роль играют нейроэндокринно-метаболические, иммунные и оксидантные нарушения, которые предшествуют росту образований, а при возникновении и развитии ДКОЯ усугубляются, что приводит к формированию в организме женщин репродуктивного возраста выраженной эндогенной интоксикации. Различная степень нарушения гомеостаза в основных регуляторных системах и выраженности эндогенной интоксикации в пределах отдельных нозологических форм ДКОЯ моделирует их биологические свойства, клиническое течение заболевания, чувствительность к разным методам лечения и реабилитации. Можно согласиться с точкой зрения, что по крайней мере основные звенья патогенеза и факторы риска ДКОЯ могут быть общими (рис. 1).









Комментировать