Общая характеристика диуретиков
А.И. ДЯДЫК, А.Э. БАГРИЙ, М.В. ХОМЕНКО, Н.Ф. ЯРОВАЯ, Кафедра внутренних болезней и общей практики — семейной медицины Донецкого национального медицинского университета им. М. Горького.
Газета «Новости медицины и фармации»
Кардиология (241) 2008 (тематический номер) / В помощь практикующему врачу
Место диуретиков в клинике внутренних болезней трудно переоценить. Они находят широкое применение в лечении больных с артериальной гипертензией (АГ) как при плановой терапии (составляя один из классов антигипертензивных препаратов первой линии), так и при экстренных/неотложных ситуациях (гипертензивных кризах). Диуретики используются в качестве базисного класса лекарственных средств в лечении больных с хронической сердечной недостаточностью (ХСН), они также применяются при различных вариантах декомпенсации ХСН (в том числе при кардиальной астме, отеке легких). Активное применение диуретики находят у больных с асцитом при циррозе печени, при нефротическом синдроме, у больных с острой и хронической почечной недостаточностью (ХПН).
В течение последнего десятилетия в отечественной литературе проблеме применения диуретиков в различных сферах клинической медицины уделялось неоправданно мало внимания. Это определило снижение уровня знаний практических врачей о возможностях и особенностях применения разных групп диуретиков, о подходах к их выбору и тактике назначения, о благоприятных и побочных эффектах.
В настоящем сообщении изложены современные представления о классификации, механизмах действия и фармакологических особенностях диуретиков, отражены подходы к их использованию в лечении ХСН (в том числе при декомпенсации); АГ (в том числе при гипертензивных кризах), отдельные разделы посвящены обсуждению роли диуретиков в лечении больных с асцитом при циррозе печени, нефротическим синдромом (НС), острой и хронической почечной недостаточностью.
Общая харрктеристика диуретиков
Диуретики представляют гетерогенный класс лекарственных препаратов, существенно различающихся по структуре, механизму действия, натрийуретическому, диуретическому действию и побочным эффектам. Классификация диуретиков представлена в табл. 1.
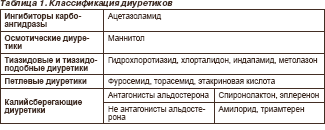
На рис. 1. представлена схема действия различных групп диуретиков на структуры нефрона.
Разные группы диуретических препаратов ис- пользуются в современной клинической практике с неодинаковой частотой. Ингибиторы карбоангидразы и осмотические диуретики находят сегодня крайне ограниченное применение в клинике внутренних болезней. Значительно шире сфера применения тиазидовых/тиа- зидоподобных (ТД/ТПД), петлевых (ПД) и калийсберегающих (КСД) диуретиков.
Ингибиторы карбоангидразы действуют на уровне проксимальных извитых канальцев нефрона (рис. 1). При первом приеме внутрь ингибитора карбоангидразы ацетазоламида отчетливо увеличивается количество мочи со щелочной реакцией, возрастает экскреция ионов Na+, K+, HCO3-,PO43- с мочой, значительно уменьшается экскреция с мочой аммония, экскреция ионов Ca2+ существенно не изменяется. При повторном применении ингибитора карбоангидразы натрийурез значительно уменьшается вследствие развития метаболического ацидоза и изменений реабсорбции HCO3-.
Сфера применения ингибиторов карбоангидразы достаточно невелика в силу незначительного и преходящего натрийуретического и диуретического эффектов, а также высокой частоты развития осложнений (в первую очередь выраженного метаболического ацидоза). Ацетазоламид может использоваться в лечении глаукомы (уменьшает внутриглазное давление), рефрактерной гидроцефалии (уменьшает образование цереброспинальной жидкости), для профилактики высотной болезни (стимулирует дыхательный центр). Наиболее серьезным побочным эффектом ингибиторов карбоангидразы является метаболический ацидоз (он чаще развивается у пожилых, у больных с сахарным диабетом, с почечной недостаточностью). Вследствие опасности развития этого эффекта длительность применения препаратов этой группы обычно ограничивается 5 днями.
Осмотические диуретики (маннитол) значительно уменьшают реабсорбцию жидкости на уровне тонкого сегмента петли Генле (рис. 1), кроме того, при их применении уменьшается реабсорбция Na+ в нижележащих отделах нефрона. Использование маннитола приводит к увеличению общего почечного кровотока, кровотока в мозговом слое почки, почечного плазмотока, снижению коллоидно-осмотического давления белков плазмы, повышению уровней клубочковой фильтрации.
Маннитол вводится только внутривенно. Период его полувыведения из плазмы зависит от исходного уровня клубочковой фильтрации, в норме он составляет 30–60 минут.
Маннитол ограниченно применяется в клинической практике. Он может использоваться для профилактики острой почечной недостаточности после кардиопульмональных оперативных вмешательств, хирургических вмешательств на фоне гипербилирубинемии, при миоглобинурии, при экскреторной пиелографии. Побочные эффекты маннитола включают значительную гемодилюцию, гиперкалиемический метаболический ацидоз (развиваются обычно у больных с почечной недостаточностью, при нарушении выведения препарата). Развитие тяжелых побочных эффектов (отека легких, тяжелой гипонатриемии, нарушений сознания) может требовать проведения ургентного гемодиализа для экстренного выведения маннитола.
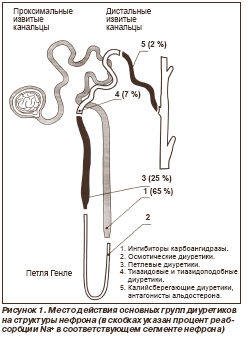
Тиазидовые и тиазидоподобные диуретики блокируют реабсорбцию ионов Na+ и Cl- в начальном отделе дистального извитого канальца. Кроме того, они опосредованно индуцируют секрецию ионов К+ в дистальном канальце нефрона. Следствием этих эффектов является существенное увеличение натрийуреза, повышение экскреции воды, умеренное увеличение калийуреза и магнийуреза, снижение экскреции кальция и уратов. Некоторые фармакологические особенности ТД/ТПД представлены в табл. 2.
Как видно из табл. 2, ТД/ТПД характеризуются достаточно высокой биодоступностью и быстрым началом действия. Продолжительность действия позволяет использовать их обычно в режиме однократного приема в течение суток.
ТД/ТПД уменьшают потери кальция и способствуют замедлению развития остеопороза , представляющего серьезную проблему, особенно у пожилых больных, в том числе у женщин в постменопаузе. Следует отметить уменьшение диуретической и антигипертензивной эффективности ТД у лиц со сниженной функцией почек: уже при умеренной хронической почечной недостаточности степень натрийуреза и диуреза, достигаемая при их использовании, обычно отчетливо ниже, чем при сохранной функции почек. У таких пациентов (и в особенности при выраженной ХПН), в соответствии с представлениями предыдущих лет, сфера применения ТД была весьма ограничена, к настоящему времени появляются сообщения об эффективности сочетания ТД с ПД при умеренной (и даже выраженной) степени ХПН.
Противопоказаниями к применению ТД/ТПД являются повышенная индивидуальная чувствительность к ним, гипокалиемия, гипомагниемия, гипонатриемия, гипохлоремия, гиперкальциемия, гиповолемия, первичный альдостеронизм. ТД противопоказаны больным с подагрой. С большой осторожностью следует применять ТД у больных с сахарным диабетом, аортальным стенозом и обструктивными формами гипертрофической кардиомиопатии. Применение ТД у беременных в настоящее время рассматривается как нежелательное в связи с риском развития/усугубления гиповолемии и снижения маточно-плацентарного кровообращения.
Использование малых дозировок ТД/ТПД (например, 12,5–25 мг/сут. гидрохлоротиазида или 1,5 мг/сут. ин дапамида при лечении АГ) существенно уменьшает частоту и тяжесть их побочных эффектов. При использовании более высоких дозировок для ТД (реже — для ТПД) побочные эффекты развиваются более часто, они включают гипокалиемию, гипомагниемию, гипонатриемию, гипохлоремию, гиперкальциемию, гиперурикемию, гиповолемию, снижение толерантности к глюкозе, гипергликемию, гипер- и дислипидемию (повышение плазменных уровней холестерина липопротеидов низкой плотности и триглицеридов), тошноту, головную боль, вялость, депрессию, а также снижение потенции у мужчин. Лечение ТД (в первую очередь более высоких дозировок) также сопряжено с риском аритмий (в том числе и жизненно опасных), в развитии которых важную роль играют гипокалиемия и гипомагниемия.
Длительное применение диуретиков (тиазидовых, петлевых и калийсберегающих) может осложняться развитием интерстициального нефрита, дерматита, кожной сыпи.
Петлевые диуретики (фуросемид, торасемид, этакриновая кислота) блокируют Na+ K+ 2Cl- — котран- спортную систему в мембране эпителия толстого участка восходящего колена петли Генле, вследствие чего существенно увеличиваются натрийурез, калийурез и экскреция воды, в меньшей степени возрастают каль- цийурез и магнийурез; экскреция уратов на начальном этапе применения ПД увеличивается, в последую- щем — снижается. Следует отметить, что появившийся недавно на фармацевтическом рынке Украины петле- вой диуретик торасемид обладает наряду с эффектами, присущими ПД, также эффектами антагониста аль- достерона. Вследствие этого при его использовании (в отличие от других ПД) существенно не увеличиваются калийурез, кальцийурез, отчетливо не изменяется экскреция уратов.
В табл. 3 представлена характеристика некоторых фармакологических свойств ПД.

Как видно из табл. 3, ПД существенно различаются между собой по фармакологическим свойствам. Так, фуросемид характеризуется высокой вариабельностью биодоступности, что обеспечивает достаточно малую предсказуемость интенсивности его диуретического (и антигипертензивного) эффекта. В то же время торасемид с его высокой и стабильной биодоступностью характеризуется низкой вариабельностью всасывания в желудочно-кишечном тракте, хорошей предсказуемостью и контролируемостью диуретического и антигипертензивного эффектов, их стабильностью и малой индивидуальной вариабель ностью. Обращают на себя внимание также различия между ПД в характере выведения из организма: фуросемид и этакриновая кислота в большей степени выводятся почками, а торасемид — печенью; в связи с этим торасемид характеризуется большей степенью безопасности при сниженной функции почек. С учетом того, что фуросемид обладает достаточно короткой продолжительностью действия (6–8 ч), кратность его назначения должна составлять 1–3 раза в сутки; длительность действия торасемида обеспечивает ему возможность однократного применения в течение суток.
Противопоказаниями к применению ПД являются повышенная индивидуальная чувствительность к ним, гипокалиемия, гипомагниемия, гипонатриемия, гиповолемия, первичный альдостеронизм. Как и в случае с ТД/ТПД, петлевые диуретики следует с особой осторожностью применять у больных с аортальным стенозом и идиопатическим гипертрофическим субаортальным стенозом. В отличие от ТД ПД могут широко применяться при сахарном диабете и гиперкальциемии.
Осложнения терапии ПД в большинстве подобны таковым у ТД/ТПД (то есть гипокалиемия, гипомагниемия, гипонатриемия, гипохлоремия, гиповолемия); в то же время гиперкальциемия не развивается. Перечисленные метаболические побочные эффекты ПД в большей степени касаются фуросемида и в меньшей — торасемида. Неблагоприятные воздействия ПД на метаболизм глюкозы, липидов и мочевой кислоты развиваются реже и выраженность их существенно меньше, чем у ТД. Лечение ПД, как и ТД, сопряжено с риском развития аритмий (в том числе и жизненно опасных). ПД (в первую очередь этакриновая кислота, в меньшей степени — фуросемид) обладают ототоксическим эффектом, риск которого и тяжесть (вплоть до необратимой глухоты) выше при почечной недостаточности, а также при внутривенном введении (особенно быстром). Торасемиду ототоксические эффекты практически не свойственны.
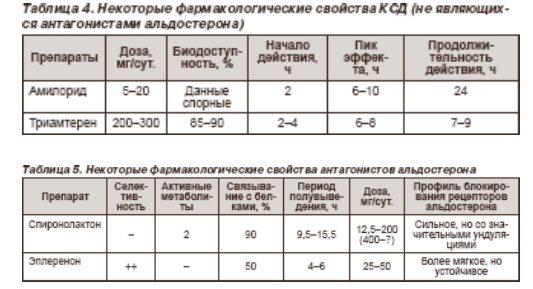
Калийсберегающие диуретики представлены двумя классами препаратов: не взаимодействующие с рецепторами альдостерона (амилорид, триамтерен) и конкурентные антагонисты альдостерона (спиронолактон, эплеренон). Механизм диуретического действия этих классов калийсберегающих диуретиков сходный и включает ингибирование абсорбции Na+ в дистальном извитом канальце и начальной части собирательной трубки, а также значительное уменьшение секреции К+ и Н+. Это приводит к умеренному увеличению натрийуреза и экскреции воды, снижению экскреции калия, Н+, для триамтерена и амилорида показано также уменьшение экскреции кальция и магния. В табл. 4 и 5 представлены некоторые фармакологические свойства КСД.
КСД противопоказаны при повышенной индивидуальной чувствительности к ним, хронической или острой почечной недостаточности, а также при гипоренинемическом гипоальдостеронизме.
Гиперкалиемия—наиболее частый и серьезный побочный эффект КСД. Риск ее развития существенно выше при назначении КСД больным с почечной недостаточностью (хронической или острой), сахарным диабетом и гипоренинемическим гипоальдостеронизмом. Риск развития гиперкалиемии существенно возрастает при комбинированном использовании КСД с нестероидными противовоспалительными препаратами, ингибиторами АПФ, β-адреноблокаторами (β-АБ) и гепарином. Назначение препаратов калия лицам, принимающим КСД, представляет большую опасность развития или усугубления гиперкалиемии. Наряду с гиперкалиемией лечение спиронолактоном может осложняться развитием вялости, сонливости, желудочно- кишечного дискомфорта, гинекомастии, импотенции,нарушением менструального цикла и маточными кровотечениями в пост менопаузе. У отдельных больных длительное применение триамтерена может приводить к камнеобразованию в почках.
Применение диуретиков при ХСН
Рекомендации международных экспертов характеризуют диуретики как один из базисных классов в лечении ХСН. В контролируемых исследованиях продемонстрирована их способность увеличивать экскрецию натрия почками и уменьшать клинические проявления задержки жидкости у больных с ХСН. В нескольких непродолжительных по времени исследованиях терапия диуретиками приводила к снижению давления в яремных венах, уменьшению легочного застоя, периферических отеков. Все это наблюдалось быстро — в течение нескольких часов/дней от начала лечения. В более длительных исследованиях было показано, что применение диуретиков ассоциировалось с улучшением систолической функции ЛЖ, уменьшением симптомов ХСН и повышением переносимости физической нагрузки.
Диуретики требуются большинству пациентов с клиническими проявлениями ХСН. Основным показанием для их назначения является наличие признаков задержки жидкости в организме (или угрозы такой задержки). Лечение больных с клиническими проявлениями ХСН диуретиками, как правило, длительное, постоянное, требующее контроля массы тела пациента (в первую очередь самоконтроля) и ведения дневника.
На начальных этапах ХСН (при наличии клинических проявлений) могут использоваться ТД/ТПД, но большинству больных с ХСН требуется назначение ПД. КСД в силу небольшой диуретической эффективности используются обычно в добавление к ПД/ТД. У больных, получающих ПД в сочетании с ингибиторами АПФ (а в части случаев также с антагонистами альдостерона), применения калиевых добавок, как правило, не требуется, оно может быть неблагоприятным. Использование диуретиков при ХСН должно сочетаться с рекомендацией ограничения приема поваренной соли и жидкости (в состоянии компенсации ХСН — около 1–1,5 л/сут.; при декомпенсации — менее 800 мл/сут.).
Следует иметь в виду, что ответ на ПД при выраженной и тяжелой ХСН обычно снижен (он составляет 1/2 или менее от того, который имеет место у лиц без ХСН). Для фуросемида показано, что его диуретический ответ при выраженной и тяжелой ХСН нередко существенно не возрастает при увеличении дозы, но может увеличиваться при возрастании кратности его применения (при этом фуросемид может применяться 2–3 раза в сутки). Для торасемида в случаях выраженной и тяжелой ХСН может требоваться увеличение суточной дозировки при сохранении однократного приема в течение суток.
Существенным при выборе пути введения ПД является то, что при выраженной и тяжелой ХСН абсорбция ПД в желудочно-кишечном тракте обычно снижена. Поэтому при необходимости получения более быстрого эффекта будет требоваться внутривенное (предпочтительно инфузионное — табл. 6) введение ПД. Дозы диуретиков при ХСН могут быть достаточно высокими. Так, в стационарных условиях у отечного больного могут использоваться дозы, которые приводят к уменьшению массы тела примерно на 0,5–1,0 кг/сут. (при отчетливом ограничении приема жидкости — до 500–800 мл/сут. и поваренной соли — до 1,5–3,0 г/сут.).
При резистентном отечном синдроме у больных с ХСН может использоваться комбинация ПД с ТД. С учетом данных исследований RALES и EPHESUS у больных с ХСН при IV ФК и с ХСН у постинфарктных больных могут быть использованы небольшие (недиуретические — спиронолактон 12,5–25 мг/сут., эплеренон 25–50 мг/сут.) дозы антагонистов альдостерона (с целью уменьшения фиброза миокарда и увеличения выживаемости). Важно еще раз подчеркнуть преимущество инфузионного (не болюсного), длящегося в течение нескольких часов введения ПД в случаях тяжелой, резистентной к диуретикам ХСН (табл. 7).
место диуретиков в лечении хсн (позиции международных рекомендаций, 2005–2006 гг.)
Украина, 2006:
- диуретики показаны больным с ХСН, имеющим задержку жидкости в организме в виде проявлений легочного застоя и периферического отечного синдрома;
- профилактический (в индивидуальном поддерживающем режиме) прием диуретиков показан гемодинамически стабильным больным с имевшимся ранее отечным синдромом, который был устранен с помощью активной диуретической терапии.
Европа, 2005:
- диуретики должны назначаться в комбинации с ингибиторами АПФ и β-АБ (при отсутствии противопоказаний к назначению последних) (уровень доказательности А).
США, 2005:
- диуретики и ограничение соли показаны больным, имеющим или имевшим ранее симптомы ХСН со сниженной систолической функцией ЛЖ при наличии у них проявлений задержки жидкости, а также при наличии угрозы такой задержки (класс I, уровень доказательности С);
- диуретики следует использовать для контроля проявлений легочного застоя и периферических отеков у больных с ХСН при сохранной систолической функции ЛЖ (класс I, уровень доказательности С);
- жесткая коррекция задержки жидкости рекомендуется больным с рефрактерной ХСН (финальной стадией ХСН — end-stage heart failure) (класс I, уровень доказательности В);
- предпочтительными у большинства больных с ХСН являются петлевые диуретики. Тиазидовые/тиазидоподобные диуретики могут быть предпочтительны у больных с ХСН при наличии у них артериальной гипертензии и при умеренной задержке жидкости;
- у больных, имеющих клинические проявления ХСН, диуретики не должны применяться в качестве монотерапии;
- недостаточный ответ даже на высокие дозы диуретиков может развиваться при приеме значительных количеств натрия с пищей, при использовании препаратов, блокирующих эффекты диуретиков (например, нестероидных противовоспалительных препаратов, включая ингибиторы циклооксигеназы-2), а также у лиц, имеющих значимое снижение функции или перфузии почек. Резистентность к диуретикам обычно может быть преодолена внутривенным введением диуретиков (включая длительные инфузии), применением комбинаций 2 или более диуретиков (например, петлевого с тиазидовым, в частности — с метолазоном); или у части больных использованием диуретиков в сочетании с препаратами, увеличивающими почечный кровоток (препаратами с положительным инотропным действием, например, добутамином или допамином). Эти подходы могут отчетливо увеличивать объем мочи, но последние два из них нередко сопровождаются нарастанием азотемии, особенно у больных, одновременно получающих ингибиторы АПФ.
В табл. 6 представлены дозы различных диуретиков, рекомендуемые при их пероральном и внутривенном (в том числе инфузионном) применении.влияние диуретиков на прогноз при хсн
Данными контролируемых рандомизированных исследований, в которых оценивались бы эффекты ТД/ ТПД или ПД на прогноз при ХСН, мы не располагаем, поскольку практически невозможно провести исследование, где часть пациентов с ХСН получала бы диуретики, а часть — лечилась бы без их использования (последние, бесспорно, имели бы значительно более плохой прогноз). В связи с этим мнение, что диуретики при ХСН прогноз не улучшают, не имеет под собой основания, поскольку лечение большинства больных с ХСН без применения диуретика просто невозможно. Однако данные исследований, где сравнивались бы эффекты на прогноз различных диуретиков, имеются. Таким исследованием является открытое проспективное исследование TORIC, в котором торасемид показал отчетливые благоприятные эффекты на прогноз у больных с ХСН в сравнении с фуросемидом.
Применение диуретиков при Аг
В соответствии с действующими сейчас международными рекомендациями по лечению АГ (Украина, 2008; Европа, 2007; США, 2008), диуретики составляют один из классов антигипертензивных препаратов первой линии. Они широко используются в лечении различных форм АГ (как эссенциальной, так и симптоматических). Диуретики находят применение в лечении разных вариантов гипертензивных кризов (в первую очередь парентеральные ПД).
Наиболее весомый объем данных доказательной медицины в отношении улучшения прогноза при плановой хронической антигипертензивной терапии имеется для ТД. В течение последних лет представлены весомые доказательства возможности применения для длительного лечения АГ также небольших субдиуретических дозировок торасемида — представителя ПД. Определенный объем данных о длительном применении при АГ есть также для ТПД (индапамид) место тд/тПд в длительной антигипертензивной терапии
ТД и в меньшей степени ТПД рассматриваются в качестве терапии выбора при лечении АГ у пожилых (в том числе и при изолированной систолической АГ), у лиц с избыточной массой тела, при наличии сопутствующей ХСН, у больных с рецидивирующими кальциевыми камнями в почках, а также при тяжелой резистентной АГ в комбинации с другим(и) классом(ами) антигипертензивных средств. По мнению ряда крупных кардиологов, отсутствие ТД в схеме антигипертензивной терапии является, вероятно, одной из самых частых причин резистентности АГ к комбинированному антигипертензивному лечению. За последние два десятилетия существенно изменились подходы к оптимальным дозировкам ТД при лечении АГ. Общепризнано, что их малые дозировки (12,5–25 мг/сут. и менее гидрохлоротиазида) не уступают по антигипертензивному эффекту более высоким дозировкам. Обычно в лечении АГ используется однократный суточный прием ТД.
Применение Пд в длительном лечении Аг
ПД являются мощными мочегонными средствами, они используются для лечения АГ в определенных клинических ситуациях: при ХСН, почечной недостаточности (хронической или острой), нефротическом синдроме, сахарном диабете, гиперкальциемии. Во многих странах в качестве обязательного компонента антигипертензивной терапии у больных с почечной недостаточностью при уровнях креатинина сыворотки ≥ 0,2 ммоль/л рекомендуются ПД.
Применение ксд при длительном лечении Аг.
КСД обычно не используются в качестве самостоятельной антигипертензивной терапии, а применяются в комбинации с ТД или ПД с целью уменьшения риска развития гипокалиемии.
Использование диуретиков в лечении гипертензивных кризов
У пациентов с гипертензивными кризами среди диуретиков используются внутривенно вводимые ПД (фуросемид, торасемид). ПД, в соответствии с международно признанными рекомендациями, не рассматриваются в настоящее время в качестве препарата для антигипертензивной монотерапии при гипертензивных кризах. В то же время их внутривенное введение (в части случаев — длительная внутривенная инфузия) считается показанным в качестве компонента комбинированного лечения (например, в сочетании с эналаприлатом, нитратами, β-АБ) у больных с гипертензивными кризами, осложнившимися отеком легких или острым коронарным синдромом. Внутримышечное введение этих ПД может применяться в лечении неосложненных гипертензивных кризов, обычно в комбинации с перорально или сублингвально используемыми антигипертензивными препаратами. В табл. 6 представлены дозы ПД, используемые при внутривенном инфузионном введении.
Применение диуретиков при нефротическом синдроме
Нефротический синдром характ еризуется наличием следующих клинико-лабораторных проявлений: массивной протеинурии (> 3 г/сут.), гипо- и диспротеинемии, гиперлипидемии и отеков. Наличие НС определяет развитие ряда особенностей фармакокинетики Пд:
- гипопротеинемия приводит к снижению связывания ПД с белками плазмы крови, что, в свою очередь, увеличивает объем их распределения в организме и повышает скорость их почечной и внепочечной элиминации;
- поступление значительного количества белка в просвет канальцев приводит к связыванию ПД с белком и уменьшает количество активного (несвязанного) ПД. При массивной протеинурии до 2/3 ПД может находиться в канальцах в неактивном (связанном) состоянии.
Ведение больных с НС требует ограничения потребления поваренной соли (достаточно жесткого — 2–3 г/сут., иногда и менее, для обеспечения этого может быть необходимо специальное приготовление пищи ввиду отсутствия готовых продуктов с низким содержанием натрия). Также необходимо ограничение приема жидкости (600–800 мл/сут., иногда и менее). Необходимыми элементами тактики являются тщательный контроль самочувствия, уровней Ад и чсс, массы тела, диуреза (что требует обучения пациента подходам к самоконтролю и ведению дневника), контроль показателей функции почек (креатинин сыворотки, подсчет скорости клубочковой фильтрации), электролитов крови.
Имеющаяся при НС гипоальбуминемия нередко способствует развитию гиповолемии, что делает активную диуретическую терапию опасной (поскольку она может усугублять гиповолемию, приводить к гипотензии и снижению функции почек). Тактика диуретической терапии у больных с НС на начальном этапе включает осторожное использование умеренных дозировок диуретиков. При сохранной функции почек приемлемо назначение КСД спиронолактона (до 100–150 мг/сут.) в сочетании с ПД (фуросемидом — 40–80 мг/сут. внутрь на 3 приема или торасемидом — 5–20 мг/сут. внутрь на 1 прием) и/или — реже — ТД (гидрохлоротиа зидом — 25–50 мг/сут. на 1 прием). При сниженной функции почек КСД не назначаются. В последующем (при отсутствии ухудшения самочувствия пациента, гемодинамических нарушений и функции почек) при необходимости возможно увеличение интенсивности диуретической терапии при сохранении кратности приема фуросемида не менее 3 раз в сутки (торасемид используется для однократного приема).
Диуретики у больных с острой почечной недостаточностью
Острая почечная недостаточность (ОПН) представляет собой синдром, характеризующийся быстры (в сроки от часов до нескольких недель) снижением скорости клубочковой фильтрации и задержкой продуктов азотистого обмена. На начальных этапах развития ОПН нередко протекает бессимптомно; достаточно частой клинической особенностью является олигурия (с уменьшением количества мочи до < 400 мл/сут.), которая выявляется приблизительно у 50 % больных. ОПН является гетерогенным клиническим синдромом.
Ведущие причины ОПН
- Преренальная азотемия, вызванная острой гипоперфузией почек, — 55–60 % случаев ОПН (кровотечения, массивные рвота и диарея, ожоги, гипотермия, острый панкреатит, гипотензия различной природы, сепсис и др.).
- Собственно ренальная азотемия, связанная с острыми поражениями почечной паренхимы, — 35–40 % случаев ОПН:
- заболевания с поражениями крупных сосудов почек (тромбозы почечных артерий и вен, васкулиты (Такаясу) и др.);
- заболевания с поражениями мелких сосудов почек и клубочков (первичные и вторичные гломерулонефриты, множественная миелома, гемолитико-уремический синдром, тромботическая тромбоцитопеническая пурпура, склеродермическая почка, преэклампсия и др.):
- острые поражения канальцев вследствие ишемии или действия токсинов, составляющие до 90 % всех случаев ренальной ОПН (прием пенициллинов, цефалоспоринов, аминогликозидов, рифампицина, сульфаниламидов, фторхинолонов, нестероидных противовоспалительных препаратов, петлевых и тиазидовых диуретиков, аллопуринола и других препаратов; вирусные, бактериальные, грибковые инфекции и др.).
- Постренальная азотемия, вызванная острой обструкцией мочевыводящих путей, — ≤ 5 % случаев ОПН (обструкция шейки мочевого пузыря при поражениях предстательной железы, неврогенном мочевом пузыре, приеме антихолинергических препаратов; двусторонняя обструкция мочеточников; обструкция мочеточника у больного с единственной почкой — конкременты, сгустки крови, неоплазмы, сдавление извне и др.).
С учетом высокой гетерогенности ОПН решение о применении диуретиков в каждом конкретном случае должно быть строго аргументировано. Петлевые диуретики могут использоваться в качестве компонента лечебной стратегии при олигурической собственно ренальной ОПН, главным образом связанной с острым поражением канальцев, развившемся вследствие ишемии или действия токсинов. Обычным подходом в этом случае является использование средних дозировок фуросемида (чаще сначала в виде болюса, затем в виде длительной внутривенной инфузии). При отсутствии достаточного эффекта от применения средних дозировок препарата использование его более высоких доз (до 1000 мг) редко приводит к существенному увеличению натрийуреза, но повышает риск побочных эффектов и поэтому обычно не рекомендуется. Осмотические диуретики в настоящее время не находят применения при ОПН.
Диуретики при хронических заболеваниях почек и хронической почечной недостаточности
Ввиду того что различные паренхиматозные хронические заболевания почек (ХЗП) в своем развитии проходят через сходные этапы (начальный этап, ХЗП с развернутой клинической картиной, ХЗП со сниженной функцией почек, выраженная ХПН, терминальная ХПН), в США и странах Европы в течение последних нескольких лет была принята классификация, объединяющая различные варианты поражений почек понятием ХЗП. Под термином ХЗП понимают: 1) существующее на протяжении ≥ 3 месяцев заболевание почек с соответствующими изменениями в анализах мочи независимо от того, имеется ли снижение функции почек или нет; 2) существующее на протяжении ≥ 3 месяцев снижение функции почек при уровнях клубочковой фильтрации < 60 мл/мин независимо от наличия изменений в анализах мочи. Классификация ХЗП ни в коей мере не устраняет нозологической самостоятельности отдельных заболеваний (гломерулонефриты, диабетический гломерулосклероз и др.), но она позволяет унифицировать оценку этапов прогрессирования ХЗП и нацелить врача широкой практики на выбор адекватных этому этапу лечебных программ. На 2-м съезде нефрологов Украины, состоявшемся в сентябре 2005 г., эта новая классификация ХЗП/ХПН была утверждена и для нашей страны. Она представлена в табл. 7.
В соответствии с современными представлениями, уровни креатинина сыворотки крови во многих случаях не позволяют корректно оценивать состояние функции почек. Более предпочтительным мировые эксперты считают подсчет уровня клубочковой фильтрации, его определение утверждено в качестве стандартного подхода к оценке функции почек также и в Украине. Для этого подсчета обычно используется формула Cockroft — Gault.
Формула Cockroft — Gault (применяется наиболее часто, однако при уровнях КФ < 10–15 мл/мин может давать искажения):![]()
Например, для женщины в возрасте 60 лет массой тела 50 кг с уровнем креатинина сыворотки крови 200 мкмоль/л КФ = [(140 – 60) ´ 50 ´ 0,85]/[0,81 ´ 200] = 20,9 мл/мин.
Реже применяются формула MDRD и формула подсчета клубочковой фильтрации по уровням мочевины и креатинина сыворотки крови и мочи.
Формула MDRD (особенно применима для тяжелой и терминальной ХПН — при уровнях КФ < 10–15 мл/мин):![]()
где Crcæ. — креатинин сыворотки, Urcæ. — мочевина сыворотки, Albcæ. — альбумин сыворотки.
Подсчет КФ по уровням Ur и Cr сыворотки и мочи (за 24 ч):
КФ = V мочи (мл)/2t ´ (Ur мочи /Ur сыв. + Cr моч и / Cr сы в ) ´ 1,73/S,
где t — длительность сбора мочи (мин) — обычно 1440, Crсыв. — креатинин сыворотки, Urсыв. — мочевина сыворотки, Cr,мочи — креатинин мочи, Urмочи — мочевина мочи, Vмочи — объем мочи.
Место диуретиков при ХПН. Диуретики широко применяются при ХПН, в основном для лечения АГ и отечного синдрома. Диуретиками выбора являются петлевые препараты, которые сохраняют достаточную эффективность и безопасность при ХПН,
- фуросемид, буметанид, торасемид. ПД являются необходимым компонентом комбинированной антигипертензивной терапии у больных с уровнями клубочковой фильтрации < 30 мл/мин. При сниженной функции почек используются высокие дозы ПД. Так, при уровнях клубочковой фильтрации в пределах 15–30 мл/мин дозы фуросемида могут составлять до 240 мг/ сут. (внутрь на 3 приема), торасемида — до 60 мг/сут. (внутрь, на 1 прием); применяется также внутривенное введение (болюсное, затем — инфузионное). Использование более высоких доз (фуросемид — 240–1000 мг/ сут.) возможно у лиц с еще более значительным снижением функции почек.
Тиазидовые диуретики у больных с ХПН используются реже, чем петлевые, так как при уровнях клубочковой фильтрации < 20–30 мл/мин многие из них теряют эффективность при изолированном приеме. У больных с выраженной ХПН ТД могут в случае необходимости (например, при рефрактерном отечном синдроме) назначаться в комбинации с ПД, однако такое сочетание требует особо тщательного клинико-лабораторного контроля за пациентом ввиду существенного повышения риска развития гиповолемии, преренальной азотемии, гипокалиемии.
Больным с ХПН противопоказаны остальные классы диуретиков из-за увеличения риска тяжелых жизненно опасных осложнений: калийсберегающие (гиперкалиемия, метаболический ацидоз), ингибиторы карбоангидразы (метаболический ацидоз), осмотические диуретики (гиперволемия, отек легких).
Диуретики в лечении отечного синдрома при циррозе печени
Отечный синдром (с развитием периферических отеков, асцита) является наиболее частым осложнением цирроза печени, ассоциирующимся с заметным ухудшением качества жизни, увеличением риска инфицирования и почечной недостаточности, а также ухудшением прогноза. Асцит развивается примерно у половины больных с циррозом печени. Двухлетняя выживаемость больных с циррозами после развития асцита составляет около 50 %. Патогенез отечного синдрома при циррозах печени многофакторный.
Стандартные требования к обследованию больных с отечным синдромом при циррозах печени включают: проведение функциональных печеночных проб и коагуляционных тестов, общеклинических исследований крови и мочи, исследование креатинина крови и электролитов, подсчет уровней клубочковой фильтрации, абдоминальное ультразвуковое или компьютерно-томографическое исследования, фиброгастроскопию (при отсутствии противопоказаний), исследование асцитической жидкости (цитоз, бактериологическое исследование, оценка уровней белка, альбумина, глюкозы, определение отношения уровней альбумина асцитической жидкости и уровней альбумина сыворотки крови).
Ведение больного с циррозом печени при наличии отечного синдрома требует ограничения употребления поваренной соли (в пределах 3–4 г/сут.) и жидкости (до 1 л/сут.), исключения приема алкогольных напитков, нестероидных противовоспалительных препаратов, глюкокортикоидов и препаратов, обладающих нефрото сическим действием.
Общие подходы к использованию диуретической терапии у таких больных включают:
- использование в начале лечения минимальных эффективных доз диуретиков;
- титрование доз диуретиков (с постепенным их повышением) до достижения желаемого эффекта;
- при недостаточном диуретическом эффекте — добавление диуретика другой группы;
- крайнюю нежелательность быстрого прекращения длительной диуретической терапии ввиду риска развития синдрома отскока;
- контроль уровней диуреза, массы тела, АД, ЧСС, электролитов крови, в ряде случаев — уровней гормонов (ангиотензина II, альдостерона, вазопрессина).
У больных, имеющих начальные стадии асцита и умеренный асцит, обычно наблюдается умеренное снижение уровней диуреза, натрийуреза, концентрации натрия в моче. Уровни креатинина сыворотки и значения клубочковой фильтрации чаще находятся в пределах нормальных значений. Диуретиками выбора в такой ситуации являются спиронолактон (как антагонист альдостерона, поскольку у больных циррозами с асцитом часто имеет место вторичный гиперальдостеронизм) в дозах 50–200 мг/сут. или (реже) амилорид в дозах 5–10 мг/сут. При необходимости к этим препаратам добавляются небольшие дозы ТД (гидрохлоротиазид 25–50 мг/ сут.) или ПД (фуросемид 20–40 мг/сут., торасемид 10–20 мг/сут.). Следует отметить, что применение торасемида (ПД, обладающего свойствами антагониста альдостерона) в этом случае может быть более предпочтительны по сравнению с фуросемидом (который не обладает воздействием на рецепторы альдостерона). Потеря массы тела у этих пациентов должна составлять 300–500 г/сут. (при отсутствии периферических отеков) или до 800–1000 г/сут. (при их наличии).
Больные, имеющие выраженный асцит, обычно характеризуются значительным снижением уровней диуреза и натрийуреза, отчетливым уменьшением концентрации натрия в моче (< 10 ммоль/л); уровни креатинина сыворотки чаще повышены, клубочковой фильтрации — снижены). При выраженном асците лечебная тактика предусматривает выбор между двумя основными подходами (R. Gines et al., 2004) агрессивной диуретической терапией и парацентезом.
Агрессивная диуретическая терапия предусматривает комбинацию средних/высоких доз КСД (спиронолактон 200 мг/сут., при переносимости возможно и более; максимальная доза — до 300 мг/сут.) с ПД (фуросемид 40–80 мг/сут. или торасемид 20–40 мг/сут. per os или, предпочтительно, длительная внутривенная инфузия — табл. 6) и ТД (гидрохлоротиазид до 50–100 мг/ сут.). Столь значительные дозы диуретиков, применяемых в комбинации, требуют особо жесткого контроля за состоянием пациента, уровнем АД, ЧСС, электролитами крови.
Альтернативой агрессивной диуретической терапии у больных с выраженным асцитом при циррозе печени является парацентез. Объем удаляемой из брюшной полости асцитической жидкости обычно не должен превышать 800–1000 мл в ходе одной процедуры парацентеза; как правило, наряду с парацентезом проводится внутривенная инфузия альбумина или плазмозаменителей (декстран или полиглюкин). Парацентез обычно проводится на фоне диуретической терапии умеренной степени интенсивности.
В случаях рефрактерного асцита, когда эффект диуретической терапии практически отсутствует и имеется высокий риск развития гепаторенального синдрома, парацентез является во многих случаях ведущим лечебным подходом. Для таких больных резервируется также трансъюгулярное внутрипеченочное портосистемное шунтирование.
диуретики и синдром идиопатических отеков
Этот синдром описан преимущественно у женщин, клинически он проявляется формированием умеренных отеков и умеренным увеличением массы тела в дневное время при достаточном уровне диуреза и возвращением к обычной массе тела в течение ночи. Синдром идиопатических отеков может быть интермиттирующим, с наличием достаточно длительных бессимптомных периодов. Синдром идиопатических отеков важно дифференцировать с синдромом предменструальных отеков (когда циклически развивается умеренная задержка натрия и воды вследствие предменструального повышения уровня эстрогенов). для установления наличия синдрома
идиопатических отеков требуется тщательное исключение других состояний, сопровождающихся развитием отечного синдрома (хсн, циррозов печени, нефротического синдрома и др). нередкими сопутствующими характеристиками являются избыточная масса тела и забота пациентки о ее снижении, часть из таких женщин для уменьшения массы тела принимает диуретики. Диагностика синдрома идиопатических отеков требует демонстрации изменений массы тела женщины на ≥ 2 кг в течение суток.
Этиология и патофизиология этого синдрома изучены недостаточно; предполагается, что они могут быть многофакторными. Обсуждается роль развивающихся у таких больных в вертикальном положении транзиторных гиповолемии, гиперсекреции вазопрессина, стимуляции ренин-ангиотензиновой системы и угнетения системы натрийуретических гормонов, что и приводит к транзиторной задержке Na+ и воды. Важное место в развитии синдрома идиопатических отеков отводят употреблению диуретиков ранее; многие из случаев этого синдрома рассматривают как проявление длительной адаптации к действию диуретиков.
Оптимальная тактика ведения таких больных является предметом дискуссий. При наличии связи развития синдрома идиопатических отеков с применением диуретиков ранее ряд авторов рекомендуют их отмену (возможно — медленную и постепенную). При этом показано, что несмотря на имеющуюся в течение первых 8–10 дней (после полной отмены препарата) тенденцию к нарастанию массы тела (обычно до 5 кг), у большей части пациенток наблюдается нормализация массы тела и устранение отеков в течение следующих 2–3 недель без возвращения к диуретической терапии. В качестве временной косметической меры обсуждается возможность редкого (!) применения диуретика, но не того класса, применение которого было ассоциировано с развитием идиопатических отеков.
Диуретики у беременных с преэклампсией
Диуретики не предупреждают развитие преэклампсии. Их использование может приводить к снижению маточно-плацентарного кровотока, для тиазидовых диуретиков, кроме того, показано увеличение риска развития тромбозирования сосудов плаценты. В связи с этим диуретики в лечении преэклампсии рассматриваются как относительно противопоказанные. Внутривенное введение фуросемида может быть использовано в лечении гипертензивного криза при беременности, особенно осложненного отеком легких.
Адаптация к диуретической терапии, торможение действия диуретика и резистентность к диуретикам
Длительное блокирование транспорта ионов в одном из сегментов нефрона обеспечивает комплекс адаптационных изменений в других его сегментах. Пролонгированное применение диуретиков определяет развитие ряда механизмов, не только ограничивающих антигипертензивное и диуретическое действие эти
препаратов, но также способствующих формированию резистентности к диуретикам и развитию побочных эффектов лечения. Показано, что адаптация к терапии одним из классов диуретиков может обеспечиваться увеличением реабсорбции Na+ в тех сегментах нефрона, которые располагаются дистальнее места его действия. Так, при развитии адаптации к действию петлевого диуретика возможно сохранение чувствительности к эффектам более дистально действующих классов — тиазидовым и калийсберегающим. Адаптация к диуретической терапии лежит в основе важных феноменов торможения действия диуретика (diuretic breaking) и постдиуретической задержки Na+.
Под термином «торможение действия диуретика» понимают комплекс адаптационных изменений нефрона, обеспечивающих восстановление изменившегося на фоне приема диуретика равновесия между потреблением и экскрецией электролитов и воды. Применение первой дозы диуретика обычно обеспечивает развитие достаточно значимого увеличения количества выделяемой мочи. Однако достаточно быстро вследствие эффекта diuretic breaking устанавливается новый уровень равновесия между потреблением и экскрецией электролитов и воды, эффект диуретика значительно уменьшается и масса тела стабилизируется. У безотечных лиц (в отсутствие существенного ограничения потребления поваренной соли) при использовании петлевых или тиазидовых диуретиков новое равновесие устанавливается в течение 1–2 дней; снижение массы тела обычно ограничивается 1–2 килограммами. У больных с отеками торможение действия диуретика также характеризуется значительным уменьшением эффекта диуретика при его последующем применении, однако при достаточном ограничении количества потребляемой поваренной соли новый уровень равновесия развивается существенно позднее, что позволяет достигать желаемого уменьшения отечной массы.
Постдиуретическая задержка Na+ — это развивающееся после завершения действия диуретика адаптационное уменьшение натрийуреза. Например, при однократном в течение суток использовании фуросемида, имеющего продолжительность действия 6–8 часов, в течение этого периода наблюдается отчетливое увеличение натрийуреза, однако в течение последующего 16–18-часового периода уровень натрийуреза компенсаторно значительно уменьшается. Суммарный баланс Na+ за сутки при этом может существенно не измениться в сравнении с тем, каким он был без приема препарата. Желательного устойчивого увеличения экскреции натрия можно добиться при использовании диуретика, имеющего более продолжительный период действия, например торасемида, период действия которого достигает 12–24 ч. В случае использования фуросемида необходимо увеличивать кратность его применения до 3 раз в сутки.
Ограничение диетического приема поваренной соли является необходимым условием достижения устойчивого натрийуретического эффекта и стабиль- ного снижения массы тела у отечного больного на фон. диуретической терапии. При высоком уровне потребления поваренной соли применение фуросемида обеспечивает значительный натрийуретический эффект с достижением выраженного отрицательного баланса Na+ в течение первых 6 часов. В то же время в течение последующих 18 часов экскреция Na+ значительно снижается вследствие постдиуретической задержки Na+, это создает положительный баланс Na+, практически нивелирующий достигнутый в течение первых 6 часов натрийуретический эффект. На 3-й день применения фуросемида его эффект ниже, чем в 1-й день (вследствие феномена diuretic breaking), при этом достигнутый за первые 6 часов уровень натрийуреза также уравновешивается последующей постдиуретической задержкой Na+. В целом у лиц, потребляющих поваренную соль в больших количествах, существенного снижения массы тела при применении фуросемида наблюдаться не будет.
При значительном ограничении диетического потребления поваренной соли первая доза фуросемида вызывает развитие значительно меньшего по выраженности натрийуретического эффекта в течение первых 6 часов. Хотя вслед за этим экскреция Na+ значительно снижается, однако существенной постдиуретической задержки Na+ при этом не развивается. Таким образом, в течение суток достигается отчетливый отрицательный баланс Na+, что приводит к устойчивому уменьшению отечной массы.
Резистентность к диуретикам и подходы к ее преодолению
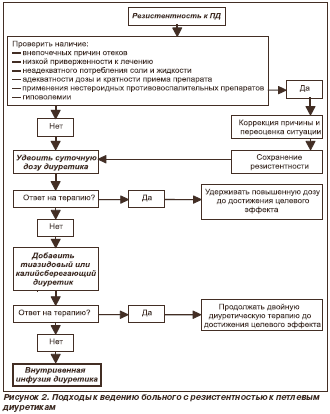
Под резистентностью понимают неадекватный эффект диуретика по устранению отеков, несмотря на использование полной дозировки препарата. Наиболее частые причины резистентности к диуретикам представлены в табл. 8, а подходы к ведению больного с резистентностью к петлевым диуретикам показаны на рис. 2.
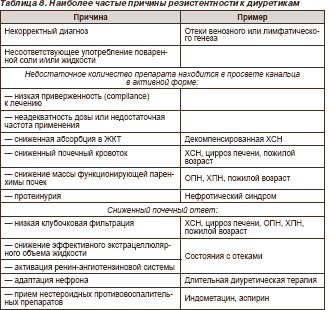
Комбинированная терапия диуретиками используется достаточно широко, как для прео доления адаптации к препарату и резистентности к нему (рис. 2.), так и для уменьшения одним из классов диуретиков неблагоприятных метаболических эффектов другого их класса. При сочетании двух диуретиков, обладающих сходными механизмами действия (то есть представителей одного и того же класса), суммарный эффект будет антагонистическим, поэтому такие комбинации не применяются. В
то же время комбинирование диуретиков с различными механизмами действия будет производить аддитивный (суммирующий) или даже синергический (взаимно усиливающий) эффект.
Hou6u+ayuu uewneæx guypewuuoæ c wuasugoæuu характеризуются синергическим эффектом. Показано, что у лиц, получающих длительную терапию петлевым диуретиком, чувствительность к тиазидовым препаратам увеличена. Больные с выраженным отечным синдромом (при ХСН, нефротическом синдроме, циррозе печени) или с устойчивой АГ, резистентные к высоким дозам петлевых диуретиков, могут показывать хороший натрийуретический ответ с уменьшением отеков и снижением АД при добавлении стандартной дозы тиазидового диуретика. Необходимо отметить, что начинать такую двойную терапию следует в условиях тщательного контроля за пациентом в стационаре (из-за повышения риска гипокалиемии, гиповолемии и азотемии, особенно у больных с исходным снижением функции почек).
Hou6u+ayuu uewneæx nu6o wuasugoæx guype- wuuoæ c uanuuc6eperaDyuuu. КСД при добавлении к ПД или ТД отчетливо уменьшают степень выраженности калийуреза, снижают риск развития гипокалиемии и метаболического алкалоза. Вследствие этих благоприятных эффектов комбинации КСД с ПД или ТД достаточно широко используются при длительной диуретической терапии у больных с сохранной функцией почек. Применение КСД противопоказано у больных с почечной недостаточностью из-за риска развития тяжелых гиперкалиемии, ацидоза, а также дальнейшего снижения функции почек.






Комментировать