Взаимосвязь между уровнем липидов и повышением риска смерти у пациентов с сахарным диабетом (СД). Липидный профиль для больных СД. Результаты проведенных исследований.
Мохорт Т.В.
Белорусский государственный медицинский университет, Минск
Резюме. Выявлена четкая взаимосвязь между уровнем липидов и повышением риска смерти у пациентов с сахарным диабетом (СД). Липидный профиль для больных СД характеризуется повышением уровней триглицеридов, холестерина липопротеидов очень низкой плотности, холестерина липопротеидов низ- кой плотности и малых частиц липопротеидов низкой плотности, АроВ и снижением уровней холесте- рина липопротеидов высокой плотности и АроА I. Пересмотрены целевые значения липидов для пациен- тов с СД. Проведено большое количество исследований, убедительно продемонстрировавших эффек- тивность использования статинов для первичной и вторичной профилактики сердечно-сосудистых со- бытий при СД, что позволило рекомендовать статины как препараты первой линии у пациентов как с дислипидемией, так и без нее. Никотиновая кислота, селективные ингибиторы абсорбции холестерола и фибраты могут использоваться как препараты второго выбора.
Ключевые слова: сахарный диабет, дислипидемия, профилактика сердечно-сосудистых осложнений, статины, никотиновая кислота, фибраты, гиполипидемическая терапия.
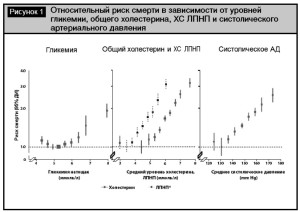
Повышение риска смерти при сердечно-сосудистой патологии у пациентов с сахарным диабетом (СД) – факт, не подлежащий обсуждению. В последние годы опубликованы результаты нескольких метаанализов, которые свидетельствуют о повышении риска смерти и у лиц с преддиабетом [12, 15, 36]. Оценка снижения продолжительности жизни при СД свидетельствует о максимальном вкладе именно сердечно-сосудистой патологии [13]. Логично предположить, что в этой ситуации основным фактором риска является гиперглике- мия и инициированные ее метаболические нарушения. Однако уже с момента завершения исследования United Kingdom prospective Diabetes Study (UKPDS) определено, что максимальное влияние на риск развития первого сердечно-сосудистого события оказывает дислипидемия – повышение уровня холестерина липопро- теидов низкой плотности (ХС ЛПНП) и снижение уровня холестерина липопротеидов высокой плотности (ХС ЛПВП) [39]. Позднее было неоднократно подтверждено практически прямопропорциональное возрастание риска кардиальной смерти от уровня общего холестерина и ХС ЛПНП [13, 16]. Выявление негативного влия- ния дислипидемии на сердечно-сосудистый прогноз инициировало многочисленные работы по оценке осо- бенностей липидного профиля при СД и разработке доказательных подходов к ее коррекции (рис. 1) [12].
Липидный профиль для пациентов с СД характеризуется повышением уровней триглицеридов (ТГ), холесте- рина липопротеидов очень низкой плотности (ХС ЛПОНП), ХС ЛПНП и малых частиц ЛНП, АроВ и снижени- ем ХС ЛПВП и АроА I [3].
В 2007 г. были опубликованы рекомендации Европейского общества кардиологов и Европейской ассоциации по изучению сахарного диабета, которая определила показания для использования гиполипидемических препаратов и порядок выбора препаратов. Препаратами первого выбора названы статины – ингибиторы гид- роксиметил-глютарил-коэнзим редуктазы А, что определено но только их гиполипидемическим эффектом, но и выраженностью плейотропных эффектов. Согласно этим рекомендациям, статины назначают:
- при наличии сердечно-сосудистых заболеваний для обеспечения ХС ЛПНП <1,8–2,0 ммоль/л;
- при СД 2-го типа у взрослых без сердечно-сосудистой патологии назначают при общем холестерине более 3,5 ммоль/л до достижения снижения его уровня на 30–40%;
- всем пациентам с СД 1-го типа и риском сердечно-сосудистых заболеваний (плохая компенсация диабета, осложнения, артериальная гипертензия, метаболический синдром) или в возрасте более 40 лет.
При гипертриглицеридемии более 2 ммоль/л для достижения цели рекомендуется использование никотиновой кислоты, селективного ингибитора абсорбции холестерина и некоторых растительных стиролов в тонком кишечнике, эзетимиба или фибратов. Главным новационным заключением этих рекомендаций явилось то, что лечение статинами при СД снижает риск первой сердечно-сосудистой атаки и может быть рекомендовано для включения в комплексную терапию СД 2-го типа у лиц без манифестной ишемической болезни сердца и выраженной дислипидемии.
Для сравнения приводим рекомендации Американской ассоциации диабета 2012 г., в которых определены целевые уровни липидов при СД:
- у пациентов без сердечно-сосудистой патологии первичная цель – ХС ЛПНП <2,6 ммоль/л;
- у пациентов с сердечно-сосудистой патологией первичная цель – ХС ЛПНП <1,8 ммоль/л;
- рекомендуется снижение ХС ЛПНП на 30–40%;
- достижение уровня ТГ <1,7 ммоль/л;
- достижение ХС ЛПВП >1,0 ммоль/л у мужчин и >1,3 ммоль/л у женщин.
Этими рекомендациями постулируется необходимость назначения статинов:
- всем пациентам с СД при наличии сердечно-сосудистой патологии;
- без сердечно-сосудистой патологии старше 40 лет с одним или более выявленными факторами риска кардиальной патологии;
- при низком риске сердечно-сосудистой патологии (т.е. без кардиальной патологии и возрасте менее 40 лет) при ХС ЛПНП более 100 мг/мл.
Аналогично предыдущим рекомендациям указывается на обоснованность комбинированной терапии при не- достижении целей.
Рекомендациями Европейского общества кардиологов и Европейского общества атеросклероза 2011 г. в разделе, посвященном СД, определено следующее:
- характерный липидный профиль при СД: постпрандиальное повышение ТГ, АроВ, малых плотных частиц ЛПН, низкие уровни ЛПВ и АроАI;
- увеличение окружности талии и уровня ТГ – наиболее важные факторы кардиального риска;
- при СД 1-го типа у всех пациентов с микроальбуминурией или болезнями почек до снижения ХС ЛПНП на 30% статины – препараты первого выбора, при достижении целей – комбинированная терапия;
- при СД 2-го типа и сердечно-сосудистой патологии и/или хронической болезни почек либо в возрасте старше 40 лет целевой уровень ХС ЛПНП менее 1,8 ммоль/л, вторичная цель – ХС ЛПнеВП менее 2,6ммоль/л и АроВ менее 80 мг/дл;
- у всех пациентов с СД 2-го типа первичная цель – уровень ХС ЛПНП менее 2,5 ммоль/л, а вторичная цель – ХС ЛПнеВП менее 3,3 ммоль/л и АроВ менее 100 мг/дл [14].
Целевые показатели липидов по рекомендациям консенсуса между Американской Ассоциацией Диабета и Европейской Ассоциацией по изучению диабета включают уровни: ХС ЛПНП менее 2,59 ммоль/л и менее 1,81 ммоль/л у лиц с кардиальной патологией; ХС ЛПВП более 1,04 ммоль/л у мужчин и более 1,30 ммоль/л у женщин; ТГ менее 1,69 ммоль/л [2].
В настоящее время определены позитивные влияния изменения образа жизни на уровни липидов (табл. 1), однако, как показывает практика, выполнение этих рекомендаций лимитировано, что диктует необходимость использования медикаментозной интервенции.
Таблица 1. Модификация образа жизни
| Рекомендации | Количественный показатель |
СнижениеХСЛПНП | |
| Снижениепотреблениясатурированных <7% итрансжи- ров | 5–10% |
| Снижениемассытелаиповышениефизическойактивности | 5% |
| Потреблениеклетчаткиболее 25 г/сут | 5–8% |
| Орехи 50–100 г/сут | 5–8% |
| Бурыйрис (поликазанол) | 10% |
| Соевыйбелок 25 г/сут | 5–8% |
| Ситостанол/ситостерол | 10% |
| Всего | 25–35% |
| ПовышениеХСЛПВПиснижениеТГ | |
| Снижениепотреблениятрансжиров | 5–10% |
| Прекращениекурения | 8–10% |
| Снижениемассытелана 4–5 кг | 4–5% |
| Физическаяактивность (джоггинг 10 кмвнеделю) | 4–5% |
| Снижениепотребленияалкоголя (мужчины– 20–30 г/сут, женщины– 10–15 г/сут) | 8–10% |
| Уменьшениепотреблениялегкоусвояемыхуглеводовна10% | 4–8% |
| Всего | 25–30% |
Результаты исследований, свидетельствующих о взаимосвязи снижения уровня ХС ЛПНП и сердечнососудистых рисков как в первичной, так и во вторичной профилактике, неоспоримо доказывают эффективность терапии статинами (табл. 2) [3].
Таблица 2. Снижение 10-летнего риска сердечно-сосудистых событий при использовании статинов по результатам крупных исследований
| Исследование | Тип профилактики | N | Статин, доза и компаратор | Снижение относительного риска, % | Снижение аб- солютного риска, % | СнижениеХС ЛПНП |
| 4S-DM | 2 | 202 | Симвастатин 20–40 мг vs пла- цебо | 50 | 42,5 | 186–119 мг/дл (36%) |
| ASPEN 2° | 2 | 505 | Аторвастатин 10 мг vs плацебо | 34 | 12,7 | 112–79 мг/дл (29%) |
| HPS-DM | 2 | 3051 | Симвастатин 40 мг vs плацебо | 17 | 7,5 | 123–84 мг/дл (31%) |
| CARE-DM | 2 | 586 | Правастатин 40мг vs плацебо | 13 | 5,4 | 136–99 мг/дл (27%) |
| TNT-DM | 2 | 1501 | Аторвастатин 80 мг vs 10 мг | 18 | 4,7 | 99–77 мг/дл (22%) |
| HPS-DM | 1 | 2912 | Симвастатин 40 мг vs плацебо | 34 | 6,0 | 124–86 мг/дл (31%) |
| СARDS | 1 | 2838 | Аторвастатин10 мг vs плацебо | 35 | 4 | 118–71 мг/дл (–40%) |
| ASPEN 1 | 1 | 1905 | Аторвастатин 10 мг vs плацебо | 19 | 1,9 | 114–80 мг/дл (–30%) |
| ASCOT DM | 1 | 2532 | Аторвастатин 10 мг vs плацебо | 8 | 0,9 | 125–82 мг/дл (–34%) |
Приведенные данные исследований убедительно продемонстрировали эффективность использования статинов для первичной и вторичной профилактики сердечно-сосудистых событий при СД, что позволило рекомендовать статины как препараты первой линии у пациентов как с дислипидемией, так и без нее.
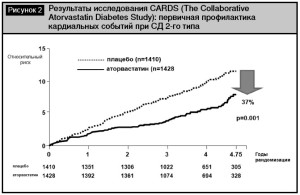
Последняя рекомендация базируется на результатах исследования CARDS (The Collaborative Atorvastatin
Diabetes Study), в котором доказано, что даже малые дозы аторвастатина (10 мг) у лиц с СД без манифестной гиперлипидемии обеспечивают снижение риска не только кардиальных событий (острых коронарных событий на 36% и частоты реваскуляризации на 31%), но и инсульта (относительный риск снизился на 48%) (рис. 2). Результаты исследования по сравнению с плацебо были столь впечатляющи, что привели к преждевременному его завершению в связи неэтичностью использования плацебо далее [8, 9]. По результатам этого исследования опубликованы данные, свидетельствующие о дополнительных бенефициях аторваста- тина у различных категорий пациентов. Так, у пациентов с СД 2-го типа с заболеванием почек и снижением скорости клубочковой фильтрации (30–60 мл/мин/1,73 м2) зарегистрировано снижение на 61% относительного риска инсульта (р = 0,04) [10]. В другом субанализе продемонстировано снижение относительного риска сложной конечной точки, включающей острые коронарные события (инфаркт миокарда, включая немой инфаркт, нестабильная стенокардия, острая коронарная смерть или реанимированная остановка сердца), коронарную реваскуляризацию или инсульт на 38% у пожилых пациентов [27].
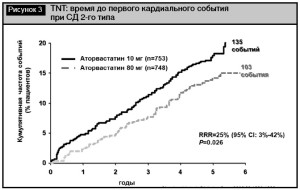
Поскольку использований низких доз статинов не обеспечивает достижения целевых показателей липидов у большого количества пациентов и снижение кардиальной смертности до уровня лиц без СД, было инициировано исследование TNT (The Treating to New Target), включающее увеличение дозы аторвастатина до 80 мг при недостижении целевых показателей липидов с целью оценки эффективности и безопасности поддержания ХС ЛПНП на уровне менее 2,6 ммоль/л (100 мг/мл) у пациентов со стабильной ИБС. В результате доказано, что кумулятивная частота сердечно-сосудистых событий была на 25% ниже группе, получавшей 80 мг аторвастатина (против 10 мг) (рис. 3). При этом частота регистрации побочных эффектов не увеличивалась пропорционально дозе и была сопоставима в группах наблюдения [18, 25].
В 2012 г. S. Mora и соавт. опубликованы данные дополнительного анализа TNT исследования и влияния аторвастатина в различных дозах (10 мг против 80 мг) на остаточный риск и вторичную профилактику сердечно-сосудистых событий в когорте 9251 пациентов с коронарной патологией с ХС ЛПНП <130 мг/дл с медианой наблюдения 4,9 лет [26]. С использованием мультивариантного анализа доказано влияние на снижение кардиального риска возраста, повышения индекса массы тела, мужского пола, артериальной гипертензии, СД 2-го типа, уровня АpoB, уровня мочевины с максимальным эффектом у группе получавшей 80 мг аторвастатина. Полученные результаты подтвердили существующие и общепринятые рекомендации по ис- пользоваию статитнов в качестве препаратов первой линии при дислипидемии [26].
Как указано выше, одним из исследований по оценке эффективности статинов (аторвастатин 10 мг vs плаце- бо) в первичной профилактике было исследование ASCOT-LLA (The Anglo-Scandinavian Cardiac Outcomes – Lipid-lowering Arm). После прекращения исследования в 2003 г. была проведена оценка смертности с медиа- ной длительности наблюдения 11 лет. Результаты продемонстрировали снижение смертности в группе аторвастатина: от всех причин – на 14%; не кардиоваскулярной – на 15%; oт инфекций и респираторных заболеваний – на 36%.
Полученные результаты подтверждают плейотропные эффекты статинов, в частности влияние на факторы воспаления, что реализовалось в максимальное снижение смертности от инфекций и респираторных заболеваний.
Приведенные результаты были продемонстрированы при использовании оригинального препарата аторвастатина (Липримар).
Одним из негиполипидемических эффектов статинов оказалось влияние на углеводный обмен. По результатам метаанализа многочисленных исследований по использованию статинов в первичной и вторичной профилактике сердечно-сосудистой патологии, оказалось, что они повышают вероятность дисгликемии и развития СД 2-го типа [35]. Приведенные данные легли в основу анализа по сравнительной оценке рисков влияния статинов на сердечно-сосудистые исходы и развитие новых случаев СД. В результате доказано снижение абсолютного риска кардиальной смерти на 9 случаев и относительно риска на 23% против увеличения абсолютного риска новых случаев СД на 1 случай и относительного риска на 9% [29]. Поскольку основной причиной смерти при СД является сердечно-сосудистая патология, очевидно, что польза от использования статинов значимо превышает риски, ассоциированные с развитием новых случаев СД [30].
Следует отметить, что плейотропные эффекты статинов могут оказывать позитивное влияние на углеводный обмен. Так, в исследовании Diabetes and Atorvastatin Trial (DIATOR trial) наблюдались 89 пациентов с впер- вые выявленным СД 1-го типа с позитивными АТ, которые в течение 18 мес. получали плацебо vs аторва- статин. В итоге было отмечено, что аторвастатин снижает скорость снижения функции бэта-клеток у лиц с повышенным уровнем СРБ или других маркеров воспаления (IL-6, IL-1RA, sICAM) [23, 37].
Таким образом, статины остаются препаратами первого выбора при коррекции дислипидемиии, а при СД на- значаются и при ее отсутствии с титрацией дозы до обеспечения целевых уровней липидов, что основано на многолетнем опыте использования статинов при первичной и вторичной профилактике сердечно-сосудистых рисков независимо от наличия дислипидемии.
Тем не менее примерно две трети всех событий развиваются у подвергавшихся лечению пациентов, даже на фоне оптимальной терапии статинами. При значимом снижении ХС ЛПНП и рисков сердечно-сосудистых со- бытий статины не обеспечивают достижения уровня «без диабета», что позволяет говорить о том, что остаточный риск обусловлен другими факторами, например повышением уровня ТГ или снижением уровня ХС ЛПВП. Повышение уровня TГ ассоциировано с высоким риском сердечно-сосудистых событий, что обуслов- лено комплексным влиянием, включающим: прямой эффект малых триглицеридобогащенных липопротеидов; низкий уровень ХС ЛПВП; связь с инсулинорезистетностью и гипер-инсулинемией; прокоагуляционный статус и другие факторы.
В табл. 3 представлены эффекты основных классов гиполипидемических препаратов с позиций оценки их влияния на липидный профиль. Сравнительный анализ позволяет оценить преимущества статинов и оце- нить потенциальные возможности других классов препаратов, из которых внимание привлекают фибраты и ниацин (витамин В3), так как именно они оказывают максимальное влияние на снижение уровня ТГ (табл. 3).
Таблица 3. Эффекты основных классов липидмодифицирующих препаратов
Класс | ХС ЛПНП | ТГ | ХС ЛПВП |
| Статины | –20–60% | –10–30% | +5–12% |
| Секвестранты желчных кислот | –15–18% | – | ±15% |
| Фибраты | –0–5% | –20–50% | +5–12% |
| ω-3 жирные кислоты | –, + | –10–30% | ±0–5% |
| Ниацин (В3) | –10–15% | –20–40% | –15–30% |
Препаратом выбора является ниацин (витамин В3), который: потенцирует действие статинов; снижает синтез ТГ в печени, что приводит к уменьшению синтеза частиц ЛПОНП; увеличивает снижение AроB и снижает катаболизм AроA; повышение уровня Aро A-1 влияет на повышение ХС ЛПВП и может снизить уровень ABC A-1 (АТФ-связывающая кассета) транспортеров, что приводит к ЛПВП-медиированной эманации холестери- на из периферичных клеток.
Использование ниацина лимитировано развитием гипериемии, что является значимым фактором снижения приверженности пациентов к лечению. В то же время, по данным исследования Arterial Biology for the Investigation of the Treatment Effects of Reducing cholesterol (ARBITER-2), гиперемия может быть маркером высокого липидного ответа на ниациновую терапию. Пациенты с гиперемией имели значительно больший ответ по увеличению ХС ЛПВП, чем больные без гиперемии. Если эти результаты будут подтверждены, па- циенты смогут продолжать лечение ниацином, не рассматривая гиперемию как серьезный побочный эф- фект. Вторым фактором, ограничивающим использование ниацина при СД, является ухудшение гликемии.
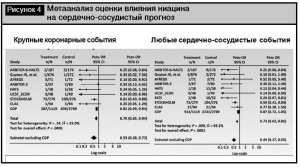
Результаты использования ниацина свидетельствуют о снижении кардиальных рисков (рис. 4) [19].
Активаторы рецептора пролифератора пероксисом альфа, фибраты активизируют бэта-окисление свобод- ных жирных кислот, обеспечивают снижение синтеза ТГ, активируют липолиз и клиренс частиц, богатых ТГ, повышают синтез АpоA I и ApoA II и снижают синтез ApoC III и ApoB. Перечисленные эффекты приводят к снижению уровня ТГ плазмы, повышению уровня ХС ЛПВП, снижению мелких плотных ЛПНП и замедлению транспорта ТГ в ткани.
С этих позиций агонисты рецепторов PPAR-альфа обладают высоким терапевтическим потенциалом реализующимся снижением макрососудистых проявлений при СД [11].
Помимо воздействия на липиды и липопротеины, фенофибрат, как и статины, обладает рядом плейотроп- ных эффектов, опосредованных PPAR-альфа-рецепторами. Доказано, что фенофибрат вызывает снижение уровней маркеров воспаления (С-реактивного белка, ФНО-альфа, IL-1бэта, IL-6, а также белка хемотаксиса моноцитов 1-го типа; снижение маркеров гемостаза (фибриногена и PAI 1); улучшение чувствительности к инсулину [33].
В исследовании DIACOR (Diabetes and Combined Lipid Therapy Regimen), было подтверждено, что максимальный эффект снижения маркеров воспаления был отмечен у пациентов более высокими исходными уровнями данных параметров.
Противовоспалительное воздействие фибратов и улучшение эндотелиальной функции – фактор, способствующий усилению антиатеросклеротического воздействия, так как атеросклероз рассматривается как хроническое воспалительное заболевание.
Полученные факты получили подтверждение в рандомизированном, многоцентровом 5-летнем исследовании Fenofibrate Inter vention and Event Lowering in Diabetes (FIELD). По результатам моделирования регрес- сии Кокса для учета влияния диспропорционального избытка дополнительной терапии статинами в группе лечения фенофибратом относительный риск составил –19% для коронарных событий и –15% для общих сердечно-сосудистых заболеваний, что соответствует степени снижения частоты сердечно-сосудистых со- бытий, определенной в рамках других крупных проспективных исследований фибратов. Кроме того, в этом исследовании при ангиографии отмечено снижение прогрессирования поражения коронарных сосудов на фоне терапии фенофибратом, а у пациентов с эссенциальной гипертонией добавление фенофибрата при- водило к снижению частоты инсульта [20, 21, 32].
Фенофибрат вызывает также нелипидные эффекты:
- снижение неоангиогенеза через активность NFKB и VEGF и проявлений оксидативного стресса по- средством повышения экспрессии и синтеза антиоксидантных ферментов;
- улучшение эндотелиальной функции сосудов через повышение NO, снижение эндотелина и апоптоза клеток эндотелия;
- улучшение реологических свойств крови (снижение уровня эндотелина, повышение уровня РАI 1);
- уменьшение толщины сосудистой стенки за счет снижения активности альдозредуктазы и уменьшения пролиферации гладкомышечных клеток сосудов [6, 22].
Микрососудистые эффекты логично подтверждаются наличием рецепторов PPAR-? в микрососудах и объ- ясняют третичные конечные точки, связанные с микрососудистыми осложнениями в исследовании FIELD, включая снижение риска развития ретинопатии, нефропатии и нетравматических ампутаций. Максимально выражено улучшение было отмечено со стороны ретинопатии. Терапия фенофибратом приводила к сниже- нию потребности в лазерной коагуляции на 30% (р = 0,0003). Согласно результатам лечение фенофибратом приводило к снижению частоты первичной лазерной терапии по поводу макулярного отека (ОР = 31%; р =0,002) и пролиферативной ретинопатии (ОР = 30%; р = 0,015). При этом отмечена эффективность терапии при первичной профилактике ретинопатии (ОР = 39%; р = 0,0008).
В офтальмологической ветви исследования FIELD, которое включало наблюдение за 1012 пациентами с ис- пользованием фотографирования глазного дна и оценку прогрессирования процесса по шкале раннего ле- чения диабетической ретинопатии, прием фенофибрата приводил к снижению прогрессирования ранее вы- явленной ретинопатии (3,1 против 14,6% плацебо; ОР = 79%; р = 0,004). Кроме того, отмечено снижение обобщенной конечной точки – значимой патологии сетчатки (первичная конечная точка плюс случаи маку- лярного отека плюс лазерная терапия по поводу ретинопатии) в общей когорте наблюдения (ОР = 31%; р =0,022). Таким образом, в исследовании продемонстрирована способность фенофибрата снижать частоту не только макрососудистых, но и микрососудистых событий, причем эффект не зависел от уровня HbA1c, артериального давления, уровня липидов и использования другой вазотропной терапии, что позволяет предположить вовлечение плейотропных механизмов [19].
Данные наблюдения требуют подтверждения в рамках других исследований, например ACCORD-EYE, в котором доказано снижение риска прогрессии ретинопатии на 40% [7, 38].
Значимые результаты, свидетельствующие о снижении риска, были получены касательно прогрессии нейро- патии и нетравматических ампутаций. Так, в исследовании FIELD достигнуто снижение риска развития новых случаев нейропатии на 18%, редукция симптомов ранее выявленной нейропатии на 40% и нетравматических ампутаций – на 36%.
Достаточно редко до последних лет в клинической практике обсуждалась кардиальная автономная нейропатия, негативное влияние которой на качество и продолжительность жизни бесспорно. Одно из проявлений автономной кардиальной нейропатии – безболевая ишемия миокарда, которая снижает возможности диаг- ностики и инициации терапии, что ведет к повышению риска ишемических событий. При этом кроме иссле- дований по долгосрочной компенсации углеводного обмена практически не было определено патогенетиче- ского терапевтического подхода. В исследовании FIELD фенофибрат на 78% (р = 0,003) снижал частоту сер- дечно-сосудистых осложнений при СД и безболевой ишемии миокарда.
Таким образом, использование фенофибрата обесспечивает не только дополнительное к влиянию статинов улучшение кардиального прогноза, но и оказывает влияние на замедление скорости развития микроангиопа- тий и нейропатий, что определяет целесообразность его использования в комплексной терапии.
Потенциально в комплексной терапии дислипидемии при СД могут быть использованы секвестранты желч- ных кислот (ионообменные смолы), омега-3 жирные кислоты, ингибиторы переноса белков холестерина (CEPT inhibitors), оказывающие влияние на липидный спектр и улучшающие показатели углеводного обмена.
Секвестранты желчных кислот используют как дополнение к терапии статинами при высокой гиперхолесте- ринемии (общий холестерин >7,0–8,0 ммоль/л). Механизм действия этой группы препаратов (колестирамин, колестипол, колесевелам, колестагель) обеспечивает:
- связывание желчных кислот в просвете кишечника, что препятствует их реабсорбции и усиливает их экскрецию с фекальными массам;
- возрастание потребности гепатоцитов в холестерине, что ведет к экспрессии рецепторов липопро- теинов на их поверхности и снижению уровня ХС ЛПНП в крови;
- минимальное системное действия.
Многолетнее использование секвестрантов желчных кислот позволило сделать заключение об улучшении гипогликемического контроля на фоне их приема, что позволило рекомендовать FDA его использование в качестве гипогликемизирующего средства [5, 17]. В настоящее время в современных рекомендациях Амери- канской ассоциации специалистов в области клинической эндокринологии и Американской коллегии эндок- ринологов колесевелам рекомендуется в качестве препарата 2-го выбора при исходном уровне НbA1с 6,5–7,5% в комбинации с метформином [31]. Эта рекомендация нашла подтверждение в рекомендациях консен- суса по лечению СД 2-го типа, достигнутого между Американской ассоциацией диабета и Европейской ассоциации по изучению сахарного диабета 2012 г., что однозначно свидетельствует о возможности использования колесевелама в комплексной терапии дислипидемии при СД [2].
Омега-3 жирные кислоты также являются препаратами выбора, оказывающими позитивное влияние на сер- дечно-сосудистый прогноз, обеспечивая, по данным исследования JELIS, снижение риска коронарных событий на 53% и улучшение показателей углеводного обмена (снижение нарушений толерантности к глюкозе на 23% в группе с исходными нарушениями и на 18% без них) [41]. Результаты ряда исследований (CART, MARGARIN, JELIS, Cardiovascular Health Study) позволили включить Американской ассоциации сердца назначение ?-3 жирных кислот в перечень препаратов, рекомендуемых всем пациентам после перенесенного инфаркта миокарда, независимо от сопутствующей патологии [4, 24, 28]. В настоящее время завершено крупнейшее исследование у пациентов с СД 2-го типа ORIGIN, в котором проведена оценка эффективности ранней инсулинизации гларгином и использования омега-3 жирных кислот, но результаты его пока не опубликованы.
Потенциальный класс препаратов для коррекции дислипидемии – ингибиторы переноса белков холестерина (CEPT inhibitors), оказывающие нормализующее влияние на ХС ЛПВП, ХС ЛПНП и углеводный обмен. Этот класс препаратов интенсивно изучается и, возможно, окажется полезным при СД.
Таким образом, современная стратегия назначения гиполипидемической терапии при СД основанная об- ширной доказательной базе включает следующие рекомендации:
- препаратами первого выбора являются статины;
- статины назначаются всем пациентам с наличием сердечно-сосудистой патологии, при декомпенсации или наличии осложнений СД с выбором оптимальной дозы, обеспечивающей целевые параметры липидного спектра;
- инициация гиполипидемической терапии статинами должна быть проведена при СД без манифестных признаков сердечно-сосудистой патологии среднетерапевтическими дозами;
- при наличии гипертриглицеридемии к статинам рекомендуется добавление фибратов или никотино- вой кислоты [1, 2, 14, 34].
К сожалению, реальная клиническая практика свидетельствует о появлении приверженности к гиполипиде- мической терапии у пациентов, которая увеличивается после перенесенных острых кардиальных событий, а первичная профилактика, являющаяся наиболее эффективной, зачастую не принимается больными и не- достаточно агрессивно рекомендуется врачами даже в виде монотерапии.
ЛИТЕРАТУРА
1. ACCORD Study Group Effects of Combination Lipid Therapy in Type 2 Diabetes Mellitus // N. E. J. M. – 2010. –Vol. 362, N 17. – P. 1563–1574.
2. ADA EASD 2012 // Diabetes Care. Diabetologia. – 19 April 2012 [Epub ahead of print].
3. American Diabetes Association Standards of medical care in diabetes – 2009 // Diabetes Care. – 2009. – Suppl.1. – S13–61.
4. Bays H.E. The Hopkins Text book of Dyslipidemia. – Lippincrott Williams & Wilkins, 2010. – P. 245–257.
5. Bays H.E., Goldberg R.B., Truitt K.E., Jones M.R. // Arch. Intern. Med. – 2008. – Vol. 168, N 18. – P. 1975–1983.
6. Belfort R.S., Berria R., DeFronzo R. et al. // Diabetologia. – 2004. – Vol. 47 (suppl. 1). – A25–A26.
7. Chew E.Y., Ambrosius W.T., Davis M.D. et al. // N. E. J. M. – 2010. – Vol. 363, N 3. – P. 233–244.
8. Colhoun H.M., Betteridge D.J., Durrington P.N. et al. // Lancet. – 2004. – Vol. 364, N 9435. – P. 685–696.
9. Colhoun H.M., Betteridge D.J., Durrington P.N. et al. // Diabetologia. – 2005. – Vol. 48, N 12. – P. 2482–2485.
10. Colhoun H.M., Betteridge D.J., Durrington P.N. et al. // Am. J. Kidney Dis. – 2009. – Vol. 54, N 5. – P. 810–819.
11. Diabetes Atherosclerosis Intervention Study 71 Investigators. Effect of fenofibrate on progression of coronary artery disease in Type 2 diabetes: the Diabetes Atherosclerosis Intervention Study, a randomised study // Lan- cet. – 2001. – Vol. 357, N 9260. – P. 905–910.
12. Emerging Risk Factors Collaboration. Diabetes mellitus, fasting blood glucose concentration, and risk of vascu- lar disease: a collaborative meta-analysis of 102 prospective studies // Lancet. – 2010. – Vol. 375, N 9733. – P.2215–2222.
13. Emerging Risk Factors Collaboration. Diabetes mellitus, fasting glucose, and risk of cause-specific death // N.Engl. J. Med. – 2011. – Vol. 364, N 9. – P. 829–841.
14. ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipi- daemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS) // Eur. Heart J. – 2011. – Vol. 32, N 14. – P. 1769–1818.
15. Ford E.S., Zhao G., Li C. // J. Am. Coll. Cardiol. – 2010. – Vol. 55, N 13. – P. 1307–1310.
16. Gaede P., Lund-Andersen H., Parving H.H., Pedersen O. // N. E. J. M. – 2008. – Vol. 358, N 6. – P. 580–591.
17. Handelsman Y. // Postgrad. Med. – 2009. – Vol. 121, N 3 (suppl 1). – P. 19–24.
18. Johnson C., Waters D.D., DeMicco D.A. et al. // Am. J. Cardiol. – 2008. – Vol. 102, N 10. – P. 1312–1317.
19. Jun M., Foote C., Lv J., Neal B. et al. // Lancet. – 2010. – Vol. 375, N 9729. – P. 1875–1884.
20. 20 Keech A., Simes R.J., Barter P. et al. // Lancet. – 2005. – Vol. 366, N 9500. – P. 1849–1861.
21. Keech A.C., Mitchell P., Summanen P.A. et al. // Lancet. – 2007. – Vol. 370, N 9600. – P. 1687–1697.
22. Kim J., Ahn J.H., Yu Y.S. et al. // Experimental Eye Res. – 2007. – Vol. 84, N 5. – P. 886–893.
23. Koening W. et al. Clinical Trials. gov NST00974740 DIATOR study.
24. Kris-Etherton P.M., Harris W.S., Appel L.J. // Circulation. – 2002. – Vol. 106, N 21. – P. 2747–2757.
25. LaRosa J.C., Deedwania P.C., Shepherd J. et al. // Am. J. Cardiol. – 2010. – Vol. 105, N 3. – P. 283–287.
26. Mora S., Wenger N.K., Demicco D.A. et al. // Circulation – 2012. – Vol. 125, N 16. – P. 1979–1987..
27. Neil H.A., DeMicco D.A., Luo D. et al. // Diabetes Care. – 2006. – Vol. 29, N 11. – P. 2378–2384.
28. Oikawa S., Yokoyama M., Origasa H. et al. // Athero-sclerosis. – 2009. – Vol. 206, N 2. – P. 535–539.
29. Preiss D., Seshasai S.R., Welsh P. et al. // JAMA. – 2011. – Vol. 305, N 24. – P. 2556–2564.
30. Rajpathak S.N., Kumbhani D.J., Crandall J. et al. // Diabetes Care. – 2009. – Vol. 32, N 10. – P. 1924–1929.
31. Rodbard H.W., Jellinger P.S., Davidson J.A. et al. // Endocr. Pract. – 2009. – Vol. 15, N 6. – P. 540–559.
32. Rosenson R.S., Fioretto P., Dodson P.M. // Atherosclerosis. – 2011. – Vol. 218, N 1. – P. 13–18.
33. Rosenson R.S., Huskin A.L., Wolf D.A. et al. // Athero-sclerosis. – 2008. – Vol. 198, N 2. – P. 381–388.
34. Sacks F.M., Carey V.J., Fruchart J.C. // N. E. J. M. – 2010. – Vol. 363, N 7. – P. 692–694.
35. Sattar N., Preiss D., Murray H.M. et al. // Lancet. – 2010. – Vol. 375, N 9716. – P. 735–742.
36. Seshasai S.R., Kaptoge S., Thompson A. et al. // N. E. J. M. – 2011. – Vol. 364, N 9. – P. 829–841.
37. Strom A., Kolb H., Martin S. et al. // PLoS One. – 2012. – Vol. 7, N 3. –e33108. Epub. 2012 Mar 2.
38. The ACCORD Study Group and ACCORD Eye Study Group Effects of medical therapies on retinopathy progression in type 2 diabetes // N. E. J. M. – 2010. – Vol. 263. – P. 233–244.
39. Turner R.C., Millns H., Neil H.A. et al. // BMJ. – 1998. – Vol. 316, N 7134. – P. 823–828.
40. Wright A.D., Dodson P.M. // Eye (Lond.). – 2011. – Vol. 25, N 7. – P. 843–849.
41. Yokoyama M., Origasa H., Matsuzaki M. et al. // Lancet. – 2007. – Vol. 369, N 9567. – P. 1090–1098.
Данная статья опубликована в журнале «Медицинские новости», 2012. №9.
Источник: www.mednovosti.by









Комментировать