Писание концепции липидного дистресс-синдрома, полученная в ходе 20-летних комплексных научных исследований в клинике факультетской хирургии им. С.И. Спасокукоцкого РГМУ по диагностике и хирургическому лечению нарушений липидного метаболизма при облитерирующем атеросклерозе.
Савельев В.С., Петухов В.А., Ан Е.С., Семенов Ж.С., Миронов А.В.
Более 20 лет назад в клинике факультетской хирургии им. С.И. Спасокукоцкого РГМУ были начаты комплексные научные исследования по диагностике и хирургическому лечению нарушений липидного метаболизма при облитерирующем атеросклерозе. За это время были открыты неизвестные аспекты этиопатогенеза, на основе которых разработаны принципиально новые методы диагностики и лечения не только атеросклероза артерий нижних конечностей, но многих других заболеваний, обусловленных либо непосредственно связанных с нарушениями липидного метаболизма. В результате обобщения полученных данных была сформирована концепция липидного дистресс–синдрома (ЛДС) [11,15,20–22,25].
Установленные при поражении различных органов–мишеней ЛДС и возникших вследствие этого заболеваниях (атеросклерозе, хронической ишемической болезни органов пищеварения, желчнокаменной болезни, холестерозе желчного пузыря и внепеченочных желчных протоков, жировом гепатозе, жировом панкреатозе и др.) закономерности нарушения функционирования различных систем не зависели от нозологии, а основывались на общих для ЛДС патологических процессах. Их основу составляют эндотоксинемия, нарушения липидного обмена, дисбиоз, различные нарушения метаболических функций печени и ее ретикулоэндотелиальной системы [6].
В последние годы в число нозологий, входящих в состав ЛДС, был включен перитонит, вернее, дисметаболические последствия перенесенного гнойного перитонита. Это связано с особенным течением у представляющих эту категорию пациентов отдаленного послеоперационного периода, характеризующегося быстрым развитием и/или прогрессированием различных сердечно–сосудистых заболеваний и их осложнений, часто заканчивающихся летальными исходами [20]. Причиной поражения артерий после перенесенной абдоминальной катастрофы различного генеза является не столько массивная эндотоксиновая агрессия, типичная для острой фазы перитонита и осложняющая его течение, сколько длительно сохраняющаяся хроническая эндотоксиновая агрессия с инициированными в острой фазе перитонита дисфункцией и повреждением эндотелия и, как следствие, стремительным развитием атеросклероза и его осложнений [18–20].
Известно, что организм человека подвергается эндотоксиновой агрессии в течение всей жизни, но клинически значимая патология возникает только при депрессии антиэндотоксинового иммунитета и нарушении функционирования главных эндотоксинсвязывающих и эндотоксинэлиминирующих систем организма [1,25]. Вследствие этого повторяющиеся эпизоды поступления в общий кровоток избыточных количеств эндотоксина (ЭТ) приводят к чрезвычайной по силе мобилизации резервных возможностей адаптационных систем организма и периодическому возникновению транзиторной (малосимптомной) полиорганной недостаточности [27–30,65].
Стрессы, инфекционные процессы, обоснованная или неоправданная антибактериальная терапия значительно уменьшают или резко истощают резервные возможности синтеза факторов антиэндотоксиновой защиты (к которым, в первую очередь, относятся липопротеиды высокой плотности), постепенно подавляется активность РЭС печени и ферментативных систем гепатоцитов, теряется возможность сглаживать (демпферировать) «адреналиновые залпы» надпочечников – т.е. в течение жизни у человека достаточно часто возникают предпосылки к старту или прогрессированию эндотелиальной дисфункции (ЭД) и атеросклероза [12,26,37,65].
Эндотоксинемия считается наиболее важной и доказанной причиной развития заболеваний в органах–мишенях при ЛДС. Длительная эндотоксиновая агрессия на фоне дисбиоза желудочно–кишечного тракта формирует реальные дисметаболические условия для развития и прогрессирования ЭД, которая в итоге реализуется в виде конкретных и очень тяжелых заболеваний (атеросклероз, атеротромбоз, гепатоз, панкреатоз, холестероз фатерова сосочка, желчного пузыря и внепеченочных желчных протоков, желчнокаменная болезнь и т.д.) [4,9,11,22]. Повторяющиеся повреждения эндотелия при хронической эндотоксиновой агрессии являются главными пусковыми и поддерживающими механизмами ЭД и поражения артерий при любой клинической форме ЛДС [22]. Однако непосредственное участие ЭД в патогенезе поражения других (не сосудистых) органов–мишеней до сих пор научными данными не подтверждено, хотя сочетание, например, атеросклероза и заболеваний органов гепатопанкреатодуоденальной зоны и наоборот достигает 75–90% и уже редко кого удивляет [9,14,22].
Многочисленные фундаментальные исследования последних лет подтвердили роль патологии эндотелия в патогенезе многих сердечно–сосудистых заболеваний. Доказано, что ключевую роль в патогенезе атеросклероза, артериальной гипертонии и ишемической болезни сердца играет именно ЭД, характеризующаяся нарушением регуляции сосудистого тонуса, продукции оксида азота, неадекватным (увеличенным или сниженным) образованием в эндотелии различных биологических веществ и повышением сосудистой проницаемости [3,6,56]. При этом ЭД проявляет себя либо в виде спазма артерий, либо в виде отсутствия реакции в ответ на воздействие физиологических или фармакологических стимулов, тогда как нормальные сосуды реагируют дилатацией. Такая патологическая реакция эндотелия считается начальным этапам развития атеросклероза с вовлечением не только крупных артерий, но и сосудов микроциркуляторного русла [32,33]. При этом тяжесть течения атеросклероза всегда коррелирует с ЭД [63], а стандартная терапия сердечно–сосудистых заболеваний не устраняет ЭД, сохраняется риск развития их осложнений в 3 раза [6,8,41,64].
Известно, что ведущим триггером нарушений функций эндотелиального монослоя наряду с другими факторами является эндотоксин (ЭТ), при этом патологический эффект реализуется через рецепторный механизм только при его низких концентрациях, при высоких – опосредованный макрофагами крови СD–14–эффект дополняется другими механизмами, главным среди которых считается активизация киназы легких цепей миозина и деполимеризация актина в эндотелиоцитах, т.е. нарушение проницаемости эндотелия [7,24]. В этой связи ЭД и повреждение эндотелиоцитов отождествляются с повышением их проницаемости [40].
Рассматривая проблему ЭД, нельзя останавливаться на поражении только артерий. Немалую роль в развитии этих событий играет печень – главный орган–мишень ЛДС. Стимулированные ЭТ клетки Купфера в печени снижают на 86% синтез синтазы оксида азота, вызывая дисфункцию печеночных синусоидов с последующим мощным цитокиновым гейзером, нарушающим кровоток в органе [34,35,44]. Это было также подтверждено в нашей клинике при исследовании печеночного кровотока при ЛДС [4,9].
При изменении конфигурации эндотелиоцитов в условиях «эндотоксиновых атак» повышенные концентрации фактора некроза опухолей, С–реактивного белка, отдельных цитокинов [51,54,55] и главным образом окисленных липопротеидов низкой плотности (в том числе и при нормолипидемии) способствуют снижению синтеза гепрана – ключевого компонента субэндотелиального матрикса – и увеличению размеров межэндотелиальных щелей [33,38,39,52]. Даже кратковременное повышение проницаемости эндотелия для активизированных ЭТ–макрофагов при очередном «эндотоксиновом залпе» значительно усиливает ЭД. Положительная роль в этом аспекте отводится липопротеидам высокой плотности, уменьшающим активность макрофагов крови и защищающим эндотелиоциты от апоптоза путем ингибирования активных радикалов О2 и блокирования митохондриального апоптического каскада [3,6,23,32,41].
Однако помимо параэндотелиального транспорта при эндотоксиновой агрессии ускоряется каолиновый механизм переноса через эндотелиоциты, его активность пропорциональна концентрации ЭТ и длительности эндотоксиновой агрессии [45,53,56,60,62].
Диагностика эндотелиальной дисфункции является чрезвычайно важной и ответственной задачей, от которой зависит составление программы лечения. В последние годы в этом плане основное внимание сосредоточено на маркерах ЭД, ими считаются определение уровней Р–селектина, интерлейкина–6 и т.д. [48,50,54, 61,62]. Но методы их определения трудно воспроизводимы и, если быть справедливым, в большей части представляют чисто научный интерес. В клинической практике для оценки ЭД особое значение придают определению концентрации высокочувствительного С–реактивного белка (СРБ) [43]. Он синтезируется в печени, является представителем семейства белков острой фазы воспаления, его синтез регулируется провоспалительными цитокинами: интерлейкином–1, интерлейкином–6, фактором некроза опухоли [31,32,47]. По данным R.Bataille (1992), СРБ достоверно отражает активность синтеза интерлейкина–6, способствующего наряду с другими провоспалительными цитокинами прогрессированию атеросклероза [31]. Патологическое действие СРБ реализуется также в сочетании с другими медиаторами воспаления, особенно с интерлейкином–6, являющимся основным индуктором синтеза СРБ [49]. СРБ участвует в привлечении моноцитов в зону атеросклеротической бляшки посредством связывания с расположенными на их поверхности специфическими рецепторами для СРБ, кроме того, стимулирует образование «пенистых» клеток за счет усиления захвата липопротеидов низкой плотности макрофагами [59,61].
Разработанные ВОЗ стандарты для высокочувствительных способов определения уровня СРБ обеспечивают достоверность и воспроизводимость результатов [47]. Информационная ценность СРБ в ряду различных лабораторных показателей при оценке ЭД и риска развития связанных с ней осложнений может быть представлена в следующем виде: СРБ > отношение «ХС/ЛПНП» > ЛПНП > ХС > гомоцистеин > ЛП(а) [58].
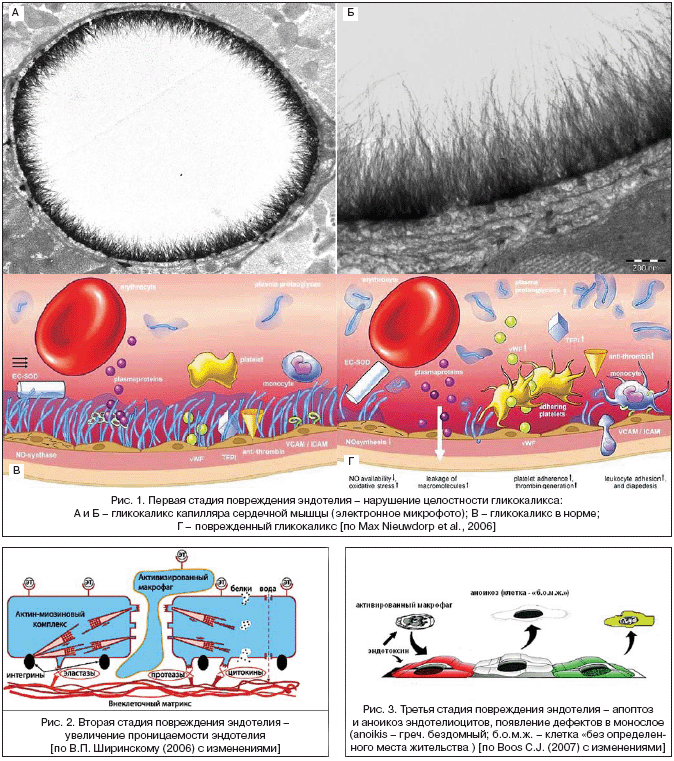
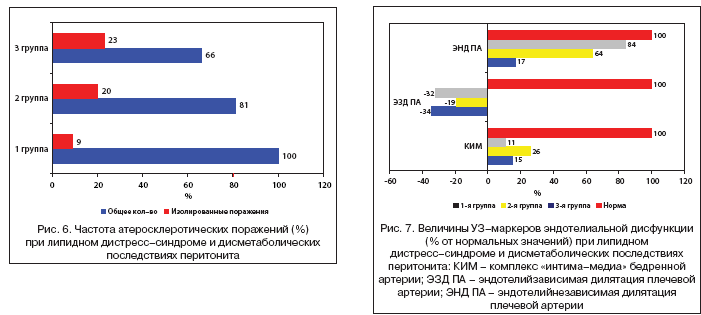
Биохимические маркеры отражают воспаление или, собственно, лишь отдельные из многочисленных процессов, характеризующих дисфункцию эндотелия, итогом которой является повреждение эндотелиального монослоя. В этой связи мы придерживаемся следующей позиции: в течении ЭД необходимо выделять несколько стадий, на каждой из которых независимая триггерная роль принадлежит ЭТ. Первая стадия – повреждение гликокаликса эндотелия (рис. 1), вторая – увеличение проницаемости эндотелия (рис. 2), третья, заключительная стадия – повреждение эндотелия (рис. 3), которое определяется с помощью циркулирующих в кровотоке эндотелиоцитов. Важно отметить, что эндотелиоциты появляются в крови вследствие двух основных процессов – апоптоза и аноикоза [30,40,44,48,52,57,63].
На ранних стадиях атеросклеротического процесса формированию атеромы предшествует утолщение слоев сосудистой стенки [3,5,10,63]. Количественный показатель, рассчитанный при суммировании ряда послойных измерений сосудистой стенки и отражающий прогрессирование атеросклеротического процесса, получил название intima–media thickness (комплекс «интима–медиа» – КИМ) [10]. Увеличение данного показателя более 1,0 мм расценивается как начальный атеросклероз в данной сосудистой области. В настоящее время появилась возможность прижизненного неинвазивного исследования стенки сосуда: выявление атеросклероза в различных сосудистых бассейнах с помощью определения толщины и рельефа КИМ [3,10,36,64].
Метод исследования сосудов с использованием ультразвука высокого разрешения (УЗВР) позволяет проводить исследование периферических артерий в трех режимах – В–модальном, цветовом и доплеровском – и дает возможность не только оценить состояние КИМ, но также оценить кровоток в артериях. Значительным прогрессом стала возможность неинвазивного определения состояния эндотелия периферических сосудов. Методика изучения функции эндотелия с помощью ультразвука высокого разрешения (УЗВР) предложена D.S. Celermajer c соавт. в 1992 г. [36]. В качестве модели чаще используется плечевая артерия. В ходе исследования рассчитывается эндотелийзависимая вазодилатация (ЭЗВД) – количественный показатель, характеризующий вазомоторную функцию эндотелия. Нормальной считается величина ЭЗВД не менее 8–10% [6,10,36].
Медикаментозная терапия ЭД была предложена более 15 лет назад и включала 5 основных позиций: прямое воздействие на рецепторы сосудистого эндотелия; влияние на активность эндотелиальной синтетазы оксида азота; восполнение дефицита эндотелиальных факторов; предотвращение действия медиаторов ЭД и опосредованное влияние через снижение действия факторов риска сердечно–сосудистых заболеваний [8]. Однако, с одной стороны, эти позиции нельзя считать этиопатогенетически обоснованными, что доказывается частыми сменами препаратов в каждой из них, с другой – препараты действуют всегда не адресно, а опосредованно, через многие механизмы.
Лечение дисфункции эндотелия при ЛДС в отличие от общепринятых стандартов основано на этиопатогенезе заболевания и проводится одновременно по всем ключевым направлениям: удаление и нейтрализация микробных токсинов и медиаторов воспаления (энтеросорбция), активизация деятельности основных эндотоксинсвязывающих и эндотоксинэлиминирующих органов (гепатопротекция), восстановление микробиоценоза кишечника (энтеропротекция), нормализация проницаемости эндотелия (эндотелиопротекция) [14,22].
Цель исследования: прогностическая оценка эндотелиальной дисфункции и результатов ее комплексного этиопатогенетического лечения при различных клинических формах липидного дистресс–синдрома Савельева и дисметаболических последствиях перитонита.
Материал и методы исследования
В исследование был включен 251 пациент в возрасте от 29 до 55 лет, из них было 136 женщин и 115 мужчин. 186 пациентов представляли заболевания различных органов–мишеней ЛДС, 65 больных были обследованы через 1–3 мес. после лапаротомии, выполненной по поводу распространенного фибринозно–гнойного перитонита. Все больные были распределены на 3 группы.
В 1–ю группу с сосудистыми органами–мишенями ЛДС (n=88) вошли 29 пациентов с облитерирующим атеросклерозом артерий нижних конечностей, 18 пациентов с атеросклеротическими поражениями артерий головного мозга, 15 с хронической ишемической болезнью органов брюшной полости, 26 с ишемической болезнью сердца (без инфаркта миокарда в анамнезе). 2–ю группу (n=98) составили пациенты с заболеваниями органов гепатопанкреатодуоденальной зоны: 52 пациента с холестерозом желчного пузыря (14 – бескаменная, 12 – полипозная и 26 – калькулезная формы), 19 больных с жировым панкреатозом, 27 пациентов с диффузным жировым гепатозом. 65 пациентов, перенесших перитонит, составили 3–ю группу. Пациенты всех групп были сопоставимы по половому и возрастному признакам.
Клинические особенности каждой из представленных в данном сообщении нозологий не рассматриваются, анализируются параметры, характеризующие эндотелиальную дисфункцию. Отметим, что ни один из пациентов 2–й и 3–й клинических групп не предъявлял жалоб, связанных с патологией органов сердечно–сосудистой системы, и, напротив, пациенты 1–й группы не имели явных клинических признаков заболеваний желудочно–кишечного тракта.
Диагностика эндотелиальной дисфункции проводилась с помощью общепризнанных современных методов. Содержание эндотоксина (ЭТ) в плазме крови исследовалось с помощью стандартного LAL–теста в нашей модификации [42]. Концентрацию высокочувствительного СРБ определяли методом кинетической турбидиметрии с латексным усилением на автоматическом иммунохимическом анализаторе специфических белков Immage®/Immage® 800 фирмы «Becman Couter®» (США).
Определение количества циркулирующих десквамированных эндотелиоцитов (ЦДЭ) проводилось по методу J. Hladovec (1973) [13]. Подсчет числа ЦДЭ проводили под микроскопом в двух сетках камеры Горяева (рис. 4).
Сосудодвигательную функцию эндотелия оценивали с помощью ультразвукового аппарата «Philips» (Голландия) линейным датчиком 7,5 МГц при проведении пробы с реактивной гиперемией [36]. Вазоконстрикцию, или развитие нарушений сосудодвигательной функции эндотелия, констатировали в случае прироста показателей менее 15% относительно исходных значений.
Комплекс интима–медиа (КИМ) оценивался на специальном участке стенки бедренной артерии, расположенном напротив впадения глубокой бедренной вены в поверхностную, что позволяет стандартизировать УЗ–исследование и исключить технические абберации (рис. 5) [14].
Комплексное лечение ЭД проводилось в рамках стратегии ЛДС [22]. Следует подчеркнуть, что все применяемые для этой цели препараты для исключения нежелательного ксенобиотического эффекта были только растительного происхождения. Базовым методом была энтеросорбция ФИШант–С® (ПентаМед, Россия), представляющим композицию биологически инертных компонентов (белое масло) и пребиотиков (пектин, агар–агар) в виде сложной капсулированной микроэмульсии. ФИШант–С® хорошо поглощает желчные кислоты и их комплексы с ЭТ, они легко переносятся через пектино–агаровую полисахаридную мембрану, растворяются в белом масле и внутри микрокапсулы транспортируются в толстую кишку, где микроорганизмы используют пектин и агар–агар в качестве пищевого (метаболического) субстрата. ФИШант–С® обладает наибольшей сорбционной способностью по отношению к ЭТ грамотрицательной микрофлоры по сравнению со многими современными рыночными сорбентами [18,21,22].
Параллельно назначался растительный гепатопротекторный препарат гепабене, обладающий комбинированным действием: холеретический эффект обусловлен наличием в его составе экстракта плодов расторопши пятнистой, содержащего группу флавоидных соединений – силимарина и силибинина. Холекинетический эффект связан с уникальными свойствами экстракта дымянки аптечной, содержащего алкалоид фумарин. Кроме того, препарат стимулирует синтез эндогенного холецистокинина, нормализуя работу сфинктеров желчных путей. В случае верифицированного холестероза фатерова сосочка дополнительно назначалось растительное спазмолитическое средство избирательного действия Бускопан® (гиоцин бутилбромид) (Берингер Ингельхайм, Германия).
Для нормализации микробиоценоза кишечника и профилактики эндотоксинемии дополнительно к приему ФИШант–С® использовался энтеропротектор хилак форте – метаболический пробиотик, стерильный концентрат продуктов жизнедеятельности микроорганизмов — синбионтов тонкой и толстой кишок, образующих молочную кислоту, аминокислоты, лактозу, короткоцепочечные жирные кислоты.
Для лечения эндотелиальной дисфункции применялся растительный эндотелиопротектор Антистакс® (Берингер Ингельхайм, Германия) – натуральный экстракт красных листьев винограда, содержащий активные флавоноиды кверцетин–глюкуронид и изокверцетин. Антистакс® стабилизирует мембраны эндотелиоцитов в условиях оксидантного и эндотоксинового стресса, нормализует проницаемость эндотелия для белков, плазмы и воды, липопротеидов низкой плотности и эфиров холестерина. Имеются сведения, что на сегодняшний день это единственный препарат, компоненты которого (кверцетин глюкуронид и изокверцетин) обладают способностью блокировать синтез киназы легких цепей миозина в эндотелии, предотвращая тем самым индуцированную ЭТ повышенную проницаемость эндотелиоцитов [19,40].
Исследования выполнены до лечения и через 4 мес. непрерывной комплексной терапии. Статистическая обработка материала производилась на персональном компьютере с использованием программы «Statistica 6.0». Корреляционный анализ проводили с использованием коэффициента корреляции Пирсона (r). Критический уровень значимости (р) при проверке статистических гипотез принимался равным 0,05. Изучаемые количественные признаки в работе представлены в виде М±m, где М – среднее значение, m – стандартная ошибка среднего.
Результаты и их обсуждение
При ультразвуковом (УЗ) сканировании бедренных артерий у всех пациентов 1–й группы имелись атеросклеротические бляшки, которые чаще всего располагались в местах бифуркации брахиоцефального ствола и общих сонных артерий, в устье внутренних сонных артерий, общих подвздошных и бедренных артериях, подколенных артериях и в аорте. Изолированные атеросклеротические бляшки (поражение артерий только одного бассейна) были установлены у 8 пациентов (9%).
У 79 пациентов 2–й группы (81%) также были выявлены атеросклеротические бляшки в различных артериях, при этом только у 16 из них (20%) это были изолированные поражения артерий. В 3–й группе атеросклеротические бляшки были обнаружены у 42 пациентов (66%), изолированный характер у 10 из них (23%).
Необходимо пояснить различие в общем количестве диагностированных атеросклеротических изменений в артериях обследованных пациентов. В 1–й группе оно составило 100% (9% изолированные) в связи с тем, что исходно все группы формировались в соответствии с органами–мишенями ЛДС, а именно данная группа представляла сосудистые органы – мишени. Более важным представляется то, что в двух других группах количество атеросклеротических поражений артерий составило от 66 до 81%, хотя пациенты не имели его клинических признаков (рис. 6).
Это имеет важное практическое значение. К примеру, у любого пациента с патологией желчного пузыря необходимо обследовать магистральные артерии и наоборот. Подобная тактика будет являться реальной клинической реализацией стратегии ЛДС: нет больного органа – есть больной организм.
При УЗ–сканировании, выполненном на специальном участке бедренной артерии, у 167 пациентов выявлено утолщение комплекса «интима–медиа» (КИМ) более 1 мм, при этом КИМ был с неровными контурами, сопровождался повышением плотности. У 19 пациентов (11,4%) изо всех обследованных толщина КИМ была нормальной (до 1 мм): в 1–й группе – у 4 пациентов (4,5%), во 2–й группе – у 7 пациентов (7,1%) и у 8 пациентов (12%) 3–й группы. Средние значения толщины КИМ представлены в таблице 1. При анализе данных, приведенных в ней, видно, что достоверных различий ТИМ у пациентов с атеросклерозом различной локализации (1–я группа), с заболеваниями органов гепатопанкреатодуоденальной зоны (2–я группа) и пациентами с дисметаболическими последствиями перитонита (3–я группа) не выявлено, величины КИМ превышали нормальные значения на 12–36% (р1=р2=р3<0,05) (рис. 7).
Диаметр плечевой артерии при УЗ–оценке параметров, характеризующих ДЭ, был практически одинаковым у пациентов всех групп. При исследовании эндотелийзависимой дилятации плечевой артерии (ЭЗД ПА) было установлено снижение показателей на 19–34% (р1=р2=р3<0,05) по сравнению с нормальными значениями. При этом установлен любопытный факт: наибольшие отклонения от нормы имелись у пациентов 1–й группы (манифестированный атеросклероз) и 3–й группы (после перенесенного перитонита без клинических признаков атеросклероза) – на 34 и 32% соответственно. У пациентов 2–й группы аналогичные отклонения были достоверно меньшими, чем в других группах, составили 19%, однако также достоверно отличались от нормальных показателей (р<0,05).
Изложенные результаты исследования современных УЗ–параметров, характеризующих ЭД как общего патологического механизма формирования заболеваний, на новом методологическом уровне подтверждают целесообразность и обоснованность объединения нозологий, представленных в 1–3–й группах пациентов, в липидный дистресс–синдром.
Дополнительным доказательством этому стали результаты исследования биохимических маркеров ДЭ (высокочувствительный СРБ), количества циркулирующих в кровотоке десквамированных эндотелиоцитов и содержания ведущего триггера патологического состояния эндотелиального монослоя – эндотоксина грамотрицательных микроорганизмов.
Результаты исследования содержания ЭТ в плазме крови обследованных пациентов приведены в таблице 2. Его средние значения превышали показатели нормы на 210–335% (рис. 8), при этом достоверных различий между группами не установлено. Однако наибольшие абсолютные значения были обнаружены у пациентов 3–й группы (после перитонита). Эти данные подтвердили наши предыдущие результаты по исследованию эндотоксинемии при ЛДС [18] и дисметаболических последствиях перенесенного перитонита [19].
Причины подобного состояния – нарушения метаболических функций печени, энтерогепатической циркуляции желчных кислот, депрессия ретикулоэндотелиальной системы печени на фоне тяжелых дисбиотических изменений тонкой и толстой кишок, т.е. всех наиболее важных этиопатогенетических звеньев липидного дистресс–синдрома [20–22].
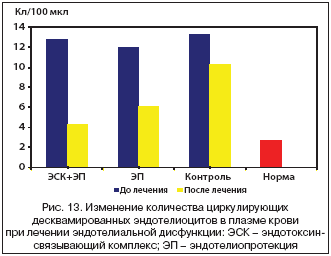
Аналогичные закономерности были установлены при оценке содержания высокочувствительного С–реактивного белка, концентрации которого (табл. 2, рис. 8) превосходили нормальные значения на 53–70% также при отсутствии различий между группами. Отметим, что у 96% пациентов 1–й группы, 87% второй и у 76% 3–й группы концентрации высокочувствительного СРБ соответствовали высокому риску развития и прогрессирования атеросклероза и его осложнений, т.к., по мнению Bell DM. (2001), высокочувствительный СРБ считается одним из достоверных маркеров атеросклероза и его осложнений [32].
Количество циркулирующих десквамированных эндотелиоцитов в плазме крови в 2,4–2,3–3,6 раза (соответственно группам) было выше нормы, при этом значения этого параметра в 3–й группе (0,87±0,1 Ед/мл) достоверно отличались от аналогичных у пациентов 1–й и 2–й групп (табл. 2, рис. 8). Единственным объяснением этому факту может быть предшествовавшая (при перитоните) массивная эндотоксиновая агрессия, во время которой был запущен главный механизм эндотелиальной дисфункции [18,19,22].
Учитывая последние научные данные о том, что основным звеном патогенеза атеросклероза является повреждение клеточных и соединительнотканных структур сосудистой стенки артерий, зарегистрированное увеличение содержания десквамированных эндотелиальных клеток в крови у пациентов 1–й группы (сосудистые органы–мишени ЛДС) представляется закономерным и не требует подробных комментариев. Увеличенное количество ЦДЭ во 2–й (органы–мишени гепатопанкреатодуоденальной зоны) и 3–й группах (пациенты без клинических признаков атеросклероза) доказывает, что этот объективный маркер дисфункции и повреждения эндотелиального монослоя артерий может свидетельствовать об атеросклеротическом процессе еще до клинической манифестации сердечно–сосудистой патологии [10,57,62,63].
Дополнительным доказательством вышесказанному послужили результаты корреляционного анализа количества ЦДЭ, концентраций ЭТ и высокочувствительного СРБ с возрастом пациентов: отсутствие достоверных взаимосвязей во всех группах подчеркивает диагностическую объективность выбранных нами параметров, т.к. величины показателей, характеризующих ДЭ, не зависят от возраста.
Оценка корреляционных взаимосвязей содержания плазменного ЭТ, высокочувствительного СРБ и количества ЦДЭ между собой показало высокие положительные значения (r от +0,76 до +0,89) во всех анализируемых группах пациентов.
Таким образом, изложенные выше данные подтвердили правильность концепции ЛДС, согласно которой во всех органах–мишенях ЛДС происходят сходные патологические процессы с обязательным участием эндотелия. Причиной и инициатором этих процессов следует считать хроническую эндотоксиновую агрессию и истощение антиэндотоксинового иммунитета организма [26].
В начале статьи было уже сказано, что существующие методы лечения дисфункции эндотелия, применяемые в комплексе либо раздельно, по нашему мнению, не имеют обоснованной этиопатогенетической базы, в связи с чем их целесообразно относить к различным вариантам симптоматической терапии.
Как показало исследование маркеров ЭД (УЗ, биохимических) и триггера патологических процессов в эндотелии (эндотоксина грамотрицательных микроорганизмов), пациенты с дисметаболическими последствиями перитонита представляют наиболее тяжелую форму повреждения эндотелия. В связи с этим пациентам данной клинической группы было проведено лечение ЭД по разработанному в клинике факультетской хирургии РГМУ методу. Он представлен двумя составляющими:
- эндотоксинсвязывающим комплексом, включающим энтеросорбцию эндотоксина (энтеросорбент ФИШант С®), восстановление эндотоксинсвязывающих и эндотоксинэлиминирующих функций печени (растительные гепатопротекторы (гепабене) и избирательные растительные спазмолитические средства (Бускопан®), восстановление (энтеропротекция) микробиоценоза кишечника (пробиотики метаболического действия (хилак форте);
- эндотелиопротекцией – уменьшение проницаемости эндотелия путем блокады или снижения синтеза киназы легких цепей миозина в эндотелиоцитах с помощью изокверцетина и кверцетин–глюкуронида красных листьев винограда (растительный препарат Антистакс®).
Результаты оценивались в трех специально сформированных для этой цели клинических группах из числа перенесших гнойный перитонит, т.е. с дисметаболическими его последствиями: пациентам группы А (n=25) назначался эндотоксинсвязывающий комплекс (ЭСК) и одновременно проводилась эндотелиопротекция (ЭП) препаратом Антистакс®; пациенты группы Б (n=20) принимали только ЭП Антистакс®; в контрольной группе (n=20) лечения не проводилось.
Целью подобной детализации была необходимость решения двух важных задач: 1) оценка эффективности комплексной этиопатогенетической терапии эндотелиальной дисфункции и 2) оценка эндотелиопротекторного значения изокверцетина и кверцетин–глюкуронида красных листьев винограда (Антистакс®) в комплексной терапии дисфункции эндотелия, т.е. предстояло четко определить необходимость назначения пациентам с ДЭ Антистакс®.
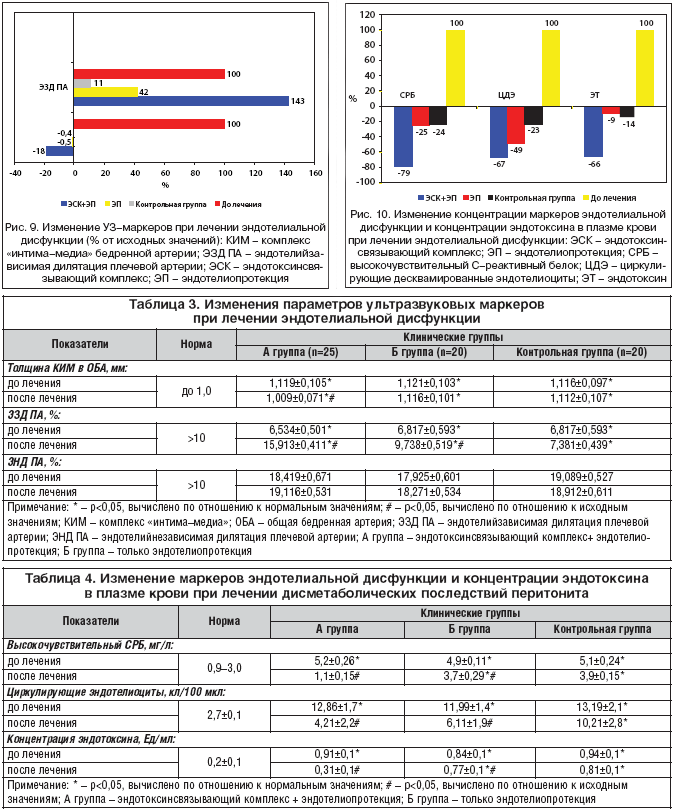
Данные УЗ–исследований (табл. 3, рис. 9) показали, что в результате комплексной терапии ДЭ (группа А) толщина КИМ уменьшилась на 18% (p<0,05), только после ЭП (группа Б) и в контрольной группе на 0,5 и 0,4% соответственно (p1=р2>0,05).
Величина, характеризующая ЭЗД плечевой артерии, в группе А увеличилась на 143% (p<0,05), в группе Б – на 42% (p<0,05), в контрольной группе – на 11% (p>0,05). Изменения ЭНД плечевой артерии в процессе лечения не установлено.
Таким образом, в результате комплексного лечения ЭД отмечалось достоверное уменьшение величины КИМ бедренной артерии и увеличение эндотелийзависимой дилятации плечевой артерии. Монотерапия эндотелиопротектором Антистакс®, не влияя на параметры КИМ, также способствует увеличению ЭЗД ПА, однако этот эффект уступает таковому при комплексном подходе к лечению.
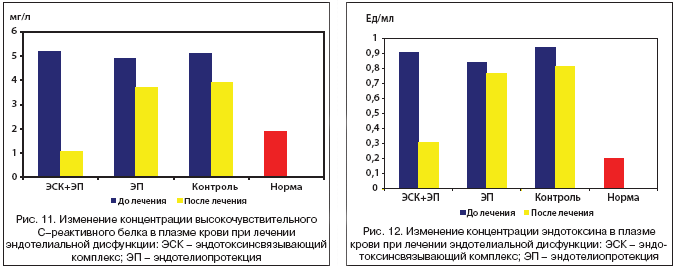
При исследовании динамики высокочувствительного СРБ (табл. 3, рис. 10,11) установлено снижение его концентрации на 79% от исходных значений в группе А, на 25% – в группе Б и на 24% в контрольной группе. При этом только у пациентов, получавших комплексную терапию ЭД, значения СРБ снизились до границ минимального риска осложнений атеросклероза – 1,1±0,15 мг/мл.
Аналогичные изменения коснулись содержания ЭТ в плазме крови (табл. 3, рис. 10,12): при комплексной терапии оно снизилось на 66% (p<0,05), при моноэндотелиопротекции – на 9% (p>0,05), в контрольной группе – на 14% (p>0,05).
Исследование количества циркулирующих десквамированных эндотелиоцитов показало их достоверное уменьшение в результате комплексной терапии (на 67%, p<0,05), однако моноэндотелиопротекция с помощью Антистакс® также способствовала достоверному и выраженному уменьшению ЦДЭ на 49% (p<0,05), что оказалось более чем в 2 раза эффективнее, чем в контрольной группе пациентов (23%, p<0,05) (табл. 3, рис. 10, 13).
В качестве заключения к данному фрагменту необходимо отметить, что только комплексная терапия, воздействующая на ключевые звенья этиопатогенеза ЭД, способна уменьшить ее проявления и, главное, степень альтерации эндотелиального монослоя. Значительная роль в этих процессах принадлежит кверцетину глюкурониду и изокверцетину, позволяющим нормализовать проницаемость эндотелия и приостановить развитие последней стадии ЭД – повреждения эндотелиального монослоя.
Выводы
- ЭД является общим и наиболее важным звеном патогенеза заболеваний органов–мишеней липидного дистресс–синдрома и дисметаболических последствий перитонита.
- Лечение эндотелиальной дисфункции должно включать средства, уменьшающие концентрацию эндотоксина грамотрицательных микроорганизмов в плазме крови (энтеросорбция), устраняющие причину хронической эндотоксиновой агрессии (дисбиоз кишечника – метаболические пробиотики), стимулирующие работу эндотоксинсвязывающих и эндотоксинэлиминирующих органов (печень – растительные гепатопротекторы), предотвращающие повышенную проницаемость эндотелия (растительные эндотелиопротекторы – кверцетин глукуронид и изокверцетин).
- Длительность терапии эндотелиальной дисфункции необходимо контролировать с помощью ультразвуковых (толщина комплекса «интима–медиа» и эндотелийзависимая дилятация артерий) и биохимических (содержание высокочувствительного С–реактивного белка) маркеров, а также определения концентрации эндотоксина и циркулирующих эндотелиоцитов в плазме крови.
Литература
- Апполонин А.В., Яковлев М.Ю., Рудик В.М. Эндотоксинсвязывающие системы крови // Журнал микробиол. 1990. №11. С.45.
- Артемов А.В. Закономерность старения // Интернет–журнал «Наука против старения», 2008.
- Астанина И.А., Дудко В.А., Ворожцова И.Н. Частота выявления каротидного атеросклероза у больных ишемической болезнью сердца и артериальной гипертонией // Терапевтический архив. 2004. №12. С. 36–39.
- Беглярова С.В Нарушение функций печени при липидном дистресс–синдроме. М., 2000. Дисс. на соискание степени кандидата мед. наук.
- Белоусов Ю.Б., Стулин И.Д. Атеросклероз сонных артерий: новые технологии диагностики, лечения и профилактики отдаленных последствий // Российские медицинские вести. 2004. №2. С. 57–61.
- Бувальцев В.И. Дисфункция эндотелия как новая концепция профилактики и лечения сердечно–сосудистых заболеваний // Международный медицинский журнал. 2001. №3. С. 202–209.
- Булатова И.А., Гальбрайх Р.Б, Щекотова А.П. Патогенез хронического гепатита С // Мир вирусных гепатитов, №3, 2008, с. 64–82.
- Галенко А.С., Шуленин С.Н. Способы немедикаментозной и фармакологической коррекции эндотелиальной дисфункции // «ФАРМиндекс–Практик», выпуск 10, 2006, с. 2–10.
- Думпе Л.Э. Инструментальная и радионуклидная диагностика поражений органов пищеварения при липидном дистресс–синдроме // Дисс. канд. мед. наук. М., 2002.
- Дупляков Д.В., Емельяненко В.М. Современные возможности изучения минимального атеросклеротического поражения сосудов с помощью ультразвука высокого разрешения // Терапевтический архив. 2001. №8. С. 13–16.
- Кузнецов М.Р. Диагностика и лечение липидного дистресс–синдрома при облитерирующем атеросклерозе. Дисс. на соискание ученой степени доктора мед. наук. М., 2000.
- Лиходед В.Т., Ющук Н.Д., Яковлев М.Ю. Роль эн¬дотоксина грамотрицательных бактерий в инфек¬ционной и неинфекционной патологии // Арх. па¬тол. 1996. № 2. С. 8.
- Петрищев Н.Н., Беркович О.А., Власов Т.Д. и др. Диагностическая ценность определения десквамированных эндотелиальных клеток в крови // Клинич. лаборатор. диагностика. 2001. № 1. С. 50–52.
- Петухов В.А. Липидный дистресс–синдром. Диагностика и принципы лечения (под редакцией академика В.С.Савельева). Пособие для врачей. М.: ВЕДИ, 2003. 87 с.
- Петухов В.А. Желчекаменная болезнь и синдром нарушенного пищеварения. М.: ВЕДИ, 2003. 148 с.
- Савельев В.С. Липидный дистресс–синдром в хирургии // Вестн. рос. воен.–мед. академии. 1999. № 1. С. 36–39.
- Савельев В.С., Яблоков Е.Г., Петухов В.А. Липидный дистресс–синдром в хирургии // Бюл. экспер. биол. 1999. Т. 127, № 6. С. 604–611.
- Савельев В.С., Петухов В.А., Сон Д.А. и др. Новый метод энтеросорбции при синдроме кишечной недостаточности // Анналы хирургии. 2005. №1. 29–32 с.
- Савельев В.С., Лубянский В.Г., Петухов В.А. Дисметаболические последствия синдрома кишечной недостаточности в абдоминальной хирургии // Анналы хирургии. 2005. №6. 39–42 с.
- Савельев В.С., Яблоков Е.Г., Петухов В.А. Дислипопротеидемия при панкреонекрозе: причинно–следственные взаимосвязи // Хирургия. 1995. №3. С. 23–26.
- Савельев В.С., Петухов В.А. Холестероз желчного пузыря. М.: ВЕДИ, 2002. 176 с.
- Савельев, Петухов В.А. Липидный дистресс–синдром. М.: МаксПресс, 2007. 359 с.
- Чижиков Н.В., Аниховская И.А., Лиходед В.Т. и др. Системная эндотоксинемия в патогенезе ате¬росклероза // Успехи соврем, биологии. 2001. Т. 121, №3. С. 266.
- Ширинский В.П. Роль киназы легких цепей миозина в барьерной функции эндотелия и перспективы использования ее ингибиторов при нарушениях сосудистой проницаемости // Кардиологический вестник. 2006. Т. 1. – №2. с. 1–5.
- Яблоков Е.Г., Петухов В.А. Дислипопротеидемия и облитерирующий атеросклероз. М.,1996. 147 с.
- Яковлев М.Ю. Системная эндотоксинемия в физи¬ологии и патологии человека. Автореф. дис. … докт. мед. наук. М., 1993. 56 с.
- Яковлев М.Ю. Функциональная морфология миокарда при экспериментальном токсикоинфекдионном шоке: Автореф. дис. … канд. мед. наук. М., 1980. 24 с.
- Яковлев М.Ю. Метаболическая гетерогенность миокарда и феномен централизации кровообращения в сердечной мышце при эндотоксиновом шоке // Вестник АМН СССР. 1981. № 5. С. 26.
- Яковлев М.Ю. Роль кишечной микрофлоры и недостаточности барьерной функции печени в клинике эндотоксинемии и воспаления // Казанский мед. журн. 1988. № 5. С. 353.
- Яковлев М.Ю. Системная эндотоксинемия в физи¬ологии и патологии человека. Автореф. дис. … докт. мед. наук. М., 1993. 56 с.
- Bataille R., Klein B. C–reactive protein levels as a direct indicator of interleukin–6 levels in humans in vivo // Arthritis Rheum. 1992. N35. P. 282–283.
- Bell DM. Markers for progression of coronary disease. Pharmacotherapy.2001; 21(9 Pt 2):190S–194S.
- Berk B.C., Min W, Yan C, Surapisitchat J, Liu Y, Hoefen R. Atheroprotective Mechanisms Activated by Fluid Shear Stress in Endothelial Cells // Drug News Perspect. – 2002. – Vol.15, №3. – P. 133–139.
- Brearly S. et al. Endotoxin levels in portal and systemic blood // Dig. Surg. – 1985. – Vol. 2 – P. 70.
- Broocs A.C., Mensies–Gow N., Wheeler–Jones C. Endothoxin–induced activation of eguine digital vien endothelial cells^ Role of h38MARK // J Cardiovasc Pharm., 2008, Vol.1, №1. – P. 157–169.
- Celermajer D.S. Testing endothelial function using ultrasound. J Cardiovasc Pharm 1992; 32: S29–S32.
- Endotoxin in Health and Disease // Eds. Brade H., Opal S.M., Vogel S.N., Morrison D.C. Nevy. York–Basel. – 1999. – 950 p.
- Diamant M., Tushuizen M., Abid–Hussein Mohammed. Simvastatin induces endothelial cell anoikis and release of caspase 3–containing microparticles // Int. Soc. Hypertens., 2006. 43: 345–67.
- Dobler D., Ahmed N., Song L. Increased Dicarbonyl Metabolism in Endothelial Cells in Hyperglyceremia Induces Anoikis and Impairs Angiogenesis by RGD and GFOGER Motif Modification // Diabetes,55:1961–1969, 2006.
- Essler M., Retzer M., Bauer M., Heemskerk J. W., Aepfelbacher M., Siess W. Mildly oxidized low density lipoprotein induces contraction of humen endothelial cells through activaton of Rho/Rho kinase and inhibition of myosin light chain phosphotase // J. Biol. Chem. – 1999. – Vol.274, №43. – P. 303– 614.
- Erridge C., Spicket C.V., Webb D.J. Non–enterobacterial endotoxins stimulate human coronary artery but not venous endothelial cell activation via Toll–lice receptor 2. Cardiovascular research, 2007, vol.73, №1, рр. 181–189.
- Fribengtr P. Endotoxin and their Detection with tht Limulus Amebocyte Lysate Test. Alan. r/Liss, Nev York. Pp 195–206, 1982.
- Gabay C., Kushnewr I. Acute–phase proteins and other systemic responses to inflammation // N EngI J Med.– 1999.–N340. – P.448–454.
- Krestow J.K., Rak J., Kertel R.S. Functionale dissociation of anoikis–like cell death and activity of stress activated protein kinase // Biochemical and biophysical ressarch communications 1999; 260 (1):48–53.
- Li A.E., Ito H., Rovira I.I. A Role for Reactive Oxygen Species in Endothelial Cell Anoikis //Circulation Reserch,1999; 85:304–310.
- Macy E.M., Hayes T.E., Tracy R.P. Variability in the measurement of C–reactive protein in healthy subjects: implications for reference intervals and epidemiological application. Clin Chem 1997;43:52—8.
- Ledue T.B., Weiner D.L., Sipe J., Poulin S.E., Collins M.F., Rifai N. Analytical evaluation of particle–enhanced immunonephelometric assays for C–reactive protein, serum amyloid A, and mannose–binding protein in human serum [Abstract]. Clin Chem 1997;43:S240.
- Minchali R.D., Malik A.B. Transport akross the endothelium: regulation of tndothelial permeability //Handb. Exp.Pharmacol., 2006; (176 pt 1): 107–44.
- Nakagomi A., Freedman S.B., Geczj C.L. Interferon–y and lipopolysaccharide potentiate monocyte tissue factor induction by C–reactive protein // Relationship with age, sex, and hormone replacement treatment // Circulation. – 2000.– Nl0l. – P.1785–1791.
- Peters K., Unger R., Brunner J., Kirkpatrik C.J. Molecular basis of endothelial dysfunction in sepsis // Cardiovascular Research, 2003, 60 (1): 49–57.
- Phelps J.E., DePaola N. Spatial variations in endothelial barrier function in disturbed flows in vitro // Am. J. Physiol. Heart. Circ. Physiol. – 2000 ;278(2):H469–76.
- Reed J.,C. Mechanism of Apoptosis //Am. J. of Pathology, 2000, 157: 1415–1430.
- Rietschel T., Kirikae T., Schade F.U. //Bacterial endotoxin: molecular relationchips of structure to activity and function. The FASEB Journal, 1994, vol. 8, 217–225.
- Rockey D.S., Chung J.J. Regulation of inducible nitric oxide synthase in hepar sinusoidal endothelial cells/ Am. J. Physiol. And liver Physiology. 1996, vol. 271: G260–G267.
- Roland C.R., Naziruddin B., Mohanacumar T. Gadolinium chloride ingibits Kupffer cell nitric oxide synthase (iNOS) induction //Journal of Leykocyte Biology, 1996, 60, 487–492.
- Schuchinger V., Fichtlscherer S., Brutten M.B., Zeiher A.M. Systemic nature of endothelial dysfunction between coronary and peripheral regulation of resistens vessels. European Heart Journal 1999; vol 20: 653., Vanhoutte P.M. Endothelial dysfunction and atherosclerosis. Europ Heart J 1997; 18: E19–E29].
- Solovey A, Lin Y, Browne P et al. Circulating activated endothelial cells in sickle cell anemia. N Engl J Med1997; 337: 1584–1590.
- Stangeby D.K., Ethier C.R. Computational analysis of coupled blood–wall arterial LDL transport // J. Biomech. Eng. – 2002. – Vol.124, №1. – P. 1–8.
- Torzewski M., Rist C., Mortensen R.F. et al. C–reactive protein in the arterial intima. Role of C–reactive protein receptor–dependent monocyte recruitment in the atherogenesis // Arterioscler Thromb Vase Biol. – 2000.– N20.– P. 2094–2099.
- Reidy M.A., Schwarts S.m. Endothelial injuri and regeneration. IV. Endotoxin: a nondenuding injuri to aortic endothelium. Lab. Invest., 1983, Jan., 48 (1): 25–34.
- Zwaka T P., Hombach V, Torzewski J. C–reactive protein–mediated low density lipoprothein uptake by macrophages // Circulation. – 2001. – N103.– P.1194–1l97.
- Woods A., Brull Di., Humphries S. E., Montgomery N.E. Genetics of inflammation and risk of coronary artery disease: the central role of interleukin–6 // Eur Heart J. – 2000.– N21.– P1574–1583.
- Vasa M, Fichtlscherer S, Aicher A et al. Number and migratory activity of circulating endothelial progenitor cells inversely correlate with risk factors for coronary artery disease. Circ Res2001; 89: E1–E7.
- Vanhoutte P.M. Endothelial dysfunction and atherosclerosis. Europ Heart J 1997; 18: E19–E29].
- Yakovlev M.Yu. Elements of endotoxin theory of human physiology and pathology: systemic endotoxinemia, endotoxin aggression and endotoxin insufficiancy // J. Endotoxin Research. – 2000. – V. 6, № 2. – P. 120.








Полезная, научная статья. Хотелось бы подробнее изучить тему, применения гастропротекторы. Слышала о таком препарате как Ребагит. Доказана ли его эффективность?
Добрый день. Клинические исследования подтверждают эффективность Ребагита в качестве гастропротектора. Данный препарат показал эффективность: в предотвращении развития НПВС-гастропатии при совместном приеме с НПВС; в лечении язвы желудка при совместном назначении с ИПП; в терапии органической диспепсии; в качестве препарата для защиты ЖКТ при приеме 5-Фторурацила и т.д. Способность ребамипида стимулировать регенеративные процессы в ЖКТ подтверждается многими исследованиями. Если вы знаете английский, можете почитать подробнее здесь: https://www.ncbi.nlm.nih.gov/pubmed/?term=Rebamipide