Выбор метода терапии лейомиомы матки. Принципы дифференцированного подхода к выбору метода органосохраняющей терапии лейомиомы матки. Практический опыт.
Косей Н.В., Березовская Е.И., Самосийная О.А.
Несмотря на развитие современных медицинских технологий и фармацевтической промышленности, лечение лейомиомы матки продолжает оставаться довольно сложной задачей. Если на протяжении многих лет к матке складывалось отно-шение исключительно как к репродуктивному органу и она стояла в числе первых среди органов,«без которых можно жить», то в последние десятилетия ситуация значительно изменилась. Увеличение частоты данного заболевания у контингента молодых женщин, настоятельное желание многих пациенток с подобной патологией сохранить матку как орган и избежать операционной травмы, а также доказательства продукции в матке важных биологически активных веществ, необходимых для жизнедеятельности организма (таких как факторы свертывающей системы, интерлейкины, лейкотриены, факторы роста, ренин, утероглобин, эндорфины и др.) стали основанием для более бережного отношения к данному органу (7, 9). В связи с этим перспективным является развитие и все более широкое внедрение органосохраняющих методов ее лечения.
При выборе метода терапии лейомиомы матки необходимо учитывать как клинические особенности, размеры, количество, локализацию и эхографическую стуктуру миоматозных узлов, так и возраст женщины. Если в репродуктивном возрасте основными задачами лечения миомы матки являются купирование симптомов и улучшение «качества жизни» женщины, предупреждение дальнейшего прогрессирования заболевания (роста миомы) и сохранение или восстановление репродуктивной функции, то в перименопаузальном возрасте, помимо купирования симптомов и предупреждения дальнейшего роста опухоли, более актуальной становится профилактика развития онкологической патологии гениталий, частота которой в этом возрасте значительно увеличивается (5, 15). Кроме того, появляются эстрогендефицитные климактерические расстройства, требующие гормональной коррекции. Учитывая, что при назначении гормональных эстроген-содержащих препаратов, увеличивается потенциальный риск роста миомы, важной задачей в ее лечении становится обеспечение условий для безопасного применения заместительной гормональной терапии.
Накопленный в нашей клинике опыт позволил разработать принципы дифференцированного подхода к выбору метода органосохраняющей терапии лейомиомы матки.
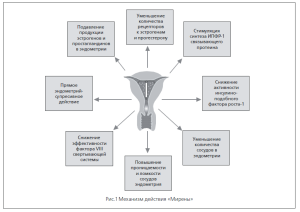
Если ранее правильным признавалось пассивное наблюдение за ростом опухоли при небольших ее размерах, то в настоящее время такая тактика недопустима, и лечение опухоли необходимо начинать как можно раньше, учитывая, что узлы до 3 см в диаметре наиболее чувствительны к гормонотерапии (7, 15). В фертильном возрасте при небольших размерах узла (до 2,5 см в диаметре) интрамуральной и интрамурально-субсерозной локализации методом выбора можно считать применение локальной гормонотерапии — введение внутриматочной левоноргестрелвыделяющей системы «Мирена». Данное устройство содержит контейнер, обеспечивающий ежесуточное выделение в полость матки 20 мкг левоноргестрела. Послед-ний, помимо прямого эндометрийсупрессивного действия, оказывает угнетающее влияние на количество рецепторов к эстрогенам и прогестерону, подавляет продукцию простагландинов и эстрогенов в эндометрии, стимулирует синтез протеина, связывающего инсулиноподобный фактор роста 1, способствуя превращению данного фактора в неактивные формы (рис.1), (4, 10, 11, 14).
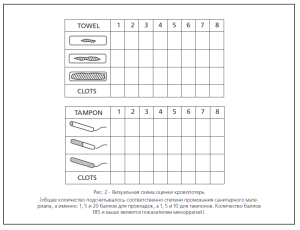
Под нашим наблюдением в течение 1 года находилось 130 женщин репродуктивного возраста с интрамуральной и интрамурально-субсерозной миомой матки. Пациентки были разделены на группы в зависимости от размеров узла, из них 35 женщинам с размерами доминантного узла до 2,5 см (1 группа) в диаметре была введена система «Мирена» и 40 пациенткам с размерами миомы от 2,5 до 4 см (2 группа) — такая внутриматочная система была введена после трех инъекций агонистов Гн-Рг в дозе 3,75 мг с интервалом в 28 дней. Проводилась оценка частоты и выраженности симптомов: мено-метроррагий, хронических тазовых болей и размеров миомы. С целью объективной оценки кровопотерь во время менструации применяли визуальную схему (Widemeersch D., Echacht E., 2002, рис.2). Степень выраженности болевого синдрома оценивали с использованием визуальной аналоговой шкалы боли. О размерах миомы судили по диаметру и объему доминантного узла (объем матки и узлов вычисляли по формуле: П/6 х А х В х С, где А — продольный, В — переднезадний, С — поперечный размеры матки и узла).
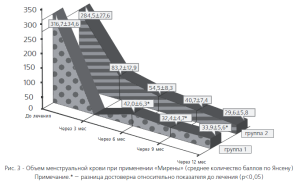
При оценке клинической симптоматики было выявлено уменьшение частоты мено-метроррагий в первой группе на 57,1%, во второй — на 62,5%, хронических тазовых болей — соответственно на 28,5 и 35,0%. В обеих группах значительно уменьшился объем менструальной кровопотери (рис. 3). Отмечено также существенное уменьшение среднего показателя степени выраженности болевого синдрома. Так, средний балл согласно визуальной аналоговой шкале боли за 12 мес. в 1 группе уменьшился с 5,8±1,2 до 2,4±0,9 баллов, во 2 группе — с 7,2±0,8 до 1,9±1,0 бал-
лов (р1–2, 3–4 < 0,05).
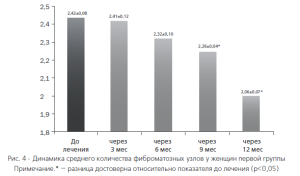
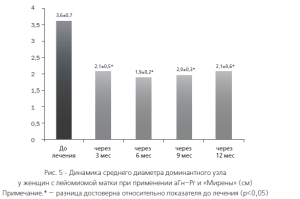
Применение вышеуказанных методов лечения не только способствовало эффективному купированию симптомов, но и через некоторое время оказывало влияние на размеры миомы. Через 6 месяцев у женщин 1 группы выявлено достоверное уменьшение среднего диаметра доминантного узла до 1,7±0,1 см против 2,3±0,2 см до лечения (р<0,05), а через 9 месяцев — и количества фиброматозных узлов (рис. 4). Во второй группе уже через 3 месяца было отмечено уменьшение среднего объема доминантного узла на 45% и его диаметра — до 2,1±0,5см против 3,6±0,7 см до начала терапии (рис. 5).
Популярным и наиболее древним (а сообщения о проведении первой операции указывают на XIX век) органосохраняющим методом лечения лейомиомы матки больших размеров является операция консервативной миомэктомии, позволяющая с одной стороны полностью удалить патологические очаги миомы, и с другой — сохранить орган и детородную функцию. Однако данная операция довольно часто сопровождается значительной кровопотерей с риском перехода в гистеректомию (6, 7). Предложено множество способов уменьшения кровопотери при миомэктомии — механические (накладывание клемм в области перешейка, затягивание истмуса эластической нитью, лигирование маточных сосудов рассасывающимися материалами и др.), введение in situ вазоактивных химических вешеств (вазопрессина, окситоцина, адреналина) и проведение предоперационной подготовки путем создания временной медикаментозной менопаузы или проведения эмболизации маточных артерий.
Третью группу составили 30 пациенток с диаметром наибольшего узла в пределах от 4 до 8 см, а четвертую —
25 женщин с размерами узлов более 8 см. Учитывая, что женщины последних двух групп желали сохранить (или восстановить) генеративную функцию, им было выполнено двухэтапное органосохраняющее лечение с проведением на 2 этапе консервативной миомэктомии. Перед выполнением операции проводилась предоперационная подготовка, направленная на уменьшение размеров и васкуляризации миомы с целью минимизации интраоперационной кровопотери. Женщинам 3 группы на предоперационном этапе назначали 2 инъекции аГн-Рг (2 инъекции до операции и 1 — после вмешательства), а пациенткам 4 группы — проводили билатеральную эмболизацию маточных артерий.
Предоперационное назначение аналогов гонадотропин-рилизинг гормона в 3 группе позволило значительно уменьшить средний объем интраоперационной кровопотери — до 237,4±8,2 мл по сравнению с 325,8±10,3 мл до операции (р<0,05), сократить длительность операции — соответственно до 43,4±7,9 против 66,5±8,5 мин (р<0,05). Благодаря уменьшению объема опухоли и, соответственно, массива резорбционных процессов до операции, удалось уменьшить среднюю длительность послеоперационной лихорадки с 4,9±0,41 до 3,24±0,33 дней (р<0,05), болевого синдрома (при его выраженности 4 и более баллов согласно визуальной аналоговой шкале) — с 7,61±0,82 до 4,35±0,73 дней (р<0,05) и длительность пребывания в стационаре — соответственно с 7,45±0,69 до 5,32±0,74 дней (р<0,05).
Консервативная миомэктомия может быть проведена лапаротомным, лапароскопическим или вагинальным путем (3, 6, 15). Для успешного проведения лапароскопической операции необходим специальный отбор пациенток с наличием 1–2 (не более 3) узлов субсерозной или субсерозно-интрамуральной локализации размерами до 5 см (не более 8 см) в диаметре, применение микрохирургической техники, современных видов энергий с минимальным повреждающим воздействием на миометрий, использование лапароскопических швов и морцеллятора.
В случаях наличия субсерозных узлов низкой локализации наиболее удобным доступом можно считать вагинальный. Вагинальная миомэктомия сопровождается минимальной кровопотерей, уменьшением длительности операции и наркоза, однако требует квалификации и опыта врача в вагинальной хирургии.
В последнее время все более широко внедряются современные миниинвазивные методы лечения лейомиомы матки, среди которых лапароскопический миолизис (с использованием лазерного луча, диатермии или криовоздействия), трансцервикальная аблация или резекция эндометрия (с использованием лазерной петли или электрохирургического шарообразного электрода), применение высокочастотного ультразвука или рентгенхирургическая эмболизация маточных артерий (ЭМА). Последняя на сегодня является уже довольно распространенным методом лечения данной патологии (1, 8, 13). В мире ежегодно проводится более 100 подобных вмешательств. В Украине ЭМА производится с 1998 года, и на сегодня в нашей клинике имеется опыт проведения более 350 эмболизаций.
Билатеральная эмболизация маточных артерий представляет собой метод, при котором производится пункция бедренной артерии (чаще правой) по методике Сельдингера с последующей катетеризацией под рентгенконтролем маточных артерий с обеих сторон и последующим введением в них эмболизирующего субстрата с целью окклюзии сосудов узлов. Вследствие прекращения кровоснабжения происходит ишемический некроз, склероз и гиалиноз тканей узла.
Применение данного метода показано при наличии симптомной миомы матки любых локализаций, кроме субсерозной на ножке, либо бессимптомной с размерами узлов более 3–4 см в диаметре. Ее проведение возможно при наличии опухоли сложных локализаций (шеечно-перешеечное расположение узла, миома в области ребра матки), а также рецидивов миомы после консервативной миомэктомии. Среди преимуществ данного метода лечения миомы матки можно отметить отсутствие наркоза и, соответственно, риска возникновения анестезиологических осложнений, уменьшение риска тромбоэмболических осложнений, значительно меньший объем кровопотери, отсутствие большой раневой поверхности и процесса рубцевания ткани с меньшим риском гистопатического разрыва матки при последующих беременностях, меньшая длительность реабилитационного периода и госпитализации, а также отсутствие психотравмирующего факта собственно операции (8).
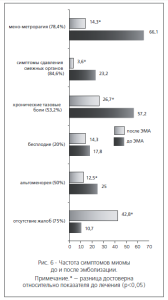
При тщательном динамическом наблюдении в течение 12 мес за 112 женщинами репродуктивного возраста с лейомиомой матки, которым была произведена ЭМА в качестве монотерапии было отмечено уменьшение частоты мено-метроррагий на 78,4% по сравнению с показателем до вмешательства; компрессионных симптомов — на 84,6%; хронических тазовых болей — на 53,2%; альгодисменореи — на 50% (рис. 6). При этом уже через 1 месяц после проведения ЭМА средний объем менструальной кровопотери снизился до 93,5±16,0 против 244,9±31,6 (р<0,05) баллов, и в последующем оставался в практически тех же пределах.
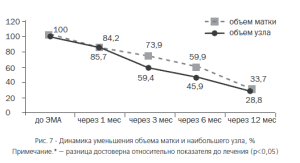
Однако ЭМА не только способствовала эффективному купированию симптомов, но и приводила к существенному уменьшению размеров опухоли. Так, за 12 месяцев наблюдения средний показатель объема матки уменьшился на 66,3%, объем доминантного узла — на 71,2% (рис. 7), чем, видимо, объяснялась высокая эффективность данного метода лечения в отношении симптомов сдавления смежных органов. В 28,6% случаев имело место самостоятельное рождение или удаление рождающихся миоматозных узлов, что ускоряло темп уменьшения размеров матки и иногда приводило к полному исчезновению патологических очагов и выздоровлению. Основным недостатком метода является отсутствие данных о гистологической структуре узла, что требует тщательного отбора пациенток для ЭМА, а также наличие рентгенологической нагрузки ввиду проведения процедуры под рентгенконтролем.
При проведении консервативной миомэктомии после эмболизации маточных артерий в случаях необходимости проведения второго хирургического этапа (при больших изначальных размерах миомы, недостаточном уменьшении узлов или сохранении симптомов миомы) отмечено значительно меньшую интраоперационную кровопотерю — 156,7±22,2 мл по сравнению с таковой даже после подготовки с применением аГн-Рг. Отличительной особенностью таких операций были четкие границы узлов, отличие тканей узла по цвету и консистенции от здорового миометрия, что значительно облегчало проведение миомэктомии (рис.8). В обеих группах (третьей и четвертой) операция консервативной миомэктомии во всех случаях прошла успешно, перехода в гистеректомию ни в одном из случаев не было. При оценке клинических данных в обеих группах операция привела к снижению частоты мено-метроррагий, симптомов сдавления смежных органов (в четвертой группе), а также уменьшению частоты жалоб на хронические тазовые боли — на 22,8% в третьей и на 25% — в четвертой группе. В четвертой группе рецидивов миомы на протяжении последующих 3-х лет наблюдения отмечено не было, в то время как у 3 (6,7%) пациенток третьей группы были выявлены рецидивы миомы в виде появления единичных узелков небольших размеров.
Рис. 8 — Миоэктомия
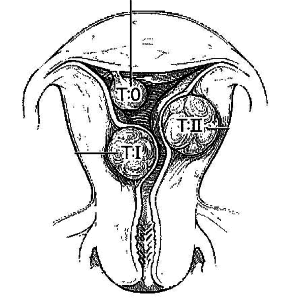
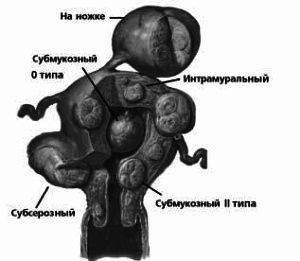
При наличии субмукозной миомы методом выбора ее лечения можно считать гистероскопическую резекцию. Согласно нашему опыту и данным литературы, проведение ее наиболее эффективно при наличии субмукозных узлов 0 и I типа согласно классификации Европейской ассоциации гинекологов-эндоскопистов по степени деформации ее полости, то есть полностью находящихся в полости матки или пенетрирующих в миометрий не более чем на 50%, размерами до 3 см. В случаях миом подобной локализации размерами от 3 до 5 см в диаметре вероятность успеха повышает предо-
перационная подготовка с использованием аГн-Рг. При размерах фиброматозных узлов более 5 см в диаметре, а также при наличии локализации миомы II типа (более чем 50% узла проникает в стенку матки) эффективность вмешательства существенно ниже, и в 80% случаев сопровождается рецидивами с необходимостью повторных вмешательств. Поэтому в подобных случаях мы рекомендуем воздерживаться от проведения гистероскопии с предпочтением альтернативных методов, в частности, эмболизации маточных артерий.
Наибольшая частота роста гиперпролиферативных процессов матки наблюдается в переходном, то есть в перименопаузальном возрасте. В то же время именно перименопаузальный период часто осложняется появлением климактерического синдрома, требующего назначения заместительной гормональной терапии, применение которой может привести к росту миомы (5).
Под нашим наблюдением находилось 70 женщин с лейомиомой матки в перименопаузе, которые были разделены на 2 группы в зависимости от размеров миомы, первую группу составили 35 женщин с размерами наибольшего узла до 2,5 см в диаметре и отсутствием субмукозных узлов, которым была введена внутриматочная система «Мирена» и назначена заместительная гормональная терапия. В качестве препарата для ЗГТ мы выбрали Фемостон 1/10, содержащий 1 мг эстрадиола валерата и 10 мг дидрогестерона. Данный препарат был избран с учетом низкой дозы эстрогенов и соотношения гормонов с преобладанием гестагенного компонента в его составе, а также учитывая метаболическую нейтральность дидрогестерона. Во вторую группу вошли также 35 женщин с размерами узлов более 2,5 см в диаметре различной локализации. Этим пациенткам была проведена билатеральная эмболизация маточных артерий с последующим назначением Фемостона 1/10.
Проводилась оценка как частоты и степени выраженности симптомов миомы, так и эффективности лечения климактерического синдрома. Лечение климактерического синдрома у женщин обеих исследуемых групп было эффективным, о чем свидетельствовало уменьшение показателей среднего индекса Куппермана до 5,3±0,8 против 24,3±1,2 баллов (р<0,05) у женщин 1 группы и соответственно до 4,4±0,6 против 26,1±1,4 баллов (р<0,05) — у пациенток 2 группы.
При анализе симптомов миомы было выявлено уменьшение частоты мено-метроррагий на 94,3% в первой группе и на 82,8% — во второй, хронических тазовых болей — соответственно на 62,8% (что свидетельствует о наличии аналгезирующего действия «Мирены» при длительном применении) и 31,45%, симптомов сдавления смежных органов, наблюдавшихся до начала лечения только у пациенток 2 группы — на 77,1% (рис.9).
При оценке данных ультразвукового обследования существенных изменений объема матки у женщин 1 группы не выявлено, однако через 12 месяцев отмечено достоверное уменьшение среднего диаметра доминантного узла с 2,2±0,36 до 1,8±0,21 см (р<0,05). У пациенток же 2 группы отмечалось уменьшение объема матки в среднем на 42,8%, а среднего диаметра доминантного узла с 5,6±0,54 до 3,5±0,42 см (р<0,05).
Роста миомы ни в одном из перечисленных случаев за 12 месяцев наблюдения отмечено не было.
Пациенткам с выявленным ростом миомы в постменопаузе, свидетельствующим либо о наличии продолжающейся гормональной стимуляции или малигнизации процесса, проводилась гистеректомия.
Таким образом, проведенные исследования дают основания рекомендовать дифференцированный подход к выбору метода лечения лейомиомы матки в зависимости от возраста женщины.
Пациенткам репродуктивного возраста с интрамуральным или интрамурально-субсерозным расположением узлов размерами до 4 см в диаметре можно рекомендовать введение внутриматочной левоноргестрелвыделяющей системы «Мирена». В случаях наличия миомы с диаметром доминантного узла от 2,5 до 4 см целесообразно ее введение на фоне медикаментозной менопаузы после применения агонистов Гн-Рг.
Для женщин фертильного возраста с интрамуральной или интрамурально-субсерозной лейомиомой больших размеров операцией выбора продолжает оставаться консервативная миомэктомия лапаротомным, лапароскопическим или вагинальным доступом с обязательной предоперационной подготовкой путем назначения агонистов Гн-Рг при условии размеров доминантного узла до 8 см и эмболизации маточных артерий — свыше 8 см. Вариант предоперационной подготовки, как и объем операции, желательно выбирать и тщательно обговаривать с учетом желания пациентки.
Женщинам репродуктивного возраста с наличием симптомной миомы любой локализации, за исключением субсерозной миомы на ножке, в том числе при наличии субмукозной миомы или центрипетального роста узла, шеечной локализации, рецидивной миомы может проводиться билатеральная эмболизация маточных артерий в качестве основного метода ее лечения. Вопрос о необходимости второго этапа в виде консервативной миомэктомии решается индивидуально в зависимости от эффективности ЭМА и репродуктивных планов пациентки.
Женщинам с субмукозной миомой 0 и I типа и величиной узла до 3 см показана гистероскопия, в случаях наличия узлов размерами от 3 до 5 см — после предварительной подготовки путем назначения аГн-Рг.
Пациенткам в перименопаузальном периоде при сочетании лейомиомы матки и климактерических расстройств с целью предупреждения роста опухоли можно рекомендовать введение системы «Мирена» при условии размеров доминантного узла не более 2,5 см в диаметре и проведение эмболизации маточных артерий — при больших размерах миомы, после чего возможно назначение ЗГТ, в частности, Фемостона 1/10.
При прогрессирующем росте опухоли любых размеров в постменопаузе пациентки подлежат оперативному лечению в объеме гистеровариоэктомии.
Проведение лечения лейомиомы матки с учетом предложенных принципов дифференцированного подхода будет способствовать повышению эффективности лечения данной патологии, максимальному использованию органосохраняющих методик и повышению «качества жизни» социально-активного контингента женщин.









Комментировать