Изучения клинико-анамнестических данных и роли диагностических методов в выявлении синдрома слабости синусового узла у детей. Результаты проведенных исследований.
Изучение клинико-анамнестических данных и роли диагностических методов в выявлении синдрома слабости синусового узла у детей в возрасте от 3 недель до 18 лет. Данные проведенного исследования.
Изучение клинико-анамнестических данных и роли диагностических методов в выявлении синдрома слабости синусового узла у детей в возрасте от 3 недель до 18 лет. Данные проведенного исследования.
Е.Ю.Емельянчик, Е.В.Анциферова, А.А.Чернова, Е.П.Кириллова, С.Ю.Никулина, Э.А.Иваницкий
Красноярский Государственный медицинский университет им. проф. В.Ф.Войно-Ясенецкого
Ключевые слова: синдром слабости синусового узла, электрокардиография, холтеровское мониторирование, атропиновая проба, тредмил-тест
Синдром слабости синусового узла (СССУ) – это комплекс состояний, в основе которых лежит снижение способности синусового узла (СУ) выполнять задачи доминантного пейсмекера или различные варианты нарушения проведения импульса. По классическому определению СССУ — это органическое необратимое поражение СУ и нижележащих центров автоматизма, приводящее к снижению частоты сердечных сокращений. Такие черты, как органический характер нарушений функции СУ, их необратимость, поражение нижележащих центров автоматизма отличают СССУ от ваготонической дисфункции СУ. Органическое происхождение заболевания проводящей системы требует как можно более раннего выявления больных и своевременной хирургической коррекции с целью предотвращения синдрома внезапной смерти [1, 2]. Так, в большинстве стран Европы, США, Японии в течение последних 23 лет проводится скрининг новорожденных с целью выявления детей из группы риска по внезапной смерти младенцев, а также детей-школьников и подростков, занимающихся спортом [3].
Клиника может быть преходящей (у детей с воспалительными заболеваниями миокарда), постоянной (на фоне врожденных пороков сердца) или прогрессирующей (например, у больных с синдромом Романо-Уорда, при кардиомиопатиях), но в большинстве случаев формируется первичное поражение проводящей системы [4]. Значительную трудность диагностики представляют случаи бессимптомного течения заболевания, когда внезапная смерть по механизму фибрилляции желудочков и/или асистолии может стать первым и единственным симптомом заболевания [5]. Поэтому анализ симптомов дебюта СССУ и особенностей выявления синдрома у детей сохраняет свою актуальность.
Целью исследования явилось изучение клинико-анамнестических данных и роли диагностических методов в выявлении синдрома слабости синусового узла у детей.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Под наблюдением находились 32 ребенка с разными вариантами СССУ в возрасте от 3 недель до 18 лет (средний возраст — 13,3 года, 25 пациентов — мальчики, 78% группы). Критериями включения были симптомы одного из четырех вариантов СССУ (по классификации М.А.Школьниковой, Т.В.Чернышовой) [1]. Из исследования были исключены: пациент с атриовентрикулярной диссоциацией, приобретенной после оперативной коррекции дефекта межжелудочковой перегородки и трикуспидальной недостаточности, 5 больных с вегетативной дисфункцией СУ, подтвержденной в ходе диагностического обследования. Контрольную группу составили 23 ребенка (средний возраст 12,7 года), направленных на обследование по поводу систолического шума, малых аномалий сердца, и не имевших нарушений на электрокардиограмме.
Обследование включало анализ клинико-анамнестических данных, стандартную электрокардиографию (12 отведений, на электрокардиографе ЭКГ-10-01 Dixion), суточное холтеровское мониторирование ритма («Инкарт»). У части детей выполнялась атропиновая проба (регистрация ЭКГ после внутривенного введения 0,1% р-ра атропина 0,02 мг/кг, проба считалась положительной, если прирост частоты сокращений сердца меньше 30% от исходной или появляются эктопические ритмы, если изменения на ЭКГ исчезают, это доказывает связь нарушений ритма с ваготонией). При наличии противопоказаний (желудочковые экстрасистолы, миопия, кардиомегалия) или отказа от фармакологической пробы проводился тест с физической нагрузкой на тредмиле Horison Omega-309 по протоколу R.Bruce (тест считался положительным в случае неадекватного прироста ЧСС или при появлении аритмии) [6]. Данные представлены в виде медианы с максимальным и минимальным значениями. Сравнение данных проводилось с помощью критериев хи-квадрат (χ2), Манна-Уитни.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В группе наблюдаемых были пациенты со всеми вариантами синдрома: 7 детей — с 1-м вариантом (21,8%), 18 больных — со 2-м (56,2%), четверо — с 3-м вариантом (12,8%) и трое пациентов (9,3%) — с наименее благоприятным 4-м вариантом СССУ. В соответствии с рекомендациями ВНОК всем пациентам с 4-м вариантом и двум детям с 3-м вариантом СССУ была проведена оперативная коррекция в период от трех недель до 7 месяцев с момента постановки ди-агноза (в четырех случаях имплантированы электро-кардиостимуляторы, одной девочке — кардиостимулятор с функциями детекции, дефибрилляции и антитахикардитической стимуляции) [7, 8].
Анализ анамнестических данных установил, что 7 детей (21,8%) не имели клинических симптомов СССУ, и предположение о нарушении функции синусового узла было сделано по результатам ЭКГ в ходе диспансеризации, в том числе у 5-летнего ребен-ка с АВ-диссоциацией и паузами ритма более 2 секунд. В числе случайно выявленных больных также были двое подростков, профессионально занимавшихся спортом длительное время. Анализ симптомов, послуживших поводом для обследования детей в специализированном стационаре, выявил отчетли-вое преобладание диагностической роли повторяющихся пресинкопальных эпизодов (головокружений) и синкопе (табл. 1).
Таблица 1.
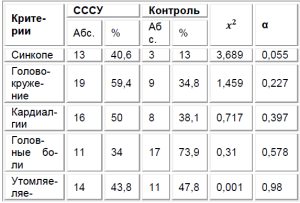
Диагностическое значение синкопальных состояний подчеркивается величиной критерия хиквадрат с максимальным уровнем достоверности среди других анализируемых симптомов. Частота встречаемости остальных клинических признаков не отличалась в сравниваемых группах: особенно близкой к показателю здоровых сверстников была встречаемость субъективных характеристик астенического синдрома (слабость, утомляемость). Необычным был тот факт, что жалобы на сердцебиение практически здоровые дети из группы сравнения предъявляли достоверно чаще, чем пациенты исследуемой группы. Наличие жалоб у детей из группы сравнения чаще всего было обусловлено вегетативной дисфункцией.
Анализ электрокардиограммы установил наличие брадикардии в покое у 18 наблюдаемых (56,3%). Кроме того, у этих детей были выявлены достоверно значимые отличия всех интервальных показателей в сравнении с показателями здоровых, что характерно для замедления проводимости различной степени выраженности и/или депрессии формирования импульса (табл. 2).
Полученные данные акцентируют внимание на интервалах QT («электрической систолы» сердца, отражающем внутрижелудочковую проводимость) и RR. Оценка роли дополнительных методов диагностики СССУ выделила холтеровское мониторирование ритма как неинвазивный, доступный и информативный метод, выявляющий функциональные нарушения проводящей системы на различном уровне практически в 100% случаев.
Суточное мониторирование ритма у пациентов с первым вариантом синдрома выявило брадиаритмию со значениями ЧСС ночью меньше критического уровня в 5 случаях из 6, миграцию предсердного водителя ритма. У детей со вторым вариантом СССУ на фоне брадикардии установлены синоатриальная блокада 2 степени и выскальзывающие сокращения
(предсердные, из атриовентрикулярного соединения или идиовентрикулярные). Третий вариант СССУ характеризовался сочетанием брадикардии с эпизодами синусовой или суправентрикулярной тахикардии, нередко в сочетании с неполной блокадой правой ножки пучка Гиса. У пациентов с четвертым вариантом выявлялись критическая брадикардия, или эпизоды асистолии на фоне атриовентрикулярной диссоциации — sinus arrest. Один из трех пациентов данной группы – новорожденный ребенок — был обследован после эпизода жизнеугрожающего состояния в возрасте 3 недель, диагноз установлен на основании данных суточного мониторирования ритма, которые содержали остановку синусового узла, брадикардию (до 42 уд/мин), паузы ритма с максимальной продолжительностью 1349 мс.
Таблица 2.
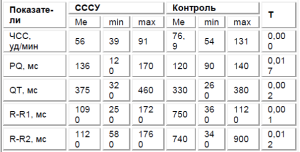
У пациентов с первым и вторым вариантами СССУ данные холтеровского мониторирования были недостаточны для подтверждения диагноза. Поэтому для дифференциации органического заболевания с вегетативной дисфункцией синусового узла и определения тактики наблюдения была проведена проба с атропином (или с физической нагрузкой на тредмиле). С помощью проб были обследованы 28 детей, после чего у четверых была выявлена вегетативная дисфункция СУ, этих пациентов исключили из исследуемой группы.
Установлено, что у 12 из 16 детей на фоне атропиновой пробы отмечался неадекватный прирост ЧСС, восстановительный период затягивался до 90-130 минут. В четырех оставшихся случаях проба оказалась отрицательной, так как сопровождалась адекватным учащением ЧСС и полным восстановлением синусового ритма через 30 минут. То есть, выявленные изменения на электрокардиограмме в покое и в ходе суточного мониторирования, вероятно, были обусловлены преобладанием вагусного влияния на синусовый узел [9]. Среди 13 детей, выполнявших тест с физической нагрузкой на тредмиле, отрицательный результат был получен только в одном случае. У остальных обследуемых на фоне нагрузочной пробы выявлены миграция водителя ритма по предсердиям, экстрасистолы, или выскальзывающие эктопические сокращения, характеризующие снижение функциональной активности синусового узла. У одного подростка на фоне нагрузки произошло внезапное снижение ЧСС до 34 уд/мин с развившимся пресинкопальным состоянием (документирован кардио-ингибиторный вариант ответа на нагрузку, пауза до 2,5 секунд).
В целом, из 29 обследованных СССУ был подтвержден у 24 пациентов. Необходимо отметить, что тест с физической нагрузкой в целом по субъективным признакам переносился лучше, чем атропиновая проба. Лекарственная проба вызывала негативное отношение обследуемых из-за инвазивности, и в ряде случаев сопровождалась побочными явлениями в виде сухости слизистой полости рта.
ЗАКЛЮЧЕНИЕ
Более 20% детей с синдромом слабости синусового узла, независимо от степени выраженности и уровня поражения проводящей системы, асимптоматичны, что требует обязательного проведения электрокар-диографического скрининга. В том числе является актуальным вопрос об электрокардиографическом скрининге новорожденных. Суточное мониторирование ритма по Холтеру позволяет выявить в большинстве случаев нарушения функции проводящей системы на различном уровне. Тем не менее, для дифференциации функциональной и органической основы поражения проводящей системы сердца не-бходимо проведение нагрузочных проб. Применение лекарственной пробы с атропином или теста с физической нагрузкой позволяет устранить регуляторное влияние парасимпатического отдела вегета-тивной нервной системы и выделить пациентов с дисфункцией синусового узла. Кроме того, нагрузочный тест может послужить провокационной пробой, уточняющей характер поражения сердца.
ЛИТЕРАТУРА
1. Аритмии у детей. Атлас электрокардиограмм / Под ред. Школьниковой М.А. — М., Медпрактика-М, 2006. — 148 с.
2. Priori S.G., Allot E., Blomstrom-Lundqvist C., et al.Update of the guidelines on sudden cardiac death of the European Society of Cardiology // Eur Heart J., 2003. — V24. — 13-15p.
3. Vetter V.L. The Role of ECG Screening in the Eval-uation of Risk of Sudden Cardiac Arrest in the Young // Pace, 2009. — V32, S2. — P. 6-14p.
4. Шульман В.А., Никулина С.Ю., Матюшин Г.В. и др. Идиопатические (первичные) заболевания проводящей системы сердца // Кардиология, 2000. — № 1. — стр. 89-92.
5. Полякова Е.Б., Мастеркова Т.Т., Школьникова М.А. Диагностика электрической нестабильности миокарда у детей с синдромом слабости синусо-вого узла как основа прогнозирования риска жизнеугрожаемых аритмий и внезапной сердеч-ной смерти // Вестник аритмологии, 2000. — № 19. — стр. 50-53.
6. Нарушения ритма сердца у детей: основные принципы диагностики и лечения / Под ред. Ко-валева И.А., Попова С.В. — Томск, 2006. — 270 стр.
7. Рекомендации Всероссийского научного обще-ства специалистов по клинической электрофи-зиологии, аритмологии и кардиостимуляции по проведению клинических электрофизиологиче-ских исследований, катетерной абляции и им-плантации антиаритмических устройств / Моск-ва, 2005. — 238 стр.
8. Kardelen F, Celiker A, Ozer S et al. Sinus node dys-function in children and adolescents — treatment by implantation of a permanent pacemaker in 26 pa-tients // Turk J Pediatr., 2002. — V44, S4. — 312-316p.
9. Ciemniewski Z., Zajac T., Wozniak-Skowerska I. The importance of the autonomic nervous system for sinus and atrioventricular node function in pa-tients with sick sinus syndrome // Kardiol Pol., 1991. — V34, S6. — 335-411p.









Комментировать