Новый взгляд на эпидемиологию венозной тромбоэмболии. Венозная тромбоэмболия: факторы риска, патогенез, этиология, патофизиология, диагностика, клинические проявления, оценка клинической вероятности. Варианты диагностики.
Рекомендации Европейской ассоциации кардиологов, 2008
Эпидемиология
Возникновению тромбоэмболии легочной артерии (ТЕЛА) и тромбоза глубоких вен способствуют одинаковые предрасполагающие факторы. Во многих случаях ТЭЛА является следствием тромбоза глубоких вен. У 50% пациентов с проксимальным тромбозом глубоких вен при сканировании легких отмечалось наличие асимптоматической ТЭЛА.
В 70% случаев у пациентов с ТЭЛА при использовании чувствительных методов диагностики обнаруживается тромбоз глубоких вен нижних конечностей.
В последнее время эпидемиология венозной тромбоэмболии была пересмотрена. Несмотря на то, что и ТЭЛА, и тромбоз глубоких вен являются проявлениями одного и того же заболевания (венозная тромбоэмболия), ТЭЛА отличается некоторыми особенностями. Риск смерти в связи с первичной или повторной ТЭЛА более высок среди больных, госпитализированных по поводу ТЭЛА, чем среди тех, кто поступил в отделение в связи с тромбозом глубоких вен. Согласно результатам последних когортных исследований уровень летальности вследствие ТЭЛА составляет 711%. Также было отмечено, что повторное развитие ТЭЛА чаще встречается среди пациентов, у которых ТЭЛА развивалась первично, чем среди пациентов, у которых первично развился тромбоз глубоких вен (60% при ТЭЛА и 20% — при тромбозе глубоких вен).
Распространенность ТЭЛА среди госпитализированных пациентов в США в период с 1979 по 1999 год составила 0,4%. Только за один год там зафиксировано 600 тыс. случаев диагноза ТЭЛА, что составило 4053 случая на 100 тыс. населения. Аналогичные данные для стран Европы отсутствуют. Согласно результатам 2356 вскрытий, проведенных в 1987 году, что составило 79% умерших больных в городе Мальмо, Швеция (население 230 тыс. человек), было выявлено 595 (25%) случаев венозной тромбоэмболии, 431 (18,3%) случай ТЭЛА. В 308 (13,1%) случаях ТЭЛА была основной причиной смерти. В тот же период среди населения города Мальмо, согласно данным сцинтиграфии легких, было зафиксировано только 48 (2%) случаев ТЭЛА. По данным вскрытий, флебографии и сцинтиграфии легких заболеваемость венозной тромбоэмболией среди жителей города Мальмо составила 42,5 случая на 10 тыс. населения в год, заболеваемость ТЭЛА — 20,8. Согласно данным исследования, проведенного среди жителей Британи (Франция) (342 тыс. населения), заболеваемость венозной тромбоэмболией и ТЭЛА составила 18,3 и 6,0 случаев на 10 тыс. населения в год соответственно. К сожалению, данные вскрытий не были предоставлены. Очень трудно оценить истинную заболеваемость ТЭЛА в связи с отсутствием специфичности клинических проявлений.
Предрасполагающие факторы
Несмотря на то, что ТЭЛА может возникнуть без каких либо четких предрасполагающих моментов, обычно при диагностических исследованиях обнаруживают один или более факторов (вторичная ТЭЛА). Согласно данным Международного совместного регистра ТЭЛА (1СОРЕР) соотношение числа пациентов с идиопатической или неспровоцированной ТЭЛА составляет около 20%.
Венозная тромбоэмболия является результатом взаимодействия факторов риска, зависящих от пациента и обусловленных пребыванием в отделении. Факторы, связанные с личностью пациента, являются постоянными, в то время как факторы риска, связанные с отделением, — временные (табл. 1).
К предрасполагающим факторам риска, которые связаны с пациентом, относятся возраст, наличие предшествующих случаев венозной тромбоэмболии, активная стадия рака, неврологические заболевания с парезом конечностей, заболевания, требующие постельного режима (сердечная или дыхательная недостаточность), врожденная или приобретенная тромбофилия, заместительная гормональная терапия или прием пе роральных контрацептивов.
Заболеваемость венозной тромбоэмболией увеличивается с возрастом (идиопатическая и вторичная). Средний возраст пациентов, у которых развилась ТЭЛА, составляет 62 года, 65% пациентов находятся в возрасте 60 лет и старше. Уровень заболеваемости ТЭЛА в 8 раз выше среди больных старше 80 лет, чем среди пациентов моложе 50 лет. Определение наличия и оценка значимости предрасполагающих факторов могут быть полезными для диагностики и первичной профилактики ТЭЛА. Согласно данным последнего исследования, которое было проведено в 358 госпиталях в 32 странах, только 58,5 % и 39,5% пациентов с риском развития венозной тромбоэмболии вследствие терапевтических или хирургических причин соответственно получали адекватную профилактику.
Недавно была определена связь между идиопатиче ской ТЭЛА и сердечнососудистыми заболеваниями (инфарктом миокарда и инсультом). Доклады о высокой частоте случаев ТЭЛА среди пациентов с ожирением, курильщиков и больных с системной гипертензией или метаболическим синдромом увеличили интерес ученых к связи между артериальной и венозной тромбоэмболией.
Этиология и патогенез
Учитывая, что ТЭЛА является следствием тромбоза глубоких вен, следует рассматривать этиопатогенез венозной тромбоэмболии как одно целое, а не отдельно для ТЭЛА и тромбоза глубоких вен.
Первые исследования этиопатогенеза венозной тромбоэмболии проводились в отделении ортопедической хирургии в 1960х годах. На основании полученных данных стало очевидным, что венозная тромбоэмболия начиналась с тромбоза глубоких вен голени у 30% пациентов. У трети больных тромбоз глубоких вен спонтанно исчезал через несколько дней, у 25% он развивался в проксимальный тромбоз и ТЭЛА. Со времени проведения этого исследования данные об этиопатогенезе венозной тромбоэмболии несколько изменились. Тромбоз глубоких вен возникает реже в отделении общей хирургии, чем в отделении ортопедической хирургии. Риск развития венозной тромбоэмболии в течение первых 2 недель после проведения оперативного вмешательства высокий и остается таким в течение 23 месяцев. Профилактическое назначение антитромботических препаратов значительно снижает риск развития предоперационной венозной тромбоэмболии. Чем продолжительнее антитром ботическая терапия, тем ниже вероятность развития данного осложнения.
У большинства больных с симптоматическим течением тромбоза глубоких вен имеют место проксимальные тромбы, и в 4050% случаев такое состояние осложняется развитием ТЭЛА (зачастую без какихлибо клинических проявлений). Бессимптомное течение ТЭЛА часто встречается в послеоперационный период, особенно у пациентов с бессимптомным течением тромбоза глубоких вен, которым не проводилась профилактика.
ТЭЛА возникает через 37 дней после начала развития тромбоза глубоких вен и в 10% случаев может закончиться летально уже через 1 час после начала проявлений симптомов. В большинстве таких случаев диагноз остается невыясненным. У 510% больных одновременно с ТЭЛА развивается шок и гипотензия, у 50% шок отсутствует, но есть лабораторное подтверждение нарушения работы правого желудочка сердца, что значительно ухудшает дальнейший прогноз. После устранения ТЭЛА у двух третей пациентов исчезают дефекты наполнения. Умирают 90% больных, которым не проводилось лечение в связи с несвоевременно диагностированной ТЭЛА. В 10% случаев смерть, связанная с развитием ТЭЛА, наступает у пациентов, которым проводилось лечение. У 0,55% больных, которым проводилось лечение, обнаружена хроническая тромбоэмболическая легочная гипертензия. Частота повторного развития венозной тромбоэмболии не зависит от первичного клинического проявления (тромбоза глубоких вен или ТЭЛА). Она значительно выше у пациентов с идиопатической венозной тромбоэмболией. Риск летального исхода ТЭЛА выше после предыдущего эпизода изолированного тромбоза глубоких вен в связи с тенденцией к повторению первичного типа в случае последующих рецидивов. Без проведения антикоагулянтной терапии у 50% больных с симптоматическим течением тромбоза глубоких вен и ТЭЛА тромбоз повторяется через 3 месяца. У пациентов с предшествующими случаями развития венозной тромбоэмболии, которые получали курс антикоагулянтной терапии (в течение 12 месяцев), риск возникновения фатальной ТЭЛА составляет 0,190,49 на 100 человеколет (в зависимости от взятого диагностического критерия).
Патофизиология
Последствиями острой ТЭЛА являются в первую очередь гемодинамические нарушения, они манифестируют, когда просвет сосуда заполнен тромбоэмболом на 3050%. Проявления рефлекторной и гуморальной ва зоконстрикции (явление, которое было доказано экспериментальным путем) у человека менее заметны.
Эмболия легочной артерии не тромбом встречается очень редко, она имеет разные последствия и клинические проявления.
Один большой или многочисленные мелкие эмбо лы могут повысить сопротивление в сосудах до уровня постнагрузки сердца, с которой не справляется правый желудочек. Внезапная смерть обычно наступает вследствие электромеханической диссоциации. Также у больного существует вероятность развития син копального состояния или системной гипотензии, которые могут привести к шоку и смерти вследствие острой правожелудочковой недостаточности. Правостороннее выпячивание межжелудочковой перегородки в дальнейшем снижает объем сердечного выброса изза диастолической дисфункции левого желудочка.
У пациентов, которые перенесли эпизод острой эмболии, несмотря на правожелудочковую недостаточность, рецепторы активируют симпатическую систему. Инотропная и хронотропная стимуляция вместе с механизмом ФранкаСтарлинга повышают давление в легочной артерии, что способствует восстановлению легочного кровотока, наполнения левого желудочка и объема сердечного выброса. Одновременно с системной вазоконстрикцией эти компенсаторные механизмы стабилизируют кровяное давление. Это очень важно, так как сниженное аортальное давление влияет на наполнение венечных сосудов правого желудочка и на его функцию. Также следует учитывать, что неподготовленный тонкостенный правый желудочек не способен создавать среднее давление в легочном стволе более 40 мм рт. ст.
Вторичная гемодинамическая дестабилизация возникает обычно в первые 2448 часов вследствие повторной эмболии или ухудшения работы правого желудочка. Это может быть вызвано ранними рецидивами, которые часто наблюдаются при недиагностирован ной или нелеченной венозной тромбоэмболии. Следует учитывать, что при длительном нарушении функции правого желудочка хронотропной и инотропной стимуляции может быть недостаточно для поддержания его работы. Это может быть связано с несоответствием между повышенной потребностью правого желудочка в кислороде и сниженным градиентом перфузии венечных артерий. Оба компонента ответственны за ишемию и дисфункцию правого желудочка. Это начало порочного круга, который приводит к смертельному исходу. Наличие сердечнососудистых заболеваний может повлиять на эффективность компенсаторных механизмов и на дальнейший прогноз.
Дыхательная недостаточность является следствием гемодинамических нарушений. Некоторые факторы могут обусловить гипоксию во время эпизода ТЭЛА. Слабый сердечный выброс способствует десатурации смешанной венозной крови, которая поступает в малый круг кровообращения. Следствием образования зон пониженного и зон повышенного притока в капиллярном русле являются перфузионновентиляционная диссоциация и гипоксемия. Приблизительно у трети больных наличие шунта справа налево через открытое овальное окно вследствие измененного градиента давления между правым и левым предсердием может вызвать острую гипоксемию, повысить риск развития парадоксальной эмболии и инсульта.
Маленькие и дистальные эмболы могут не влиять на гемодинамику, но могут и вызвать альвеолярное кровотечение, которое приводит к кровохарканью, плевриту и образованию плеврального выпота. Данное клиническое проявления известно как инфаркт легкого. Его влияние на газообмен умеренное (за исключением случаев серьезных сердечнососудистых заболеваний).
Тяжесть течения легочной эмболии
Под тяжестью течения ТЭЛА следует, прежде всего, понимать соотношение между индивидуальными особенностями пациента и уровнем риска ранней смерти. Во вторую очередь нужно оценивать анатомическое расположение, форму и распространение внутрилегоч ного эмбола. Авторы данных рекомендаций сделали попытку заменить термины «массивная», «субмассивная» и «немассивная» ТЭЛА на дефиницию «степень риска развития ранней смерти».
Течение ТЭЛА можно разделить на несколько степеней риска развития ранней смерти (внутригоспиталь ная или в течение первых 30 дней), основываясь на наличии маркеров риска. Для практического использования данные маркеры риска можно разделить на 3 группы (табл. 2).

Быстрое определение у постели больного наличия или отсутствия клинических маркеров позволяет классифицировать его состояние как состояние с высоким риском развития ТЭЛА и состояние с невысоким риском соответственно (табл.3). Эту классификацию можно использовать у пациентов с подозрением на развитие ТЭЛА. Она полезна для выбора оптимальных диагностических исследований и первичного метода лечения.
Состояние с высоким уровнем риска развития ТЭЛА является угрожающим для жизни и требует применения специфических диагностической и терапевтической стратегий.
У пациентов с низким уровнем риска развития ТЭЛА при наличии маркеров повреждения миокарда или дисфункции правого желудочка уровень риска становится средним. О среднем уровне риска можно говорить, если имеется один из признаков дисфункции правого желудочка или один из признаков повреждения миокарда. Диагноз «низкий уровень риска» устанавливают, если все маркеры дисфункции правого желудочка или повреждения миокарда отрицательны (ранняя смертность, связанная с ТЭЛА, составляет < 1%).
Диагностика
В данных рекомендациях под термином «подтвержденная ТЭЛА» подразумевается высокая вероятность ее развития, что требует назначения специфического лечения. Термин «исключенная ТЭЛА» обозначает низкую вероятность развития ТЭЛА и возможность отмены специфического лечения, несмотря на предположение о ее наличии. Данные термины не определяют абсолютной уверенности в наличии или отсутствие эмбола в русле легочной артерии.
Клинические проявления
Главной задачей при оценке вероятности развития ТЭЛА является индивидуальный подход к каждому пациенту в трактовке результатов диагностических исследований и в выборе терапевтической стратегии. В 90% случаев подозрение о развитии ТЭЛА возникает при наличии таких симптомов, как диспноэ, боль в грудной клетке, обморочное состояние. Эти симптомы могут появляться одновременно или каждый отдельно. У 90% пациентов с диспноэ, тахипноэ и болью в груди был установлен диагноз ТЭЛА. Обморочное состояние — редкое, но очень важное клиническое проявление ТЭЛА, так как оно может указывать на снижение гемодинамического резерва. В наиболее тяжелых случаях могут развиваться шок и гипотензия. Чаще всего ТЭЛА проявляется комбинацией диспноэ и боли в грудной клетке (табл. 4).
Боль возникает вследствие раздражения плевры в связи с наличием дистального эмбола, который вызывает инфаркт легкого, альвеолярное кровотечение и кровохарканье. Внезапное возникновение изолированного диспноэ свидетельствует о наличии центральной ТЭЛА, которая обусловливает более явные гемодинами ческие нарушения, чем при инфаркте легкого. Оно может быть связано с ангинозноподобной болью, которая указывает на ишемию правого желудочка. В некоторых случаях диспноэ может прогрессировать в течение нескольких недель, до тех пор, пока все возможные причины прогрессирования не будут исключены. У пациентов с выраженной сердечной недостаточностью или заболеваниями легких диспноэ может быть единственным симптомом, указывающим на наличие ТЭЛА.
Знание о наличии предрасполагающих факторов очень важно для оценки вероятности развития ТЭЛА, которая возрастает с увеличением количества таких факторов. Однако приблизительно в 30% случаев ТЭЛА возникает без какихлибо предрасполагающих факторов (неспровоцированная, или идиопатическая ТЭЛА). Индивидуальные симптомы и признаки практически не используются при установлении диагноза, так как они не являются чувствительными и специфическими. Рентгенограмма органов грудной клетки отображает патологический процесс. Наиболее часто встречающиеся изменения не являются специфическими (блюдцевидный ателектаз, плевральный выпот и односторонний подъем диафрагмы). Однако рентгенография используется для исключения других причин возникновения диспноэ и боли в грудной клетке. При ТЭЛА часто наблюдается гипоксемия, хотя в 20% случаев у пациентов отмечаются нормальное парциальное давление кислорода в артериальной крови (РаО2) и нормальный альвеолярноартериальный кислородный градиент ^ (Аа) О2). При остром начале ТЭЛА для диагностики выполняют электрокардиографию (ЭКГ). Такие изменения на электрокардиограмме (ЭКГ), как инверсия зубца Т в отведениях У1У4, структура зубца QR в отведении У1, наличие классического типа S1Q3T3 и полная или неполная блокада правой ножки пучка Гиса, свидетельствуют о наличии перегрузки правого желудочка. Эти изменения характерны для тяжелого течения ТЭЛА и могут быть обнаружены при перегрузке правого желудочка любой этиологии.
Клинические признаки и симптомы, данные лабораторных исследований не позволяют подтвердить или опровергнуть диагноз ТЭЛА, но могут усилить подозрение о ее наличии.
Оценка клинической вероятности
Несмотря на ограниченную чувствительность результатов стандартных исследований и специфичность индивидуальных симптомов и проявлений, совокупность полученных данных позволяет (непосредственно врачу или с помощью определенного правила) разделить пациентов с подозрением на развитие ТЭЛА по категориям в зависимости от степени вероятности. Это является ключевым моментом во всех диагностических алгоритмах касательно ТЭЛА. Степень вероятности развития ТЭЛА после проведения исследования зависит не только от его характеристики, но и от степени вероятности до проведения исследования. Практическое применение вышеизложенного будет рассмотрено в следующих разделах.
Ценность независимого клинического суждения была продемонстрирована в нескольких больших испытаниях, в том числе и в исследовании по вопросам диагностики легочной эмболии (PЮPED), которое завершилось рядом открытий.
- Пациентов следует классифицировать на 3 категории по клинической вероятности развития ТЭЛА; распространенность ТЭЛА возрастает с увеличением степени вероятности (низкая — 9%, средняя — 30%, высокая — 68%).
- У 90% пациентов степень вероятности низкая или средняя.
- При одинаковых результатах проведенной вентиляционноперфузионной сцинтиграфии легких распространенность ТЭЛА разнится в зависимости от клинической вероятности или степени вероятности до проведения исследования.
Главными ограничениями в использовании независимого клинического суждения являются невозможность его стандартизации и невозможность научиться этому. Поэтому в последние годы было разработано несколько правил для прогнозирования. Наиболее часто используется Канадское правило, созданное Веллсом (табл. 5).
В данном правиле используются три степени вероятности (низкая, средняя и высокая) и схема двух категорий (вероятное и маловероятное развитие ТЭЛА). По своей сути правило простое и основано на быстро собранной информации. Однако результативность данного правила вариабельна в связи с одним из компонентов — альтернативный диагноз менее вероятный, чем диагноз ТЭЛА. В Европе также используется пересмотренное Женевское правило. Оно достаточно простое и стандартизированное, основанное на клинических данных. Однако данное правило менее распространено, чем правило Веллса. Независимо от правила, которое используется, доля пациентов с низкой степенью вероятности развития ТЭЛА составляет 10%, со средней степенью — 30%, с высокой — 65%.
Клиническое обследование больных позволяет классифицировать их по степени вероятности (основываясь на увеличении заболеваемости ТЭЛА). Оценивать состояние можно с помощью независимого клинического суждения или с использованием специальных правил.
D-димер
Плазменный Dдимер — это продукт расщепления связанного фибрина (в последнее время проводятся исследования данного вещества). Уровень Dдимера в плазме повышается при наличии острого тромба в связи с одновременной активацией системы свертывания крови и фибринолиза. Следовательно, при ТЭЛА или венозной тромбоэмболии уровень Dдимера не может оставаться нормальным (отрицательная прогностическая ценность Dдимера очень высока). С другой стороны, Dдимер специфичен для фибрина, однако наличие фибрина не является патогномоничным признаком венозной тромбоэмболии, так как он появляется и при
других состояниях (рак, воспаление, инфекция, некроз, расслоение аорты). Положительная прогностическая ценность Dдимера очень низка. Поэтому его нельзя использовать для подтверждения наличия ТЭЛА. Существует несколько диагностических исследований с разными характеристиками. Применяют количественный анализ для определения содержания иммуноабсорбента, связанного с ферментом (твердофазный иммунофер ментный анализ — ELISA), и его производных. Чувствительность данного метода составляет более 95%, специфичность — 40%. В связи с этим данные анализы могут использоваться для исключения диагноза ТЭЛА у пациентов с низкой и средней степенью вероятности ее развития. В приемном отделении отрицательный результат анализа ELISA помогает исключить диагноз ТЭЛА без дальнейшего проведения исследований в 30% случаев. Отдаленные результаты проведенных исследований показали, что риск развития тромбоэмболии в первые 3 месяца среди пациентов, которым не проводилось лечение на основании отрицательного результата анализа ELISA (Vidas), составил менее 1% (табл. 6).
Специфичность Dдимера при подозрении на развитие ТЭЛА снижается пропорционально возрасту (так, в возрасте 80 лет она может составить 10%). Уровень Dдимера часто повышается у больных раком, у госпитализированных пациентов и во время беременности. Решение о проведении измерения уровня Dдимера принимается в каждом отдельном случае.
Отрицательный результат высокочувствительного анализа по определению уровня Dдимера исключает развитие ТЭЛА у пациентов с низкой или средней степенью вероятности, в то время как отрицательный результат исследования со средней чувствительностью исключает развитие ТЭЛА у пациентов с низкой степенью вероятности. При использовании двухуровневой схемы определения клинической вероятности развития ТЭЛА негативный результат анализа по определению содержания Dдимера исключает вероятность ее развития только среди пациентов с малой вероятностью развития ТЭЛА.
Компрессионная ультрасонография и КТ венография
В 90% случаев ТЭЛА развивается при тромбозе глубоких вен нижних конечностей. В классическом исследовании с использованием венографии у 70% пациентов с установленной ТЭЛА был обнаружен тромбоз глубоких вен. В настоящее время для диагностики тромбоза глубоких вен чаще применяют компрессионную венозную ультрасонографию. Чувствительность ультра сонографии для выявления проксимального тромбоза глубоких вен составляет 90%, специфичность — около 95%. С помощью ультрасонографии у 3050% больных с ТЭЛА был обнаружен тромбоз глубоких вен. Диагностика проксимального тромбоза глубоких вен у пациентов с подозрением на развитие ТЭЛА необходима для назначения антикоагулянтной терапии без последующего проведения анализов. При подозрении на развитие ТЭЛА ультрасонографию можно ограничить проведением 4точечного исследования (паховая область и подколенная ямка). Единственным диагностическим критерием глубокого тромбоза вен является неполная сжимаемость вены, что указывает на наличие тромба, в то время как другие критерии — менее достоверны. При подозрении на развитие ТЭЛА диагностический диапазон должен быть расширен, нужно проводить полную уль трасонографию, в том числе и дистальных вен. Согласно данным последних исследований среди пациентов с ТЭЛА выявляемость тромбоза глубоких вен увеличилось с 22% (при проведении ультрасонографии только проксимальных сосудов) до 43% (при проведении полной ультрасонографии), но специфичность снизилась с 96 до 84%. Высокая специфичность положительного результата ультрасонографии проксимальных сосудов при ТЭЛА была подтверждена результатами большого исследования по отдаленным исходам (в котором 524 пациентам проводили ультрасонографию и компьютерную томографию (КТ) с несколькими датчиками). Чувствительность ультрасонографии при наличии ТЭЛА по данным КТ составила 39%, специфичность — 99%. Вероятность положительного результата ультрасоногра фии проксимальных сосудов при подозрении на развитие ТЭЛА выше у пациентов с симптомами и признаками поражения нижних конечностей, чем у пациентов без какихлибо признаков.
В последнее время больным с подозрением на развитие ТЭЛА для диа гностики тромбоза глубоких вен рекомендуют проводить КТвенографию, так как этот метод дает возможность комбинировать осмотр вен конечностей с КТангиографией грудной клетки во время одной процедуры путем однократного внутривенного введения контрастного вещества. В последнем исследовании РЮРЕй II комбинирование КТвенографии и КТангиографии повысило чувствительность выявления ТЭЛА с 83 до 90%, а также и специфичность (~95%). Увеличение отрицательного прогностического значения было клинически незначимым. КТвенография повышает частоту выявления только частично у пациентов с подозрением на развитие ТЭЛА. При использовании данного метода больной подвергается определенной лучевой нагрузке, что следует учитывать, особенно у молодых женщин.
При проведении ультрасонографии среди пациентов с ТЭЛА тромбоз проксимальных глубоких вен был обнаружен в 20% случаев. Ультрасонография может использоваться как дополнительное исследование для снижения уровня ложных результатов (при проведении КТ с одним датчиком) и как альтернативный метод диагностики, если у пациента есть противопоказания к введению контраста или к облучению. Комбинирование КТ ангиографии и КТвенографии значительно увеличивает лучевую нагрузку.
Вентиляционноперфузионная сцинтиграфия
Вентиляционноперфузионная сцинтиграфия (ВПС) — это проверенный метод диагностики при подозрении на развитие ТЭЛА. Он безопасен, описано только несколько случаев аллергических реакций. Основной принцип этой методики основан на внутривенном введении крупных частиц альбумина, меченных технецием (Тс99), которые блокируют небольшую часть легочных капилляров и позволяют оценить перфузию легких на тканевом уровне с помощью сцинтиграфии. Если есть обструкция ветвей легочных артерий, в капиллярное русло не будут поступать меченные частицы, и данные области останутся «холодными» на соответствующих изображениях. При определении перфузии исследуется также вентиляция с помощью таких индикаторов, как ксенон (Хе133), Тс99 в виде аэрозоля или микрочастиц углерода, меченных Тс99. Дополнительное исследование вентиляции помогает определить гиповентиляцию, которая возникла в связи с гипоперфузией по причине реактивной вазоконстрик ции (вентиляционноперфузионное соотношение). В случае развития ТЭЛА в зоне гипоперфузии вентиляционный коэффициент остается в пределах нормы (вентиляционноперфузионная диссоциация).
Стандартно изображения делают в 6 проекциях. Индикатор вентиляции, меченный Тс99, одобрен для клинического использования в Европе (в отличие от США). Данный индикатор более предпочтителен, чем радиоактивные газы, так как он распространяется в бронхоальвеолярной системе с небольшим вымыванием радиоактивных веществ, что, в свою очередь, позволяет сделать снимки в нескольких проекциях, а также получить более четкое изображение состояния вентиляционно перфузионного соотношения. Лучевая нагрузка при проведении сцинтиграфии легких с использованием 100 МВq крупных частиц альбумина, меченных Тс99, составляет 1,1 mSv на среднестатистического человека согласно требованиям Международной комиссии по радиологической защите (ОР), что значительно меньше, чем при проведении спиральной КТ (26 mSv). Для сравнения: лучевая нагрузка при проведении рентгенографии грудной клетки составляет 0,05 mSv.
Результаты проведения сцинтиграфии легких классифицируются согласно критериям Североамериканского исследования РЮРЕй на 4 категории: нормальные, низкая, средняя или высокая степень вероятности развития ТЭЛА. Критерии для подобной классификации до сих пор остаются предметом споров и пересмотров. Однако достоверность нормальных результатов сцинтиграфии легких была подтверждена в нескольких исследованиях по отдаленным результатам лечения, то есть антикоагулянт ная терапия отменялась при нормальных результатах сцинтиграфии легких. Недавно это было подтверждено в большом рандомизированном исследовании по сравнению использования ВПС и КТ: у 247 (35%) пациентов результаты были в пределах нормы, только у 2 (0,8%) больных при проведении ультрасонографии был обнаружен тромбоз проксимальных глубоких вен и им была назначена антикоагулянтная терапия. У остальных 245 человек не отмечалось ни одного эпизода тромбоэмболии в течение длительного времени.
Некоторые радиологи/рентгенологи согласны, что единичные сегментарные дефекты перфузии могут указывать на высокую степень вероятности развития ТЭЛА. Действительно, у 350 пациентов хотя бы с одним дефектом перфузии и с нормальным уровнем вентиляции положительное прогностическое значение составило 88% (ДИ 95% 8491%). Положительное прогностическое значение является весомым доказательством наличия ТЭЛА и основанием для начала длительной антикоагу лянтной терапии у большинства больных.
В исследовании РЮРЕй критерии были более строгие. Для подтверждения развития ТЭЛА требовалось обнаружение двух дефектов перфузии и более, и положительное прогностическое значение должно было быть выше. При анализе данных последнего исследования РЮРЕй II была подтверждена необходимость проведения ВПС для диагностики ТЭЛА. В некоторых центрах выполняют только перфузионную фазу данного исследования, а для определения состояния вентиляции проводят рентгенографию грудной клетки. Данной стратегии не следует придерживаться, если по результатам перфузионной стадии сцинтиграфии легких есть какието патологические изменения. Но данную методику можно проводить, если на рентгенограмме грудной клетки нет изменений, и любой дефект перфузии в этой ситуации будет расценен как диссоциация.
Зачастую результаты сцинтиграфии легких, указывающие на среднюю (недиагностируемую) степень вероятности развития ТЭЛА, подвергались критике в связи с тем, что требовалось проведение дальнейших диагностических исследований. Было предложено большое количество стратегий для устранения этой проблемы. Последние исследования подтвердили, что проведение однофотонной эмиссионной КТ повышает вероятность установления правильного диагноза и снижает частоту недиагностируемых случаев (со средней степенью вероятности). Однофотонная эмиссионная КТ позволяет также использовать автоматизированные алгоритмы определения развития ТЭЛА.
Нормальные показатели перфузии при проведении сцинтиграфии легких являются основанием для исключения диагноза ТЭЛА. Комбинация данных ВПС со средней степенью вероятности развития ТЭЛА и данных клинического обследования с низкой степенью вероятности также является основанием для исключения диагноза ТЭЛА. Данные ВПС с высокой степенью вероятности подтверждают диагноз ТЭЛА, однако при низкой степени клинической вероятности может потребоваться проведение дополнительных исследований, так как в этом случае положительное прогностическое значение ВПС будет ниже. При других комбинациях степени вероятности данных ВПС и степени клинической вероятности следует проводить дополнительные исследования.
Компьютерная томография
В связи с последними изменениями в технологии проведения КТангиографии изменилась и ее ценность для принятия решений при подозрении на развитие ТЭЛА. Два пересмотра техники проведения однодатчи ковой спиральной КТ (ОСКТ) при подозрении на развитие ТЭЛА дали большие изменения в чувствительности (53100%) и специфичности (73100%) данного метода. При проведении двух больших клинических исследований чувствительность и специфичность ОСКТ составили 70 и 90% соответственно. Количество некачественных ангиограмм вследствие артефактов или недостаточного контрастирования легочных сосудов составило 58%. Поэтому отрицательный результат ОСКТ не является достаточным основанием для исключения диагноза ТЭЛА. В то же время при комбинация отрицательных результатов ОСКТ и венозной ультрасонографии у пациентов с невысокой степенью вероятности риск тромбоэмболии в первые 3 месяца составил 1% согласно отдаленным результатам исследования (2 шкалы). С началом использования мультидетекторной КТ с высоким пространственным и временным разрешением и качественным контрастированием артерий КТангиография стала методикой выбора для получения изображения легочных сосудов при подозрении на развитие ТЭЛА при стандартных клинических исследованиях. Данный метод позволяет визуализировать легочные артерии на сегментарном уровне. В ранних исследованиях чувствительность и специфичность КТ по отношению к ТЭЛА составляла 90%, однако согласно результатам большого исследования PIOPED II чувствительность мультидетекторной КТ (в основном 4 датчика) составила 83%, специфичность — 96%. Хотя в данном исследовании выбор диагностических критериев для установления диагноза ТЭЛА был раскритикован, однако особо было отмечено влияние клинической вероятности на прогностическую ценность результатов мультидетекторной КТ. У пациентов с низкой или средней степенью клинической вероятности развития ТЭЛA, согласно правилу Веллса, отрицательный результат КТ имеет высокую отрицательную прогностическую ценность (96 и 89% соответственно), в то время как у пациентов с высокой степенью клинической вероятности она составила только 60%. Положительная прогностическая ценность положительного результата КТ очень высока (9296%) у пациентов со средней и высокой степенью клинической вероятности, но значительно ниже (58%) у больных с низкой степенью вероятности развития ТЭЛA. Поэтому врачи должны всегда учитывать подобное несоответствие между результатами клинического исследования и результатами мультидетекторной КТ.
При проведении последних 4 исследований ученые предложили использовать КТ как единственное диагностическое обследование для исключения диагноза ТЭЛA. В ходе исследования по выбору метода лечения, в котором принимали участие 756 пациентов, обратившиеся в приемное отделение с подозрением на развитие ТЭЛA, всем больным с высокой и низкой степенью клинической вероятности и с положительным результатом анализа ELISA были проведены ультрасонография и мультидетекторная КТ. Соотношение количества пациентов, у которых при проведении ультрасонографии был обнаружен тромбоз глубоких вен, и количества пациентов, у которых результат проведения мультидетекторной КТ оказался отрицательным, составило всего 3/324 (0,9%; 95% ДИ 0,32,7%).
В исследовании Christopher все больные были разделены на категории c вероятным развитием ТЭЛA согласно правилу Веллса и с положительным результатом анализа на определение Dдимера. Им проводилась мультидетекторная КТ грудной клетки. Риск развития тромбоэмболии в первые 3 месяца среди 1505 пациентов, которым не проводилось лечение в связи с отрицательным результатом КТ, был низким (1,1%; 95% ДИ 0,61,9%). Результаты 2 рандомизированных контролируемых исследований оказались аналогичными. Согласно результатам Канадского исследования, в котором сравнивалась результативность проведения ВПС и КТ легких, только у 531 пациента с отрицательным результатом КТ был обнаружен тромбоз глубоких вен и только у 1 больного было отмечено развитие тромбоэмболии. Следовательно, риск развития тромбоэмболии в течение первых 3 месяцев составил 1,5% (95% ДИ 0,82,9%) при использовании только КТ.
В Европейском исследовании проводилось сравнение двух методов — определения содержания Dдимера и мультидетекторной КТ без проведения ультрасонографии нижних конечностей. При анализе полученных данных риск развития тромбоэмболии в течение первых 3 месяцев составил 0,3% (95% ДИ 0,11,2%) среди 527 пациентов, которым не проводилось лечение в связи с отрицательным результатом проведенных исследований. Исходя из этого, можно предположить, что отрицательный результат мультидетекторной КТ является адекватным критерием для исключения диагноза ТЭЛA у пациентов с низкой степенью клинической вероятности ее развития. В то же время больным с отрицательным результатом КТ и высокой степенью клинической вероятности следует дополнительно провести ультрасонографию или ВПС легких и ангиографию легочных сосудов. Наличие ТЭЛА на сегментарном или на более проксимальном уровне по данным КТ является адекватным подтверждением наличия ТЭЛА у пациентов с низкой степенью клинической вероятности. Так как положительная прогностическая ценность результатов мультидетекторной КТ у пациентов с низкой степенью клинической вероятности низкая (58% согласно результатам исследования PIOPED II), следует проводить дополнительные диагностические исследования. Вследствие того, что специфичность и положительная прогностическая ценность мультидетекторной КТ зависят не только от степени клинической вероятности, но также и от наличия тромба на более проксимальном уровне, дополнительное исследование должно проводиться среди пациентов с низкой степенью вероятности и тромбом на сегментарном уровне (в течение периода лечения следует провести КТ для исключения наличия тромба в долевой артерии или в легочном стволе).
Велись споры о роли КТвенографии как дополнительного метода исследования при проведении КТ ангиографии грудной клетки для диагностики ТЭЛА. Согласно результатам исследования PIOPED II чувствительность КТангиографии и КТвенографии составила 90%, тогда как чувствительность только КТангиографии — 83%. Однако польза от проведения КТвенографии невелика — у 14 дополнительно обследованных пациентов из 824 была определена ТЭЛА. Это увеличило отрицательную прогностическую ценность только на 2 % (97% по сравнению с 95%). По сравнению с КТангиографией грудной клетки применение КТвенографии вместе с клиническим исследованием значительно не влияет на прогноз. Необоснованность клинического использования КТвенографии в данной ситуации подтверждается результатами исследований. Кроме того, КТвенография увеличивает лучевую нагрузку, особенно в области малого таза. Объем облучения органов малого таза зависит от протокола проведения КТвенографии, который использовался. Так, при использовании КТ с одним датчиком доза облучения на грудной клетке составила 2,2 mSv, а в области малого таза — 2,5 mSv, что в 2 раза превышает дозу облучения при ВПС. При проведении КТвенографии доза облучения на половые железы в два раза превышает таковую при проведении только КТангиографии. Интересно отметить, что по данным анализа в подгруппе пациентов (711 человек), которым проводили и ультрасонографию и КТвенографию, кон кордантность результатов составила 95,5%.
Другим предметом дискуссии является клиническая значимость наличия субсегментарной ТЭЛА, то есть единичного субсегментарного тромба при проведении КТ с несколькими датчиками. Данное состояние обнаруживается у 15% пациентов с подозрением на развитие ТЭЛА. Действительно, положительная прогностическая ценность такого результата мала. Данные проведенных исследований показывают, что эти пациенты не подвергаются антикоагулянтной терапии, и у них не отмечаются эпизоды тромбоэмболии в дальнейшем. В данной ситуации следует провести ультрасонографию для того, чтобы убедится, что у больного нет тромбоза глубоких вен, требующего назначения соответствующего лечения. Четких рекомендаций для подобной ситуации нет (пациент с изолированной субсегментарной ТЭЛА и без тромбоза глубоких вен) по причине маловероятности получения достоверных результатов.
Проведение КТ с одним датчиком и КТ с несколькими датчиками позволяет визуализировать тромб на сегментарном уровне. Результаты исследований могут расцениваться как адекватное обоснование диагноза ТЭЛА. На данном этапе остается невыясненным, является ли необходимым лечение пациента с изолированной субсегментарной ТЭЛА без тромбоза глубоких вен. У больных с низкой степенью клинической вероятности развития ТЭЛА и отрицательным результатом проведенной КТ с одним датчиком и ультрасонографии можно исключить диагноз ТЭЛА. При использовании КТ с несколькими датчиками дополнительных исследований можно не проводить.
Ангиография легочных сосудов
Ангиографию легочных сосудов проводят с 1960 года. До настоящего времени эта методика была усовершенствована. Эра цифровой субтракционной ангиографии изменила качество получаемого изображения. Диагностические критерии для установления диагноза ТЭЛА были определены еще 40 лет назад. К ним относится прямое доказательство наличия тромба — дефект наполнения или «ампутация» (отсутствие) ветви легочной артерии. С помощью прямой ангиографии можно визуализировать тромб размером 12 мм на субсегмен тарном уровне. На этом уровне существуют некоторые расхождения. Косвенными признаками наличия ТЭЛА являются замедленный ток контраста, местная гипоперфузия и отсроченный или сниженный венозный ток, но они, к сожалению, не подтверждены и поэтому не являются диагностическими.
Для измерения степени обструкции просвета сосуда в Европе используется шкала Миллера, в США — шкала Волша. В настоящее время в связи с развитием и усовершенствованием КТангиографии легочных сосудов прямая ангиография с введением контраста в легочные артерии практически не используется.
Ангиография легочных сосудов — это инвазивный метод, который не лишен опасностей. Уровень смертности при проведении ангиографии легочных сосудов составляет 0,2% (95% ДИ 00,3%) согласно проведенному анализу данных 5696 пациентов. Случаи смерти при проведении ангиографии легочных сосудов были зафиксированы среди пациентов с гемодинамически ми нарушениями или острой дыхательной недостаточностью. Ранее ангиография легочных сосудов была «золотым стандартом» при диагностике ТЭЛА, но в данный момент неинвазивная КТангиография предоставляет такие же или даже лучшие данные. До недавнего времени для диагностики дисфункции правого желудочка вследствие ТЭЛА использовалась вентрикулография правого желудочка, в настоящее время она замещена эхокардиографией и определением биомаркеров. Более того, при проведении стандартной ангиографии ле
точных сосудов возрастает риск развития местного кровотечения, если требуется проведение тромболизиса пациентам с ТЭЛА. Если проводится ангиография, следует зафиксировать гемодинамические показатели давления в легочной артерии.
В заключение следует указать, что, ангиография легочных сосудов — это надежный, но инвазивный метод исследования. Проведение его необходимо, если результаты выполненных неинвазивных методов исследования неоднозначны. Если проводится ангиография, следует обязательно зафиксировать гемодинамические показатели.
Эхокардиография
У 25% пациентов с ТЭЛА при проведении эхокар диографии (ЭхоКГ) или КТ обнаруживается расширение правого желудочка. Наличие данных изменений очень важно в определении риска. Эхокардиографические критерии диагностики ТЭЛА отличаются в разных исследованиях, они обычно основываются на скорости тока при недостаточности трехстворчатого клапана и на измерении правого желудочка. В виду того, что чувствительность данного метода составляет 6070%, отрицательный результат не исключает диагноз ТЭЛА. С другой стороны, признаки перегрузки правого желудочка или его дисфункции могут возникать вследствие сопутствующих заболеваний сердца или дыхательной системы при отсутствии ТЭЛА. Данные, которые подтверждают специфичность результатов ЭхоКГ, ограничены. Были отобраны три группы эхокардиографических критериев, которые могут использоваться для диагностики ТЭЛА. В исследовании принимали участие 100 пациентов с симптомами, 62% из них были отобраны в отделении интенсивной терапии. Критерии диагностики, которые основывались либо на нарушении выброса из правого желудочка, либо на снижении сократительной способности свободной его стенки по сравнению с верхушкой (признак МакКоннела), обладали более высокой прогностической ценностью, несмотря на существующие сердечнососудистые заболевания (табл. 7). Для недопущения ложного диагноза ТЭЛА у пациентов с гипо или акинезией свободной стенки правого желудочка вследствие его инфаркта (что может иметь сходство с признаком МакКоннела) следует обращать внимание на эхокардиографические признаки, указывающие на перегрузку давлением. Доплерография используется для получения индексов продуктивности работы миокарда. Чувствительность данного метода составляет 8592%, специфичность — 7892% для ТЭЛА, однако эти данные ограничены.
Не следует проводить ЭхоКГ как часть элективной диагностической стратегии у пациентов со стабильной гемодинамикой с подозрением на ТЭЛА.
У больных с высокой степенью вероятности ТЭЛА, с шоковым состоянием или гипотензией отсутствие эхокардиографических признаков перегрузки или дисфункции правого желудочка практически исключает диагноз ТЭЛА как причину гемодинамической нестабильности. Также проведение ЭхоКГ может помочь в дифференциальной диагностике причин шокового состояния, в определении тампонады сердца, острой дисфункции клапанов, острого инфаркта миокарда или гиповоле мии. Наличие четких признаков перегрузки давлением или дисфункции правого желудочка у пациента с гемо динамическими нарушениями с подозрением на развитие ТЭЛА является показанием для активного проведения лечения. В некоторых исследованиях такое лечение назначали пациентам с высокой степенью клинической вероятности, шоковым индексом >1 (частота сердечных сокращений/систолическое артериальное давление), с признаками дисфункции правого желудочка. В течение первых 30 дней проведения этих мероприятий были получены приемлемые результаты.
В особых клинических случаях следует провести поиск венозных тромбов в проксимальных венах с помощью компрессионной ультрасонографии и эмболов в легочных артериях — с помощью трансэзофагеальной ЭхоКГ. Действительно, в связи с возможностью развития билатеральной центральной тромбоэмболии у пациентов с гемодинамически значимой ТЭЛА для подтверждения диагноза следует проводить трансэзофагеаль ную ЭхоКГ. Также у 418% пациентов с острой формой ТЭЛА с помощью трансторакальной ЭхоКГ можно обнаружить тромб в правом отделе сердца.
Если больной с подозрением на развитие ТЭЛА находится в критическом состоянии, следует провести ЭхоКГ у его постели для принятия решения по поводу
лечения. В случае отсутствия у пациента в шоковом состоянии или с гипотензией эхокардиографических признаков перегрузки или дисфункции правого желудочка можно исключить ТЭЛА как причину гемодинамических нарушений. Основной задачей эхокардиографического исследования у пациентов с низкой степенью риска является сортировка их на категории с низкой и средней степенью вероятности.
Диагностические стратегии
При поступлении больного в стационар для выяснения диагностической стратегии следует сразу же определить степень риска развития у него ТЭЛА. Распространенность ТЭЛА среди пациентов с подозрением на ее развитие по данным последних исследований составляет 1035%. Ангиография легочных сосудов — это дорогостоящий инвазивный метод, результаты которого иногда трудно поддаются интерпретации. Поэтому в настоящее время используются комбинации различных неинвазивных методов: клиническое обследование, определение концентрации йдимера в плазме, ультра сонография нижних конечностей, ВПС легких, КТ вместо ангиографии. Данная стратегия применяется в отношении пациентов с подозрением на развитие ТЭЛА, находящихся в приемном отделении или в стационаре. В одном исследовании при отмене антикоагулянт ной терапии на основании данных диагностических исследовании при подозрении на развитие ТЭЛА повысилось число случаев венозной тромбоэмболии и внезапной смерти в течение первых 3 месяцев. Подход к выбору стратегии диагностики при подозрении на развитие ТЭЛА может быть разным в зависимости от возможностей местной лаборатории. В таблице 8 указана необходимая информация для создания альтернативных, базирующихся на признаках, диагностических стратегий.
Высокий риск развития ТЭЛА
При возникновении у больного шока и гипотензии высока вероятность развития ТЭЛА. Необходимо проводить дифференциальный диагноз с кардиогенным шоком, нарушением работы клапанов, тампонадой сердца и расслоением аорты. Наиболее практичным методом первичной диагностики в данной ситуации является проведение ЭхоКГ. Данный метод демонстрирует косвенные признаки острой гипертензии в легочной артерии и перегрузку правого желудочка (если ТЭЛА является причиной данных гемодинамических нарушений). Иногда при проведении трансторакальной ЭхоКГ можно обнаружить транзит тромба через правые отделы сердца, возможна визуализация тромба в легочной артерии. В случае, если состояние пациента нестабильное или нет возможности проведения какихлибо других исследований, диагноз ТЭЛА может быть установлен на основании косвенных признаков, обнаруженных с помощью ЭхоКГ. Если состояние больного удалось стабилизировать путем проведения поддерживающей терапии, следует установить точный диагноз. При наличии тромба в малом круге кровообращения метод КТ может подтвердить диагноз. Не рекомендуется проводить стандартную ангиографию легочной артерии в связи с высоким риском летального исхода, а также повышением риска развития кровотечений (вследствие тромболизиса).
Маловероятное развитие ТЭЛА
Стратегия, основанная на проведении КТанги ографии. КТангиография в последнее время стала основным методом визуализации легочной артерии при подозрении на развитие ТЭЛА. Вентиляционно перфузонная сцинтиграфия легких также используется, но реже в связи с большим количеством неоднозначных результатов. Так как у большинства пациентов с подозрением на развитие ТЭЛА диагноз не подтверждается, не следует проводить КТангиографию как метод диагностики первого звена. Первым логическим шагом в диагностике ТЭЛА при поступлении больного в приемное отделение является клиническое обследование и измерение уровня Dдимера в плазме крови. При этом почти у 30% пациентов диагноз ТЭЛА исключается, риск развития тромбоэмболических событий в течение первых 3 месяцев составляет 1%. Не следует проводить измерение уровня Dдимера у больных с высоким риском ТЭЛА в связи с отрицательной прогностической ценностью данного анализа для данной группы пациентов. Также не следует проводить этот анализ у госпитализированных пациентов, так как для достижения отрицательного результата требуется длительное лечение. В большинстве медицинских центров проведение КТ с несколькими датчиками является методом диагностики второго звена у больных с повышенным уровнем Dдимера и методом диагностики первого звена — у пациентов с высокой степенью клинической вероятности развития ТЭЛА. Проведение КТ с одним или с несколькими датчиками является диагностически положительным, если визуализируется тромб на сегментарном уровне легочной артерии. Отрицательный результат мультидатчиковой КТ является достаточным основанием для исключения диагноза ТЭЛА.
Для исключения диагноза ТЭЛА кроме КТ с одним датчиком следует также проводить ультрасонографию. Отмечались ложноотрицательные результаты КТ с одним датчиком и КТ с несколькими датчиками у пациентов с высокой степенью клинической вероятности. Такая ситуация встречается не так часто, и риск развития тромбоэмболических событий в течение первых 3 месяцев у таких пациентов низкий. Поэтому мнения о необходимости проведения данных методов у них противоречивы.
Ультрасонография нижних конечностей. Роль уль трасонографии нижних конечностей до сих пор дискутируется. Проведение ее является обязательным при КТ с одним датчиком в связи с низкой чувствительностью последней. Действительно, с помощью ультрасоногра фии можно визуализировать тромбоз глубоких вен у пациентов с отрицательным результатом КТ с одним датчиком. В настоящее время большинство медицинских центров оборудовано КТ с несколькими датчиками. Согласно данным нескольких современных исследований отрицательный результат КТ с несколькими датчиками исключает диагноз ТЭЛА у пациентов с низкой степенью клинической вероятности. Тем не менее, проведение ультрасонографии может оказаться полезным и при использовании КТ с несколькими датчиками. Ультрасонография позволяет визуализировать тромбоз глубоких вен у 3050% пациентов с ТЭЛА. Обнаружение тромбоза проксимального отдела глубоких вен у больных с подозрением на развитие ТЭЛА является показанием к назначению антикоагулянтной терапии (без последующего обследования). Проведение ультрасонографии до КТ возможно, если КТ пациенту противопоказана (почечная недостаточность, аллергия на контрастное вещество). Специфичность ультрасонографии для ТЭЛА без проведения КТ с одним датчиком низкая. Ультрасонография используется для стратификации риска, так как наличие тромбоза проксимального отдела глубоких вен повышает риск развития повторной венозной тромбоэмболии у пациентов с ТЭЛА.
Вентиляционноперфузионная сцинтиграфия. В медицинских центрах, где есть возможность проведения ВПС легких, данный метод — наиболее приемлемый для пациентов с повышенной концентрацией Dдимера и противопоказаниями к проведению КТ. ВПС используется приблизительно у 3050% пациентов, которые находятся в приемном отделении с подозрением на развитие ТЭЛА. Если брать в расчет степень клинической вероятности, то количество пациентов с неоднозначными результатами проведенного исследования уменьшается. Отрицательная прогностическая ценность комбинации этих исследований уменьшается в случае отсутствия тромбоза глубоких вен по данным ультрасонографии. В одном из исследований у 24% пациентов при проведении данной комбинации исследований был исключен диагноз ТЭЛА, и риск развития тромбоэмболических эпизодов в течение первых 3 месяцев составил 1,7%. В другом исследовании при комбинации методов диагностики (измерение уровня Dдимера, ультрасоно графия, ВПС и клиническое обследование) у 89% пациентов был подтвержден или исключен диагноз ТЭЛА. В рандомизированном исследовании проводилось сравнение двух диагностических стратегий. Согласно полученным данным можно назначать лечение, основываясь на результатах сцинтиграфии легких, ультрасонографии (при поступлении и повторно — через 1 неделю у отдельных пациентов) и клинического обследования (без ангиографии легочной артерии или КТ). Только у 6 из 611 пациентов (1%; 95% ДИ 0,52,1%), у которых был исключен диагноз ТЭЛА, впоследствии развилась венозная тромбоэмболия. Результативность повторно проведенной ультрасонографии очень низкая (1 случай тромбоза глубоких вен на 78 обследований).
Эхокардиография. Проведение ЭхоКГ не играет главной роли в диагностике ТЭЛА. Действительно, данный метод обладает низкой чувствительностью (6070%), и отрицательный результат не исключает диагноз ТЭЛА. Специфичность ЭхоКГ для ТЭЛА составляет 90%. Наличие эхокардиографических признаков дисфункции правого желудочка у пациентов со средней или высокой степенью клинической вероятности развития ТЭЛА теоретически повышает вероятность подтверждения данного диагноза. Для большинства врачей необходимы более четкие признаки наличия тромба в сосудах нижних конечностей или в легочной артерии для подтверждения диагноза перед назначением антикоагулянтной терапии. Основной задачей ЭхоКГ является стратификация риска среди пациентов с маловероятным развитием ТЭЛА.
«Пробелы» в диагностике
Несмотря на значительный прогресс, в диагностике ТЭЛА существует несколько «пробелов». Диагностическая ценность и клиническая значимость единичного субсегментарного дефекта, обнаруженного при КТ с несколькими датчиками, до сих пор дискутируется. Вопросы о диагностических стратегиях и лечении следует решать индивидуально. В связи с тем, что были зафиксированы случаи ложноотрицательных результатов КТ с несколькими датчиками среди пациентов с высокой степенью клинической вероятности, остается неясным, следует ли проводить данным больным дальнейшие исследования. В частности, ангиография легочных артерий не является более «золотым стандартом» в диагностике ТЭЛА. Соотношение цена/качество ультрасонографии для пациентов с подозрением на развитие ТЭЛА должно быть уточнено.
Прогностическая оценка
Клиническая оценка состояния гемодинамики
Гипотензия и шоковое состояние. Недавно была пересмотрена прогностическая значимость шока и гипотензии при ТЭЛА. Большинство данных получено из обзорных исследований ICOPER и МАРРЕТ (прогноз и лечение эмболии легочной артерии). По результатам исследования ICOPER уровень смертности в течение первых 90 дней составил 52,4% (95% ДИ 43,362,1%) у больных с систолическим артериальным давлением (САД) менее 90 мм рт. ст. по сравнению с 14,7% (95% ДИ 13,316,2%) у пациентов с нормальным давлением. Согласно данным исследования МАРРЕТ системная гипотензия (САД менее 90 мм рт. ст. или снижение САД на 40 мм рт. ст. в течение 15 минут) связано со значительно меньшим риском смерти по сравнению с шоковым состоянием (внутриго спитальная смертность 15,2 против 24,5% соответственно). Однако уровень смертности попрежнему остается высоким, что оправдывает классифицирование больных на категории с высоким (требующих агрессивного лечения) и низким уровнем риска.
У пациентов с ТЭЛА могут возникнуть синкопальное состояние и сердечный приступ. В большинстве случаев данное событие развивается при постоянной системной гипотензии и шоке, которые являются признаками высокого риска. У больных, которые сразу же приходят в себя и их САД стабилизируется, оценивание степени риска должно основываться на данных анамнеза. Следует принимать во внимание степень дисфункции правого желудочка и наличие эмболии вследствие флотирующего тромба в правых отделах сердца или в проксимальном отделе вен нижних конечностей.
Таким образом, шок и гипотензия являются главными признаками высокого риска ранней смерти при развитии острой ТЭЛА.
Показатели дисфункции правого желудочка
Эхокардиография. У 25% пациентов с ТЭЛА при проведении ЭхоКГ можно обнаружить некоторые изменения. Согласно метаанализу риск смерти при ТЭЛА в 2 раза выше у пациентов с эхокардиографическими признаками дисфункции правого желудочка. В 2 из 7 исследований проводилась оценка риска у пациентов с нормальным АД и ТЭЛА. У данных пациентов чувствительность к дисфункции правого желудочка составляет 5661% и при этом увеличивается уровень ранней смертности, связанной с ТЭЛА. Очень важно отметить, что у пациентов с нормальными показателями ЭхоКГ был хороший исход лечения, и уровень внутригоспи тальной смертности, связанной с ТЭЛА, составил менее 1% в большинстве исследований.
К сожалению, эхокардиографические признаки дисфункции правого желудочка, а именно дилатация правого желудочка, гипокинез, увеличение соотношения диаметров левого и правого желудочков и увеличение скорости выброса при регургитации трехстворчатого клапана, в разных исследованиях не одинаковы. Так как не существует универсального определения дисфункции правого желудочка, только полностью нормальный результат ЭхоКГ можно расценивать как показатель низкого уровня риска развития ТЭЛА. Это очень важно, потому что в некоторых исследованиях наличие эхокардиографических признаков перегрузки давлением правого желудочка (повышение пикового градиента недостаточности трехстворчатого клапана и уменьшение времени ускорения кровотока в правом желудочке) считают достаточным для того, чтобы классифицировать больного в группу пациентов с дисфункцией правого желудочка. Также с помощью ЭхоКГ можно определить два специфических показателя, каждый из которых удваивает риск развития ТЭЛА, — шунт справа налево через открытое овальное окно и наличие тромба в правых отделах сердца.
Компьютерная томография. Контрастная несин хронизированная с ЭКГ спиральная КТ используется как ангиография легочной артерии. Она позволяет оценить соотношение размеров правого и левого желудочков, но не дает четкой информации о функции правого желудочка. При проведении КТ с одним датчиком определение длины малой оси правого и левого желудочков требует измерения относительной поперечной плоскости грудной клетки. Соотношение правый желудочек/левый желудочек (ПЖ/ЛЖ)>1 было обнаружено у 58% пациентов из 120 больных в стабильном состоянии с подтвержденным диагнозом ТЭЛА, по отношению к уровню смертности в течение первых 30 дней положительная прогностическая ценность составила 10% (95% ДИ 2,917,4%). Комбинация соотношения ПЖ/ЛЖ >1 и индекса обструкции сосудов (данные КТ) >40% увеличивает положительную прогностическую ценность для уровня смертности в течение первых 30 дней до 18,8%. Прогностическая ценность соотношения ПЖ/ЛЖ <1 для благоприятного исхода составила 100% (95% ДИ 94,3100%).
В двух испытаниях обследования проводились с помощью КТ с 16 датчиками. Согласно полученным данным соотношение ПЖ/ЛЖ составило >0,9 (изображение 4 камер, несинхронизированное с ЭКГ), что оказалось несколько больше, чем измеренные оси у пациентов с ТЭЛА с плохим прогнозом. В другом исследовании с участием 431 пациента соотношение ПЖ/ЛЖ составило >0,9 у 64% больных с ТЭЛА, отрицательная прогностическая ценность и положительная прогностическая ценность по отношению к уровню смертности в течение первых 30 дней составили 92 и 15,6% соответственно. Риск смерти в течение первых 30 дней при соотношении ПЖ/ЛЖ >0,9 составил 5,17 (95% ДИ 1,6316,35; р=0,005) после учета таких факторов риска, как пневмония, рак, ХОЗЛ и пожилой возраст.
После того как во внимание были приняты результаты исследований на небольших группах пациентов, большинство ученых пришло к выводу, что КТ помогает провести стратификацию риска у больных с подтвержденным диагнозом ТЭЛА. Наибольшая ценность данного метода — это выявление пациентов с низким уровнем риска (в связи с отсутствием дилатации правого желудочка). Другие индексы, которые можно определить при проведении КТ (форма межжелудочковой перегородки, размеры легочной артерии, индекс обструкции сосудов), не имеют такой прогностической ценности.
Мозговой натрийуретический пептид. Дисфункция желудочка связана с увеличением растяжения миокарда, что ведет к увеличению секреции натрийурети ческого пептида (BNP). Существует предположение, что при острой ТЭЛА уровень BNP или Nтерминального пронатрийуретического пептида (NTproBNP) отображает тяжесть ее течения и тяжесть гемодинамической декомпенсации. Последние исследования показали, что содержание BNP и NTproBNP можно использовать как дополнительные прогностические показатели.
Хотя повышенное содержание BNP и NTproBNP связано с худшим прогнозом, положительная прогностическая ценность данного исследования очень низкая (1226%). С другой стороны, низкое содержание BNP и NTproBNP используется как показатель хорошего прогноза для показателей ранней смертности и осложненного течения (отрицательная прогностическая ценность 94100%).
Другие показатели дисфункции правого желудочка. Расширение яремной вены у пациентов с ТЭЛА можно расценивать как показатель дисфункции правого желудочка, если нет признаков тампонады сердца или опухоли средостения. Другие клинические признаки, такие как шум при регургитации в правое предсердие и ритм галопа, более субъективны и поэтому менее показательны. Изменения на ЭКГ, указывающие на нарушение в правом желудочке, инверсию зубца Т в отведениях У1У4, зубец QR в отведении У1, классическую модель S1Q3T3 и признаки полной или неполной блокады правой ножки пучка Гиса можно использовать для диагностики дисфункции правого желудочка, однако у этих показателей ограниченная чувствительность. Катетеризация правых отделов сердца позволяет непосредственно оценить давление при наполнении правого желудочка и объем сердечного выброса, однако не рекомендуется использовать данный метод для стратификации риска при остром течении ТЭЛА.
Таким образом, нарушение работы правого желудочка связано с увеличением риска ранней смерти при остром течении ТЭЛА. Возможность прогностической оценки признаков нарушения работы правого желудочка ограничена в связи с отсутствием универсальных критериев (в некоторых исследованиях они расцениваются как изолированные показатели гипертензии в легочной артерии).
Маркеры поражения миокарда
Сердечные тропонины. При вскрытии у пациентов, которые скончались в связи с массивной ТЭЛА, был обнаружен трансмуральный инфаркт миокарда при ин тактных венечных артериях. Согласно данным нескольких исследований у больных с ТЭЛА зафиксировано повышение уровня сердечных тропонинов, что связано с ухудшением прогноза. Источником этих маркеров не всегда был миокард правого желудочка.
В более ранних исследованиях положительный результат анализа на тропонин Т (>0,1 нг/мл) был зафиксирован у 035 и 50% пациентов с немассивной, субмассив ной и массивной формами ТЭЛА соответственно. Повышение содержания тропонина Т было связано с увеличением уровня внутригоспитальной смертности до 44% по сравнению с 3% среди пациентов с отрицательным результатом данного анализа (относительный риск (ОР) 15,2; 95% ДИ 1,2190,4). В другом исследовании повышение уровней тропонина Т и тропонина I было связаны с уровнем внутригоспитальной смертности и развитием осложнений. Увеличение внутригоспитальной смертности зафиксировано также среди больных ТЭЛА с нормальным АД при граничном содержании тропонина Т 0,01 нг/мл (ОР 21,0; 95% ДИ 1,2389,0). Через 612 часов после поступления в стационар следует проводить повторное определение уровня сердечных тропонинов, так как первоначальный отрицательный результат может измениться. При анализе данных, полученных при проведении большого терапевтического исследования 458 пациентов с субмассив ной формой ТЭЛА, у 13,5% из них обнаружено повышение уровня тропонина I (>0,5 нг/мл), который измерялся в течение 24 часов после поступления.
Увеличение содержания сердечных тропонинов было связано с повышением риска смерти в течение первых трех месяцев в 3,5 раза (95% ДИ 111,9). Повышение уровня тропонина I до 23 мг/л (что соответствует развитию инфаркта миокарда) было зафиксировано у 3,5% пациентов (95% ДИ 25,6). В большинстве исследований положительной и отрицательной прогностической ценности повышенное содержания сердечных тропонинов в отношении ранней смертности, связанной с ТЭЛА, составляющей 1244%, имеет очень высокую отрицательную прогностическую ценность (99100%). Последний метаанализ данных показал, что увеличение содержания сердечных тропонинов в крови в подгруппе пациентов со стабильной гемодинамикой связано с повышением уровня смертности (ОР 5,9; 95% ДИ 2,712,9).
Новые маркеры повреждения миокарда. Есть данные о прогностической ценности других биомаркеров повреждения миокарда для пациентов с острым течением ТЭЛА. Миокардиальный белок, связывающий жирные кислоты, является более ранним, чем тропонин или миоглобин, маркером повреждения миокарда. Его определение используется для стратификации риска при развитии ТЭЛА. Содержание миокардиального белка, связывающего жирные кислоты, >6 нг/мл имеет положительную и отрицательную прогностическую ценность в отношении ранней смерти — 2337 и 96100% соответственно.
Комбинация маркеров повреждения миокарда и нарушения работы правого желудочка. Одновременное определение содержания тропонина и NTproBNP помогает более четко стратифицировать риск у пациентов с нормальным АД с подозрением на развитие ТЭЛА. Уровень смертности в первые 40 дней в группе больных с повышенным уровнем сердечных тропонинов и Ж“ргоВ^ составил 30%; у пациентов с изолированным повышением NTproBNP — 3,7%. Низкий уровень содержания этих маркеров является показателем хорошего прогноза.
Еще одной диагностической стратегией является комбинация определения уровня сердечных тропони нов и проведения ЭхоКГ. В одном из исследований содержание тропонина I >0,1 нг/л и соотношение ПЖ/ЛЖ >0,9 было связано с увеличением уровня смертности в первые 30 дней до 38%. Отсутствие признаков повреждения миокарда и нарушения работы правого желудочка гарантировало благоприятный прогноз.
К сожалению, современные данные не позволяют определить граничное содержание маркеров, которые можно было бы использовать для принятия решений в отношении дальнейшей стратегии. В настоящее время проводится большое рандомизированное исследование по оценке преимуществ проведения тромболизиса у пациентов с нормальным АД, эхокардиографическими признаками нарушения работы правого желудочка и повышенным содержанием сердечных тропонинов.
Таким образом, повреждение миокарда у пациентов с ТЭЛА можно обнаружить с помощью определения содержания уровня сердечных тропонинов Т и I. Положительные результаты данных анализов связаны со средним риском ранней смерти при остром течении ТЭЛА.
Прогностическая оценка признаков повреждения миокарда ограничена в связи с отсутствием универсальных критериев. Одновременное определение новых маркеров повреждения миокарда и маркеров нарушения работы правого желудочка может помочь в стратификации риска для пациентов с острым течением ТЭЛА.
Дополнительные маркеры риска
Стандартные клинические лабораторные исследования. При проведении стандартных клинических исследований несколько показателей имеют прогностическую ценность для пациентов с ТЭЛА. Некоторые из них больше связаны с ранее наблюдаемыми у отдельных больных состояниями и сопутствующими заболеваниями, чем с тяжестью течения ТЭЛА. Например, в исследовании ICOPER возраст более 70 лет, наличие онкологических заболеваний, застойной сердечной недостаточности и ХОЗЛ расценивались как прогностические факторы. Было изучено несколько других данных стандартных клинических исследований и предложены шкалы риска на основании этих показателей. Некоторые шкалы используются для выявления пациентов с низким уровнем риска, являющихся кандидатами на раннюю выписку и амбулаторное лечение, другие шкалы используются для выявления пациентов с высоким риском, которым необходимо проведение интенсивной терапии.
Женевская прогностическая шкала — это восьмибалльная система, в которой учитывается 6 показателей неблагоприятного исхода: наличие рака, гипотензии (100 мм рт. ст.) — 2 балла каждый; наличие сердечной недостаточности, предшествующего тромбоза глубоких вен, артериальной гипоксемии (РаО2<8кРа), доказанного с помощью ультразвукового исследования тромбоза глубоких вен — 1 балл каждый показатель. Мужской пол, тахикардия, гипотермия, нарушение сознания и низкая сатурация являются также клиническими прогностическими показателями и используются в клинической модели для оценки риска. В этой шкале риска используются 11 клинических показателей для распределения пациентов на 5 степеней риска по отношению к уровню смертности в течение первых 30 дней (начиная с самой низкой степени и заканчивая самой высокой) (табл. 9).
Повышение уровня сывороточного креатинина также имеет прогностическую ценность у пациентов с острым течением ТЭЛА. В другом исследовании уровень йдимера менее 1500 нг/л имел 99% отрицательную прогностическую ценность в отношении уровня смертности в течение первых 3 месяцев.
Таким образом, для прогнозирования при острой форме ТЭЛА можно использовать большое количество данных стандартных клинических исследований. Для окончательной стратификации риска следует принимать во внимание предшествующие факторы риска.
Стратегия проведения прогностической оценки
Прогностическая оценка необходима не только для установления диагноза, но и для стратификации риска и принятия решения относительно проводимой терапии.
Стратификация риска осуществляется поэтапно: она начинается с клинической оценки гемодинамического состояния и продолжается с помощью лабораторных исследований.
Высокий риск развития ТЭЛА устанавливается при наличии шока или постоянной артериальной гипотензии (САД<90 мм рт. ст., снижение АД>40 мм рт. ст. за 15 минут; если она не вызвана аритмией, гиповолемией или сепсисом) и является угрожающим жизни состоянием, которое требует назначения специфического лечения.
У пациентов с нормальным АД и маловероятным развитием ТЭЛА при наличии маркеров повреждения миокарда и нарушения работы правого желудочка устанавливают среднюю степень риска. Обнаружение маркеров повреждения миокарда и нарушения работы правого желудочка значительно увеличивает риск.
У пациентов со стабильной гемодинамикой, без признаков нарушения работы правого желудочка и повреждения миокарда устанавливают низкий уровень риска.
Результаты стандартных лабораторных и клинических исследований также имеют прогностическое значение и могут использоваться в шкале риска (табл. 9). Такая шкала, в которой учитываются сопутствующие и предшествующие заболевания, может быть полезной для принятия решений о ранней выписке больного и амбулаторном лечении.
Анатомическое расположение и размеры тромба можно определить с помощью КТангиографии (шкала
Миллера и Волша), спиральной КТ (индекс обструкции) или сцинтиграфии легких. Однако оценка анатомического расположения тромба для стратификации риска используется реже, чем оценка функциональных изменений.
Ее не рекомендуется использовать для прогностических целей.
Таким образом, оценка гемодинамического статуса, признаков нарушения работы правого желудочка и повреждения миокарда, принятие во внимание дополнительных факторов риска используются для оптимальной стратификации риска.
Лечение
Респираторная и гемодинамическая поддержка
Острая недостаточность правого желудочка со слабым сердечным выбросом является одной из главных причин смерти больных с ТЭЛА. Следовательно, пациентам с ТЭЛА и недостаточностью правого желудочка следует назначать поддерживающее лечение.
Согласно данным экспериментальных исследований агрессивное увеличение объема жидкости может ухудшить работу правого желудочка вследствие механического его перерастяжения и снижения сократительной способности. С другой стороны, в сообщении о небольшом клиническом испытании говорится о том, что после инфузии 500 мл декстрана пациентам с нормальным АД при острой форме ТЭЛА и низком сердечном индексе последний повысился с 1,6 до 2,0 л/мин. Следовательно, инфузия умеренного количества жидкости может обусловить увеличение сердечного индек
са у пациентов с острой формой ТЭЛА, низким сердечным выбросом и нормальным АД.
Изопротеренол — инотропный препарат, который вызывает дилатацию легочных артерий и одновременное расширение периферических сосудов. Вызванная гипотензия может привести к ухудшению перфузии правого желудочка и ишемии. Норэпинефрин благодаря своему прямому положительному инотропно му эффекту улучшает перфузию венечных артерий путем стимуляции периферических аадренорецепторов и повышает АД. К сожалению, нет данных о действии норэпинефрина у больных с ТЭЛА. Также следует ограничить назначение данного препарата пациентам с гипотензией. По данным малых исследований в отделении интенсивной терапии пациентам с ТЭЛА назначают добутамин, который увеличивает объем сердечного выброса, транспорт кислорода и оксигенацию тканей при постоянном значении РО2. В другом исследовании у 10 больных с ТЭЛА, низким сердечным индексом и нормальным АД при внутривенном введении до бутамина отмечалось увеличение сердечного индекса на 35% без значительного изменения ЧСС, системного АД и давления в легочных артериях. Таким образом, добутамин или дофамин можно назначать пациентам с ТЭЛА, низким сердечным индексом и нормальным АД. Однако повышение сердечного индекса сверх физиологических значений может ухудшить вентиляционную диссоциацию путем перераспределения кровотока из закупоренных сосудов в открытые. Эпинефрин обладает свойствами норэпинефрина и добутамина, кроме вазодилатирующего эффекта последнего препарата. Его можно применять у пациентов с ТЭЛА, находящихся в шоковом состоянии.
Вазодилататоры снижают давление и сопротивление в легочных сосудах в эксперименте у животных и в меньшей степени — у больных с ТЭЛА. Единственным недостатком данных препаратов является их недостаточная специфичность в отношении легочных сосудов при внутривенном введении. Чтобы нивелировать данное ограничение, следует вводить вазодилататоры ингаляционным путем. Согласно результатам небольших клинических исследований ингаляционное введение оксида азота может улучшить состояние гемодинамики и газообмен при ТЭЛА. Есть сведения об использовании простациклина (в ингаляционной форме) для устранения легочной гипертензии, вторичной по отношению к ТЭЛА.
Получены предварительные данные о том, что лево симендан восстанавливает работу правого желудочка и легочной артерии при острой форме ТЭЛА путем расширения легочной артерии и увеличения сократительной способности правого желудочка.
Возрастает интерес к использованию антагонистов эндотелиновых рецепторов и ингибиторов фосфодиэ стеразы5 при ТЭЛА. В экспериментальных исследованиях показано, что антагонисты рецепторов эндотели на влияют на тяжесть легочной гипертензии, вызванной массивной ТЭЛА, и что введение силденафила также влияет на давление в легочной артерии.
При ТЭЛА часто встречаются гипоксемия и гипокап ния, степень которых зависит от тяжести состояния. Открытое овальное окно может усиливать степень гипоксии за счет шунта слева направо. Гипоксемию устраняют путем подачи кислорода через маску, и только в редких случаях проводят механическую вентиляцию легких. Потребление кислорода можно уменьшить, снизив жар и возбуждение; если процесс дыхания неэффективен, следует прибегнуть к механической вентиляции, однако необходимо ограничить ее влияние на гемодинамику. В частности, положительное внутригруд ное давление может обусловить снижение венозного возврата и усиление недостаточности правого желудочка у пациентов с массивной ТЭЛА. Поэтому вентиляцию с положительным давлением на выдохе нужно проводить с осторожностью. Для поддержания положительного давления на выдохе на уровне 30 см вод. ст. следует вводить малые объемы воздушной смеси (приблизительно 6 мл/кг массы тела).
Таким образом, респираторная и гемодинамиче ская поддержка необходима пациентам в шоковом состоянии или с гипотензией при подозрении на развитие ТЭЛА.
Тромболизис
Данные рандомизированных исследований показали, что проведение тромболитической терапии быстро устраняет обструкции и благоприятно влияет на гемодинамику. Ранее в малых исследованиях через 72 часа после введения стрептокиназы наблюдали повышение сердечного индекса на 80% и снижение давления в легочной артерии на 40%. При проведении мультицентрового исследования в Италии по изучению активатора плазминогена (гї:РА) на нескольких ангиограммах отмечалось снижение обструкции сосудов на 12% при введении 100 мг гїРА (в течение 2 часов) по сравнению с введением гепарина. Под влиянием гїРА снижалось среднее давление в легочной артерии на 30% и повышался сердечный индекс на 15%. В одном из самых больших исследований с применением тромболи зиса данные ЭхоКГ продемонстрировали значительное уменьшение размера правого желудочка в конце диастолы через 3 часа после введения гї:РА.
При изучении влияния урокиназы и стрептокиназы на течение ТЭЛА в исследовании USPET была доказана равноценность действия этих тромболитических препаратов, если они введены в течение 1224 часов. Последние рандомизированные исследования показали, что введение 100 мг гїРА в течение 2 часов значительно быстрее улучшает гемодинамику и ангиографи ческую картину по сравнению с действием урокиназы, которую вводят в период между 12 и 24 часами из расчета 4400 МЕ/кг в час, однако после инфузии результаты не отличались. Точно так же введение гїРА в течение 2 часов значительно лучше влияет на состояние пациента, чем введение стрептокиназы в течение 12 часов (100 тыс. МЕ/ч), однако не отмечалось никакой разницы при введении стрептокиназы в течение 2 часов. В двух исследованиях сравнивалось действие 100 мг гї:РА при введении его в течение 2 часов и в течение 15 минут в дозе 0,6 мг/кг. Наблюдались незначительные расхождения в результатах, и частота кровотечений была немного выше в первом случае. Эффект при прямом местном введении ^РА с помощью катетера в легочную артерию (уменьшенная доза) значительно не отличался от такового при системном внутривенном введении. Такой способ не рекомендуется применять, так как он повышает риск кровотечения в месте прокола.
Утвержденные курсы введения стрептокиназы, урокиназы и рекомбинантного тканевого активатора плазминогена
Стрептокиназа — 250 тыс. ЕД в качестве нагрузочной дозы в течение 30 минут с последующим введением ее со скоростью 100 тыс. ЕД/ч в течение 1224 часов.
Режим быстрого введения: 1,5 млн ЕД в течение 2 часов.
Урокиназа — 4400 ЕД/кг в качестве нагрузочной дозы в течение 10 минут с последующим введением 4400 ЕД/ кг в час в течение 1224 часов.
Режим быстрого введения: 3 млн ЕД в течение 2 часов.
Рекомбинантный человеческий активатор плазминогена тканевого типа — 100 мг в течение 2 часов или 0,6 мг/ кг в течение 15 минут (максимальная доза—50 мг).
Улучшение состояния гемодинамики было достигнуто при двойном болюсном введении ретеплазы — 2 инъекции (10 ЕД) в течение 30 минут. Предварительные неконтролируемые данные указывают на эффективность и безопасность введения тенектеплазы при острой ТЭЛА. Не следует применять гепарин одновременно с урокиназой или стрептокиназой, но возможно одновременное введение его с альтеплазой.
Согласно полученным клиническим данным и данным ЭхоКГ, в течение первых 36 часов приблизительно 92% пациентов чувствительны к проведению тромболизиса. Наиболее явный эффект наблюдается при начале лечения в течение 48 часов с момента проявления симптомов, однако можно проводить тромболизис пациентам, у которых наличие симптомов отмечалось в течение 614 дней.
При проведении тромболизиса следует учитывать, что препарат действует быстро, однако только на протяжении нескольких дней. Через неделю не обнаруживается значительной разницы в степени обструкции сосудов и нарушения работы правого желудочка у пациентов, получавших гепарин, и у больных, которым вводили тромболитические препараты.
При проведении тромболитической терапии нужно помнить о высоком риске развития кровотечений, особенно если есть предрасполагающие факторы и сопутствующие заболевания. Данные рандомизированных исследований показывают повышение частоты развития массивных кровотечений на 13% и внутричерепных на 1,8%. В последних исследованиях случаи опасных для жизни кровотечений наблюдались редко. Уровень кровотечений при проведении тромболизиса значительно ниже, если для диагностики ТЭЛА используются неинвазивные методы (за последние 10 лет их применяют все чаще).
Итак, тромболитическая терапия является методом лечения первой линии при высоком риске летального исхода у больных с кардиогенным шоком и постоянной артериальной гипотензией. Стандартное использование тромболитических препаратов у пациентов с маловероятным развитием ТЭЛА не рекомендуется. Возможно проведение данного вида лечения у пациентов со средним риском развития ТЭЛА с учетом всех состояний, которые повышают риск развития кровотечения. Не следует назначать тромболитическую терапию в случаях низкой степени риска.
Эмболэктомия
Первая успешная эмболэктомия была проведена в 1924 году. В течение долгого времени эту ургентную операцию выполняли очень редко, хотя и существовали некоторые данные о ее безопасности и эффективности. В настоящее время в некоторых медицинских центрах для лечения ТЭЛА стали привлекать кардиохирургов.
Традиционно эмболэктомию проводят пациентам с ТЭЛА, которые нуждаются в сердечнолегочной реанимации; при наличии противопоказаний к тромболизису, неадекватной реакции на тромболизис; больным с открытым овальным окном и внутрисердечным тромбом.
При помощи портативного аппарата искусственного кровообращения и катетеризации бедренной артерии в критических ситуациях можно обеспечить циркуляцию и оксигенацию крови, а также установить окончательный диагноз. В некоторых случаях эмболэктомию выполняли у пациентов с ТЭЛА и нарушением работы правого желудочка без постоянной гипотензии или шокового состояния.
В медицинских центрах, где оказывают стандартную кардиохирургическую помощь, эмболэктомия считается простой операцией. После анестезии и срединной стернотомии устанавливают кардиопульмональный шунт. При наличии внутрисердечного тромба или открытого овального окна пережимать аорту не следует, необходимо избегать остановки сердца. После рассечения легочного ствола и дополнительной артерио томии правой легочной артерии тромбы можно удалить с помощью тупых инструментов. До восстановления нормальной работы правого желудочка могут потребоваться продолжительное кардиопульмональное шунтирование и постепенное отключение механической вентиляции. Одной из проблем послеоперационного периода может быть кровотечение вследствие проведения предоперационного тромболизиса, который, однако, не является противопоказанием к эмболэктомии. Остается невыясненным вопрос относительно установки фильтра в нижнюю полую вену.
В прошлом после эмболэктомии наблюдалась высокая ранняя смертность. При расширении спектра показаний к ее проведению у пациентов с нарушением работы правого желудочка и отсутствием острого шокового состояния уровень ранней смертности снизился и составляет 68%.
Если эпизод острой ТЭЛА сопровождается длительным диспноэ и тяжелой легочной гипертензией, речь, скорее всего, может идти о хронической тромбоэмбо
лической легочной гипертензии. Таким пациентам не следует проводить эмболэктомию, им выполняют эн дартерэктомию в специальных медицинских центрах.
Можно заключить, что благодаря современной хирургической технике эмболэктомия стала доступным методом лечения пациентов с высоким риском летального исхода и с абсолютными противопоказаниями к проведению тромболизиса.
Чрескожная катетерная эмболэктомия и фрагментация
Чрескожное вмешательство для открытия частично закрытого легочного ствола или основных ветвей легочной артерии в некоторых критических ситуациях у пациентов с ТЭЛА может спасти положение. Несмотря на то что информация о данной технике ограничена, ее можно использовать как альтернативу тромболизи са при наличии абсолютных противопоказаний к нему, как дополнительный метод лечения, если тромболизис не улучшил гемодинамику, или как альтернативу хирургическому лечению, если невозможно осуществить немедленный доступ.
Всасывающий эмболэктомический катетер Гринфилда был создан в 1969 году. Он остается единственным прибором, одобренным Американским советом по медицинскому оборудованию, медикаментам и т.д. Для фрагментации и дисперсии тромба применяют специальные сердечные катетеры или специально сконструированные катетеры с ротационными или режущими приборами. При использовании данных приборов отмечаются положительные результаты, однако клинические исследования данного метода лечения не проводились.
Некоторые приборы вводятся в легочные артерии с помощью катетера диаметром 611 F, что требует определенной ловкости, особенно если правая основная легочная артерия закрыта. Не следует использовать катетеры для фрагментации тромба в мелких ветвях легочных артерий, так как возможно их повреждение и перфорация.
Изменение гемодинамики после успешно проведенной фрагментации тромба является опасным симптомом. Манипуляцию следует сразу же прекратить, несмотря на данные ангиографии. Значительное изменение кровотока в легочных артериях на ангиограмме может выглядеть как малые отклонения.
К осложнениям чрескожных манипуляций относятся: повреждения в месте прокола (бедренной вены), перфорация структур сердца, тампонада и аллергическая реакция на контрастное вещество. Кровоток в подвздошной и полой венах можно оценить с помощью ангиографии, обструкция оставшимся тромбом встречается редко.
Итак, катетерную эмболэктомию и фрагментацию тромба в проксимальных отделах легочной артерии можно использовать как альтернативный метод лечения при абсолютных противопоказаниях к проведению тромболизиса.
Первичная антикоагулянтная терапия
Антикоагулянтная терапия занимает значительное место в лечении больных с ТЭЛА. Необходимость в немедленном ее проведении у данной категории пациентов основана на результатах исследования, которое было выполнено в 1960 году. Оно продемонстрировало преимущества использования нефракционирован ного гепарина. Целью первичной антикоагулянтной терапии является предотвращение смертельного исхода и развития рецидивов, а также контроль частоты случаев кровотечения.
Быстрый антикоагулянтный эффект достигается при внутривенном введении нефракционированного гепарина, подкожном введении низкомолекулярного гепарина и фондапаринукса.
После парентерального введения антикоагулянтов необходимо назначить антагонисты витамина К перорально. В рандомизированном контролируемом исследовании сравнивали действие антагонистов витамина К в комбинации с гепарином и одних антагонистов витамина К. При применении только антагонистов витамина К увеличилась частота случаев повторного развития венозной тромбоэмболии. После внутривенной инфузии нефракционированного гепарина в дозе 80 ЕД/кг для ее фиксирования следует болюсно ввести 18 ЕД/кг гепарина. Доза нефракционированного гепарина регулируется по значению активированного частичного тромбо пластинового времени (АЧТВ), которое в норме составляет 1,52,5 секунды (табл. 10). АЧТВ следует измерять через 46 часов после болюсного введения препарата, через 3 часа после каждой коррекции дозы и при достижении терапевтического эффекта при 1 введении в день.
Нужно отметить, что АЧТВ не является идеальным маркером степени антикоагуляционного действия гепарина. Поэтому нет необходимости повышать скорость инфузии до 1667 ЕД/ч, что соответствует 40 тыс. ЕД/ день, если уровень антифактора Ха составляет 0,35 МЕ/ мл, даже если АЧТВ ниже терапевтического значения.
Низкомолекулярный гепарин следует с осторожностью назначать пациентам с почечной недостаточностью. В этом случае его доза должна коррелировать с уровнем антифактора Ха. При острой почечной недостаточности показано внутривенное введение нефракционированного гепарина (клиренс креатинина < 30 мл/мин), так как он не выводится почками. У больных с высоким риском развития кровотечения при внутривенном введении нефракционированного гепарина его антикоагуляционное действие можно быстро прекратить путем отмены. Во всех остальных случаях острой ТЭЛА нефракционированный гепарин можно заменить низкомолекулярным (подкожное введение с контролем показателей).
В некоторых исследованиях сравнивались эффективность и безопасность подкожного введения низкомолекулярного и нефракционированного гепарина. В метаанализ был включен 1951 пациент с симптоматической ТЭЛА низкой степени риска, бессимптомной ТЭЛА на фоне симптоматического течения тромбоза глубоких вен. После окончания курса лечения (514 дней) оказалось, что низкомолекулярный гепарин так же эффективен (частота повторных венозных тромбоэмболий — отношение шансов [ОШ] 0,63; 95% ДИ 0,331,18) и так же безопасен, как и нефракционированный гепарин (ОШ 0,67; 95% ДИ 0,361,27). Уровень смертности был одинаковым в обеих группах (ОШ 1,2; 95% ДИ 0,592,45).
В таблице 11 указаны низкомолекулярные гепари ны, одобренные для применения при острой форме ТЭЛА. Другие низкомолекулярные гепарины используются при тромбозе глубоких вен и иногда — при острой форме ТЭЛА. Нельзя рекомендовать назначение низкомолекулярного гепарина больным с ТЭЛА высокой степени риска и нестабильной гемодинамикой, так как эта группа пациентов не принимала участия в рандомизированных исследованиях безопасности и эффективности данных препаратов. Активность антифактора Ха измерять постоянно не обязательно, если пациент получает низкомолекулярный гепарин, однако ее следует учитывать у больных с острой почечной недостаточностью и у беременных. Измерения проводят через 4 часа после утреннего введения препарата, когда уровень антифактора Ха наиболее высокий. При введении низкомолекулярного гепарина дважды в день уровень антифактора Ха должен составлять 0,61 МЕ/мл, при однократном введении — 12 МЕ/мл.
При назначении нефракционированного или низкомолекулярного гепарина следует постоянно контролировать количество тромбоцитов в связи с риском развития спровоцированной гепарином тромбоцитопении.
Фондапаринукс (селективный ингибитор Ха фактора), введенный подкожно, является достойной альтернативой низкомолекулярному гепарину. Так как время полураспада фондапаринукса составляет 1520 часов, его можно назначать один раз в день. При проведении открытого исследования с участием 2213 пациентов с острой формой ТЭЛА и без нее, которым была показана тромболитическая терапия, при назначении фондапаринукса частота повторной венозной тромбоэмболии (3,8 против 5% в первые 3 месяца) и частота массивных кровотечений (1,3 против 1,1%) были аналогичны таковым при внутривенном введении нефрак
ционированного гепарина. В связи с тем, что не было зафиксировано ни одного случая тромбоцитопении, спровоцированной фондапаринуксом, сделано заключение, что контролировать количество тромбоцитов необязательно. Введение фондапаринукса противопоказано при острой почечной недостаточности с клиренсом креатинина < 20 мл/мин.
Антикоагуляционная терапия с помощью нефракционированного гепарина, низкомолекулярного гепарина и фондапаринукса должна проводиться в течение 5 дней. Данные двух рандомизированных исследований показали, что эффективность нефракционированного гепарина, вводимого 57 дней, аналогична эффективности нефракционированного гепарина, применяемого в течение 1014 дней (при условии, что после этого проводится адекватная длительная антикоагуляционная терапия). Антагонисты витамина К необходимо назначать как можно раньше, предпочтительнее в один день с началом первичной антикоагуляционной терапии. Парентеральное введение антикоагулянтов следует прекратить, если международное нормализованное отношение (МНО) равно 2,03,0 в течение 2 дней. При использовании антагониста витамина К совместно с варфари ном начальная доза должна составлять 57,5 мг. По данным двух исследований, в которых участвовали госпитализированные пациенты, варфарин в дозе 5 мг вызывает менее выраженное антикоагуляционное действие, чем в дозе 10 мг. Также эти исследования показали, что стартовая доза варфарина для пациентов моложе 60 лет составляет 10 мг, а для лиц более пожилого возраста и госпитализированных больных — 5 мг. Следует регулировать дозу гепарина для поддержания значения МНО на уровне 2,5.
Точных данных, свидетельствующих о пользе иммобилизации для пациентов с ТЭЛА, пока нет. Доказана целесообразность иммобилизации больных с тромбозом глубоких вен. В ходе последних исследований ученые обнаружили, что частота развития новых тромбоэмболий (согласно данным сцинтиграфии легких) при ранней выписке и компрессионном воздействии на нижнюю конечность была такой же, как и при иммобилизации пациента. В Кокрановском обзоре, в котором были собраны данные всех последних исследований, указано, что использование компрессионных чулок значительно снижает частоту и распространенность пост тромботического синдрома у больных с тромбозом глубоких проксимальных вен через 2 года после эпизода ЮШ 0,3; 95% ДИ 0,20,5).
В последних испытаниях возможность амбулаторного лечения ТЭЛА не была рассмотрена изза отсутствия соответствующих пациентов. Такой подход можно предложить пациентам с ТЭЛА с низкой степенью риска.
При первичном лечении венозной тромбоэмболии быстродействующие пероральные антикоагулянты могут заменить парентеральное введение антикоагулянтов. В настоящее время проводятся клинические исследования новых пероральных антикоагулянтов (в основном ингибиторов факторов Ха и На, при использовании которых не требуется контроль количества тромбоцитов).
Таким образом, антикоагулянтную терапию (нефрак ционированным гепарином, низкомолекулярным гепарином и фондапаринуксом) следует проводить незамедлительно у пациентов с подтвержденным диагнозом ТЭЛА и больных с высокой степенью клинической вероятности ее развития (при диагностических манипуляциях). В качестве первичного лечения во всех случаях, кроме случаев с высоким риском развития кровотечения и острой почечной недостаточности, показано подкожное введение низкомолекулярного гепарина или фондапаринукса.
Терапевтические стратегии
ТЭЛА высокой степени риска. При ТЭЛА у пациентов в шоковом состоянии или с гипотензией риск летального исхода в первые часы после поступления очень высок. Наиболее приемлемым в качестве первичного лечения является внутривенное введение нефракционированного гепарина, которое необходимо проводить всем пациентам с высокой степенью риска при отсутствии абсолютных противопоказаний. Данные одного из исследований позволили предположить, что в случаях ТЭЛА и наличия свободного тромба в правых отделах сердца проведение тромболизиса может быть эффективной и безопасной альтернативой хирургическому вмешательству.
У пациентов с абсолютными противопоказаниями к проведению тромболизиса и нестабильной гемодинамикой после предпринятых соответствующих мер эмболэктомия является манипуляцией выбора. Если ее в данный момент нельзя осуществить, проводят катетер ную эмболэктомию или фрагментацию тромба.
ТЭЛА с низкой степенью риска. У больных с нормальным АД и низкой степенью риска краткосрочный прогноз благоприятен. В большинстве случаев при ТЭЛА у пациентов с низкой степенью риска без острого нарушения функции почек препаратом выбора является низкомолекулярный гепарин или фондапаринукс (подкожное введение) без контроля количества тромбоцитов. Согласно данным 6 исследований, в данной группе пациентов проведение тромболизиса клинических преимуществ не дает.
К группе средней степени риска относятся больные со стабильной гемодинамикой, но с вероятностью развития дисфункции правого желудочка или повреждения миокарда. Проведено исследование, в котором 256 пациентов с ТЭЛА средней степени риска без относительных противопоказаний к проведению тромболи зиса были рандомизированы для получения гепарина или ^РА. В группе, где проводили тромболизис, частота случаев смерти и клинических событий, которые требовали интенсивного лечения, была значительно ниже, чем в группе пациентов, которым был назначен гепарин. Это связано с тем, что при применении гепарина требовалось проведение вторичного тромболизиса во время пребывания в стационаре. Учитывая отсутствие повышенного риска развития кровотечения, пациентам с ТЭЛА средней степени риска следует проводить тромболизис. В настоящее время в Европе проходит крупное исследование, цель которого заключается в устранении всех противоречий, связанных со стратегией лечения в этой группе пациентов.
Диагноз ТЭЛА низкой степени риска устанавливают при отсутствии основных факторов риска, связанных с ТЭЛА. После оказания необходимой амбулаторной помощи и антикоагулянтной терапии эти пациенты подлежат ранней выписке. Следует всегда учитывать существующие факторы риска и риск развития кровотечения.
Длительная антикоагулянтная терапия и вторичная профилактика
Для предотвращения фатальных и нефатальных повторных эпизодов венозной тромбоэмболии проводится длительная антикоагулянтная терапия. Несмотря на то что низкомолекулярный гепарин может быть безопасной и эффективной альтернативой антагонистам витамина К, большинству пациентов с онкологическими заболеваниями назначают антагонисты витамина К в дозах, достаточных для поддержания МНО на уровне 2,5.
В большинстве исследований с применением длительной антикоагулянтной терапии при венозной тромбоэмболии принимали участие пациенты с тромбозом глубоких вен и только в одном — больные с ТЭЛА. Показания к ней при тромбозе глубоких вен и ТЭЛА практически одинаковы, единственное отличие заключается в том, что повторные эпизоды ТЭЛА у пациентов с ТЭЛА встречаются в три раза чаще, чем при тромбозе глубоких вен.
Необходимость назначения длительной антикоагу лянтной терапии при венозной тромбоэмболии была подтверждена во всех рандомизированных исследованиях. По данным одного исследования, при отсутствии длительной антикоагулянтной терапии частота рецидивов у пациентов с тромбозом вен голени в течение первых 3 месяцев составила 20%. В другом исследовании была продемонстрирована меньшая эффективность низкомолекулярного гепарина по сравнению с антагонистами витамина К при тромбозе проксимального отдела глубоких вен. Рецидивы чаще наблюдались при сокращении продолжительности лечения до 46 недель и были значительно реже в случаях проведения терапии 36 месяцев.
Клинические исследования по изучению эффективности антикоагулянтной терапии в зависимости от ее продолжительности были разделены на следующие категории:
- краткая и средняя продолжительность;
- два курса различной средней продолжительности;
- средняя и неограниченная продолжительность.
На основании результатов этих исследований было сделано заключение, что у пациентов с венозной тромбоэмболией продолжительность антикоагулянтной терапии не должна ограничиваться 46 неделями; риск рецидивов при антикоагулянтной терапии, проводимой в течение 6 или 12 месяцев, такой же, как и при 3месячном курсе; при неограниченном сроке данного лечения риск рецидивов венозной тромбоэмболии снижается на 90%, однако возрастает риск массивных кровотечений. Антагонисты витамина К эффективно предотвращают рецидивы венозной тромбоэмболии во время лечения, но они не устраняют риск рецидивов после его прекращения. Продолжительность антикоагулянтной терапии для каждого пациента определяется соотношением между риском рецидивов при прекращении лечения и риском развития кровотечений при его продолжении. При лечении антагонистами витамина К требуется постоянный контроль МНО, что связано с определенными неудобствами.
Рак в активной стадии является основным фактором риска развития рецидивов венозной тромбоэмболии в течение первых 12 месяцев — их частота составила 20%. Среди факторов риска развития рецидивов рак находится на первом месте. Поэтому первый эпизод ТЭЛА у пациентов с онкологическими заболеваниями является показанием к проведению антикоагулянтной терапии неограниченной продолжительности. В рандомизированном исследовании пациентам с тромбозом глубоких вен и раком назначали низкомолекулярный гепарин (дальтепарин) в дозе 200 ЕД/кг один раз в день в течение 46 недель с последующим приемом в течение 6 месяцев 75% стартовой дозы. Этим больным рекомендуется назначение низкомолекулярного гепарина в течение 6 месяцев с последующим продолжением до выхода заболевания из активной стадии.
В исследовании пациентов с первым эпизодом ТЭЛА, вызванной обратимыми факторами риска, частота рецидивов после прекращения лечения составила 2,5%, у больных с идиопатической ТЭЛА — 4,5%. Такие же результаты были получены при исследовании пациентов с тромбозом глубоких вен. К обратимым факторам риска венозной тромбоэмболии относятся хирургическое вмешательство, травма, прием эстрогенов и беременность. При вторичной ТЭЛА антагонисты витамина К следует назначать в течение 3 месяцев, кроме случаев тромбоза дистального отдела глубоких вен. Не рекомендуется применять антагонисты витамина К более 3 месяцев, если фактор риска устранен.
У пациентов с идиопатической ТЭЛА стратификация риска остается неопределенной. К факторам высокого риска рецидива венозной тромбоэмболии (ОР 1,52) относятся: один или более предшествующих эпизодов венозной тромбоэмболии; синдром антифосфолипидных антител; наследственная тромбофилия; мужской пол; остаточный тромбоз в проксимальных венах. Дополнительным фактором риска рецидива венозной тромбоэмболии при выписке из больницы пациентов с ТЭЛА является постоянная дисфункция правого желудочка, определяемая с помощью ЭхоКГ. С другой стороны, отрицательный результат анализа по определению уровня Dдимера после отмены антагонистов витамина К является благоприятным фактором (ОР 0,4).
Кандидатами на проведение неограниченного сроками лечения после первого эпизода неспровоцированной венозной тромбоэмболии являются пациенты с дефицитом белка С или S, гомозиготные по Уфактору Лейдена или по фактору РТG20210А, носители молекулярной тромбофилии, больные красной волчанкой.
Кроме риска рецидива при определении длительности антикоагулянтной терапии следует также учитывать риск развития кровотечения. К факторам риска развития кровотечений относятся: пожилой возраст (старше 75 лет); предшествующие желудочнокишечные кровотечения; предшествующий неишемический инсульт, хронические заболевания печени или почек; параллельное проведение антитромбоцитарной терапии, чего следует избегать; тяжелые острые или хронические заболевания; неадекватный контроль антикоагу лянтной терапии; некачественное проведение лабораторных исследований.
На основании изложенного можно заключить, что пациенты с неспровоцированной ТЭЛА должны получать антагонисты витамина К в течение 3 месяцев. При назначении антикоагулянтов на неограниченный срок следует оценить соотношение риска и преимущества данного лечения. Проведение неограниченной антикоагулянтной терапии рекомендуется пациентам с первым эпизодом неспровоцированной ТЭЛА или тромбоза глубоких вен, с низкой степенью риска развития кровотечения, при совпадении данной рекомендации с желанием больного, всем пациентам со вторым эпизодом неспровоцированной ТЭЛА или тромбоза глубоких вен.
Назначение уменьшенных доз антагонистов витамина К пациентам с идиопатической ТЭЛА было более эффективным и безопасным по сравнению с плацебо, но менее эффективным и безопасным по сравнению с антикоагулянтной терапией. Данный метод следует использовать только в особых случаях.
Эффективность длительной антикоагулянтной терапии разной продолжительности в предотвращении развития хронической тромбоэмболической легочной гипертензии не изучена.
Для длительного лечения ТЭЛА необходимы пе роральные антикоагулянты, прием которых не требует проведения контроля. В настоящее время проходит исследование таких препаратов — селективного ингибитора тромбина дабигатрана и ингибиторов фактора Ха — ривароксабана и апиксабана.
Венозные фильтры
Прерывание тока крови по нижней полой вене как метод предотвращения ТЭЛА был впервые предложен Троссо в 1868 году. Венозный фильтр был изобретен в 1960 году. Его подкожное введение стало возможным 30 лет назад. Венозные фиа##945;ьтры устанавливают в ин фраренальном отделе нижней полой вены. Если тромб находится в нижней полой вене выше почечных вен, венозные фильтры устанавливают выше.
Постоянные венозные фильтры могут обеспечить длительную защиту от ТЭЛА, однако есть вероятность возникновения осложнений (поздний рецидив, пост тромботический синдром, повторное развитие тромбоза глубоких вен).
Осложнения при установке постоянных венозных фильтров возникают часто, но редко приводят к летальному исходу. Ранние осложнения (тромбоз в месте введения фильтра) возникают в 10% случаев, поздние — чаще: рецидив тромбоза глубоких вен встречается в 20% случаев, посттромботический синдром — в 40%. Несмотря на использование антикоагулянтов и продолжительное лечение, окклюзия нижней полой вены возникает у 22% пациентов в течение 5 лет и у 33% больных — в течение 9 лет. Другие венозные фильтры через некоторое время должны быть удалены. Временные фильтры рекомендуется удалять через 2 недели после имплантации. Есть данные, что временные фильтры, оставленные на более продолжительный срок, вследствие их тромбоза и смещения были связаны с 10% частотой поздних осложнений. Трудно определить соотношение риска и преимущества для венозных фильтров, так как наблюдения за пациентами были непостоянными в большинстве исследований и при рецидиве не проводились объективные исследования для подтверждения ТЭЛА. В одном рандомизированном испытании 400 пациентам с тромбозом глубоких вен проводилась антикоагулянтная терапия с назначением нефракционированного гепарина, низкомолекулярного гепарина и перорального антикоагулянта и антикоагулянтная терапия в комбинации с установкой венозного фильтра. В течение первых 12 дней частота развития ТЭЛА составила 1,1% у больных с венозным фильтром и 4,8% — у пациентов, которым была назначена только антикоагулянтная терапия (р = 0,03). При наблюдении в течении 2 лет разница стала незначительной. Хотя уровни смертности в этих группах в течение первых 12 дней не отличались (по 2,5%), в группе, где больные получали только антикоагулянт ную терапию, из 5 смертей 4 — были связаны с ТЭЛА, в то время как в группе пациентов с установленным венозным фильтром ТЭЛА не была причиной смерти. В настоящее время получены данные наблюдения в течение 8 лет: у больных с постоянным венозным фильтром риск развития ТЭЛА снизился, но риск рецидива тромбоза глубоких вен повысился.
В основной популяции пациентов с венозной тромбоэмболией не рекомендуется массовое использование венозных фильтров. С другой стороны, их можно применять при абсолютных противопоказаниях к проведению антикоагулянтной терапии, при высокой степени риска рецидива венозной тромбоэмболии (в период после нейрохирургической или другой большой операции). Также возможна установка фильтра беременным женщинам, у которых может развиться тромбоз за несколько недель до родов. При отмене противопоказаний следует назначить антикоагулянты и удалить временный венозный фильтр. Однако данных относительно оптимальной продолжительности его использования нет.
Нет также доказательств целесообразности постоянного использования венозных фильтров у больных с флотирующими тромбами в проксимальном отделе глубоких вен. Согласно материалам исследования частота рецидивов ТЭЛА у таких пациентов при назначении адекватной антикоагулянтной терапии была низкой (3,3%). Плановый тромболизис не является показанием для профилактической установки венозного фильтра.
Специфические проблемы
Беременность
Распространенность ТЭЛА в период беременности составляет 0,31 случай на 1 тыс. родов. В развитых странах ТЭЛА является основной причиной материнской смерти, связанной с беременностью. Риск развития ТЭЛА в послеродовой период особенно высок после кесарева сечения. Клинических особенностей развития ТЭЛА при беременности нет. Наиболее частой жалобой беременной женщины при ТЭЛА является удушье. Если нет внезапного начала или симптом изолированный, его следует оценивать с осторожностью. Значение РаО2 во время беременности остается нормальным. Для его определения забор артериальной крови следует проводить в положении стоя, так как в третьем триместре в положении сидя этот показатель будет ниже.
Диагностика ТЭЛА во время беременности. При подозрении на развитие ТЭЛА у беременной проведение диагностических мероприятий связано с негативным влиянием на плод ионизирующего излучения. К тому же назначение антикоагулянтной терапии может плохо сказаться на здоровье женщины и состоянии плода. Поэтому необходимо разработать точную методику установления диагноза.
Уровень Dдимера в плазме во время беременности повышен физиологически. Согласно данным исследования у 50% женщин на 20й неделе беременности уровень Dдимера оставался в пределах нормы. При подозрении на развитие ТЭЛА у беременных нормальный уровень Dдимера имеет такую же прогностическую ценность, как и у остальных людей. Даже при низкой вероятности отрицательного результата его необходимо измерять, чтобы не прибегать к рентгенографии. После получения положительного результата анализа следует провести ультрасонографию нижних конечностей. Если с помощью ультрасонографии диагноз подтвердить не удается, ищут другие возможности для этого.
Допустимая доза радиации для плода составляет 50 mSv (50 000 ^м). Согласно последним данным доза радиации, полученная при КТ грудной клетки, ниже, чем при проведении сцинтиграфии легких в первом и втором триместрах, хотя она и дает неплохие результаты при диагностике ТЭЛА (75% беременных женщин). Ретроспективные исследования показали благоприятный исход при отсутствии лечения у беременных женщин на основании отрицательного результата сцинтиграфии легких. Величина дозы облучения на молочную железу при сцинтиграфии легких такая же, как и при КТ грудной клетки. Проведение вентиляционной фазы не дает достаточно информации для того, чтобы оправдать дополнительное облучение. Пациенткам, которым не проводилась сцинтиграфия легких, следует выполнить КТ грудной клетки, поскольку ангиография легочной артерии дает большую дозу облучения (2,23,7 mSv).
Лечение при ТЭЛА в период беременности. Лечебные мероприятия включают в себя введение нефракционированного или низкомолекулярного гепарина. Ни тот ни другой препарат не проходит через гематоплацентар ный барьер (ГПБ) и не накапливается в грудном молоке в значительном количестве. Данные ряда исследований показывают, что использование низкомолекулярного гепарина при беременности является безопасным, его необходимо назначать из расчета на массу тела. При измерении уровня антифактора Ха следует учитывать избыток массы тела при беременности и наличие заболеваний почек. Гепарин следует применять в течение всей беременности. Поскольку данные об использовании фондапаринукса при беременности отсутствуют, его назначать не рекомендуется. Антагонисты витамина К проникают через ГПБ и обладают эмбриопатическим действием в первом триместре беременности. При назначении их в третьем триместре может возникнуть кровотечение у плода в неонатальный период, а также отслойка плаценты. Применение варфарина во время беременности (в любом триместре) связано с появлением у плода патологии нервной системы. Несмотря на то что некоторые эксперты рекомендуют использовать варфарин во время второго триместра беременности, как и при наличии искусственного клапана сердца, этого следует избегать. Ведение родов требует особого внимания. За 12 часов до проведения эпидуральной анестезии необходимо отменить введение низкомолекулярного гепарина и продолжить его через 1224 часов после удаления эпидураль ного катетера. Во время родов должны тесно сотрудничать акушер, анестезиолог и неонатолог.
После родов гепарин можно заменить антагонистами витамина К. Антикоагулянтную терапию следует продолжать в течение 3 месяцев после родов. Антагонисты витамина К можно назначать при кормлении грудью.
Опубликованы данные о назначении тромболитиче ских препаратов 36 беременным женщинам, показанием к чему у трети из них послужило развитие массивной формы ТЭЛА. Наиболее часто при этом использовали стрептокиназу, которая не проникает через плаценту. Частота кровотечений у матерей составила 8% (обычно из половых путей). Данный риск не считается значительным по сравнению с уровнем смертности при массивной форме ТЭЛА при назначении только гепарина. Тромболитическую терапию во время родов можно проводить только в очень тяжелых случаях и при отсутствии возможности выполнения эмболэктомии. Показания для установки венозных фильтров такие же, как и у обычных пациентов.
В заключение подчеркнем, что беременным женщинам с подозрением на развитие ТЭЛА следует установить точный диагноз, потому что может потребоваться назначение курса гепарина. Все диагностические методы исследования (в том числе и КТсканирование) можно применять без значительного риска для плода. При подтверждении диагноза ТЭЛА рекомендуется назначение низкомолекулярного гепарина. Не следует использовать антагонисты витамина К во время первого и третьего триместров, а во втором триместре их нужно назначать с осторожностью.
Антикоагулянтную терапию необходимо продолжать в течение 3 месяцев после родов.
Онкологические заболевания
Связь между ТЭЛА и раком хорошо описана. При проведении когортных и клинических исследований ученые предположили, что у пациентов с идиопатиче ской или неспровоцированной ТЭЛА приблизительно в 10% случаев в течение 510 лет может развиться рак.
Риск тромбоза у больных с онкологической патологией в 4 раза выше, чем в общей популяции, и он повышается в 67 раз при проведении химиотерапии. Применение некоторых противоопухолевых препаратов и средств поддерживающей терапии связано с повышением риска тромбоэмболических событий. Гормональные и химиотерапевтические препараты у больных раком работают как синергисты в развитии тромбоза. Использование антиангиогенных средств, таких как тали домид, также связано с развитием тромбоза.
У пациентов с онкологическими заболеваниями при проведении антикоагулянтной терапии тромбоэмболические осложнения и массивные кровотечения развиваются чаще, чем у лиц без злокачественных опухолей. Риск коррелирует с распространенностью рака.
Целесообразность проведения разных диагностических исследований (ультразвукового, эндоскопии пищевого канала, КТ, магнитнорезонансной томографии) у больных раком и идиопатической ТЭЛА является спорной. Большинство авторов считают, что интенсивное исследование следует осуществлять только при сильном подозрении на развитие рака после тщательного клинического обследования, сбора анамнеза и применения стандартных лабораторных и инструментальных методов (рентгенография).
Повышение свертываемости крови, часто встречаемое у больных раком, не только является фактором риска тромбоза, но может также влиять на прогрессирование опухоли и метастазирование. Гепарин и другие антикоагулянты обладают противоопухолевым эффектом, о чем свидетельствуют данные рандомизированных исследований.
Было опубликовано несколько статей об эффективности низкомолекулярного гепарина относительно производных кумарина. В исследовании ^ОТ (рандомизированное исследование по сравнению эффективности низкомолекулярного гепарина и перораль ных антикоагулянтов в предотвращении рецидивов венозной тромбоэмболии у больных раком) использование дальтепарина было связано с увеличением выживаемости пациентов с большими опухолями, у которых не наблюдался процесс метастазирования во время острого тромбоэмболического события. В исследовании FAMOUS увеличение выживаемости отмечалось только в группе больных с благоприятным прогнозом, а не в группе пациентов с отягощенным раковым процессом. Результаты данных исследований демонстрируют безопасность назначения низкомолекулярного гепарина при раке, дает основание предполагать, что гепарин более безопасен, чем антагонисты витамина К. Пациентам с ТЭЛА и раком низкомолекулярный гепарин следует назначать в течение 36 месяцев. После этого низкомолекулярный гепарин или антагонисты витамина К необходимо применять до тех пор, пока раковый процесс будет находиться в активной стадии.
Таким образом, онкологические заболевания являются предрасполагающими факторами развития венозной тромбоэмболии. Не рекомендуется проводить углубленное исследование в целях обнаружения онкологического процесса у пациентов с идиопатической ТЭЛА. Больным раком с подтвержденным диагнозом ТЭЛА следует назначать низкомолекулярный гепарин в течение 36 месяцев, а затем до тех пор, пока раковый процесс будет находиться в активной стадии.
Тромб в правых отделах сердца
При проведении ЭхоКГ у пациентов с ТЭЛА в правых отделах сердца довольно часто выявляется тромб. У таких больных системное кровяное давление ниже, часто встречается гипотензия, увеличена частота сердечных сокращений и чаще развивается гипокинез правого желудочка, чем у других пациентов. Это объясняет распространенность случаев наличия тромба в правых отделах сердца среди пациентов, находящихся в отделении интенсивной терапии (718%). Распространенность случаев тромба в правых отделах сердца среди неотобранных пациентов с ТЭЛА выше 4%, поэтому клинически стабильным пациентам не следует проводить эхокардиографическое исследование.
У пациентов с ТЭЛА наличие тромба в правых отделах сердца (особенно если он подвижный), миграция его в легкие из периферических вен связаны с повышением уровня ранней смертности. Является ли тромб в правых отделах сердца независимым фактором риска смерти — неизвестно. Полученные данные указывают, что тромб в правых отделах сердца следует рассматривать как угрожающее жизни состояние, которое связано с высокой степенью риска развития повторной ТЭЛА. Если не проводить должного лечения, уровень смертности при подвижном тромбе в правых отделах сердца достигает 80100%. Стратегия лечения таких больных четко не определена. В регистре ICOPER проводилось тромболитиче ское лечение, однако уровень смертности в течении первых 14 дней составил 20%. Отличные результаты такой терапии зафиксированы в последних исследованиях, где при проведении 16 пациентам тромболитической терапии 50, 75 и 100% тромбов в правых отелах сердца исчезли через 2, 12 и 24 часа соответственно после проведения тромболизиса. В течение первых 30 дней пациенты выжили, хотя исчезновение тромбоза произошло в результате эмболии в малом круге кровообращения, а не за счет лизиса in situ. Это обстоятельство не позволяет оценить уровень выживаемости при проведении тромболизиса по сравнению с таковым среди пациентов, которым проводилось хирургическое вмешательство.
Применение только гепарина может быть недостаточным у больных в таком состоянии. Хирургическая и катетерная эмболэктомия могут использоваться как альтернативные методы лечения, однако этот вопрос изучен недостаточно. Хирургическая эмболэктомия является методом выбора в случаях наличия тромба в правых отделах сердца при переходе его через открытое овальное окно.
Независимо от выбранного метода лечение необходимо проводить немедленно. При обнаружении подвижного тромба в правых отделах сердца на ЭхоКГ дальнейших диагностических исследований проводить не нужно.
Итак, наличие мигрирующего из периферических сосудов тромба в правых отделах сердца связано со значительным риском развития ранней смерти у пациентов с острой формой ТЭЛА. В таких случаях необходимо проведение немедленного лечения. В связи с отсутствием данных контролируемых исследований оптимальный метод лечения окончательно не определен. Наиболее эффективными являются тромболизис и эмболэктомия.
Тромбоцитопения на фоне приема гепарина
Данное состояние является серьезным осложнением антикоагулянтной терапии. Иммунноопосредованная тромбоцитопения относится ко 2му типу. При этом типе иммуноглобулин G направлен против тромбоци тарного фактора комплекса гепарин4. Тромбоцитопения возникает на 514й день после введения гепарина или раньше — в случаях передозировки. Парадоксально, но, несмотря на быстрое снижение количества тромбоцитов, наблюдается склонность к возникновению венозной или артериальной тромбоэмболии.
Некоторые факторы могут влиять на частоту развития тромбоцитопении. К ним относятся: тип гепарина (нефракционированный гепарин > низкомолекулярный гепарин > фондапаринукс), лечение (хирургическое > терапевтическое) и пол (женский > мужской). Распространенность тромбоцитопении составляет 13% у пациентов, которые получают нефракционированный гепарин, и 1% — у больных, которым назначен низкомолекулярный гепарин. Последний метаанализ не подтвердил снижение частоты тромбоцитопении среди пациентов с венозной тромбоэмболией, которым вводили низкомолекулярный гепарин. Тромбоцитопения 2го типа возникает в 2% случаев после проведения хирургического вмешательства на сердце или грудной клетке с применением кардиопульмонального шунтирования.
Развитие тромбоцитопении 2го типа следует подозревать у всех пациентов с количеством тромбоцитов менее 100 тыс./ммЗ или снижением его на 50% по сравнению с начальным уровнем. Диагноз тромбоцито пении 2го типа должен быть подтвержден с помощью специфических иммунологических анализов.
Если есть подозрение на развитие тромбоцитопении 2го типа, введение гепарина следует прекратить и при необходимости дальнейшего проведения антикоагулянтной терапии — вводить другой препарат, пока количество тромбоцитов не восстановится до уровня выше 100 тыс./мм3. Эффективными средствами лечения тромбоцитопении являются прямые ингибиторы тромбина, такие как лепирудин и аргатробан. В острой стадии заболевания назначение пероральных антикоагулянтов противопоказано, однако может использоваться длительная антикоагулянтная терапия.
При приеме фондапаринукса случаев тромбоцито пении зафиксировано не было, однако есть упоминание о его использовании в лечении тромбоцитопении 2го типа.
В заключение можно констатировать, что тромбоцитопения является угрожающим жизни иммунологическим осложнением антикоагулянтной терапии. Необходимо контролировать количество тромбоцитов у пациентов, получающих гепарин, для раннего выявления тромбоцитопении. Лечение данного состояния заключается в прекращении введения гепарина и назначении альтернативной антикоагулянтной терапии.
Хроническая тромбоэмболическая легочная гипертензия
Хроническая тромбоэмболическая легочная гипертензия (ХТЛГ) является редким осложнением ТЭЛА. У пациентов с ХТЛГ первичный эмбол через определенный промежуток времени замещается фиброзной тканью, которая затем инкапсулируется в интиме или ме дии легочных сосудов. Эмбол может находиться в сегментарных или субсегментарных ветвях легочной артерии. Может возникнуть частичная реканализация или полная окклюзия поврежденных сосудов.
Хроническая обструкция легочных сосудов приводит к прогрессирующему возрастанию их сопротивления, что чревато развитием недостаточности правого отдела сердца. Начальная стадия данного заболевания протекает бессимптомно, может сопровождаться диспноэ и гипоксемией. В более поздних стадиях у пациентов проявляются признаки отягощенной недостаточности правых отделов сердца.
ХТЛГ следует подозревать у всех больных с легочной гипертензией. Диагностическая стратегия основана на проведении ЭхоКГ, сцинтиграфии легких, КТ, катетеризации правого отдела сердца и ангиографии легочной артерии. Лечение направлено на устранение недостаточности правого отдела сердца и снижение сопротивления легочных сосудов. Предварительные данные показывают, что гемодинамика и функциональное состояние улучшаются при назначении аналогов простациклина, антагонистов рецепторов эндотелина и ингибиторов фосфоди эстеразы5. Эффективность любого вида терапии зависит от морфологического субстрата в легочной артерии. Кандидатами для проведения длительного медикаментозного лечения являются неоперабельные больные и пациенты, у которых оперативное вмешательство не принесло положительных результатов. Впервые тромбэндартерэк томия была проведена в 1957 году и в настоящее время является стандартным методом лечения при ХТЛГ. Критерии отбора больных для проведения тромбэндартерэк томии указаны в руководствах Американской коллегии торакальных хирургов. К ним относятся: симптомы 3го и 4го функциональных классов НьюЙоркской ассоциации сердца; сопротивление в легочных сосудах до операции более 300 дин/см5 в секунду; доступный для хирургического удаления тромб в основном стволе легочной артерии, в сегментарных и лобарных ветвях; отсутствие сопутствующей патологии.
Хирургическое удаление обтурирующего материала требует проведения истинной эндартерэктомии. Поэтому данная операция выполняется при кардиопульмональном шунтировании в условиях глубокой гипотермии с полным отключением кровотока для обеспечения адекватной видимости. Основные легочные артерии должны быть рассечены, что поможет определить уровень проведения правой эндартерэктомии. Затем с помощью специальных диссекторов хирург достигает сегментарных, лобарных и субсегментарных ветвей.
В настоящее время отсутствует классификация ХТЛГ. В зависимости от локализации и типа повреждений, обнаруженных во время хирургического вмешательства, пациенты могут быть разделены на 4 группы. Первая группа характеризуется наличием свежего тромба в долевой ветви легочной артерии; вторая — утолщением и фиброзом интимы в проксимальном отделе сегментарных ветвей; третья — поражением только дистального отдела сегментарных ветвей; четвертая — поражением на уровне артериол без видимых проявлений тромбоэмболического заболевания.
Уровень послеоперационной смертности зависит от тяжести заболевания. У пациентов с сопротивлением легочных сосудов до операции менее 900 дин/см5 в секунду он составил 4%, у больных с сопротивлением легочных сосудов до операции менее 1200 дин/см5 в секунду — 20%. Результаты тромбэндартерэктомии оценены как превосходные, уровень выживаемости в течение первых 3 лет — 80%. Хотя последние данные указывают на развитие ХТЛГ у 3,8% пациентов с ТЭЛА (в течение 2 лет), никаких рекомендаций по ее выявлению у больных, перенесших ТЭЛА, нет.
Таким образом, ХТЛГ — это тяжелое, но редкое осложнение ТЭЛА. Легочная эндартерэтомия является методом лечения первой очереди. Согласно данным клинических исследований применение медикаментозной терапии для улучшения циркуляции в малом круге кровообращения не дало желаемых результатов.
Нетромботическая эмболия легочной артерии
Септическая эмболия. Септическая эмболия в малом круге кровообращения в клинике встречается довольно редко. Образование септических эмболов связано с наличием эндокардита трехстворчатого клапана, который возникает при наркомании у пациентов с инфицированными катетерами и пейсмейкерами, у больных с периферическим септическим тромбофлебитом или лиц с трансплантированными органами.
Чаще всего больные поступают с жалобами на жар, кашель и кровохарканье. Назначение антибиотиков может дать желаемый результат, но источник эмболов следует удалить хирургическим путем.
Внутрисосудистые инородные тела. К внутрисосуди стым инородным телам, которые могут эмболизировать легочные артерии, относятся: поломанные катетеры, венозные фильтры, стенты. Большинство инородных тел найдено в легочных артериях, остальные — в правых отделах сердца и в полой вене. Проведение внутрисо судистого удаления обычно бывает успешным.
Жировая эмболия. Синдром жировой эмболии проявляется дыхательными, гематологическими, неврологическими и кожными симптомами, а также признаками, связанными с травмой и другими хирургическими или терапевтическими состояниями. Распространенность этого клинического синдрома низкая — менее 1%. Эмболия костным мозгом бывает вследствие переломов длинных костей. Проявления могут развиться молниеносно: легочная и системная эмболия, недостаточность правого отдела сердца и сердечнососудистый коллапс. Однако чаще всего клиническая картина разворачивается постепенно — через 1236 часов после повреждения появляются гипоксемия, неврологические симптомы, жар и петехиальная сыпь. Жировая эмболия возникает и вследствие других причин: липосакции, введения пропофола, у пациентов с жировой дистрофией печени.
Патогенез синдрома жировой эмболии еще до конца не выяснен. Лечение неспецифическое.
Воздушная эмболия. Воздушная эмболия возникает вследствие попадания воздуха (или экзогенных газов) из операционной раны в сосудистое русло, вследствие чего возникают системные нарушения. Заболеваемость и смертность вследствие воздушной эмболии зависят от объема попавшего воздуха и степени аккумуляции. Для взрослого смертельный объем воздуха составляет 200300 мл, или 35 мл/кг при введении со скоростью 100 мл/с.
Основным проявлением воздушной эмболии является обструкция выхода из правого желудочка или обструкция легочных артериол смесью воздушных пузырьков и нитей фибрина, которые формируются в сердце. В результате возникают сердечнососудистая дисфункция и недостаточность. Основной целью лечения является предотвращение дальнейшего поступления воздуха, снижение объема полученного воздуха и гемодинамическая поддержка.
Пациентов с подозрением на воздушную эмболию следует поставить в левую латеральную локтевую позицию с опущенной головой. Во время операции большие пузырьки воздуха можно удалить с помощью аспираци онной иглы.
В некоторых случаях возможно проведение гипер барической терапии, особенно у больных с эмболией мозговых артерий.
Эмболия околоплодными водами. Эмболия околоплодными водами — это редкое, но очень тяжелое осложнение беременности, встречается в одном случае на 8000 80 000 беременностей. Уровень материнской смертности и смертности плода — 80 и 40% соответственно. Это состояние может проявляться дисфункцией органов от средней степени до коагулопатии, сердечнососудистого коллапса и смерти.
Эмболия околоплодными водами возникает, когда амниотическая жидкость попадает в кровоток через небольшие трещины в маточных венах во время физиологических родов. Внезапно появляются диспноэ, цианоз и шоковое состояние, которые затем переходят в сердечнолегочной коллапс и отек легких. Патофизиология эмболии околоплодными водами многофакторная и до конца не исследована. Диагноз устанавливается методом исключения, терапия поддерживающая.
Эмболия тальком. Такие вещества, как тальк, крахмал и целлюлоза, используются в производстве лекарственных препаратов. Некоторые из этих препаратов, предназначенных для перорального применения (ам фитамины, метилфенидат, гидроморфин и декстропро поксифен), наркоманы крошат, растворяют и вводят внутривенно. Маленькие их частицы попадают в легочные сосуды, вызывают тромбоз и формирование вну трисосудистой гранулемы.
Эмболия опухолевыми клетками. В 26% случаев при вскрытии умерших от рака встречается эмболия опухолевыми клетками, очень редко это состояние диагностируется при жизни. Рентгенологически картина напоминает пневмонию, туберкулез или интерстициональ ные заболевания легких. Наиболее часто в эмболах обнаруживают клетки карциномы предстательной, молочной, поджелудочной желез и гепатомы. К сожалению, вопросы лечения данного заболевания не разрабатывались, так как чаще всего диагноз устанавливают посмертно. Есть данные об успешных результатах химиотерапии.
Редкие случаи. К редким случаям нетромботической эмболии относятся: хлопковая эмболия, эмболия йодированным маслом, цементная эмболия. При этих эмболиях возникают разнообразные симптомы.
На основании изложенного можно заключить, что при нетромботической эмболии нет определенной клинической картины. Эмболия может быть вызвана разными веществами и проявляется широким спектром клинических симптомов, поэтому трудно установить диагноз. Гемодинамические нарушения при нетромботической эмболии характеризуются средней степенью тяжести (кроме жировой и воздушной эмболии). Лечение — поддерживающее, зависит от вида эмболии и тяжести течения.


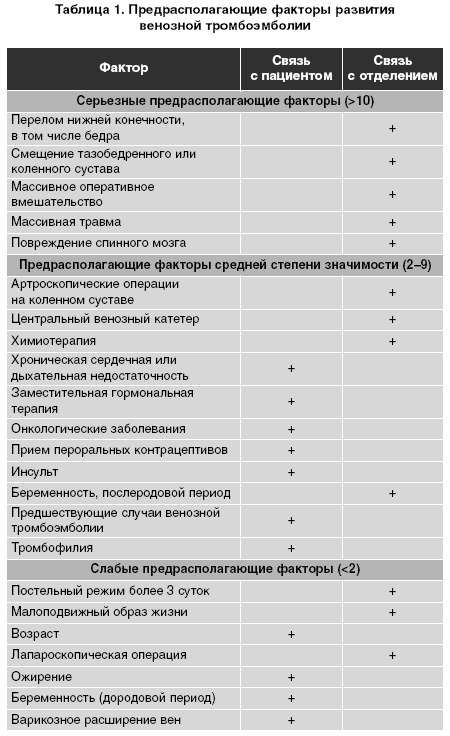
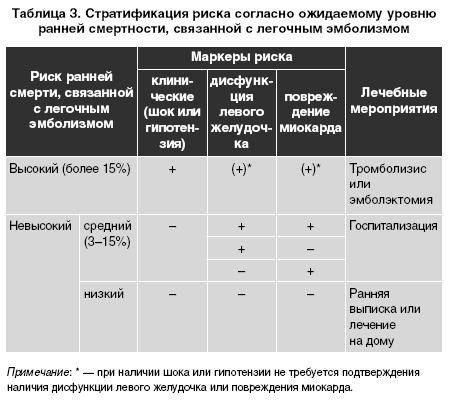
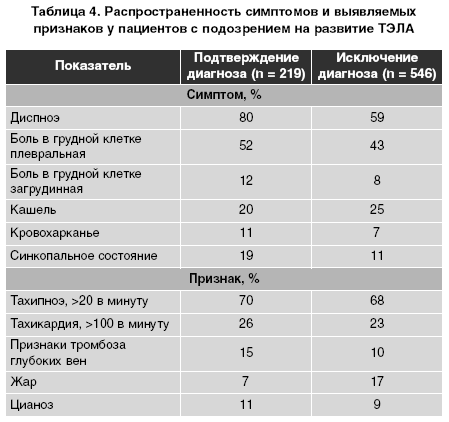
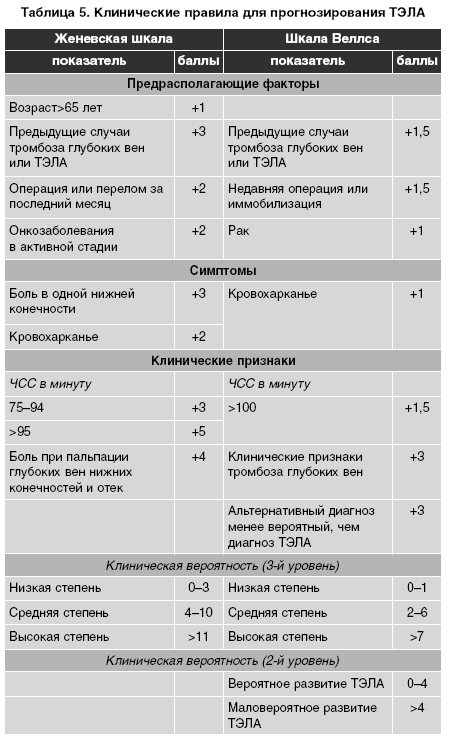
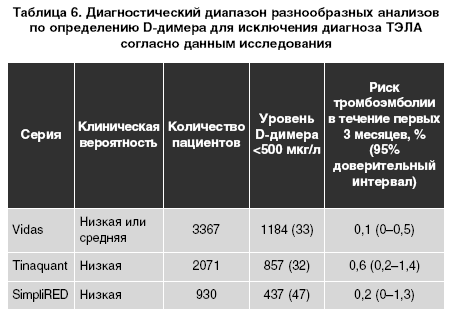
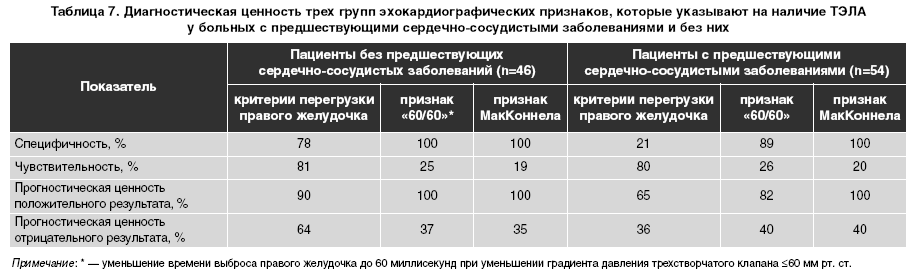
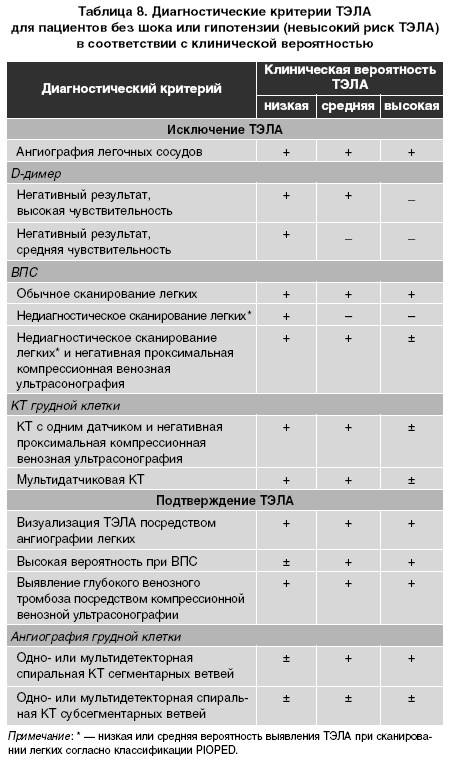
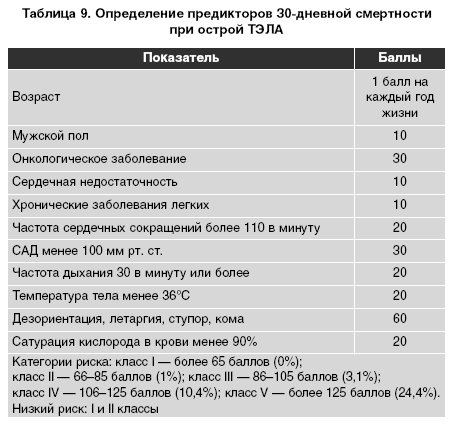

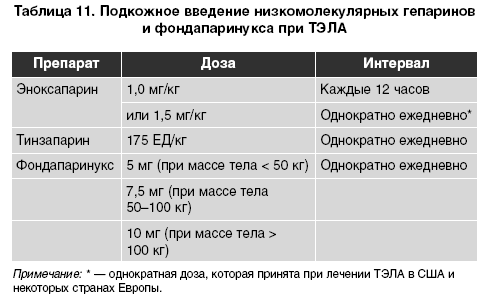






Комментировать