Диабетическая автономная невропатия. Результаты проведенных исследований.
Строков И.А., Зилов А.В., Альбекова Ж.С., Фокина А.А.
Диабетическая автономная невропатия (ДАН) чаще возникает при сахарном диабете (СД) 1 типа, может являться причиной смерти больных, играть значительную роль в нарушении трудоспособности и снижении качества жизни больных [1]. Клинические проявления ДАН многообразны и проявляются кардиоваскулярными, гастроинтестинальными, урогенитальными и нарушениями функции потоотделения. У многих больных СД можно выявить нарушение зрачковых реакций; гастроинтестинальную патологию в виде гастропареза, синдрома замедления перистальтики кишечника; гипотоничный мочевой пузырь с нарушением мочеиспускания; нарушение функции потовых желез с гипо– и ангидрозом кожи ног в дистальных отделах; эректильную дисфункцию.
Кардиоваскулярная автономная невропатия (КАН) выявляется наиболее рано у больных СД и может быть субклинической, т.е. проявляться только при проведении специальных тестов. Под КАН понимают нарушение автономного контроля над кардиоваскулярной системой [2]. Частота выявления КАН широко варьирует в многочисленных исследованиях, что определяется используемыми критериями диагностики, возрастом больных и длительностью течения СД [3].
«Золотым стандартом» клинического выявления ДАН считается исследование кардиоваскулярных рефлексов, имеющих высокую чувствительность, хорошую воспроизводимость и, что очень важно, относящихся к безопасным неинвазивным методам. Наиболее часто используется исследование вариабельности сердечного ритма по R–R– интервалам в покое и при пробе с глубоким дыханием, которая имеет специфичность для выявления ДАН около 80%. Тест с глубоким дыханием P.J. Dyck включил в диагностику автономного вовлечения при диабетической полиневропатии (ДПН)[4,5].
ДАН может быть клинически представлена как нарушениями автономной регуляции во многих органах и системах – синдром пандизавтономии, так и проявляться дисфункцией автономной иннервации только в каком–либо одном органе или одной системе – изолированная (селективная) автономная невропатия. Легкие нарушения в кардиоваскулярной системе могут проявляться только изменениями вариабельности сердечного ритма, а в тяжелых случаях развивается ортостатическая артериальная гипотония, иногда с повышением АД в положении лежа, и может нарушаться суточный ритм АД (повышение АД в ночное время). ДАН манифестирует с дисфункции одного или нескольких органов, почти всегда сочетается с сенсорной или сенсорно–моторной ДПН, однако может быть и изолированной, часто предшествуя развитию других осложнений. По данным литературы, вовлечение в патологический процесс автономной нервной системы при СД обнаруживается в 20–40% случаев. В среднем у больных СД 1 типа ДАН выявляется в 16,7% случаев.
Для исследования распространенности ДАН у больных СД 1 типа нами обследованы пациенты, находившиеся на стационарном лечении в отделении диабетологии и общей эндокринологии университетской клиники № 2 МГМУ имени И.М. Сеченова. В группу обследования включались все пациенты с СД 1 типа независимо от наличия или отсутствия ДПН. Всего обследовано 120 пациентов с СД 1 типа (62 мужчины и 58 женщин). Возраст пациентов в среднем составил 31,5±10,7 (от 18 до 67) лет. Средняя длительность заболевания – 12,5±10,1 лет (от впервые выявленного СД до течения СД на протяжение 43 лет).
Стадии ДПН определяли по P.J. Dyck [8]. Пациенты без диабетической полиневропатии обозначались, как ДПН–0. Больные, имевшие ДПН (по данным ЭМГ и QAT (количественное автономное тестирование) и допустимые 2–4 балла по шкале NIS LL, но не предъявлявшие каких–либо невропатических жалоб, относились к стадии ДПН–1. К стадии ДПН–2 относили больных с ДПН, у которых выявлялись изменения при объективном обследовании, имелся неврологический дефицит по шкале NIS LL>2 баллов и имелась типичная позитивная невропатическая симптоматика. В том случае, если ДПН вызывала нарушение социальной и/или трудовой адаптации, устанавливалась стадия ДПН–3.
Количественное автономное тестирование осуществляли на аппарате CASE IV (США). По R–R интервалам определяли вариабельность сердечного ритма при пробе с глубоким дыханием. У здоровых людей ЧСС изменяется соответственно изменениям частоты дыхания: она возрастает на вдохе и понижается на выдохе. Этот феномен называется респираторной аритмией (дыхательные волны). Максимальное значение подобных изменений достигается, когда частота вдоха и выдоха составляет около 6 в мин. Респираторная аритмия контролируется парасимпатическими влияниями, при развитии ДАН ее выраженность снижается или она полностью исчезает. За одну минуту должно быть произведено 6 глубоких вдохов и 6 глубоких выдохов. Определялось соотношение максимально удлиненного кардиоинтервала R–R во время выдоха к максимально укороченному интервалу R–R во время вдоха. Прибор автоматически проводил сравнение полученных результатов с данными обследования когорты здоровых людей того же возраста. 5%–е лимиты эталонных значений в перцентилях использовались для диагностики наличия автономной кардиальной невропатии. Выявление изменений более 95 или менее 5 перцентилей свидетельствует о наличии автономной нейропатии.
Для статистической обработки данных использован пакет прикладных статистических программ (PASW Statistics, версия 18, для ОС Windows, SPSS Inc.). Интервальные показатели представлены в виде «среднее ± стандартное отклонение», а также в виде «медиана; межквартильный размах». Проверка на нормальность осуществлялась при помощи критерия Шапиро–Уилка. В случае нормального распределения для сравнения групп использован критерий Стьюдента, в случае отклонения от нормального распределения – критерий Манна–Уитни. Значимыми во всех случаях считались различия при р<0,05.
Проведенное когортное исследование 120 больных СД 1 типа показало значительную распространенность ДПН, составившую 68,3% (n=82), причем наиболее часто стадии ДПН–2 и ДПН–3 выявлялись у больных с течением СД более 10 лет. Нарушение автономного контроля деятельности сердца при пробе с глубоким дыханием в общей группе выявлено у 24,2% больных; среднее значение для всех обследуемых пациентов составило 40,7±30 перцентилль.
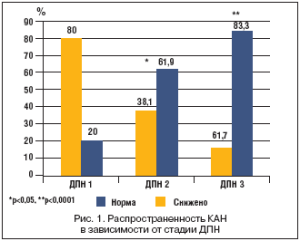
Проведен анализ зависимости выявления КАН от выраженности ДПН (рис. 1). При ДПН–0 не выявлено изменения автономной кардиоиннервации и среднее значение вариабельности ЧСС составляло 59,4±21,3 перцентилль. При ДПН–1 медиана составляла 45,6±25,5 перцентилль, изменения автономной иннервации выявлены у 11 (20%) больных. В группе ДПН–2 медиана составляла 28,5±36,1 перцентилль, нарушения обнаружены у 13 (61,9%) больных. При ДПН–3 отмечена самая низкая медиана – 2,4±2,4 перцентиль, изменения вариабельности сердечного ритма выявлены у 5 (83,3%) больных. При проведении статистической обработки полученных результатов выявлены достоверные различия между суммой перцентилль при количественном автономном тестировании между группой ДПН–1 и группой ДПН–3 (p<0,0001), между группой ДПН–1 и группой ДПН–2 (p<0,05). Результаты исследования вариабельности сердечного ритма показывают, что вовлечение в патологический процесс автономных кардиальных нервных волокон протекает параллельно с формированием более тяжелого поражения соматических нервов.
Клинические симптомы ДАН появляются не сразу после верификации диагноза СД. Субклинические проявления автономной дисфункции можно обнаружить при СД 1 типа примерно через 2 года при отсутствии идеального контроля гликемии [6,7]. В нашем исследовании изменения автономной кардиоиннервации возникали уже на субклинической стадии ДПН–1 (20% больных), усугублялись при стадии ДПН–2 (61,9%), а при ДПН–3 обнаруживались у 83,3% больных. Исследование автономной иннервации при пробе с глубоким дыханием должно включаться в обязательные исследования у больных СД, тем более, что выявление наличия ДАН ухудшает прогноз в отношении продолжительности жизни больных [1].
Патогенетическая терапия неврологических осложнений СД, к которым относится ДАН, в основе которой лежит поражение постганглионарных автономных структур, основана на современных представлениях о биохимических и молекулярных механизмах клеточной патологии при СД. Согласно общепринятой точке зрения основную роль в развитии метаболических нарушений в клетках различных органов играет оксидативный стресс [8,9]. В митохондриях образуется большое количество свободных радикалов, в том числе и супероксида. Супероксид приводит к нарушению структуры ДНК митохондрий, что вызывает активацию регенеративного энзима – PARP (poly–(ADP–ribose–)polymerase), ингибирующего ключевой гликолитический фермент GAPDH (glyceraldehyde 3–phosphate dehydrogenase). Блокада обмена глюкозы ведет к накоплению промежуточных продуктов метаболизма глюкозы фруктозо–6–фосфата и глицеральдегид–3–фосфата.
При гипергликемии происходит активация полиолового пути обмена глюкозы с истощением содержания такого важного антиоксидантного фермента, как восстановленный глутатион. Накопление фруктозо–6–фосфата за счет действия фермента глутамина вызывает гиперпродукцию эндотелина–1, трансформируемого фактора роста β и ингибитора активации плазминогена–1, что проявляется нарушением кровотока в системе микроциркуляции. Накопление глицеральдегид–3–фосфата опосредованно, через активацию протеинкиназы С, увеличивает транскрипцию ядерного фактора каппа В (NFkB), уменьшает эндотелиальную синтетазу окиси азота, вызывает увеличение продукции эндотелина–1. Важным для развития клеточной патологии является влияние глицеральдегид–3–фосфата на увеличение в цитоплазме клеток метилглиоксаля, который реагирует со свободными аминогруппами белков, приводя к образованию конечных продуктов избыточного гликирования (AGEs — advanced glycation endproducts). AGEs ответственны за формирование клеточной дисфункции, развитие воспалительных процессов и патологии сосудистой стенки.
Таким образом, при СД основную роль в развитии клеточной патологии играют метаболические нарушения, обусловленные гипергликемией. Изменения в системе микроциркуляции возникают в результате нарушений углеводного обмена, однако при формировании стойких изменений эндотелия и сосудистой стенки, сосудистые нарушения и связанная с ними ишемия и гипоксия играют самостоятельную роль в появлении и прогрессировании гибели клеток различных структур (сетчатка, почки, соматические и автономные нервы). P.J. Dyck показал, что имеется корреляция между числом нервных волокон в периферическом нерве и толщиной стенки эндоневральных сосудов при СД, и таким образом сосудистый компонент является одним из ведущих в развитии диабетической дистальной симметричной сенсорно–моторной полиневропатии (ДПН) [10].
Антиоксиданты в течение многих лет успешно используются для лечения ДПН в связи с основным механизмом их действия – уменьшением оксидативного стресса [12]. В частности, изучение эффективности альфа–липоевой кислоты (АЛК) в отношении диабетической автономной кардионевропатии показало, что антиоксиданты улучшают состояние кардиоиннервации. Выявлено достоверное увеличение вариабельности сердечного ритма в группе АЛК по сравнению с группой плацебо (p<0,05). Частота побочных эффектов в группах достоверно не отличалась [11].
Недавно проведенное двойное слепое плацебо контролируемое исследование эффективности Актовегина при дистальной периферической полинейропатии, проведенное в рамках (GCP – Good Clinical Practice (Надлежащей Клинической Практики) положительно ответило на вопрос об эффективности и безопасности применения препарата для лечения ДПН. Были сделаны выводы, что последовательная внутривенная, а затем пероральная терапия Актовегином в течение 160 дней улучшила симптомы невропатии, снизила порог вибрационной чувствительности и улучшила сенсорную функцию у пациентов с СД 2 типа и диабетической полиневропатией. Показано значимое улучшение качества жизни (по шкале психического здоровья) в группе Актовегина по сравнению с плацебо. Отмечено, что группы пациентов, получавших Актовегин и плацебо, имели сравнимый профиль безопасности.
Актовегин потенциально является эффективным препаратом для лечения диабетической автономной невропатии, в частности, кардионевропатии, т.к. помимо антиоксидантного действия обладает уникальной способность улучшать вхождение кислорода в клетку, уменьшая проявления гипоксии [13]. Препарат улучшает выживаемость нейронов в условиях острой и хронической гипоксии за счет улучшения внутриклеточного метаболизма. Помимо этого, результатами последних экспериментальных исследований продемонстрировано, что Актовегин уменьшает клеточный апоптоз, уменьшая активность каспазы–3 и обладает дозозависимым эффектом в отношении увеличения количества синаптических связей [14]. Таким образом, в настоящее время, необходимо проведение новых исследований, подтверждающих эффективность препарата при лечении симптомов автономной диабетической невропатии в широкой клинической практике.
Литература
1. Vinic A., Ziegler D. Diabetic cardiovascular autonomic neuropathy // Circulation – 2007 – Vol.115 – P.387–397.
2. Tesfaye S., Boulton A.J.M., Dyck P.J. et al. Diabetic Neuropathies: update on definitions, diagnostic criteria, estimation of severity, and treatment // Diabetes Care – 2010 – Vol.33 – P.2285–2293.
3. Low P.A., Benrud–Larson L.M., Sletten D.M. et al.Autonomic symptoms and diabetic neuropathy: a population–based study // Diabetes Care – 2004 – Vol.27 – P.2942–2947.
4. Dyck P.J., Kratz К.М., Karnes J.L. et al. The prevalence by staged severity of various types of diabetic neuropathy, retinopathy, and nephropathy in a population–based cohort. The Rochester Diabetic Neuropathy Study Neurology 1993;43:817–30.
5. Dyck P.J., Litchy W.J., Lehman K.F. et al.Variables influencing neuropathic endpoints: the Rochester Diabetic Neuropathy Study of Healthy Subjects. // Neurology. – 1995. – Vol. 45. – №6. – Р.1115–1121.
6. Boulton A. J.M., Malik R. A., Arezzo J. C., Sosenco J. M. Diabetic Somatic Neuropathies. //Diabetes Care – 2004 – Vol.27 – P.1458–1486.
7. Vinik A.I., Erbas T. Recognizing and treating diabetic autonomic neuropathy. // Clev Clin J Med – 2001 – Vol.68 – P. 928–944.
8. Brownlee M. Biochemistry and molecular cell biology of diabetic complication // Nature, 2001;414: 813–820.
9. Brownlee M. The pathobiology of diabetic complications. A unifying mechanism. // Diabetes, 2005; 54: 1615–1625.
10. Dyck P.J., Thomas P.K. Diabetic neuropathy, 2nd ed., Philadelphia: W.B. Saunders – 1999. – P.481–503.
11. Ziegler D., Reljanovic M., Mehnert H. et al. α–Lipoic acid in the treatment of diabetic polyneuropathy in Germany: Current evidence from clinical trials // Exp.Clin. Endocrinol Diabetes– 1999 – Vol. 107 – P. 421–430.
12. Ziegler D., H.–J. Tritschler, Строков И.А., Аметов А.С. Лечение диабетической полиневропатии тиоктовой кислотой (обзор литературы) // Фарматека – 2008 – №17 – стр.28–35.
13. Buchmayer F., Pleiner J., Elmlinger M.W. et al.Actovegin®: A biological drug for more than 5 decades // Wiener Medizinische Wochenschrift –2011 – Vol.161 – P.80–88.
14. Elmlinger M.V. et al. Neuromolecular Med Neuromol Med DOI 10.1007/s12017-011-8157-7 (2011).






Комментировать