Обзор на рекомендациях международных консенсусов по проблеме синдрома поликистозных яичников (СПКЯ), определивших современную тактику ведения больных при СПКЯ, в том числе в случаях его сочетания с другими эндокринопатиями: Международного ESHRE/ARSM консенсуса по проблеме определения критериев синдрома поликистозных яичников (Роттердам, 2003), Международного консенсуса по определению ультразвуковых критериев поликистозных яичников (2003), Рекомендациях 1-го Всемирного конгресса по инсулинорезистентности (Лос-Анджелес, 2003), Международного ESHRE/ARSM консенсуса по лечению бесплодия при синдроме поликистозных яичников (Тессалоники, 2007). Необходимость этапного лечения пациенток коррекции гормональных и эндокринных нарушений с момента установления диагноза, нормализации менструального цикла, при необходимости дополняемого терапией эндокринного бесплодия.
Сафина М.Р., Лобачевская О.С., Елинская Н.А.
Городская гинекологическая больница, Минск, Комитет по здравоохранению Минского горисполкома
Обзор основан на рекомендациях международных консенсусов по проблеме синдрома поликистозных яичников (СПКЯ), определивших современную тактику ведения больных при СПКЯ, в том числе в случаях его сочетания с другими эндокринопатиями: Международного ESHRE/ARSM консенсуса по проблеме определения критериев синдрома поликистозных яичников (Роттердам, 2003), Международного консенсуса по определению ультразвуковых критериев поликистозных яичников (2003), Рекомендациях 1-го Всемирного конгресса по инсулинорезистентности (Лос-Анджелес, 2003), Международного ESHRE/ARSM консенсуса по лечению бесплодия при синдроме поликистозных яичников (Тессалоники, 2007). Акцент делается на необходимости этапного лечения пациенток коррекции гормональных и эндокринных нарушений с момента установления диагноза, нормализации менструального цикла, при необходимости дополняемого терапией эндокринного бесплодия.
Со времени первого описания (Штейн Левенталь, 1935) оценка синдрома поликистозных яичников (СПКЯ) сменилась как с позиции эпидемиологической распространенности, так и с позиции социальной значимости. Из категории редкой спорадической патологии, которой занимались гинекологирепродуктологи, синдрома поликистозных яичников перешел в разряд самой распространенной эндокринопатии у женщин: его частота у женщин фертильного возраста составляет 3-10% [8, 27].
Синдром поликистозных яичников является серьезной проблемой общесоматического здоровья, определяющей репродуктивный потенциал молодых женщин, а также риски развития сердечнососудистой патологии, злокачественных заболеваний.
В Роттердаме (2003) объединенная рабочая группа ESHRE/ASRM специалистов двух континентов разработала новое определение, новые критерии синдрома поликистозных яичников и тактику междисциплинарного подхода, вошедшие в медицинскую практику под названием «Роттердамский консенсус по СПКЯ» [40].
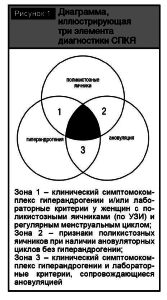
По определению синдром поликистозных яичников представляет собой синдром овариальной дисфункции, к специфическим проявлениям которого относятся гиперандрогения и поликистозная морфология яичников, устанавливаемая при ультразвуковом исследовании. Патология внесена в МКБ 10-го пересмотра в раздел «Эндокринные болезни» (Е 28,2) и требует исключения других проявлений гиперандрогении, которые могут развиваться с подобной синдрому поликистозных яичников симптоматикой. Консенсус выделил три критерия, позволяющих верифицировать диагноз синдром поликистозных яичников при наличии хотя бы двух из трех симптомокомплексов.
- Наличие менструальной дисфункции в виде нерегулярных месячных и/или хронической ановуляции как основного симптома. При этом могут наблюдаться как классические нарушения цикла в виде олигоменореи (у 50%) и аменореи (у 20%), так и абсолютно регулярные по ритму менструации на фоне ановуляторных циклов (незрелости фолликулов) у 30% больных [9]. Также установлено, что у некоторых пациенток они могут перемежаться с овуляторными циклами. Например, при отсутствии симптомов инсулинорезистентности и гиперинсулинемии у больных с типичными ультразвуковыми критериями ПКЯ и гиперандрогении могут встречаться овуляторные циклы.
Ановуляция приводит к нарушениям менструального цикла и бесплодию эндокринного генеза (у 94% пациентов [1]), гиперплазии эндометрия (у 32,5% [24]) и дисфункциональным кровотечениям.
- Гиперандрогения с клиническими проявлениями в виде патологического оволосения в андроген-зависимых зонах туловища, лица и конечностей (гирсутизма), простых угрей (acnevulgaris), алопеции. При клинических признаках гирсутизма, которые базируются на оценке патологического оволосения по шкале Ферримана Голлвея, не требуется лабораторная верификация гиперандрогении. Акне синоним хронического рецидивирующего фолликулита, а себорея представляет собой кожные изменения, обусловленные гиперфункцией сальных желёз. Лабораторное тестирование проводится с целью исключения других заболеваний надпочечников (гиперкортицизма, врожденной гиперплазии коры надпочечников, вирилизирующей опухоли). Лабораторные критерии гиперандрогении включают уровни тестостерона > 70 ng/dl, андростендиона > 245 ng/dl, ДГЭАсульфата >248 ng/dl.
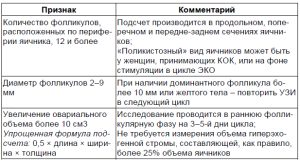
- Морфологическая (ультразвуковая) верификация овариального поликистоза (табл. 1). Ультразвуковые признаки поликистоза в произвольной популяции женщин 18-42 лет вне зависимости от наличия клинических проявлений были обнаружены в 21-22% случаев [12, 21]. Интерпретация и окончательное заключение по этому критерию выносится клиницистом в совокупности с клинической оценкой менструальной и репродуктивной функции пациентки. Авторы консенсуса подчеркнули важность проведения исследования на 3-5-й день цикла для установления реального увеличения объема яичников, обязательного измерения в максимальном сечении всех трех линейных размеров каждого яичника.
Таблица 1 Ультразвуковые критерии СПКЯ (определение Международного консенсуса [10, 34])
Синдром поликистозных яичников отличается большой вариабельностью конкурентных клинических проявлений и биохимических лабораторных изменений (рис. 1). Согласно консенсусу, диагноз правомочно выставлять и при неполной триаде признаков, при наличии характерных сонографических изменений в сочетании с перечисленными клинико-лабораторными симптомами. В 20-м веке синдром поликистозных яичников диагностировался на фоне длительно существующих гормональных и метаболических нарушений, которые вторично приводили к поликистозным морфологическим изменениям в яичниках и формировали «классическую» форму СПКЯ. Многообразие различных клинических проявлений связано также с тем, что СПКЯ стал диагностироваться у пациенток в более молодом возрасте, когда полный классический спектр симптомов еще не сформирован.
Роттердамским консенсусом закреплено положение, согласно которому диагноз синдром поликистозных яичников требует исключения других эндокринопатий. Особое внимание должно уделяться сочетанию гиперпролактинемии с СПКЯ, которое выявляется у 30% пациентов [20, 37]. Первоначально должна быть выявлена и откорректирована гиперпролактинемия, что обеспечивает лучшую эффективность терапии бесплодия.
Основные патогенетические нарушения в развитии синдрома генетические и приобретенные гормональные изменения [3, 23, 26, 31]. Изучается генетическая предрасположенность к СПКЯ, предположительно ассоциированная с генами, определяющими стероидный синтез (CYP11A, CYP17), инсулиновыми рецепторами, фоллистатин кодирующим геном и др. В патогенезе выделяются:
- Нарушение гипоталамо-гипофизарной деятельности, вызывающее дисфункцию ГнРГ и ЛГ (гипоталамический синдром, аденомы гипофиза).
- Первичные ферментные нарушения яичникового стероидогенеза: 1) повышение активности фермента 17-альфа гидроксилазы, ведущей к гиперсекреции дегидроэпиандростерона (ДГЭА) и андростендиона; 2) или недостаточность 17бета гидроксистероиддегидрогеназы, превращающей андростендион в тестостерон и эстрон в эстрадиол.
- Избыточная продукция надпочечниковых андрогенов в период препубертата (YenS., 1994): периферическая конверсия андрогенов в эстрон стимулирует секрецию ЛГ и подавляет выработку ФСГ. ЛГ вызывает избыточную секрецию яичниковых андрогенов, а недостаток ФСГ препятствует адекватному развитию фолликулов. Анаболический эффект адрогенов приводит к ускоренному физическому развитию, избыточной массе тела, проявляющейся уже в период препубертата.
- Метаболические нарушения инсулинорезистентность и гиперинсулинизм являются центральными в патофизилогии синдрома поликистозных яичников [29]. Рецепторы к инсулину выявлены как в гипофизе, так и в яичниковой ткани (YenS., 1994). Избыток инсулина стимулирует секрецию ЛГ в аденогипофизе и повышает его пульсовую амплитуду. Связываясь с рецепторами инсулиноподобного фактора роста, он усиливает продукцию андрогенов текаклетками яичников.
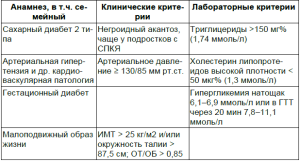
Роттердамский консенсус определил ведущую патофизиологическую роль инсулинорезистентности в развитии синдрома поликистозных яичников. Выраженное снижение (в среднем на 50%) чувствительности периферических тканей (печени, жировой, мышечной ткани) к инсулину при СПКЯ выявляется в 2-3 раза чаще, чем в общей популяции [3]. Это явление универсальное, вне зависимости, полная женщина или худая [29]. Рефрактерность к инсулину ведет к компенсаторной гиперинсулинемии и последующему развитию метаболического синдрома. На 1-м Всемирном конгрессе по инсулинорезистентности (Лос-Анджелес, 2003) разработаны рекомендации по критериям диагностики этого синдрома (табл. 2).
Таблица 2 Критерии инсулинорезистентности для женщин [4]
При синдроме поликистозных яичников повышается риск развития сердечно-сосудистых заболеваний, поэтому актуальна проблема лечения пациенток старшей возрастной группы. Кардиоваскулярные нарушения при СПКЯ происходят в связи с развитием следующих регуляторных механизмов:
- эндотелиальная дисфункция вследствие нарушения регуляции инсулином синтеза нитрида азота и последующего нарушения N0регулируемой вазодилатации [35, 38];
- повышение уровня эндотелина-1 (маркёра васкулопатии) [18];
- повышение уровня провоспалительных и атерогенных маркёров (СРБ3, ингибитора-1 активатора плазминогена), снижение фибринолитической активности [19].
- Указанные механизмы причина раннего развития гипертензии у пациентов с СПКЯ (риск развития в 3 раза выше, чем при отсутствии СПКЯ) и инфаркта миокарда (риск выше в 4-7 раз) [7, 14, 17].
Диагностика
Семейная предрасположенность к наследованию заболевания позволяет наиболее рано диагностировать СПКЯ с привлечением семейного врача, гинеколога, терапевта, эндокринолога, детского гинеколога.
Симптомы синдрома поликистозных яичников можно распознать через 2-3 года после менархе. Типичная ошибка в ведении пациенток молодого возраста несвоевременное начало патогенетической терапии под предлогом, что нет бесплодия, проблем с зачатием, нет половой жизни и т.д.
Существует прямая корреляция между ультразвуковыми и гистопатологическими признаками синдрома поликистозных яичников: выявляется повышенное число фолликулов, гипертрофия и лютеинизация клеток ‘^воа-Мвта и утолщение белочной оболочки.
Дополнительно при сонографии у 35-42% пациенток выявляются признаки гипоплазии матки [2].
Толщина эндометрия зависит от его морфофункционального состояния в связи с различным уровнем продукции эстрогенов: у 61% больных ширина Мэхо была меньше нормы, у 12% соответствовала гиперплазии эндометрия и лишь у 27% была близкой к нормальным значениям [2]. Патогенетическим звеном генитальной дисфункции может быть также повышенная резистентность маточных сосудов вследствие прямого сосудосуживающего эффекта андрогенов на сосудистую стенку и ее фиброзирования [5].
Гормональные изменения при синдроме поликистозных яичников.
У 95% пациенток выявляется нарушение соотношения ЛГ/ФСГ (так называемый «гонадотропный индекс») это базовый признак синдром поликистозных яичников Абсолютное повышение уровня ЛГ (более 10 МЕ/л) происходит за счет увеличения амплитуды и/или учащения выброса гормона в системный кровоток с повышением ЛГ/ФСГ > 2.
У 30% пациенток с синдром поликистозных яичников умеренно повышен уровень пролактина, особенно в позднюю фолликулиновую и лютеиновую фазы менструального цикла [20, 37]. Умеренная гиперпролактинемия и повышение ЛГ могут быть вызваны снижением тормозящего допаминового влияния [20, 28, 37].
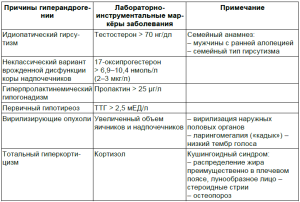
Проведение исследования андрогенов как свободного тестостерона, так и надпочечниковых (ДГЭА сульфата, 17-оксипрогестерона) целесообразно с целью установления «безгирсутной» формы СПКЯ (асимптоматической гиперандрогении). Роттердамским консенсусом закреплено положение о том, что диагноз синдром поликистозных яичников требует исключения других известных форм заболеваний, которые проявляются универсальными признаками гиперандрогении (табл. 3).
Таблица 3 Дифференциальный диагноз СПКЯ с другими причинами гиперандрогении
Ожирение не считается диагностическим критерием СПКЯ. Нарушение жирового обмена (ИМТ > 25 27 кг/м2) выявляется не менее чем у 35-50% больных [24]. Оценка метаболических нарушений необходима и при наличии семейных факторов риска (СПКЯ у близких родственниц, сахарный диабет типа 2). При повышенной массе тела 31% больных с синдромом поликистозных яичников имеют положительный глюкозо-толерантный тест, 7,5% сахарный диабет [32]. При ожирении также снижается уровень полового гормон-связывающего глобулина (ПГСГ), что поддерживает циркуляцию активного тестостерона в крови.
У пациенток репродуктивного возраста основной причиной бесплодия являются указанные нарушения гормонального статуса, ведущие к ановуляции.
Стратегия терапии СПКЯ
- раннее распознавание симптомов СПКЯ;
- изменение образа жизни, отказ от курения;
- нормализация массы тела с использованием аэробных физических нагрузок и сбалансированной диеты;
- скрининг на сахарный диабет, коррекция инсулинорезистентности;
- коррекция гормональных нарушений (гиперсекреции ЛГ, гиперандрогении, гиперпролактинемии) и нарушений менструального цикла;
- стимуляция овуляции;
- коррекция дислипидемии, контроль атерогенных маркёров;
- хирургические методы лечения (лапароскопическая диатермопунктура, демедулляция яичников).
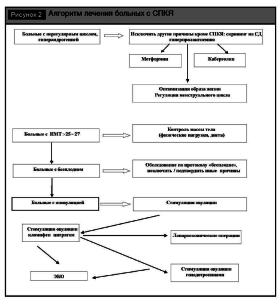
Терапия СПКЯ, как и других эндокринопатий, проводится на протяжении всей жизни женщины (рис. 2).
Отказ от лечения в связи с отсутствием половой жизни или сохранением регулярных менструаций при наличии других критериев синдрома поликистозных яичников приводит к развитию более выраженных морфологических изменений яичников. У молодых женщин основная задача терапии наиболее раннее воздействие на гормональные нарушения, приводящие к гиперандрогении и гирсутизму. С этой целью используются ингибиторы продукции андрогенов (оральные контрацептивы, аналоги ГнРГ), периферические блокаторы андрогенов (ципротерон ацетат, спиронолактон и др.). Своевременно должна быть начата терапия гиперпролактинемии. Агонисты допамина (каберголин) и инсулин-сенситайзеры (метформин) также снижают продукцию андрогенов. Менструальный цикл нормализуется оральными контрацептивами.
При бесплодии у больных с СПКЯ основной задачей является индукция овуляции с помощью непрямых стимуляторов (кломифена цитрата), у кломифенрезистентных пациенток с помощью препаратов ФСГ с добавлением препаратов ХЧГ (гонадотропин хорионический HCG). Если консервативная терапия неэффективна, показана лапароскопия с диатермопунктурой (электрокаутеризацией) или демедулляцией яичников. Клиновидная резекция яичников проводится крайне редко в связи с возможным снижением овариального резерва и развитием спаечного процесса. При неэффективности гормональных методов лечения бесплодия применяются репродуктивные технологии (ЭКО).
В позднем репродуктивном периоде уменьшается объем яичников и число фолликулов, однако нарастает риск экстрагенитальных кардиоваскулярных заболеваний, рака и гиперплазии эндометрия [6]. На этом этапе важнейшими задачами являются коррекция дислипидемии, контроль атерогенных маркеров и нормализация гормональных отклонений, способствующих развитию гиперпластических процессов.
Изменение образа жизни. Регулярная физическая активность в сочетании со сбалансированной диетой обеспечивает более долгосрочное снижение массы тела. Диетологи рекомендуют гипокалорийное питание (не более 1500 ккал в сутки) с преимуществом протеиновой диеты перед иными вариантами. Уменьшение веса на 5% и более от исходного приводит к восстановлению регулярных менструаций и овуляторных циклов [29].
Применение инсулин-сенситайзеров. Метформин при синдроме поликистозных яичников применяется более 10 лет [11]. При наличии клинических признаков инсулинорезистентности и повышении толерантности к глюкозе (уровень Hgb A1c > 6,5) рекомендуется назначение метформина в дозах 5001000 мг в сутки в течение 6-12 месяцев (препарат следует принимать с началом приема пищи). Он снижает уровень инсулина, но не вызывает значительных изменений ИМТ или ОТ/ОБ [33].
При СПКЯрекомендуется следующий режим дозирования [3]:
1-я неделя: метформин 500 мг (1/2 таблетки) вечером;
2-я неделя: метформин 500 мг (1/2 таблетки) 2 раза в день;
3-я неделя: метформин 500 мг (1/2 таблетки) 3 раза в день.
В рандомизированных мультицентровых исследованиях было показано, что частота восстановления овуляторных циклов при синдроме поликистозных яичников на фоне метформина сопоставима с уровнем, достижимым при снижении массы за счет изменения образа жизни [16]. Метформин патогенетически влияет на восстановление нормальных гормональных параметров (снижение уровня инсулина, ИФР-1, тестостерона, андростендиона, ЛГ, повышение уровня половых стероидов связывающего глобулина (ПССГ), ИФР-1 связывающего белка, улучшение показателей липидного обмена) и клинических проявлений синдрома (восстановление менструального цикла, улучшение результативности индукции овуляции, уменьшение степени гирсутизма) [40].
Допамин и его агонисты способствуют снижению ЛГ секреции и уровня андрогенов у пациентов как с повышенным, так и с нормальным уровнем пролактина [30, 36]. Умеренная гиперпролактинемия у пациентов с синдромом поликистозных яичников это уже показание для назначения каберголина (Достинекса). Являясь длительно действующим агонистом D2 допаминэргических рецепторов, он позволяет назначать удобные режимы приема и минимальные дозы и достигать быстрого результата. В отличие от бромокриптина он практически не вызывает побочных эффектов. Каберголин снижает уровень пролактина при использовании интермиттирующего режима в дозах 0,5 мг (1/2 или 1 таблетка в неделю, под лабораторным контролем 1 раз в месяц). Применение каберголина также нормализует уровень ЛГ и андрогенов (Т, А, ДГЭАС, 17-ОП) у больных с СПКЯ [20, 30, 36]. Своевременное лечение при исходной гиперпролактинемии восстанавливает цикличность менструации и овуляторные циклы у 70% больных без применения других методов стимуляции [37]. Тем самым предотвращается потеря времени в лечении бесплодия. Исследование PapaleoE. etal. демонстрирует, что лечение каберголином в стимулированных циклах увеличивает эффективность стимуляции овуляции, уменьшая риск развития синдрома гиперстимуляции яичников [37].
Терапия каберголином влияет также на резистентность маточных сосудов [5]. При ультразвуковом исследовании больных с СПКЯ в рандомизированных исследованиях было показано снижение резистентности маточных сосудов и улучшение перфузии матки, что, по мнению авторов, может улучшить рецепцию эндометрия. Отмечалась прямая корреляция уровня андрогенов и пульсового индекса в маточной артерии.
Регуляция менструального цикла у больных с синдром поликистозных яичников достигается путем назначения комбинированных оральных контрацептивов (ОК) с активным гестагенным компонентом для оказания антипролиферативного воздействия на эндометрий. Патогенетическим механизмом является подавление секреции ЛГ (за счет гестагенного компонента), что препятствует прогрессивному увеличению объема стромальной ткани и всего яичника. Предпочтение отдается ОК с выраженным антиандрогенным компонентом. Эстрогенный компонент поддерживает адекватную трофику яичников и матки, препятствуя развитию гипоплазии и атрофии. Кроме того, эстрогены повышают уровень ПССГ. Во избежание развития синдрома гиперторможения рекомендуется лечение прерывистыми короткими курсами по 4-6 месяцев с контролем овуляции в цикле отмены (reboundeffect).
Лечение бесплодия у больных с СПКЯ определено консенсусом специалистов ESHRE/ASRMв Тессалониках (2007) [16].
Стимуляция овуляции на первом этапе осуществляется нестероидными антагонистами рецепторов эстрогенов. Антиэстроген кломифен цитрат остается препаратом выбора для индукции овуляции у больных с синдромом поликистозных яичников [16], которая достигается по механизму обратной отрицательной связи посредством синтеза гонадолиберина, а затем и повышенной секреции ФСГ. Прогностическими факторами эффективности являются возраст, отсутствие / наличие ожирения, степень выраженности гиперандрогении. Схемы стимуляции овуляции начинаются с применения дозы 50 мг в сутки со 2-го по 5-й дни от начала менструации или индуцированного прогестинами кровотечения (положительный ответ достигается у 52% пациентов). При отсутствии эффекта дозы возрастают до 100 мг в сутки (положительный ответ у 22%) и максимально 150 мг в сутки в последующих циклах [41]. Рекомендаций по срокам перехода на более высокие дозировки нет, но считается, что целесообразно повышать их после 1-2 ановуляторных циклов. Дальнейшее повышение дозы не увеличивает эффективности стимуляции овуляции, которая в целом достигается у 75-80% больных синдром поликистозных яичников. Однако частота зачатия составляет около 22% за цикл, при этом среди всех случаев беременности многоплодная беременность установлена менее чем у 10% пациенток [16]. Прогностически неблагоприятным фактором является толщина эндометрия менее 0,7 см на 22-24-й дни менструального цикла, вне зависимости, был ли он овуляторным или ановуляторным [2].
Новые перспективы стимуляции овуляции связывают с лечением ингибитором ароматазы летрозолом.
Стимуляция овуляции на втором этапе. У 20-25% пациенток наблюдается резистентность к стимуляции кломифен цитратом. Этим женщинам для индукции созревания фолликулов назначаются менопаузальные гонадотропины (пергонал, хумегон) и рекомбинантные ФСГ содержащие препараты (пурегон). Учитывая высокий риск развития СГЯ и необходимость мониторинга развития фолликулов, а также проведения у некоторых пациенток внутриматочной инсеминации, этот этап проводится в специализированных репродуктивных центрах.
Включение каберголина (Достинекса) в схему лечения перед стимуляцией овуляции у больных с СПКЯ и гиперпролактинемией: 1) улучшает эффективность стимуляции овуляции в циклах с кломифеном и длинном протоколе стимуляции овуляции [13]; 2) уменьшает риск гиперстимуляции яичников [25, 37].
Индукция овуляции в цикле ЭКО предлагается пациенткам при отсутствии результативности в указанных схемах и при высоком риске синдрома гиперстимуляции яичников (СГЯ). Включение в протоколы стимуляции агонистов ГнРГ позволяет снизить вероятность развития лютеинизации неовулированного фолликула.
Репродуктивные потери у пациенток с синдромом поликистозных яичников связаны большей частью с гиперсекрецией ЛГ. В циклах ЭКО повышенный уровень ЛГ ассоциирован со сниженной фертильностью (67% против 88% в контроле) [15, 39]; повышенный уровень ЛГ и андрогенов с повышенным риском прерывания беременности на ранних сроках (65% против 12% в контроле) [39]. Супрессия ЛГ агонистами ГнРГ, предшествующая стимуляции овуляции, снижает ранние потери беременности в циклах ЭКО (17,6% против 39,1% в контроле) [39].
Лапароскопические технологии.
Традиционная методика клиновидной резекции яичников вытеснена современными минимальноинвазивными технологиями. Часто используется метод множественного пунктирования яичников с помощью лазера или монополярной диатермии («яичниковый дриллинг»). Не доказано преимущества какой-либо из указанных энергий, однако требуется проведение от 4 до 10 пунктирований каждого яичника (количество зависит от исходного размера яичника). Более множественное воздействие может привести к преждевременному истощению овариального резерва. Эффективна также методика демедулляции стромы яичника.
Показания для направления на лапароскопию:
1) отсутствие эффекта от стимуляции кломифен цитратом;
2) персистирующая гиперсекреция ЛГ;
3) отсутствие возможности мониторирования больных в циклах стимуляции гонадотропинами;
4) наличие иных (трубно-перитонеальных) факторов бесплодия.
Эффективность лапароскопических методов у кломифенрезистентных больных с СПКЯ различна. При отсутствии восстановления овуляторных циклов через 12 недель после вмешательства 50% пациентов после лапароскопии требуется проведение дополнительной терапии кломифен цитратом [16]. Преимущество оперативных технологий в сравнении со схемами стимуляции гонадотропинами заключается в низком уровне многоплодной беременности (относительный риск 0,13; 95% CI), отсутствии риска развития синдрома гиперстимуляции яичников. При этом частота невынашивания статистически не различается в этих группах.
Таким образом, лапароскопические технологии являются альтернативой схемам стимуляции гонадотропинами у кломифен-резистентных пациенток. Однако консенсус по лечению бесплодия у больных СПКЯ не рекомендует применять лапароскопию по иным показаниям кроме бесплодия [16].
ЛИТЕРАТУРА
- Анциферов М.Б., Гринорян Щ.Р., Чернова Т.О.// Пробл. репрод. -2001. № 2. С. 49-55.
- Серова О.Ф., Зароченцева Р.В. // Гинекол. эндо-кринол. -2005. Т.7, № 9.
- Шилин Д.Е. // Фарматека. 2004. №12.С.12-19
- AGE Guidelines for glycemic control: AASE position statement on insulin resistance syndrome // Endocrine practice.2003.Vol.9, suppl. 1. P. 7-19.
- Ajossa S., Paoletti M. et al. // Fertil. Steril. 1999. — Vol. 71, N 2. P. 314-318.
- Alsamarai S., Adams J. et al. // J. Clin. Endocrin. Metab. 2009. N 94 (12). P. 4961-4970.
- American association of clinical endocrinologist position statement on metabolic and cardiovascular consequences of polycystic ovary syndrome // Endocrine Practice. 2005.Vol. 11, N 2.
- Azziz R., Woods K.S. et al. // J. Clin. Endocrin. Metab. 2004. N 89 P. 2745-2749.
- Balen A., Convay G., Kaltsas G. et al. // Hum. reprod. 1995. N 10. P. 2107-2111.
- Balen A., Laven J., Tan S.-L., Devailly D. // Hum. reprod. apdate. 2003.Vol. 3, N 6. P. 505514.
- Barbieri R. // Obstet. Gyn. 2003. -Vol.101, N 4. P. 785-793.
- Botis D., Kasanova D., Pyrgiotis E. et al. // Ultrasound Obstet. Gyn.1995, N 6 P. 182-185.
- Bracero N., Zakur H.A. // Obstet. Gynec. Clin. North Am.2001. 28(1) P. 77-84.
- Christian R.C., Dumestic D.A. et al.// J. Clin. Endocrin. Metabol.2003. Vol. 88 P. 25622568.
- Clifford K. // Gyn. Forum. 1998. -Vol. 3, N 1. P.13-18.
- Consensus on infertility treatment related to polycyctic ovary syndrome // Thessalonicki ESHRE|ASRM sponsored PCOS consensus Workshop Group, 2007.
- Dahlgren E., Janson P. et al. // Acta Obstet. Gyn. Scand. 1992. N 71. P. 599-604.
- Diamanti-Kandarakis E., Spina G. et al.// J. Clin. Endocrin. Metabol.2001. Vol. 86 P. 46664673.
- Ehrmann D.A., Schneider D.J. et al. // J. Clin. Endocrin. Metab.1997. Vol. 82 P. 2108-2116.
- Falashi P., Rocco A. et al. // J. Clin. Endocrin. Metab.-1986. Vol. 62 P. 348-351.
- Farquhar C., Birdsall M., Manning P. et al. //Austral. Zealand. J. Obstet. Gyn. 1994. N 34. P. 67-72.
- Franks S. // J. Clin. Endocrin. Metab. 2006. N 91(3). P. 786-789.
- Franks S., Gharani N. at al. //Hum. reprod. 1997. N 12. -P. 2641-2648.
- Gambienery A., Pelusi C. et al. //Int. J. Obesity Related Metab. Disorders. 2002. N 26. P. 883-893.
- Garcia-Velasko J.A.//Reprod. Biomed. Online. 2009. N 18, suppl. 2 P. 71-75.
- Genuth S., Braunlee M., Kuller L. et al. // Междунар. мед. журн. 2001.№1.
- Hurt R., Hickey M., Franks S.//Best Practic. Research Clin. Obstet. Gyn. 2004. Vol. 18, N 5. P. 671-683.
- Isik A.Z., Gulecli B. et al. //Gyn. Obstet. Invesr. 1997. N43 P. 183-185
- Kawwass J., Loucks T.,Berga S.//Middle East Fertil. Society J. 2010.
- Klibanski A., Beinits I.Z. et al. // J. Clin. Endocrin. Metab.1984. N 58 P. 1141-1147.
- Legro R.S.// Amer. J. Med. 1995. N 98. P. 9
- Legro R.S., Kunselman A., Dodson W. et al. // J. Clin. Endocrin. Metab.1999. N 84. P. 165169.
- Lord J., Flight I., Norman R. // Cochraine Database Syst. Revue. 2003. N 3. P. CD003053.
- Nardo L.G., Buckett W., Khullar V. // Fertil. Steril. 2003. Vol.79. P. 632-633.
- Nestler J.E. // Clin. Endocrinol. Update 2003 Syllabus. 2003. P. 299-303.
- PaolettiA., Cagnacci A. et al. // Fertil. Steril.-1996.- N 66 P. 527-532.
- Papaleo, DoldiN. et al. // Hum. Reproduction. 2001. Vol. 16, N 11. P. 2263-2266.
- Paradici G., Steinberg H.Q. et al.// Circulation. 2001. Vol. 103. P. 1410-1415.
- Regan L., Owen E. et al.// Lancet.1990. N 336. P. 1141-4.
- Rotterdam ESHRE/ARSM sponsored consensus workshop group // Hum. reprod. 2004. Vol.19, N 1. P. 41-47.
- Zain M., Jamaluddin R. et al. // Fertil. Steril. 2009. N 91. P. 514-521.
Данная статья взята из журнала «Медицинские новости», № 2, 2011.














Комментировать