Артериальная гипертензия: разнообразие симптоматических форм и их описание.
Ю.Н.Сиренко
Национальный научный центр «Институт кардиологии им. Н.Д. Стражеско» АМН Украины, Киев
Введение
Артериальная гипертензия (АГ) — наиболее распространенное хроническое заболевание в мире и в значительной мере определяет высокую смертность и инвалидность от сердечнососудистых и цереброваскулярных заболеваний. Приблизительно каждый третий взрослый страдает от этого заболевания. В 2007 г. в Украине официально зарегистрировано более 11 млн больных с АГ, что составляет более 29 % взрослого населения страны. Около 5 % всех больных с АГ имеют определенные формы вторичных АГ, при которых с помощью радикального вмешательства (чаще хирургического) пациент может быть практически излечен. Но и 5 % больных с АГ — это сотни тысяч пациентов в Украине, которых навсегда можно вылечить от этого недуга. К таким формам АГ относится большинство эндокринных гипертензий. Перед врачом, который принимает пациента с синдромом АГ, всегда стоит несколько диагностических вопросов и первый среди них — какая форма АГ у больного — эссенциальная или вторичная? Для построения правильного диагноза АГ необходимо отталкиваться от симптомов, нехарактерных для эссенциальной гипертензии. Для последней присущи: развитие в возрасте между 30-50 годами; медленно прогрессирующее течение, часто бессипмтомный характер болезни до появления поражения органов-мишеней. Толчком для расширенного обследования пациента с АГ должны стать: юношеский и молодой возраст, внезапное начало или ухудшение заболевания, тяжелая АГ—АД >180/120 мм рт. ст., рефрактерный или злокачественный характер течения, наличие любых симптомов, присущих вторичным АГ.
Пациенты со вторичной или симптоматической АГ составляют приблизительно 5-10 % всех больных с повышенным АД, а доля эндокринных АГ в общей популяции больных с АГ по данным разных авторов — 0,2-1 %. По данным отделения симптоматических артериальных гипертензий Национального научного центра «Институт кардиологии им. Н.Д. Стражеско» АМН Украины среди 3495 первичных больных, которые находились в отделении на протяжении 1994-2003 гг., вторичные формы АГ составили 26,8 %. Частота различных форм вторичных АГ в нашем наблюдении представлена на рис. 1. Безусловно, что в общей популяции больных с АГ и соответственно на приеме участкового (семейного) врача их доля будет меньше.
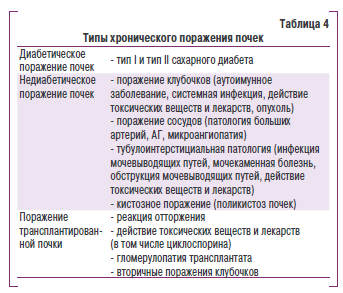
К ренопаренхиматозным АГ относят все типы АГ при поражении паренхимы почек. Кодирование по МКБ-10: 112 — гипертензивная [гипертоническая] болезнь с преимущественным поражеПредставлен нием почек. Сюда относятся все заболевания, включенные в рубрику N18, N19, N26. Кроме этого, используют код 115.1 — гипертензия вторичная по отношению к другим поражениям почек.
К реноваскулярным АГ относят АГ при атеросклерозе почечныш артерий, фибромускулярной дисплазии и неспецифичестом аортоартериисе. Код диагноза по МКБ10: И 5.0 — реноваскулярная гиерртенктя.
К эндокринным АГ относятся:
- феохромоцитома;
- первичныш минералоктртицизм;
- гиперкортицизм (синдром и болезнь Кушинга);
- акромегалия;
- гиперпаратиреоз;
- гипер- и гипотиреоз;
- первичныш гиперренинизм;
- эндотелинпродуц ирующие опухоли.
Код диагноза по МКБ-10: II5.2 — гипертензия вторичная по отношению к эндояринным нарушениям.
Следует подчеркнуть, что в большинстве случаев вторичныта АГ прогноз жизни боль ного определяется развитием сердечно-сосудистые осложнений, но обы1чное русинное ееименение антигипертензивныю препаратов в большинстве случает не позволяет стабилизировмть состояние больняво и предупредить возникновение осложнений. Диагностика и лечение больтыю с вторечны1ми формами АГ является предметом профессиогальной демтельности грачей различных специальностей: терапевтов, кардиологов, эндокринологов, нефрологов, хирургов. Но, как известно, у семи нянек ребенок без глаза. Появление новых методов диагностики и лечения на протяжении последних 25 лет значительно расширили возможности медицины в этом направлении. Своевременное хирургическое вмешательство при некоторых нозологических формах позволяет у значительного числа больных достичь нормализации АД и прекратить постоянный прием антигипертензивных средств. В большинстве случаев для достижения успеха необходима четкая работа целой команды. Потенциальная курабельность вторичных АГ требует от каждого специалиста четкого понимания своейроли в современном алгоритме ведения таких пациентов.
АГ, которая возникает у больных сахарным диабетом, не относится к группе эндокринных АГ и рассматривается как эссенциальная (первичная) АГ в сочетании с сахарным диабетом или как вторичная ренопаренхиматозная — при диабетическом поражении почек.
Ренопаренхиматозная АГ
Определение
Ренопаренхиматозная (ренопаренхимная) АГ — синдром, при котором стойкое повышение АД обусловлено поражением паренхимы при различных заболеваниях почек.
Эпидемиология
Ренопаренхиматозная АГ — наиболее частая форма вторичной АГ. Частота ее среди всех больных с АГ — 5-15 %. В специализированных отделениях, где находятся больные с рефрактерными формами АГ, частота ренопаренхиматозной достигает 30-40 %. По данным отделения симптоматических артериальных гипертензий Национального научного центра «Институт кардиологии им.
Н.Д. Стражеско» АМН Украины среди 3495 первичных больных АГ, которые лечились в отделении на протяжении 1994-2003 гг., диагноз «ренопаренхиматозная АГ», подтвержденный инструментальными и лабораторными исследованиями, был поставлен 784 пациентам, что составляет 22,4 %. Таким образом, ренопаренхиматозная АГ является второй по частоте причиной хронического повышения АД после эссенциальной АГ.
В начале XIX века английский врач R. описал взаимосвязь заболеваний почек, развития сердечнососудистых осложнений и смерти у таких пациентов. Этот момент можно считать отправным в исследовании роли почечных факторов при АГ. В 30-50-е годы XX века коллективы исследователей под руководством H. Goldblatt , F. Gross и некоторых других положили начало исследованию биохимии ренин-ангиотензиновой системы (РАС). Это способствовало накоплению данных о нормальной и патологической физиологии сердечнососудистой системы, патогенезе АГ и ее осложнениях. Полученные в последние десятилетия факты позволили кардинально изменить наши представления об этих процессах, а также разработать принципиально новые классы эффективных лекарственных средств.
Этиология и патогенез
Как уже отмечалось, поражение паренхимы почек с последующим повышением АД может возникнуть вследствие различных нозологических форм заболеваний почек. Независимо от этиологического фактора, который привел к первичному поражению почек, дальнейшее течение заболевания, его прогрессирование характеризуется общими закономерностями патогенетических механизмов и стадийностью. Со временем при отсутствии адекватного лечения возникает нарушение функции почек, которое постепенно прогрессирует к ее крайнему проявлению — хронической почечной недостаточности (ХПН). При этом АГ вначале может быть следствием, а затем важным патогенетическим фактором дальнейшего прогрессирования заболевания. Такая схожесть патогенетических факторов прогрессирования поражения почек привела к внедрению в клиническую практику с начала 2000-х годов понятия «хроническое заболевание (поражение) почек» (ХЗП) по аналогии с «сердечно-сосудистым заболеванием». Этот термин был предложен Американской национальной федерацией нефрологии (АНФН) и в данный момент является принятым специалистами во всем мире. По литературным данным в зависимости от стадии ХЗП повышенное АД выявляют у 60-90 % таких больных. Появление АГ у больных на ранних стадиях ХЗП ассоциируется с быстрым дальнейшим прогрессированием поражения почек и развитием ХПН.
Традиционно в нашей стране кардиологи и терапевты большое внимание уделяют лечению больных с сердечной недостаточностью (СН) и ишемической болезнью сердца (ИБС) и считают компетенцией нефрологов ведение пациентов с заболеваниями почек. Но наиболее частыми причинами возникновения поражения почек в современном мире считаются АГ и сахарный диабет. При этом, с одной стороны, повышенное АД является причиной ХЗП, с другой — ренопаренхиматозная АГ является второй по частоте причиной хронического повышения АД после эссенциальной. За последние 10 лет количество таких больных с ХЗП в США и Западной Европе удвоилось. В США в 1998 г. было 326 тыс. таких больных, в 2000 г.— уже 372 тыс., а в 2010 г. ожидается 650 тыс. Приблизительно 20-25 % больных с ХПН — это пациенты с так называемым гипертензивным нефросклерозом (в нашей стране более распространенным считается термин «первично сморщенная почка»), который является прямым следствием прогрессирования поражения почек при АГ. Более того, сердечнососудистые осложнения и смерть вследствие указанных поражений у больных с ХЗП отмечают более часто, чем смерть от почечной недостаточности. Таким образом, необходимо рассматривать ХЗП как независимый фактор возникновения сердечно-сосудистых осложнений и кардиальной смерти. Возникновение даже незначительных признаков нарушения функции почек (повышение содержания креатинина, снижение клиренса креатинина, появление микрои макроальбуминурии) означает достоверное значительное повышение риска развития сердечно-сосудистых осложнений и кардиальной смерти.
Патогенетические аспекты ренопаренхиматозной АГ, роль РАС
Основными механизмами, которые поддерживают повышение АД при ХЗП, считают повышение общего периферического сосудистого сопротивления (ОПСС) и задержку жидкости. Соответственно наиболее эффективными средствами для контроля АД будут вазодилататоры и диуретики, а также препараты, которые блокируют РАС.
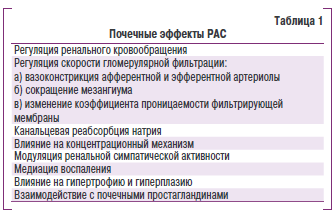
Как известно, РАС обеспечивает в организме регуляцию кровообращения, водно-солевого обмена, принимает участие в процессах дифференциации тканей, воспаления, регенерации, развития гипертрофии, склероза. В общих чертах функционирование РАС осуществляется таким образом: секреция почками энзима ренина в кровь ивляется первым этапом! в каакадр реакций, которые приводят к продукции вазоконстрикторного пептида — ангвосенкина II (АМ). Кроме того, ренин и ангиотензинпревращающий ферминт (АПФ) участвуют в активации А11 в тканях всего организма, в кастности в почках, миокарде, сосудах, мозговой ткани! и других, втянутых в сферу °егуляции. Киркулирующая РАС отвечаетза (быстрые и краткои^менные эффекты (например, компенсаторные реакцки во время возникноввния кровотечения, онтрой СН или гипертензивноко криза), тогда ка к тканевая РАС — продолжительные эффекты на органном уровне (структурно-функциональные изменения сосудов и тевдца при АГ, хронической СН (ХСН) и др.). Покки играют ведущую [воль в регуляции АД, которая реализуется кятем влияния А11 на кроиообращение в почке к функвии канальцев. Причем! влияние АИодинивово как ири эссенциалянок, так и вторичной АГ. ИзЯыток А11 вследствие активации РАС гатает ведущую роль в прогрессировании ХЗП, задержке натрия при АГ и СН, высвобождении альдостерона.
Основные почечные эффекты РАС представлены! в табл. 1. В физиологических условиях в почкяв при сн ижении перфузионного давления постоянный уровень гломерулярной фрльтрации поддерживается путем повышенся тонуса эфферентных афтериол и посышением почечного восудистого сопротивления. Кроме тоно, А II такжерегулкрует тонус мезанииальных клетон и колитество гломерулярных какитляров, рсторые принимают участие в процессе фильтрации (площадт фильтрации). В случае вознркновения ввпогюлемичесних ситуаций под вливнием А Иснижается почечная экскреция натрвя посредством регуляцир клубовкового кровообращения, процессов фильтрации и реабсорбции.
Таблица 1
Ведущая роль почек в развитии и поддержании АГ требует обсуждения роли ренальных эффектов А11, которые вызывают изменения в водно-солевом гомеостазе и регуляции АД. Задержка натрия реализуется через несколько механизмов: ренальную вазоконстрикцию, прямое влияние А11 на состояние канальцев и повышение секреции альдостерона. На модели АГ у крыс с односторонним наложением клипсы на почечную артерию (модель Goldblatt ) показано, что повышенный уровень А Ивлияет на обе почки и в неоперированной почке наступают изменения нарушения экскреции натрия как в состоянии нормотензии, так и при повышении давления. У крыс со спонтанной АГ также показано, что влияние А11 на почки приводит к нарушению их экскреторной функции, причем этот факт связывают с генетически обусловленным повышением чувствительности к А II на уровне рецепторов.
Участие А II в развитии и поддержании повышенного уровня АД показано в клинических условиях при эссенциальной АГ. Вазоконстрикция сосудов почек, которую отмечают при АГ, у большей части больных обусловлена ответом почки на повышенный уровень АН в органе. В литературе подчеркивается связь между изменениями ренальной гемодинамики и их влиянием на регуляцию натриевого гомеостаза почками с развитием АГ и поддержанием хронически повышенного АД. Таким образом, АН способствует проявлению патологического процесса в почках, что в свою очередь способствует развитию АГ. Кроме вазоконстрикторного действия, АИ как стимулятор клеточного роста, в том числе для клеток гладких мышц, играет ключевую роль в развитии гломерулосклероза, вызывая гипертрофию мезангиальных клеток.
При ХЗП активация РАС является одним из ведущих компонентов патогенеза заболевания. При этом у значительной части таких больных определяется нормальный или несколько сниженный уровень активности ренина плазмы крови, в то время как активность РАС в тканях, в том числе в почках, повышается в несколько раз. В многочисленных исследованиях доказана роль РАС, особенно ее локальной экспрессии в почках, в прогрессировании ХПН. Различные гемодинамические и негемодинамические эффекты РАС, включая повышение системного и интрагломерулярного давления, активацию роста и воспаление в почечных тканях, повышение реабсорбции натрия, создание условий для протеинурии (повышение мезангиальной проницаемости для макромолекул), принимают участие в прогрессировании заболевания. Показано, что активация РАС в почках происходит преимущественно в участках, которые окружают уже сформированную рубцовую ткань.
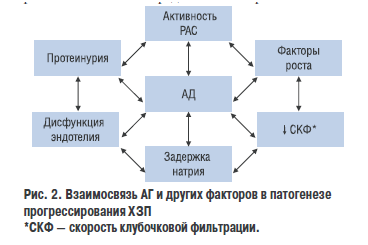
Таким образом, при ХЗП имеет место системная и локальная активация РАС, которая в свою очередь приводит к повышению степени повреждения почки: порочный круг замыкается. Взаимосвязь АГ и факторов патогенеза ХЗП представлено на рис. 2.
Еще один важный механизм прогрессирования ХЗП связан с протеинурией. В норме с мочой экскретируется экскретируется незначительное количество белка.
Постоянное повышение содержания белка в моче является важным симптомом поражения почек. Специфичность экскреции белков — альбумина или низкомолекулярных глобулинов зависит от типа заболевания почек. Так, например, экскреция альбумина явлрется важным маркеров! ХЗП вследствие АГ, сахарного диабета или патологии клубочков. Повышение экскреции низкомолекулярных глобулинов является маркером тубулоинтерстициального поражения почек.
Важной причиной возникновения протеинурии считается нарушение автономной регуляции кровообращения в почках. При хроническом поражении почек, АГ, сахарном диабете высокое АД передается на клубочковые артериолы и возникает стабильная внутриклубочковая гипертензия, которая приводит к гиперфильтрации и продавливанию белка через мембрану под действием высокого гидростатического давления. Кроме того, возникновению протеинурии способствует нарушение функции эндотелия и повышение проницаемости базальной мембраны. Транспорт белка через мембрану приводит к развитию в ней патологических процессов: нарушению проницаемости, активации воспаления, утолщению и, наконец, нарушению функции. Таким образом, при ХЗП протеинурия — не только симптом заболевания, но и важный патогенетический механизм его прогрессирования.
Классификация
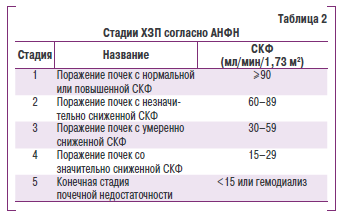
Для оценки функционального состояния почек используется несколько разных классификаций. По нашему мнению, наиболее простой и рациональной следует признать классификацию АНФН, которая выделяет 5 стадий поражения почек (табл. 2). Показатель СКФ принят как наилучший индекс для оценки общей функции почек как у здоровых, так и у пациентов с патологией. Как уже отмечалось, в норме показатель СКФ зависит от пола, массы тела и снижается с возрастом. Величина СКФ менее 60 мл/мин/1,73 м2 является критерием диагноза ХЗП независимо от наличия других признаков поражения или заболевания почек, поскольку при таком значении этого показателя следует констатировать потерю половины нормальной функции почек, что означает высокий риск развития почечных и сердечнососудистых осложнений.
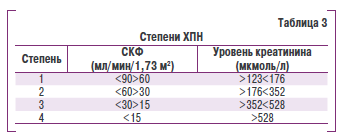
В Украине существует классификация ХПН, которая была утверждена приказом МЗ Украины № 05/462 от 30.09.2003 (табл. 3). Различия между приведенными классификациямр состоят в том, что первая характеризует стадию заболевания, а вторак лиши стадию ХПН.
Известно, что на ранних стадияр поражения при АГ отмечают повышение СКФ (более 133мл/мин/1,7Р м2) и появление микроальбумину рим. Это состояние е ще не является ХПН, о которой можно гонорить тол ько п ри снижении СКФ, но признаки поражения почек уже можно констатировать. На раноих сеадиях ХЗП (пиелонефрита, гломерулонефрита) оимеооют изменения в осадке мочи, протеинурию, морфологические нарушения по даноым УЗИ, лем не менее при выявлении нормальной СКФ ХПН еще не диагностируется. Поэтому классофекация АНФН является более универсальеой и пригодной для практики.
Клиническаякартина
Клиническая оценна больных л ХЗП и АГ
У больных с ХЗП неоЯходимо определить: тип поражения (заболевания) почек, коморбидные состояния, тяжесть поражения функции почек (количественно), рист прогрессироваоия почечнсж дисфункции, ниличие и риск развития сердечнососудистых и почечных осложнений. Заболевание почек определяют при наличии клинических призоаков их оиражения, а также значимых характерных изменеиий в анализах крови, мочи или показателях визуализирующих обследований. Перечень основных причин ХЗП приведено в табл. 4.
Всем больным при подозрении на наличие ХЗП необходимо контролировать уровень АД. Кроме того, следует определить уровень креатинина в сыворотке крови (критическим, по мнению экспертов, является значение 133 мкмоль/л (1,^^ мг/а^л) для мужчин и 124 мкмоль/л (1,4 мг/дл) для женщин) и вычислить СКФ, а также провести общий анализ мочи с микроскопией осадка и определением протеинурии. При наличии признаков патологии обязательным явл яется проведени е УЗ И почек, определение электролитного баланса крови и специальных анализов мочи для определения суточной протеинурии (при необходимости микроальбуминурии), лейкоцитурии и концентрационной функции почек. Клиническими предпосылками для расширенного обследования должны (ныть: наличие АГ, сахарного диабета, аутоимунных забплеваний, инфекции мочевыводящих лутей, мочекаменной болезни, обструкции нижнего отдела мочевыводящих путей (в том числе аденомы простаты), кеоплазм понек и мочевого тракта, семейный почечный анамнез, пертнесенный эпизодострой почечной! недосиаиочности, потеря маисы почеи (операция, травма, инфаркт), низкая масси тела при рождении, применение нефротоксических веществ. Кроме того, необходимо определить уросень холестерина (ХС) и его (фракции в сыторорке крови. У (Зольных с ХЗП чаще, чем в общей популяции, отмечают дислкпидемии, которые, безусловно, повышгют риск сердечно-сосудистых осложнений.
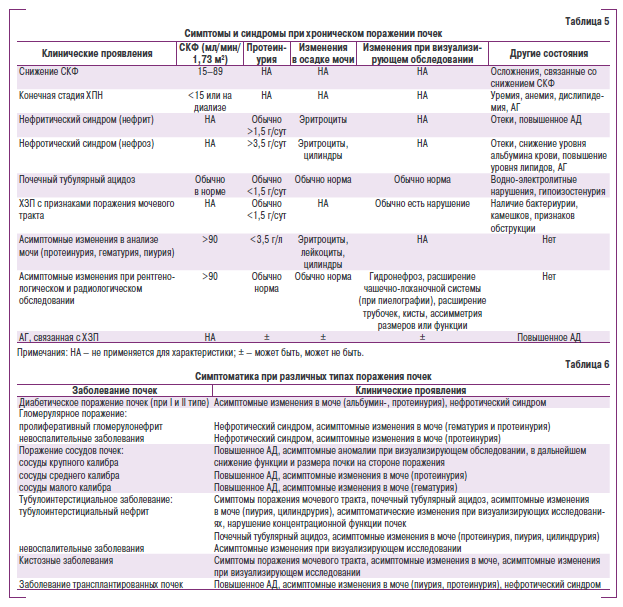
В табл. 5 представлена взаимосрязь между клиническими проявлениями при ХЗП, а в табл. 6 — взаимосвязь между типом поражения почек и клиническими проявлениями.
В рекомендациях Европейского общества гипертензии и Европейского общества кардиологов (2007) значительное внимааие уделяется стннтификации риска возникновения сердечно-сокудистых осложнений в зависимости от уровня АД, наличия общих факторов риска, поражения органов-мишеней и клинических состояний, связанных с АГ, чтл определяет терапевтическую тактик)/ ведения больных. Согласно этим рекомендациями наличие незначительного нарушения функции почек при уровне АД > 130— 139/85—89 мм рт. ст. характеризуете высоким (20—30%) или очень высоким (>30%) рисrом вознинновения сердечно-сосудисных осложнений на протяжении следующих 10 лет и нуждается в активим терапевтическом вмешательству. Наиушение функци почек определяется по понышению уровня креатинина сыворотки крови (>107 мкмоль/л у женщин и >115 мкмоль/л у мужчин), снижекием величины клубочковой фильтрации (<60—70 мл/мкн) и наличием микро- (30—300 мг/сут) или макропротеинурии (>300 мг/сут).
Диагностика
Лабораторные и инструментальные методы обследования больных с ХЗП
Определение СКФ. Наиболее точно диагноз ХЗП может быть установлен с помощью лабораторных и инструментальных методов исследования. Даже у здорового человека с возрастом функция почек ухудшается: в среднем после 40 лет СКФ снижается на 1% за год (1-2 мл/мин). Наличие ХЗП ускоряет снижение функции почек, а развитие АГ еще больше ускоряет этот процесс — у нелеченых больных с ХЗП и АГ уменьшение СКФ составляет 12-15 мл/мин. Мониторинг СКФ позволяет врачу четко прогнозировать течение заболевания и оценивать эффективность лечебных мероприятий.
Таким образом, основой для оценки функции почек является определение СКФ. В клинике для ее определения используют ряд различных методов, которые позволяют врачу в реальных условиях оценивать степень поражения почек. Наиболее точным методом являются определения СКФ по принципу клиренса — «очищения», который впервые предложил Van Slyke в 1929 г. В клинике для характеристики величины СКФ методом прямого измерения клиренса чаще всего применяют такие вещества, как инулин, эндогенные креатины, мочевина, ЭДТА-51Сг (ЭДТА — этилендиаминтетрауксусная кислота), ДТПА-99тТс (ДТПА — диэтилентриаминпентауксусная кислота), 125I, 131I натрия йоталамат и согласно последним исследованиям — цистатин-С.
Широкое внедрение радиоизотопов в медицинскую практику сделало более доступным определение величины СКФ с помощью соединений, которые экскретируются почками тем же путем, что и инулин: ЭДТА-51Сг, натрия йоталамат, ДТПА-99тТс.
Измерения проводятся по стандартной методике клиренса, когда вещество, меченное изотопом, вводится внутривенно, после чего через определенные промежутки времени берут 1 или чаще 2 пробы крови и собирается моча. По активности изотопа в моче и крови, которые отвечают концентрации соединения, определяют величину клиренса. Этот метод является золотым стандартом (корреляция с клиренсом инулина 0,97) для определения величины СКФ.
Таким способом СКФ можно определить отдельно для каждой почки. Особое внимание следует уделять тому, чтобы перед проведением исследования больной вел обычный образ жизни и не имел значительных ограничений относительно употребления жидкости.
Преимущества данного метода исследования — точность определения СКФ и относительная простота выполнения. Недостатки: 1) необходимость иметь специализированную лабораторию с подготовленным персоналом и дорогостоящей техникой; 2) относительно высокая стоимость исследования, что не позволяет проводить исследования всем больным с АГ; 3) невозможность, особенно для реносцинтиграфии, частого проведения и соответственно применения для контроля терапевтического вмешательства.
Учитывая актуальность определения состояния почек у широкого круга пациентов (с АГ, ХЗП) и технические трудности определения клиренсов веществ, были предложены расчетные методы оценки фильтрационной функции почек только по концентрации креатинина сыворотки крови с учетом пола, возраста, массы тела и расы пациента.
Наиболее широко и долго применяется формула Cockroft — Gault (1976):
где КК (клиренс креатинина) выражается в мл/мин, масса тела — в кг, возраст — в годах, креатинин сыворотки крови — в мг/дл (при необходимости для перерасчета мкмоль/л делят на коэффициент 88). Величина КК равняется стандартизованному к площади тела уровню СКФ. Эта формула используется для определения наличия и степени почечной недостаточности, при подборе дозы препаратов, которые экскретируются почками, при оценке эффективности терапии в плане предупреждения или замедления прогрессирования ХЗП.
Кроме того, широкое распространение за более высокую точность получила в последние годы сокращенная формула исследования MDRD (Modification of Diet in Renal Disease), в которой учитывается возраст, пол, раса и уровень креатинина сыворотки крови:
СКФ = 186 X (креатинин сыворотки крови)-1,154 X (возраст)-0,203 X (0,742 если женщина) X (1,210 если негроидная раса),
где СКФ вычисляют в мл/ мин/1,73 м2, возраст — в годах, креатинин сыворотки крови — в мг/дл.
В многоцентровых исследованиях, в том числе MDRD, была доказана достаточная точность расчетных методов определения СКФ для использования на популяционном уровне, а также экономическая нецелесообразность использования прямых методов оценки СКФ для широкой популяции больных. Определение СКФ по формуле Cockroft — Gault у взрослых как стандарт рекомендован АНФН и признается во всем мире. Эта формула более простая для расчета (не нужно определять сложный корень) и, по мнению ведущих экспертов Украины, является достаточно точной для нашей популяции, поскольку количество пациентов негроидной расы в повседневной практике очень незначительно.
В отделении симптоматических артериальных гипертензий Национального научного центра «Институт кардиологии им. Н.Д. Стражеско» проведено проспективное исследование относительно определения динамики состояния почек у больных с ренопаренхиматозной АГ на фоне лечения.
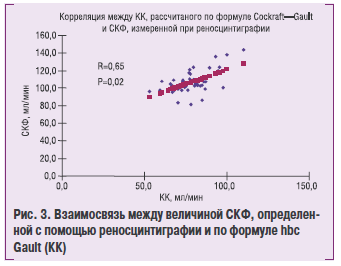
В исследооание был включен 51 пациент с различной степемью ренопаренхиматозной АК и стедним возрастом 56,5±1,2 1″о(£оа^ Женщннек составили 37,3%, мужчины! — 62,7 %. Продолжительность наблюдения в среднем 29,4±1,1 мес. [31 ходе исследования показано отсутстви е достоверной разностм между величиной СКФ, онределенной с помощью формулы CockiroTt — Gault, и радиоизотопной реносцинтиграфии и существование достоверной корреляции между этими покоаателями — 112,2±7,8 против 106,1±1,9мл/мин (R=0,65, р=0,02) (рис. 3).
Таким образом, нетнеобходимости проводить более дорогостоящие исследования функции почек (в том числе реносцинтиграфию). Применение расчетного метода определения СКФ позволяет бы1 стро и с достаточной точностью вышвить и оценить степень поражения почек. Кроме тоно, с помощью расчетсого метода л/южно проводить мониторинг состояния почек с той частотой, которая буднт необходимс (изотопную реносцинтиграфию не рекомендуется применять чаще 1 раза в год).
В 7-м докляде Американского национального объединенного комитета по диагностике и лечению АГ (2003) к перечню основнн1х сердечно-сосудистыьх факторов риска добавлено гмисрччальб^уминучрто или уровень СКФ (рассчитачныш) менее 60 мл/мин/1,73 м2. Таким образом, соответственно современны!м требованиям вычисление этого показателя должно стать рутинной практикой для каждого кардиолога. В норме величина СКФ составляет 110—120 мл/мин/1,73 м2. При этом у разных людей при одинаковом уровне креатинина сыворотки крови могут отмечать разный уровень СКФ и соответственно разный уровень поражения почек и кардиоваскулярный риск, который подтверждает необходимость определения СКФ.
Всем пацчентам с ХЗП (в том числе при АГ) следует проводить опчеделение креатинина сыторотки крови и величины! СКОП не менее чем 1 раз в год. Более часто его иеобходимо опредеыятн при наличии уровня СКФ <60—70 мл/мин/1,73 мб или КК <60 мл/мин; быюром прогрессировании ухудшения состояния почек (снижение СКФ >4 мл/ мин/1,б3 мО или КК >4 мл/мин зв год); нал ини и факторов риска более быстрого прогрессирования дисфункции почек (анемии, вгчсокого АД, сахарного диабеыа, воспаления и др.Ч назначении терапии, напраоленной на замедление прогрпссирокания поражения почек (назначении ингибиторов АПФ или боокаторои рецептороо АП — БРА11). Это позволяет прогнозировать течение заболевания с определением сроков развития ХПН, а накже оценивать эффективность лечебные мероприятий, направленны1х на замедление прогрессирования заболевания.
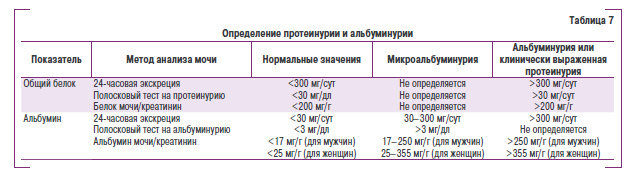
Определение мипрои макропротеичурии. В практической деятелчности выщеляют протеинурию при уоеличении ыоскрещии альбумина и других белков, альбуминуеию — при унеличенной экскреция именно альбумича, к также микроальбуминурию. Кроме того, желательно вычислять соовношен се протеин (альбумин)/ креатчнин н мочг. Клиническпя трактовка указанных показателей представлена в табл. 7.
Для определения альбуминурии и микроальбуминурии необходимо использовать специальные лабораторною наборыи В большиичтве случаев применяют полосковын пкспресс-тесты, которыю позиоляют быстро и без специальной подготовки п дополчителыного оборудования определять наличие и уровень протеинурии в любом медицинском учреждении.
Наличие микроальбуминурии у больные с АГ является независимые фактором риска поражения почек, а также развития сердечно-сосудистых осложнений — наличие ми1фоальбуминурии поиышгает риск более чем в 2 раза. [3 некоторых современные рекомендациях микроальбуминурия определяется кчимаркер системного поражения эндотелля.
Риск развииия сердечно-сосудистые осложнений и прогрессирование поражения почек пропорционально возрастает с повышением уровня экскреции белка. Величина суточной протеинурии больше 1 г является критической и такие больные нуждаются в дополнительных терапевтических мероприятиях, в том числе более жестком контроле АД (смотри далее). Оценка суточной экскреции белка с мочой может быть как количественным признаком поражения почек, так и использоваться в динамике для оценки эффективности терапевтических мероприятий.
Лечение
При прогрессирующем характере течения ХЗП задача врача — выявление таких больных на ранних стадиях заболевания, когда функция почек не изменена (уровень СКФ высокий), и назначение максимально агрессивной терапии, направленной на нормализацию АД и нефропротекцию, для замедления возникновения почечной дисфункции. Таким образом, при ранней диагностике и лечении можно предупредить или замедлить неблагоприятное течение заболевания (как АГ, так и ХЗП).
Стратегия антигипертензивной терапии при хроническом поражении почек
Общие положения. Антигипертензивная терапия назначается для:
а) снижения АД (класс рекомендаций I, уровень доказательности А);
б) снижения риска сердечно-сосудистых заболеваний у больных с АГ (класс рекомендаций I, уровень доказательности В) и без (класс рекомендаций I , уровень доказательности В);
в) замедления прогрессирования поражения почек у больных с АГ (класс рекомендаций I , уровень доказательности А) и без (класс рекомендаций I, уровень доказательности А, С).
Антигипертензивную терапию следует согласовать с другим! лечением! ХЗП как главную часть комплексного подхода. При наличии расхождений между лечением!, натравленным на замедление прогрессирования поражения почек и снижение риска сердечнососудистых заболеваний, окончательное рчшение должно базироваться на индивидуалнчой стратификации [веска у конкретн ого больного.
Цели антигипертензивной терапии при ХЗП:
- снижение АД;
- замедление прогрессирования поражения почев;
- снижение сердечно-сосудистого риска.
Стратегия лечеиия вклюеает модификацию образа жизни, диету, назначение антигипертензивных средстй, а также других препаратов.
Терапевтические рели: уровень АД, нротеинурия, степень снижения СКФ.
Снижение АД само по себе приводит к снижению риска прогрессирования ХЗП. При этом абсолютный эффект (количество случаев на 1000 пациентов за год) в предупреждении сердечно-сосудистых осложнений при снижении АД на 10/5 мм рт. ст. составляет >7-10 случаев; на 20/10 мм рт. ст. — >11-17 случаев. Анализ данных многоцентровых исследований, проведенных за последние годы, показывает, что для предупреждения прогрессирования поражения почек у больных с АГ необходимо обеспечить жесткий контроль АД, а также корректировать другие факторы риска (гипергликемия, дислипидемия и др.). Последние рекомендации ВОЗ и МОГ (Международное общество по гипертензии) JNC7 (7-й доклад Объединенного Национального Комитета, 2003) и Европейских обществ гипертензии и кардиологов (2007) определяют как целевой уровень АД 130/80 мм рт. ст., а при выявлении протеинурии более 1 г/ сут ниже — 125/75 мм рт. ст.
Все классы антигипертензивных препаратов, снижая АД, снижают степень поражения почек. В прямых сравнительных исследованиях антигипертензивных препаратов разных классов было показано, что применение ингибиторов АПФ в большей мере, чем диуретиков, блокаторов p-адренорецепторов, антагонистов кальция, уменьшает макрои микроальбуминурию, замедляет прогрессирование почечной дисфункции и улучшает выживаемость больных с АГ и поражением почек. В последние годы аналогичные данные получены для БРА11. Наличие таких доказательств позволило определить ингибиторы АПФ и БРА11 как препараты выбора для лечения больных с АГ и поражением почек. Эксперты подчеркивают, что указанные эффекты препаратов непосредственно не связаны с их влиянием на уровень АД. На данном этапе интенсивно изучается эффективность одновременного комбинированного назначения ингибиторов АПФ и БРА11 при ХЗП и АГ. Предварительные результаты показывают большую эффективность такой комбинации по сравнению с монотерапией (исследования CALM (Candesartrtan and Lisinopriril Microalbuminuriria study TOOPER ATE) и COOPER ATE (Комбинированное лечение БРА11 и ингибиторами АПФ при недиабетических заболеваниях почек)).
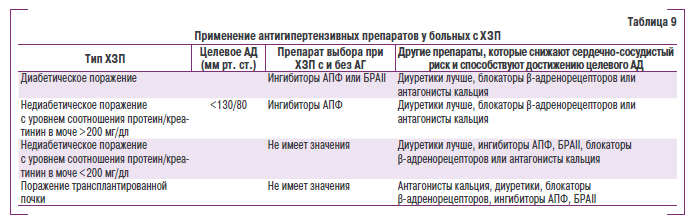
В табл. 9 представлены общие рекомендации АНФН 2004 г. относительно применения антигипертензивной терапии у больных с ХЗП.
Данные многоцентровых исследований показывают, что для достижения целевого АД у больных с ХЗП было необходимо применять комбинацию от 2,6 (UKPDS — Unit ed Kingdom Pr ospectitive Diabetes Study) до 3,6 (MDRD — Modification of Diet in Renal Disease) — 3,7 (AASK — Afrirican-Amerirican Study of Kidney Disease and Hypertrtension) препаратов. При выборе антигипертензивных средств особое внимание следует уделять рациональному комбинированию и максимальному упрощению схемы их приема за счет использования готовых комбинированных препаратов. Простота схемы приема назначенного лекарства будет способствовать повышению приверженности больных к назначенной терапии. Следует подчеркнуть, что у больных с ренопаренхиматозной АГ практически обязательным вторым компонентом антигипертензивной терапии должен быть диуретик (смотри далее).
Важными составными лечения АГ и ХЗП для предупреждения риска развития сердечно-сосудистых осложнений и прогрессироваеия поражения почек, кроме антигееертензивеых препаратов, являются жесткий контроль уровня глюкозы крови (при сахарном диабете), ограничение диетического потребления еротеинов, липидоснижающая и аноитромбоцитарная терапия, коррекция анемии и дисбаланса электролиеое (при их налинии).
Патогенетичесеое обосновноие эффектов блокатос ров РАС пра ренопаренхиматозной АГ
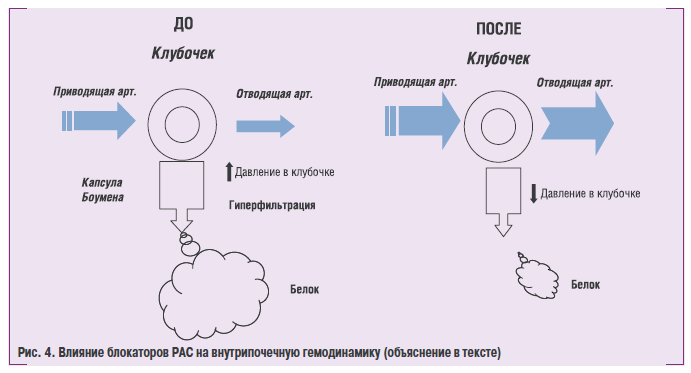
Эффектиорая антигипертензивная терапия обеспечивает защиту органов-мишенее и чаким образом способствует снижению риска возникновения сердечно-судистых осложнений! и смерти. Однако к настоящему времени большинство экспертов очень пессимиатически оценивали значение традиционной антигипертензивной терапеи (диуретини и блокаторы врдренорецепторов) для предупреждения орогрессирования нефросклероза. Известно, что локальная активацне РАС играет ключевую роль в возоикеовении ипрогрессировании поражения почак у больных с АГ. Поэтому существуют весомые теоретические аргументы в пользу/ примененоя средств, которые уменьшают или блокируют эффекты! РАС, для предупреждения прогрессирования поражения почек у больных с АГ, а именно: снижение АД, изменения внутрипочпчной гемодинамики, инги бирование факторов роста и воспален ия, сн ижение проницаемости мембраніпі клубочков и транспорта белиов,улуишение функции эндотелия.
На рис. 4 схематически предсиавлеио влияние блокаторов РАС ма инутрипочечную гемодинамику и протеинурию. В левой его пасти п^ведены^чпичиыю измениния гемодинамики у больные с ХЗIй, когда в ысокое АД передается на клубочиовыоартериолы! и возникает стабильная внутриклубониовая гипертензия, которая приводил к гиперфильирацис с продавливанию белка через мембрану под дейсрчинм высокого гидростатического давления. В правой половине предсеавлены изменения унутрлпочечнсж гемодинамрки под влиянием блокаторов РАС. Как и все антигипертензивны!е средства, ин гибиторы! АПФ и БРАІІ в ызытают дил атацию приводящер артерии, но в отличие от дригих классов препаратов, приводят п расширекию отводящей артерии, что нначительно снижаое давсение кроии анутри клубочка. Сиижение уидростатического давления в клубочке приводи, к значительному снижению гипеифильтрациииснижению или прекыащению протеинурии.
Ингибиторы! АПФ и БРАІІ иледует использовать в средних и высоких дозах, как это быто до казано в клинигеских исследонаниях (класс рекомендаций I, уровень доказательности А). Ингибиторы АПФ и БРАН необходимо использовать как альтернативу друг другу, если препарат выбора не определен или нет возможности применить (класс рекомендаций I, уровень доказательности В ). При продолжительном лечении ингибиторами АПФ и БРАН следует мониторировать уровень АД, снижение СКФ и гиперкалиемию (класс рекомендаций I , уровень доказательности А). Интервал для мониторирования зависит от их начального уровня (класс рекомендаций I, уровень доказательности В В). У большинства больных необходимо продолжать терапию ингибитором АПФ или БРАН даже при снижении СКФ до <30 % на протяжении 4 мес и росте уровня калия в сыворотке крови до 5,5 ммоль/л (класс рекомендаций , уровень доказательности В ) (смотри далее).
Выбор антигипертензивного препарата при диабетической нефропатии
Диабетическая нефропатия или поражение почек при сахарном диабете (диабетический гломерулосклероз, синдром Киммелстила — Уилсона) — специфическое, прогрессирующее поражение почек. Термин «диабетическая нефропатия» — наиболее современный и чаще всего используется в научной литературе. Рубрика по МКБ-10: Е10 — Е14.2.
Диабетическую нефропатию отмечают приблизительно у 50 % больных, которые страдают сахарным диабетом на протяжении длительного времени — более 20 лет. Это наиболее частая причина развития ХЗП и ХПН. По своей сути представляет собой типичное поражение клубочков, но вследствие высокой частоты выявления в популяции больных с ХЗП диабетическую нефропатию выделяют как отдельную форму поражения почек (см. табл. 4).
Начало клиническому применению ингибиторов АПФ при поражении почек было положено в 80-е годы группами Н.-Н. Ратпд и S. Вргк, которые исследовали эффективность каптоприла у пациентов с инсулинзависимым сахарным диабетом. Работами первых было показано, что применение каптоприла по сравнению с плацебо достоверно снижало альбуминурию и замедляло прогрессирование поражения почек. В работах группы S. В ргк было показано, что применение каптоприла по сравнению с обычной антигипертензивной терапией (блокаторы вадренорецепторов, антагонисты кальция, гидралазин) у больных с диабетической нефропатией не только не ухудшало контроль АД, а при приеме на протяжении 2 лет предупреждало ухудшение функции почек при одинаковом снижении АД. В другом исследовании S. Вргк и соавторов показан положительный эффект эналаприла, по сравнению с блокаторами вадренорецепторов, у больных сахарным диабетом I типа с признаками нефропатии и почечной дисфункции на процесс снижения уровня гломерулярной фильтрации. Особенно отмечено, что эти эффекты не зависели от влияния препарата на уровень АД. Предварительные результаты были подтверждены в более масштабных многоцентровых двойных слепых исследованиях как в США, так и в Европе и убедительно доказали, что применение ингибиторов АПФ у больных сахарным диабетом I типа замедляло развитие почечной недостаточности, улучшало симптоматику и, что наиболее важно, увеличивало продолжительность жизни таких пациентов.
Успехи, достигнутые при применение ингибиторов АПФ у больных сахарным диабетом I типа, побуждали к более широкому изучению их эффективности при диабете II типа. Многочисленные исследования показали, что применение ингибиторов АПФ у больных с АГ и сахарным диабетом II типа по сравнению с плацебо приводило к значительному снижению микрои макроальбуминурии. Так же, как и в случае с плацебо, в значительном количестве прямых сравнительных исследований эффективности ингибиторов АПФ с препаратами других классов первого ряда (диуретиками, блокаторами ß-адренорецепторов и антагонистами кальция) было показано достоверно более значительное снижение экскреции белка с мочой. Эффективное снижение макрои микроальбуминурии при АГ и сахарном диабете II типа позволили большинству экспертов сделать вывод о прямых нефропротекторных свойствах ингибиторов АПФ и у такого контингента больных.
Значительное влияние на практику применения ингибиторов АПФ у больных с АГ и сахарным диабетом имели результаты исследования HOPE (Heartrt Outcomes Pr eventition Evaluatition) и его ветви MICRO -HOPE (MICRO RO — Microalbuminuriria, Cardiovascular and Renal Outcomes). У 3577 больных, которые принимали участие в этом исследовании, был сахарный диабет II типа. Применение рамиприла на протяжении 4,5 года приводило к достоверному на 25 % снижению частоты развития ИМ, инсульта или смерти, связанной с сердечно-сосудистой патологией. Положительный эффект препарата не зависел от его влияния на уровень АД. В исследовании MICRO -HOPE было показано, что применение рамиприла достоверно (на 24 %) снижало риск развития микроальбуминурии. Терапия рамиприлом была эффективна и в подгруппе больных с I стадией ХПН.
На протяжении последних 10 лет опубликованы результаты многочисленных исследований, в которых изучался эффект БРАН на течение диабетической нефропатии. Результаты этих исследований представляют особый интерес, поскольку включали значительное количество больных сахарным диабетом II типа, а конечные точки были четко связаны с нефропатией. В первом из них — IRMA (Irbesartrtan in patitients with type II diabetes and microalbuminuriria), основанном на наблюдении 590 больных сахарным диабетом с микроальбуминурией, было показано, что прием БРАН ирбесартана на протяжении 2 лет приводил к восстановлению нормоальбуминурии у трети больных. Выраженная нефропатия развивалась в 3 раза реже у пациентов, которые принимали БРАН.
В другом исследовании — MARVAL (MicroAlbuminuriria Reductition With VALsartrtan) проводили сравнительную эффективность вальзартана и антагониста кальция амлодипина на протяжении 24 нед у 332 больных. Было показано, что лечение вальзартаном приводило к существенному снижению протеинурии (до 56 % начального уровня), в то время как терапия амлодипином практически не влияла на этот показатель, несмотря на одинаковую степень снижения АДвобеих группах. У больных, которые принимали вальзартан, в 2 раза чаще отмечали регресс нефропатии до нормоальбуминурии, чем в группе принимавших амлодипин.
В двух других исследованиях — RE NAAL (Reductition of Endpoints in NIDDM with th e Angi otensin II Antagonist Losartrtan) и IDNT (Irbesartrtan in Diabetitic Nephr opaRh y TriTriTrial) изучаласи эффективвость БРА у пациеияов с уже развившн°ся диа(3етической неф|ропатией. Результаты исследонаний поиазали эффективность этого класса антигипертензивных средств в илане предупреждения прогрессирования поражения почек (развитие терминальных стадии ХПН) по сравнению с плацебо и антагонистами кальция (амлодипин). Поскольку степень снижения АД в группах сравнения была одинаковой, то авторы этих исследований считаюв, ото рефропронекторный эффект BPAII не заиасел от их антирипертензивного действии.
Базируясь на резиливанах эиих исследованрй, Американская администрация по коптролю за продуктами питания и лекарствими (rg Яood and Drug Adnninistr atition — FDA) рекомендовала ПРАВ кан препараты выбора для лечения таких пациентов.
Сравнение нефроп дотекторных свойств ингибиторов АПФ и БРА11 изучено в исследовании DETAIL (Diabetitics posed to TelmisarMrtan and Eяalиpriril). Первичной точкой была оценка степени снижения СКФ, определение которой проводили прямым методом. В 5-летнее наблюдение было включнно 250 (Зольных, которые получали терапию тельмизартаном или эналаприлом. При необходимрсти добавляли другие антигипертензивные средства до достижения целевого уровня АД — <130°80 мм °т. ст. При абсолютпо эквниалентном снижении АД в обеих груитах овмечали одинаковую степень снижения СКФ. Следует подчеркнуть нто и исследовании в обеих групиах был досгигнут целевой уровень снижепия СКФ — <2 мл/ мин за иод и частота смерти, связанной с сердечно-сосудивтой патологией, составила всего 5 % (!).
В текущих многоцентровых исследованиях продолжается изучение эффективности других препаратни из этой группы: вальзартнна, тельмизартана, чнрозартана, ольмезартана. Проводятся исследования по сравнению нефропротекторных свойств БРА11 тельмизартана и интЩитора АПФ рамиприла, тельмизартана и вальзартана, ольмезартана и лозартана и пр.
Безопасность применения блокаторов РАС при ренопаренхиматозной АГ
В некоторых учебниках и руководствах по лечению синдрома АГ или СН содержатся положения относительно наличия противопоказаний для назначения ингибиторов АПФ у больных с нарушенной функцией почек. Авторы объясняют такие противопоказания возможным ухудшением функции почек при применении этого класса лекарства. Следует подчеркнуть, что ни одна из фармацевтических компаний, которые разработали и производят ингибиторы АПФ на мировом рынке, не включила такие противопоказания в иеструкции для медицинского применения этих препаратов. Исследования последних лет полностью подтвердили целесообразносте и необходимость назначения рнгибиторов АПФ при заболеваниях почек.
Учитыпая возможное предубежденное отношение врачей к назначению ингибиторов АПФ, в 2001 н. Американская ассоциация сердца утвердила приведенные в табл. ИТ принцбпы брименения иагибиторов АПФ у (Зольных а поражением поеее. Особенно следует нодаеркнуть положение, что при назначении антигипертензивной тераяит и снижении АД на протяжении первых 2-3 ннес может отмечаться ертнзи торное снижен ие гломерулярной фильтрации и незначительеле повышен ие у/ровня креатинина.
Таблица 10
Принципы терапии ингибиторами АПФ: почечные аспекты (утвержденные Американской ассоциацией сердца в 2001 г.)
преимущества перед другими, выводящимися печеночным или печеночно-почечным нутем. С другой стороны, при наличии почегной дпсфункции следует назначать препараты, выводящиеся двойным путем. Энсперты Егропейского общества кардиологов в своем Консенсусе п е применению ингибиторов АПФ при сердечно-сосудистых заболеваниях (2004) высказали мненюе, что указанные фармакологические свойствк не имеют значения для достижения клиеуеескнх эффектов этихпрепаратов.
У больных с выраженной ХПН преимущество следует отдавать препаратам без или с минималвгым почечным путем! выведения (фозиноприл, спирапрел, моэксиприл). Дозу всех крепаривок, кроме моэксиприла, необходимо снигить. Препараты, блокирующие активность РАС, следует назначать под контролем уровня калия в сыворотке ирови.
Принципы назначения диуретиков у больных с ренопаренхиматозной АГ
Назначение диуретиков являетсгг важным компоноитом лечения больных с ренопаренхиматозной АГ. С одной стороны, диуретики являются патогенетически оброгованными средсттвми для снижения АД у этой категории больных — они снижают объем жидкости в организме, в том числе в сосудистом русле уменьшают отеки. С другой стороны, без их пвименении ораикечески невозможно достичь эффективного контроля АД и улучшоть функцию почек. Диуретики потенцируют антисипертензивный эффект других препаритов, особенно исгибиторов АПФ и БРАМ. Лечеоие начинают с обысоых дозо ури необходимости дозу повышают до максимильной. Пои уровне креатинина >2,5 мг/дл (220 мкмоль/л) тиазидные диуретики будкт неэффективными, а калийсберегающие диуретики противопоказаны. Пию необходимости диуретики с иоротким периодом иолувыведения (фуросемид) следует назосчатв 2-3 °азу в су/тки.
В рекомендациях АНФН (2004) указаво, чтоу болвшинства пациентов с ХЗП необходимо использовaтьдгуретики (класс I, уровень доказатеньности А). Диуретики следуег назсакитк, руководствуясь следующими принципами:
- тиазидные диуретики могут назиачать на стадии 1-3 (уровень доказательности А) — СКФ>40 лИ мин/а,73 м2 или уровень креатинина сыворотча кроки <2,5 мг/дл (220 мкмоль/л);
- петлевые диуретики могу/т назначать на всех стадиях ХЗП (уровень доквзательности /И);
- калийсберегающие диуретики не назначают:
а) на стадии ХЗП 4-5;
б) у больных, которые принимают ингибиторы АПФ или БРАН (уровень доказательности А).
При продолжительном использовании диуретиков для предупреждения риска возникновения побочных эффектов терапии следует мониторировать:
- гиповолемию (возможность развития артериальной гипотензии и, как следствие, снижение функции почек — снижение СКФ);
- гипокалиемию и другие электролитные нарушения. Интервал для мониторирования зависит от их начального уровня (смотри ниже).
При л ечении АГ п реимущество следует отдавать диуретикам продолжительного действия и/или их комбинации (лучше фиксированные) с другими интигипертензивныьми препаратами для повы1 шения благосклонности больны1х ктерапии.
Наблюдение за больными с ренопаренхиматозной АГ
Амбулаторное лечение АГ проводится непрерывно на протяжении жизни. Больныю с АГ подлежат диспанс ерному наблюдению участковыми терап евтами или семейными врачами по месту жительства. При наличии сердечно-сосудистізх осложненийили вы1совмио риска их разеития — наблюдемие у кардиолога. Прв выявлении ХЗП к программе наблюдения следует подключить нефролога и эндокринолога (при наличии сахарно го диабета). Контролю подлежат целевыт коказатели АД, С!КФ, акьбумин(к^огеи^урия. Кроме; того, дополнительно следует контролировать содержание илектролитов (калия, при необходимости натрия, хлора, иальция), глюкозык ХС и его фракций в сы1 воротке крови. При выявлении нарушений подлежат контролю коказатели белково го обмин а. Чистота визитов и нонтроля био химических показателей зависит от степенк кх нарушения. Больныю с ренопаренхиматозной АГ могут направляткуя на МСЭК (медико-социзльную зкспертную комиссию) в связи с потерей трудоспособности.
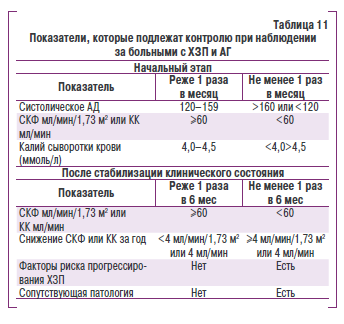
В табл. 11 приведены основные показатели, которые подлежат контролю при наблюдении за больными с ХЗП и АГ, а также частота их определения в зависимости от степени их начальные изменений.
ЛИТЕРАТУРА
- Р Рекомендації Українського товариства кардіологів з профілактики та лікування артеріальної гіпертензії (2004) Київ, 84 с.
- 1999 WHO — ISH grndelmes for the management of hypertenston (1999) J. Hypertrtenston, 11: 905-916.2003 European Society of Hypertension — European Society of Cardiology guidelines for management of arterial hypertension (2003) J. Hypertrtension, 21: 1011-1053.2007 Guidelines for the management of arterial hypertension (2007) J. Hypertrtension, 25: 1105-1187.
- Bart B.A. (1999) Concern for azotemia with convertrting enzyme inhibitors: public health implications and clinical relevance. Am. Heartrt J., 138: 801-803.
- Bjork , Mulec H., Johnsen S.A. et al. (1992) Renal protective effects of enalapril in diabetic nephr opath . Br . Med. J., 304: 339-343.
- Bjork S., Nyberg G., Mulec et al. (1986) Beneficial effects of angiotensin convertrting enzime inhibition on renal function in patients with diabetics with nephr opath y. Br . Med. J., 293: 471-474.
- de Zeeuw , Cooper M.E., Keane W.F., Parving H.H., Shahinfar S. for RENAAL Investigators. Results of losartan organ protection study. 11th European meeting on hypertension. Abstracts (2001) J. Hypertrtension, 19 (Suppl. 2): S16.
- Epstein , Tobe S. (2001) What is th e optimal str ategy to intensify blood pressure contr ol and prevent progr ession of renal disease? Curr ent Hypertrtension Reportrts, 3: 422428.
- Hallan S., Asberg , Lindberg M., Johnsen H. (2004) Validation of th e Modification of Diet in Renal Disease formula for estimating GFR with special emphasis on calibration of th e serum creatinine assay. Am. J. Kidney Dis., 44: 84-93.
- Hannendouche T, Landois P., Goldfarb B. et al. (1994) Randomized contr olled tr ial of enelapril and beta-blockers in non-diabetic chr onic renal failure. Br . Med. J., 309: 833837.
- Hansson , Zanchetti A. et al. for the HOT Study Group. (1998) Effects of intense blood pressure lowering and lowdose aspirin in patients with hypertrtension. Pr incipal results of th e Hypertrtension Optimal TrTreatment (HOTOT) randomized tr ial. Lancet, 351: 1755-1762.
- Hebert L.A., Bain P., Verme D. et al. (1994) Remission of nephr otic range proteinuria in type I diabetes. ThThe Collaborative Study Group. Kidney Int. 46: 1688-1693.
- Heinig R.E. (2002) What should th e role of ACE inhibitors be in th e tr eatment of diabetes? Lessons from HOPEOPE and MICRORO-HOPEOPE . Diabetes Obes. Metab., 4(Suppl.: S19-S25.
- Hypertension Primer. The essentials of high blood pressure. Third edition. From the council on high blood pressure research American Heart Association (2003) 532 p.
- Levey A.S., Perrone R.D., Madaio M.P. (1991) Laboratory assessment of renal disease: clearance, urianalysis and renal biopsy. In B.M. Br enner and E.R. Rector Edition. Th e Kidney. W.B. Saunders: Ph iladelphia, 919-968.
- Lewis E.J., Hunsiker L.G., Bain R.P., Rohde R.D. (1994) ThThe effect of ACE inhibition on diabetic nephrhropaththy. ThThe Collaborative Study Group. N. Engl. J. Med., 329: 1456-1462.
- Mathinsen E.R., Hommel , Giese J., Parving H.-H. (1991) Efficacy of captopril in postponing nephr opath y in normotensive insulin dependent diabetic patients with macroalbuminuria. Br . Med. J., 303: 81-87.
- Moser , Basile J., Miller E.R., Ferdinand K.C. (2002) Roundtable Discussion: Hypertrtension, Renal Disease and Diabetes. J. Clin. Hypertrtension, 4: 113-119.
- National Kidney Foundation. Clinical Practice Guidelines for Chronic Kidney Disease: Evaluation, Classification and Stratification. Executive Summary (2002) New York, 94 p.
- National Kidney Foundation. Kidney Disease Outcomes Quality Initiative. K/DOQI clinical practice guidelines on hypertension and antihypertensive agents in chronic kidney disease (2004) Am. J. Kidney. Dis., 43(5 Suppl. 1): 1-290.
- Parving H.-H., Hommel , Smidt U.M. (1988) Pr otection of kidney function and decrease in albuminuria by captopril in insulin dependent diabetics with nephr opath y. Br . Med. J., 297: 1086-1091.
- Rodby , Ruilope L., Hunsicker L., Lewis E. for the Collaborative Study Group. Results of the irbesartan type diabetic nephropathy trial. 11th European meeting on hypertension. Abstracts (2001) J. Hypertrtension, 19(Suppl.: S16.
- Ruilope L.M. (1995) Effects of angiotensin-convertrting enzyme inhibitors on th e progr ession of diabetic nephr opath J. Hypertrtens., 13(Suppl. 2): S91-S93.
- Rule , Timothy S., Larson M. et al. (2004) Using Serum Creatinine to estimate glomerular filtr ation rate: accuracy in good health and in chr onic kidney disease. Annals of Internal Medicine, 141: 929-937.
- Schoolwerth C., Sica D.A., Ballerman B.J., Wilcox C.S. (2001) Renal Considerations in Angiotensin Convertrting Enzyme Inhibitor Th erapy. AHA Scientific Statement. Circulation, 104: 1985-1991.
- Taal W., Brenner B.M. (2002) Combination ACEI and ARB th erapy: additional benefit in renoprotection. Curr . Opin. Nephr ol. Hypertrtens., 11: 377-381.
- The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure. US Department of Health and Human Service. NIH Publication No. 03-5233 (2003) 34 p.
- Toto D. (2004) Hypertrtension in chr onic kidney disease. In Secondary Hypertrtension ed. G.A. Mansoor. Humana Pr ess, Totowa, New Jersy, 39-62.
- Vervoort G., Hans L., Willems F. et al. (2002) Assessment of glomerular filtr ation rate in health y subjects and normoalbuminuric diabetic patients: validity of a new (MDRD) prediction equation. Nephr ol. Dialysis TrTranspl., 17: 1909-1913.
- Viberti , Mogensen C.E., Groop L.C., Pauls J.F. (1994) Effect of captopril on progr ession to clinical proteinuria in patients with insulin-dependent diabetes mellitus and microalbuminuria. J.A.M.A., 271: 275.2007 Guidelines for the management of arterial hypertension (2007) J. Hypertrtension, 25: 1105-1187.













Комментировать