Проблема профилактики, раннего выявления предраковых заболеваний и рака шейки матки. Систематизация современных данных по заболеваниям шейки матки и скринингу рака шейки матки.
Проблема профилактики, раннего выявления предраковых заболеваний и рака шейки матки чрезвычайно актуальна в современных условиях. 20-летний период, последовавший за распадом СССР (1991) и развалом «советской» системы диспансеризации, когда практически каждая женщина была охвачена наблюдением врача акушера-гинеколога, акушерками смотровых кабинетов, скринингом на цитологическое исследование мазка, сменился недоступностью бесплатной медицинской помощи для большого количества пациенток. Отсутствие единых стандартов ведения гинекологических больных привело к тому, что сих пор в ряде регионов РФ пользуются классификацией Василевской Л.Н., Винокур М.Л., Яковлевой И.А., Кукутэ Б.Г., (1987), разде- лением на фоновые и предраковые заболевания и нарушением общемировых стандартов ведения гинекологических больных.
При лейкоплакии, например, рутинное наблюдение недопустимо, должно быть проведено гистологическое исследование измененного участка шейки матки, т.к. под участком гиперкератоза может быть участок атипии. Деструктивные методы (крио-, ДЭК и др.) лечения шейки матки в 70 — 80% обнаружения любых измене- ний (эктопия, лейкоплакия и др.), формируют рубцы и, в дальнейшем, ложноотрицательные цитологические заключения. Сформировавшиеся в последние годы тенденции в лечении заболеваний шейки матки недоста- точно эффективны, агрессивны, и приводят к отдаленным осложнения: приросту клинически запущенных случаев рака шейки матки.
Настоящий клинический протокол призван систематизировать современные данные по заболеваниям шейки матки и скринингу рака шейки матки. Представленные диагностические и тактические алгоритмы могут быть использованы врачами акушерами-гинекологами, клиническими ординаторами, аспирантами и врачами других специальностей.
АКТУАЛЬНОСТЬ
Заболевания шейки матки встречаются с частотой 25-45%, т.е. каждая 2-3 пациентка требует дополнитель- ных методов обследования (цитология, ВПЧ — тестирование, кольпоскопия) с целью точной диагностики и определения правильной тактики.
Рак шейки матки — вторая по частоте злокачественная опухоль женских половых органов в Российской Феде- рации. Распространенность на 100 000 населения составляла в 2000 г. — 116,4; в 2009г. — 111,6, в 2010 г. -112,6, т.е. не имеет тенденции к снижению. Отмечается прирост в 2 раза больных, у которых заболевание выявлено в стадии cr. in situ, в сравнении в 2000 г. (11,4%) из всех больных раком в 2010 г. (21%), что характеризует повышение квалификации врачей акушеров-гинекологов и улучшение качества диагностических мероприятий в РФ. Вместе с тем, удельный вес больных с запущенными стадиями опухолевого процесса (III- IY стадия) от числа больных с впервые в жизни установленным диагнозом злокачественного новообразования в России в 2000г. составлял 39,2%, в 2010 г. 38,1%, и, не имеет тенденции к снижению [1].
Около 47% больных раком шейки матки моложе 35 лет. С 1993 по 2010 г.г. прирост женщин моложе 35 лет с раком шейки матки составил более 150% [2].
Программы цитологического скрининга рака шейки матки проводятся с 50-х годов XX века в США, с 60-х го- дов — в Японии, Финляндии, Швеции, Исландии и др., с 70-х годов — в Германии, Бразилии и других странах. Критериями оценки эффективности скрининга являются снижение показателей заболеваемости, смертности от рака шейки матки, а также изменение структуры заболеваемости за счет увеличения количества ранних стадий рака, уменьшения запущенных форм. При правильно организованном цитологическом скрининге эф- фективность его достаточно высока: В Исландии, где общенациональные программы охватывали почти все возрастные группы (29-59 лет) и охват женщин приближался к 100%, смертность от рака шейки матки снизи- лась за 20-летний период на 80%. В Финляндии и Швеции — на 50% и 34% соответственно. В Дании приблизительно 40% населения было охвачено скринингом , и смертность снизилась на 25%. В Норвегии, где только 5% населения принимало участие в скрининге, смертность от рака шейки матки снизилась лишь на 10%[3]. В РФ не отмечено, каких либо значительных улучшений в период с 2000 по 2010 г.г., количество запу- щенных форм, смертность от рака шейки матки сохраняется на высоких цифрах, что требует улучшения диагностики, своевременного лечения и внедрения единой врачебной тактики во всех медицинских учреждениях.
ФАКТОРЫ РИСКА РАКА ШЕЙКИ МАТКИ:
1. Сексуальный дебют до 17лет [4, 5].
2. 3 и более партнеров в течение года [6].
3. Более 6 половых партнеров в течение жизни (ИППП [7,8].)
4. Иммунодефицитные состояния (ВИЧ) [9,10], после трансплантации органов [11]
5. Снижение количества лактобатерий во влагалище (вагинозы, вагиниты) [12,13]
6. Курение [14, 15]
7. Авитаминозы [16], низкий социально-экономический уровень
8. Урбанизация [17]
9. Женщины, половые партнеры, которых имели половые связи с женщиной, умершей от рака шейки ма- тки
10. Женщины, половые партнеры, которых имели множество половых связей, и/или генитальные ВПЧ -ассоциированные поражения, или карциному полового члена [18].
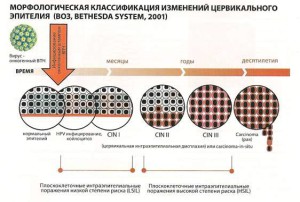
РАК ШЕЙКИ МАТКИ — ОНКОЗАБОЛЕВАНИЕ С ДОКАЗАННОЙ ВИРУСНОЙ ЭТИОЛОГИЕЙ
Ведущая роль в возникновении рака шейки матки отводится ВПЧ, который передается половым путем, ши- роко распространен в популяции, высоко контагиозен, реплицируется в клетках хозяина.
В настоящее время идентифицировано более 140 различных типов ВПЧ, более 40 типов обладают способ- ностью инфицировать генитальный тракт. Все типы ВПЧ делятся на две категории:
с высоким онкогенным риском — 16,18, 31. 33, 35, 39,45, 51, 52, 56, 58,59, 66,68, 73, 82
с низким онкогенным риском — 6, 11, 36,42,43,44,46,47, 50
Принадлежность к той или категории определяется выявляемостью конкретного типа ВПЧ в раковых опухолях.
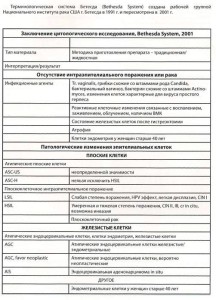
Главный недостаток цитологического исследования традиционного Пап — мазка из шейки матки — большая доля (до 20-40%) ложноотрицательных заключений.
Ошибки цитологического метода более чем в 60% определяются качеством взятия и подготовки материала для исследования:
- недостаточное количество эпителиально-клеточного материала в мазке,
- неравномерное распределение биологического материала на стекле,
- большое содержание слизи, элементов воспаления, элементов периферической крови, высокая частота артефактов по причине высыхания препарата после взятия мазка (отсутствие влажной фиксации),
- неполное прокрашивание клеточного материала, связанное с его многослойностью (толстый мазок).
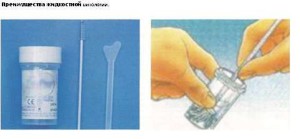
ЖИДКОСТНАЯ ЦИТОЛОГИЯ — НОВЫЙ СТАНДАРТ ПРОВЕДЕНИЯ ЦИТОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ
БИОМАТЕРИАЛА ИЗ ШЕЙКИ МАТКИ
Жидкостная цитология — это новая стандартизированная технология приготовления цитологического препарата. Рекомендована ВОЗ в качестве «золотого стандарта» для исследования мазков со слизистой цервикального канала и влагалищной части шейки матки.
1. Улучшенное качество материала:
в контейнер со стабилизирующим раствором попадает весь полученный эпителиально-клеточный материал;
минимизируется содержание слизи, элементов периферической крови, элементов воспаления, разрушенных клеток;
клетки сохраняют как морфологические, так и молекулярно-биологические свойства.
2. Длительный срок хранения полученного биоматериала:
забор материала осуществляется в специальный стабилизирующий раствор Preserv-Cyt, который предотвращает преждевременное высыхание клеток, уменьшает частоту ложноположительных результатов
3. Приготовление нескольких цитологических препаратов.
4. Приготовление стандартизованного монослойного мазка.
5. Проведение дополнительных методов диагностики (количественный ВПЧ-тест, обследование на ИППП), без повторного гинекологического осмотра
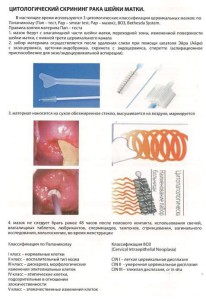
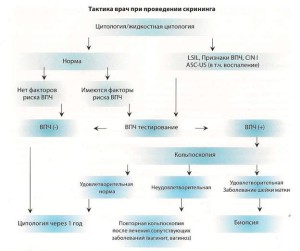
РЕКОМЕНДАЦИИ по проведению цитологического скрининга на рак шейки матки:
1. Стартовый возраст 25 лет, возраст окончания скрининга 65 лет
2. Интервалы при проведении: каждые 3 года у женщин моложе 50 лет, каждые 5 лет с 50 до 65 лет
3. После 65 лет показания для скрининга для каждой женщины определяются индивидуально
ВПЧ — ТЕСТИРОВАНИЕ — МЕТОДЫ ВЫЯВЛЕНИЯ ДНК ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА
Анализ на ВПЧ позволяет выявить на 30-100% больше предраковых заболеваний, чем традиционное цито- логическое исследование, и на 20-50% больше чем жидкостная цитология [19,20].
Виды ВПЧ — тестов
1. Полимеразная цепная реакция (ПЦР) — многократное копирование определенного участка вирусной
ДНК типоспецифичесикми и видооспецифическими праймерами
2. ПЦР real-time — в реальном времени оценивается вирусная нагрузка, дифееренциорцются клинически значимые количества ВПЧ от малозначимых
3. Молекулярная гибридизация II поколения (Hybrid Capture II) — формирование специфических ДНК-ДНК
гибридов, улавливаемых антителами. Качественная и количественная оценка результатов.
4. ВПЧ Digene-тест-определяет клинически значимую концентрацию вируса, в копиях ДНК ВПЧ на 1 мл образца.
Высокая ВПЧ нагрузка от 107 копий /мл и более риск рака шейки матки
Умеренная ВПЧ нагрузка 105 -107 копий/мл — наличие CIN Клинически малозначимое количество ВПЧ — менее 105 копий/мл
Рекомендации по применению ВПЧ — теста в скрининге рака шейки матки
1. От 25 до 65 лет при наличии факторов риска ВПЧ инфекции (см. выше)
2. У женщин старше 30 лет в первичном скрининге в качестве самостоятельного теста или в сочетании с цитологическим исследованием
3. Определение тактики у пациенток с ASCIIS
4. Оценка эффективности лечения HSIL, cr. in situ, инвазивного рака
Метод кольпоскопии.
Кольпоскопическое исследование — методичный осмотр нижнего отдела генитального тракта с увеличением
и хорошим освещением. Основные задачи кольпоскопии:
1. Отличить норму от заболевания органов нижнего отдела генитального тракта
2. Сформировать мнение о доброкачественности процесса, прединвазивного поражения или рака шейки матки
3. Обеспечить биопсию из очагов при LSIL, cr. in situ Чувствительность метода 87-99%, специфичность 23-87% [21]
Метод кольпоскопии не может быть использован для установления диагноза.Гистологическое исс- ледование.
Не является скрининговым тестом, выполняется по определенным показаниям, дополняет цитологический метод и ВПЧ тест для верификации диагноза.
Профилактика рака шейки матки.
Первичная — проведение мероприятий в отношении лиц, не имеющих признаков заболевания, с целью пре- дотвращения его развития в дальнейшем:
вакцинопрофилактика, ограничение факторов риска
Вторичная — раннее выявление и лечение лиц, имеющих заболевания шейки матки, с целью предупрежде- ния в последующем развитие инвазивного рака
Библиографический список:
1. Состояние онкологической помощи населению россии в 2010 году/под. ред. В.И. Чиссова, В.В., Старинско- го, Г.В. Петровой. — М.: ФГУ «МНИОИ им. П.А. Герцена» Минздравсоцразвития России, 2011.-188с.
2. Заболевания шейки матки: Руководство для врачей (изд. 2-е, перерарб. И доп.) / Т.Е. Белокриницкая, Е.С.Свердлова. — Чита, 2011. — 48 с.
3. Махсон А.Н., Сдвижков A.M., Евтягин В.В., Цыганкова Н.Г., Кропачева Т.Д., Васильева И.Д., Борисов В.И. Скрининг для выявления рака шейки матки в Москве// Протокол заседания московского общества онкологов (29 марта 2012 г.)// http://www.oncology.ru/
4. Altekruse S.F., Lacey J.V Jr., Brinton L.A. Comparison of human papillomavirus genotypes, sexual, and reproductive risk factors of cervical adenocarcinoma and squamous cell carcinoma: Northeastern United States // Am. J. Obstet. Gynecol. 2003. Mar.;188 (3):657-63.
5. Schlecht N.F., Franco E.L., Rohan Т.Е. Repeatability of sexual history in longitudinal studies on HPV infection and cervical neoplasia: determinants of reporting error at follow-up interviews // J. Epidemiol. Biostat. 2001; 6 (5):393- 407.
6. Семенов Д.М. Триггерные факторы, определяющие клиническое течение папилломавирусной инфекции у женщин с патологией шейки матки // Охрана материнства и детства. 2006. №2 (8). С.98-106.
7. Franco Е., Duarte-Franco Е., Ferenczy A. Cervical cancer: epidemiology,prevention and role of human papillomavirus infection //GMA/ 2001;164:1017-1025
8. Новиков А.И., Кононов А.В., Ваганова ИТ. Инфекции, передаваемые половым путем, и экзоцервикс. М.: Медицина, 2002. С. 34-59.
9. Vernon S.D., Holmes К.К., Reeves W.C. Human papillomavirus infection and associated disease in persons infected with human immunodeficiency virus //Clin. Infect. Dis. 1995. Aug.; 21 Suppl 1:5121—4.
10. Lipsey L.R., Northfelt D.W. Anogenital neoplasia in patients with HIV infection //Curr. Opin. Oncol. 2003. Sep.; 5 (5):861-6.
11. Дранник Г.Н. Клиническая иммунология и аллергология / М.: Мед.информ. агентство, 2003. С. 113-127.













Комментировать