Астма физического напряжения: общая характеристика заболевания. Различие между терминами «бронхоспазм» и «астма физического напряжения». Медикаментозные методы лечения. Результаты проведенного исследования по анализу реакции дыхательной системы на физическую нагрузку у детей с бронхиальной астмой, получающих левокарнитин. Оценка состояния сердечно-сосудистой системы у детей с бронхиальной астмой, имеющих постнагрузочный бронхоспазм и получающих левокарнитин, и физической работоспособности детей с бронхиальной астмой, получающих левокарнитин.
Г. А. Новик, доктор медицинских наук, профессор, ГБОУВПО СПбГПМА Минздравсоцразвития России, Санкт-Петербург
Ключевые слова: бронхиальная астма, астма физического напряжения, метаболическая терапия, бронхоспазм, физическая дезадаптация, триггер, обструкция дыхательных путей, удушье, нагрузочный тест, спирография.
В последние десятилетия отмечается значительный рост интереса специалистов к проблеме бронхиальной астмы и физической нагрузки. Это связано, с одной стороны, с созданием удобной модели для изучения обратимого бронхоспазма у больных, страдающих бронхиальной астмой, с другой стороны, с постоянно интригующей загадкой для специалистов в виде необоснованной легкости возникновения приступа и быстротой его обратного развития. Актуальность проблемы обусловлена и необходимостью создания рефрактерности больного к физической нагрузке. Наличие физической дезадаптации больного бронхиальной астмой — это один из основных психоэмоциональных стрессовых факторов, мешающих нормальному образу жизни пациента.
Особенно важной эта проблема становится у детей, для которых характерен подвижный образ жизни. Астма физического напряжения (Exercise-induced asthma, EIA) довольно часто отмечается и у взрослых людей, когда они подвергаются сильной и длительной физической нагрузке. У взрослых, больных бронхиальной астмой, сформированная физическая интолерантность приводит к потере работоспособности и ранней инвалидизации.
Под астмой физического напряжения понимают острый, обычно произвольно проходящий бронхоспазм, наступающий во время физической нагрузки или непосредственно сразу после нее. По литературным данным, частота астмы напряжения варьирует от 30% до 90% в зависимости от применяемых критериев определения болезни и исследования [23, 29, 36]. Симптомы и обострения бронхиальной астмы провоцируются многочисленными триггерами, в том числе вирусными инфекциями, аллергенами, физической нагрузкой, табачным дымом и другими поллютантами. В одном из последних международных документов по бронхиальной астме у детей констатируется [38], что возраст и характерные триггеры могут быть использованы для выделения фенотипов заболевания (рис. 1).

По мнению 44 международных экспертов из 20 стран, выделение отдельных фенотипов может быть целесообразным, поскольку бронхиальная астма у детей является гетерогенной. Будучи частью «синдрома астмы», фенотипы бронхиальной астмы не являются отдельными заболеваниями. Рекомендации, учитывающие различные фенотипы астмы, должны помочь оптимизировать тактику лечения и прогноз.
Использование самых современных иммунологических и инструментальных методов исследования позволяют однозначно придти к выводу, что физическая нагрузка является одним из важнейших неиммунологических и нефармакологических стимулов, которые приводят к развитию острого спазма дыхательных путей у больных с бронхиальной астмой. Астма физического усилия — это одно из проявлений гиперчувствительности дыхательных путей, а не особая форма астмы. По мнению ряда исследователей, понятие «бронхиальная астма физической нагрузки» подразумевает развитие постнагрузочного бронхоспазма у больных атопической бронхиальной астмой. Это мнение нашло отражение в материалах Консенсуса «Бронхиальная астма. Глобальная стратегия» (2008—2011) и «Бронхиальная астма у детей. Стратегия лечения и профилактика» (2006), в клинических материалах для педиатров «Аллергология и иммунология» под редакцией А. А. Баранова и Р. М. Хаитова (2011) [1—3].
Признаки EIA достаточно хорошо выявляются с помощью сбора анамнеза и объективного обследования во время проведения функциональных нагрузочных тестов.
После физической нагрузки (бег, тестирование на велоэргометре или степ-тесте) в течение 6 мин у части больных с бронхиальной астмой отмечается бронхоспазм, остро развившийся через 2, 5 или 10 мин. Наступившая обструкция дыхательных путей обычно ощущается пациентом как удушье и легко регистрируется с помощью функциональных тестов, отражающих скоростные изменения выдыхаемого потока воздуха — пиковая скорость выдоха (ПСВ), максимальная объемная скорость (МОС25 50 75), объем форсированного выдоха за 1 сек (ОФВ1) [16, 37]. В течение первых нескольких минут нагрузки отмечается фаза расширения бронхов, которая в конце нагрузочной пробы сменяется бронхоспазмом [36]. EIA страдают до 90% больных бронхиальной астмой и 40% пациентов с аллергическим ринитом; среди атлетов и в общей популяции распространенность колеблется от 6% до 13%. EIA часто остается не выявленной. Приблизительно 9% больных EIA не имеют никаких клинических признаков астмы или аллергии [9].
Большинство больных с тяжелой формой бронхиальной астмы уже через 3—4 мин нагрузки вынуждены прервать проведение пробы из-за быстро наступившего бронхоспазма. На протяжении последующих 30—60 мин бронхоспазм проходит. В этот период больной рефрактерен к физической нагрузке, и только после его окончания повторная нагрузка вновь приводит к развитию обратимого, но значительно менее выраженного бронхоспазма [17, 24].
Следует различать два часто используемых в литературе термина:
- бронхоспазм, вызванный физической нагрузкой (Exercise-induced bronchospasm, EIB) — бронхообструкция и спазм, возникающие в ответ на физическую нагрузку у человека с нормальной функцией легких в покое;
- Астма физического напряжения (Exercise-induced asthma, EIA) — затруднение дыхания у пациента с астмой во время и после физнагрузки. Снижение ОФВ1по сравнению с донагрузочным более чем на 15% обычно у казывает на на ли чие EIA. По данным ряда исследований, показатель ОФВ0,5 описывает бронхоконстрикцию лучше, чем ОФВ1, и лучше коррелирует со степенью выраженности клинических симптомов бронхиальной астмы. Снижение ОФВ0,5 на 13% по сравнению с донагрузочным значением является достоверным клиническим параметром наличия астмы физического напряжения [35].
Патогенез обратимой обструкции при астме физического усилия, несмотря на интенсивное изучение, остается не до конца уточненным [7, 9, 18].
Одним из основных механизмов является охлаждение слизистой дыхательных путей вследствие гипервентиляции, обусловленной физической нагрузкой (так называемая респираторная потеря тепла). Охлаждение дыхательных путей — это один из основных пусковых механизмов EIA, так как даже одна гипервентиляция без физической нагрузки, вызывающая снижение температуры слизистой, может привести к бронхоспазму [35, 37].
Высушивание слизистой оболочки дыхательных путей за счет респираторной потери воды приводит к повышению осмолярности на поверхности слизистой. Это, в свою очередь, ведет к дегрануляции тучных клеток и раздражению ирритантных рецепторов слизистой оболочки дыхательных путей [15, 25].
Продукты метаболизма арахидоновой кислоты имеют существенное значение в развитии EIA. Блокада лейкотриеновых рецепторов приводит к значительному уменьшению постнагрузочного бронхоспазма [16]. Физические усилия увеличивают продукцию лейкотриенов, в том числе лейкотриенов С4, D4 и E4, играющих значительную роль в формировании бронхоспазма. Даже у здоровых людей после значительной физической нагрузки происходит активация генов ALOX и ALOX5 AP, кодирующих 5-липоксигеназу (5-ЛО), 5-липоксигеназ-активирующий протеин (FLAP), p38 митоген-активируемую протеинкиназу (MAPK). Физическое усилие влияет на активность факторов транскрипции, таких как ядерный фактор каппа Б (NF-kB), активаторный протеин-1 (AP-1), на образование ряда цитокинов и хемокинов, участвующих в формировании аллергического воспаления [4].
Легочный сурфактант препятствует спадению узких дыхательных путей. Воспаление, сопровождающееся пропотеванием плазменных белков в просвет дыхательных путей, приводит к потере сурфактантом части этих свойств, особенно в условиях понижения температуры слизистой оболочки бронхов во время физических упражнений или в холодное время года у больных с EIA [14].
Для понимания механизма бронхоспазма, возникающего у больных с EIA, представляется интересным сообщение группы японских исследователей, изучавших состояние адренорецепторного аппарата клеток у больных с бронхиальной астмой. У больных с EIA имеет место несоответствие между концентрацией адреналина во время физической нагрузки и количеством рецепторов, способных воспринять этот медиатор [23].
Вполне вероятно, что патогенез EIA многофакторный и зависит, в первую очередь, от баланса гуморальных и нервных механизмов регуляции бронхотонуса.
Несмотря на имеющиеся противоречия, неуточненный патогенез заболевания, следует признать правомочность следующего суждения: у больных EIA астма возникла не вследствие физической нагрузки, и физическая нагрузка не является единственным провоцирующим фактором у этих пациентов. Реакция на физическую нагрузку есть проявление сформировавшейся гиперреактивности бронхов, присущей любой форме бронхиальной астмы.
Медикаментозные методы лечения EIA
Большое количество лекарств блокирует постнагрузочный бронхоспазм. Короткодействующие бета-2-агонисты обеспечивают защиту 80—95% больных EIA с незначительным побочным эффектом, М-холинолитики — 50—70%. Эти препараты долгие годы рассматривались как терапия первой линии. С созданием двух пролонгированных бронхолитических средств — сальметерола и формотерола — начался новый этап эффективного предотвращения постнагрузочного бронхоспазма. Ингаляция 50 мкг сальметерола защищает от EIA в течение 9 часов. Однако при продолжительном ежедневном приеме появляется тенденция к уменьшению эффективного времени защиты [9].
Хроническому аллергическому воспалению слизистой дыхательных путей придается ведущее значение в патогенезе EIA, однако данные об эффективности противовоспалительных препаратов у этой группы больных многочисленны, но противоречивы [21].
Назначение ингаляционных глюкокортикостероидов (ИКС) до нагрузки не предотвращает развитие удушья [19, 28, 29]. У 50% больных, получающих ингаляционные кортикостероиды с хорошо контролируемым эффектом лечения, сохраняются признаки EIA [21, 24]. У больных EIA 53% максимального профилактического эффекта будесонида было получено при назначении низких доз и 83% при назначении высоких доз. При EIA применение ИКС с профилактической целью требует назначения значительно больших доз, чем для осуществления контроля за заболеванием [29, 13]. У 59% больных, получающих будесонид и сальбутамол длительным курсом (22 мес), сохранились признаки EIA. Большие дозы ИКС могут контролировать бронхоспазм, вызываемый физической нагрузкой [13].
Заслуживают внимания сообщения об успешном использовании для предупреждения EIA ингибиторов или антагонистов лейкотриенов, влияющих на аллергическое воспаление слизистых дыхательных путей [8, 10].
Кромоглициевая кислота (Интал) эффективен у 70—87% больных с диагностированной EIA и имеет минимальный побочный эффект. Недокромил натрия (Тайлед) обеспечивает равнозначный защитный эффект у детей [20, 24]. Этот препарат предотвращает развитие бронхоспазма у части больных EIA. Причем протективный эффект сильнее при выраженном бронхоспазме [32]. Однако полученные в последнее время сведения о сравнительной с плацебо эффективности Интала ставят под сомнение целесообразность использования кромонов в лечении бронхиальной астмы.
Бронхоспастический эффект провокационного теста с физической нагрузкой не удалось выявить у 53% больных EIA, получавших Бета-каротин в суточной дозе 64 мг в сутки в течение 1 недели. Бета-каротин является активным антиоксидантным препаратом, что, по-видимому, объясняет этот эффект [26]. Аналогичный эффект был получен у 55% больных с EIA при назначении Ликопина, также относящегося к антиоксидантам, в дозе 30 мг в день в течение 1 недели, предшествующей провокационной пробе [27].
Возможности применения метаболиков (левокарнитина) у детей с бронхиальной астмой со сниженной толерантностью к физической нагрузке
Использование короткодействующих бета-2-агонистов и М-холинолитиков эффективно предотвращает формирование постнагрузочного бронхоспазма у большинства больных бронхиальной астмой. Однако использование медикаментозной защиты у больных бронхиальной астмой перед предполагаемой физической нагрузкой, иногда даже незначительной, не всегда оправдано, так как подчеркивает психосоциальную дезадаптацию пациента. Поэтому во всем мире продолжается активный поиск новых препаратов, обладающих профилактическим действием в отношении постнагрузочного бронхоспазма.
Достаточно перспективный путь в лечении и профилактике постнагрузочного бронхоспазма — это использование метаболиков. Медикаментозная коррекция метаболических нарушений может привести к формированию толерантности к физической нагрузке у больных бронхиальной астмой.
Левокарнитин является активным метаболиком и существенно влияет на биоэнергетические процессы. Играет жизненно важную роль в обеспечении физиологических функций организма и поддержании здоровья.
Любая физическая нагрузка выполняется с затратами энергии. Единственным источником энергии для мышечного сокращения служит аденозинтрифосфат (АТФ). Именно карнитин принимает непосредственное участие в катаболизме липидов, обеспечивая его начальные этапы — перенос длинноцепочечных жирных кислот в виде сложных эфиров из цитоплазмы через наружную и внутреннюю митохондриальные мембраны в матрикс митохондрий.
Энергетические возможности организма являются одним из наиболее важных факторов, лимитирующих его физическую работоспособность.
Целью нашего исследования явилось изучение возможности использования левокарнитина (препарата Элькар®) для профилактики постнагрузочного бронхоспазма у детей с бронхиальной астмой.
Задачи исследования
- Провести анализ реакции дыхательной системы на физическую нагрузку у детей с бронхиальной астмой, получающих левокарнитин.
- Оценить состояние сердечнососудистой системы у детей с бронхиальной астмой, имеющих постнагрузочный бронхоспазм и получающих левокарнитин.
- Оценить физическую работоспособность детей с бронхиальной астмой, получающих левокарнитин.
Материалы и методы. Обследован 61 ребенок в возрасте от 6 до 18 лет, страдающий бронхиальной астмой. Основная группа — дети с бронхиальной астмой (n = 39), имеющие подтвержденный постнагрузочный бронхоспазм и получающие левокарнитин (Элькар®) ежедневно в течение 2 месяцев в дозах, рекомендованных производителем (по 200—300 мг 2—3 раза/сут, суточная доза — 400—900 мг). Контрольная группа (n = 22) левокарнитин не получала. Наличие постнагрузочного бронхоспазма было верифицировано с помощью стандартного нагрузочного теста.
Нагрузочный тест. Нагрузочная проба была проведена на велоэргометре, степ-тесте или тредмиле. Проба двухступенчатая с мощностью нагрузки 1—1,5 и 2—2,5 Вт/кг до выявления пороговой реакции. Время проведения пробы — 6 минут. Частота вращения педалей на велоэргометре — 60 об./мин. Проба проводилась с одетым носовым зажимом. До пробы у больного регистрировали ЭКГ и проводили спирографическое исследование. Непосредственно перед исследованием осуществляли подсчет пульса, измерение АД, пикфлоуметрию. В дальнейшем подсчет пульса проводился на 3-й минуте от начала проведения пробы и через 5 минут после ее окончания. АД измеряли сразу и через 5 минут после окончания пробы. Выявление нарушения бронхиальной проходимости регистрировалось с помощью пикфлуометра (ПСВ) и контролировалось аускультативно и с помощью спирограммы.
Нагрузочная проба считалась положительной при появлении клинически выявленного бронхоспазма (ослабление дыхания), сухих свистящих хрипов и/или снижении показателей ПСВ через 5 минут от окончания тренировки на 15% и более по данным пикфлоуметрии и/или других «скоростных» показателей спирографии (ОФВ1, МОС25, 50, 75).
Физическая работоспособность (Physical Work Capacity, РWС) определена расчетным методом с помощью модифицированной формулы, предложенной В. Л. Карпманом (1969) [5]:
PWC170 = N нагрузки х (170 — СС покоя)/ЧСС при 2-й нагрузке — ЧСС покоя (кг х м/мин)
Особенности реакции гемодинамики на нагрузку определяли по следующим показателям:
- индекс хронотропного резерва — ИХР (ΔЧСС/ЧССисх);
- индекс интропного резерва — ИИР (ΔСАД/САДисх);
- прирост систолического (САД) и диастолического АД (ДАД) по отношению к приросту ЧСС (ΔСАД/ΔЧСС и ΔДАД/ΔЧСС);
- индекс эффективности работы сердца (ИЭРС) по формуле P. Aptekar (1982)
ИЭРС = 100 PWC : ЧСС х САД х S х 10-2 (S — поверхность тела в м2);
- вегетативный индекс Кердо (ИК)
ИК = (1 — ДАД/ЧСС) х 100
Использовались следующие функциональные методики:
1) спирография с анализом кривой поток—объем (до и после окончания курса лечения левокарнитином);
2) дыхательное мониторирование [4];
3) электрокардиографическое исследование;
4) нагрузочные пробы с функциональным контролем показателей дыхательной и сердечно-сосудистой систем проведены у обследованных детей до начала лечения левокарнитином (препаратом Элькар®) и после окончания 2-месячного курса лечения.
Результаты исследования
Представлены результаты обследования и лечения 61 ребенка с бронхиальной астмой. Дети в возрасте до 7 лет составляли 1,6%, от 7 до 10 лет — 24,6% и старше 10 лет — 73,8%. Соотношение мальчиков и девочек — 2,8:1. У 78,7% больных выявлена бытовая сенсибилизация, у 21,3% — сочетание бытовой и пыльцевой аллергии. Больные с легким и среднетяжелым течением составили 80,3%. Связь приступов удушья с физической нагрузкой отмечалась у 63,9% детей, с резкими запахами — у 37,7%, с переменой погоды — у 41%. Проявления пищевой аллергии наблюдались у 36,1% больных. Средний возраст формирования бронхиальной астмы составил 8 лет 2 месяца, средняя продолжительность заболевания на момент обследования — 7 лет 4 месяца. Больные получали базисную терапию ингаляционными глюкокортикостероидами в дозе от 200 до 800 мкг по беклометазону.
В табл. 1 представлены данные о формировании толерантности к физической нагрузке у детей с бронхиальной астмой в процессе лечения левокарнитином (препаратом Элькар®). У 15,3% больных основной группы до лечения отмечена положительная реакция на нагрузку 1,0 Вт/кг, что свидетельствовало о крайней степени дезадаптации к физической нагрузке и высокой степени гиперреактивности бронхов. У 56,4% тест оказался положительным на нагрузку 1,5 Вт/кг и у 28,3% — на 2,0 Вт/кг. Вполне сопоставимые результаты были в контрольной группе: у 18,2% больных отмечена положительная реакция уже на нагрузку 1,0 Вт/кг, у 68,2% — на нагрузку 1,5 Вт/кг и у 13,6% нагрузка в 2,0 Вт/кг вызывала бронхоспазм (табл. 1).
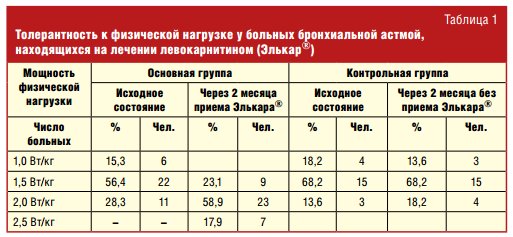
После окончания 2-месячного курса левокарнитина толерантность у больных достоверно возросла (р < 0,001). Так, ни у одного из больных основной группы мощность нагрузки в конце курса не составляла 1,0 Вт/кг и 17,9% удалось увеличить нагрузку до 2,5 Вт/кг. В контрольной группе достоверных отличий в тесте на определение толерантности к физической нагрузки получено не было.
РWC больных бронхиальной астмой значительно снижена по сравнению со здоровыми. У наблюдавшихся детей она составила 63,8% от максимальной нагрузки в основной группе и 61,3% в контрольной группе, что может быть расценено как крайне низкая толерантность к физической нагрузке (табл. 2).

Через 2 месяца приема левокарнитина (препарата Элькар®) показатель PWC в основной группе повысился до 74,8% от максимальной нагрузки. Однако достигнутый уровень физической работоспособности остался еще не удовлетворительным. Повышение работоспособности больных бронхиальной астмой, другими словами, социальная адаптация пациентов к физической нагрузке — важнейшая цель проводимой комплексной терапии.
У здоровых людей (лиц, не страдающих бронхиальной астмой) проведение нагрузочного теста приводит сразу после окончания теста к повышению значение ПСВ и через 5 минут этот показатель остается выше исходного значения. У больных бронхиальной астмой с непереносимостью физической нагрузки в результате нагрузочного теста сразу после нагрузки происходит либо снижение показателей ПСВ, либо их незначительное повышение, но не более чем на 5% от исходного уровня. Через 5 минут после окончания теста происходит существенное падение значений ПСВ, как правило, более чем на 15—20%.
В обследуемой нами группе больных, не получающих левокарнитин, показатели динамики ПСВ изменились схожим образом. Сразу после нагрузки АПСВ выросла в среднем на 5,6%, а через 5 минут значение ПСВ снизилось на 18,9% (рис. 2). У больных, получавших в течение 2 месяцев левокарнитин (Элькар®), реакция на нагрузку кардинально изменилась.
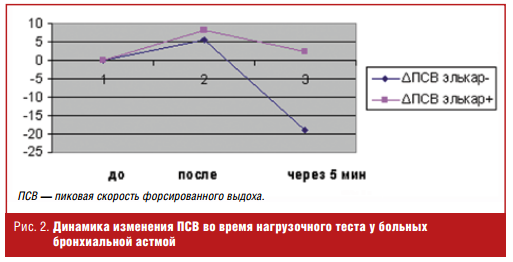
Сразу после нагрузки прирост ПСВ составил в среднем 8,2% (р < 0,05), а через 5 минут после окончания теста с физической нагрузкой показатель ПСВ вырос на 2,5% (р < 0,001).
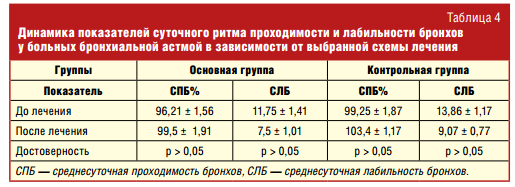
Анализ влияния приема левокарнитина на проходимость дыхательных путей по данным спирографического исследования у больных бронхиальной астмой приведен в табл. 3.

Изменение показателей функции внешнего дыхания у больных, находящихся в периоде ремиссии бронхиальной астмы, не достигло уровня достоверности и не зависело от приема левокарнитина. Как представлено в табл. 4, изучение динамики показателей суточного ритма бронхов также не позволило выявить связь между приемом левокарнитина и изменением среднесуточной проходимости бронхов (СПБ) и среднесуточной лабильности бронхов (СЛБ).
Для выяснения влияния приема левокарнитина на формирование толерантности к физической нагрузке и реакции сердечно-сосудистой системы на нагрузочный тест дополнительно была обследована контрольная группа детей (n = 16), не имеющих патологии органов дыхания и заболевания сердца и сосудов.
Характеристика гемодинамических показателей свидетельствует о неадекватной реакции сердечно-сосудистой системы на физическую нагрузку у больных бронхиальной астмой.
Особенности реакции гемодинамики на нагрузку до лечения, оцениваемые по индексу хронотропного резерва, заключались в более низких значениях этого показателя. Возможно, это связано с использованием более низких нагрузок у детей с бронхиальной астмой по сравнению с группой здоровых детей (табл. 5).
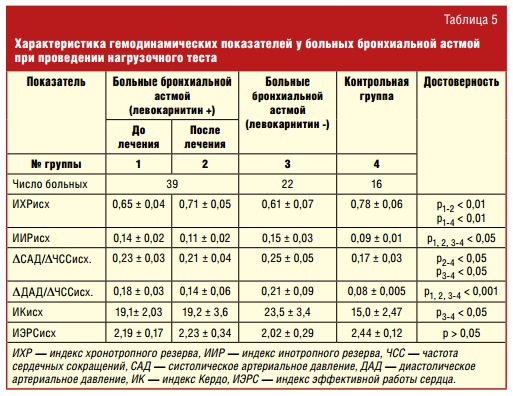
У здоровых детей при физической нагрузке происходит ускорение кровотока, снижение периферического сопротивления, пропорциональное повышение САД из-за увеличенного сердечного выброса при, как правило, неизмененном ДАД. Больные бронхиальной астмой реагировали на физическую нагрузку неадекватно более высоким подъемом САД, значительным колебанием ДАД. Увеличение минутного объема кровообращения обеспечивалось главным образом не ЧСС, а неадекватным нагрузке приростом ударного объема, что отмечается у здоровых детей только в начальной фазе работы малой и средней интенсивности. Такую работу сердца в условиях физической нагрузки следует расценить как неэкономичную, приводящую в дальнейшем к истощению миокарда.
Использование левокарнитина существенно повлияло на гемодинамические показатели у детей с бронхиальной астмой (рис. 3).
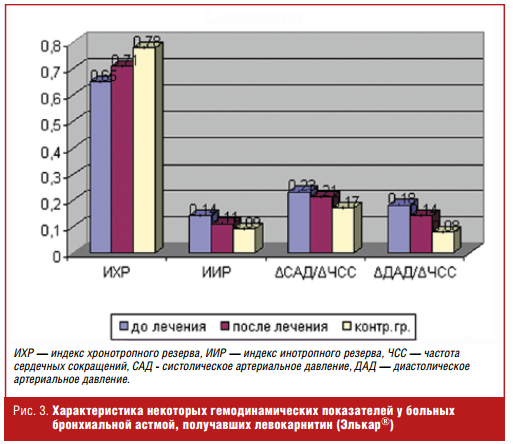
После проведения 2-месячного курса левокарнитина (препарат Элькар®) у больных с нарушенной адаптацией к физической нагрузке отмечалось достоверное повышение ИХР и снижение ИИР, а также индексов, отражающих прирост систолического и диастолического АД (ΔСАД/ΔЧСС и ΔДАД/ΔЧСС). Данную реакцию кардиореспираторной системы можно рассматривать как более адекватную с тенденцией к нормальному ответу на физическую нагрузку. Использование левокарнитина существенно не повлияло на состояние вегетативной нервной системы, так как индекс Кердо достоверно не менялся после приема препарата (рис. 4).
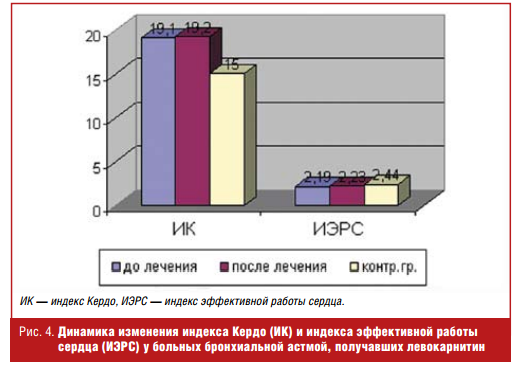
В целом при возросшей физической работоспособности реакция сердечнососудистой системы после курса приема левокарнитина (препарата Элькар®) стала более адекватной и эффективной.
Выводы
- Использование левокарнитина (препарата Элькар®) приводит к формированию толерантности к физической нагрузке у детей с бронхиальной астмой. После окончания 2-месячного курса левокарнитина больные бронхиальной астмой начинают переносить пороговые значения физической нагрузки. Почти у 18% больных формируется переносимость нагрузки в 2,5 Вт/кг, что соответствует нагрузке, возникающей при беге «трусцой».
- Левокарнитин (Элькар®) существенно повышает общую физическую работоспособность у больных бронхиальной астмой, хотя и составляет 74,8% от максимальной по тесту PWC170.
- Прием левокарнитина существенно не меняет показатели функции внешнего дыхания. Основные «скоростные» показатели кривой поток-объем (ОФВ1, ПСВ, МОС25, 50, 75) не изменились после курса приема левокарнитина. Отсутствует существенное влияние приема левокар-нитина на суточную периодику колебания просвета бронхов. Показатели дыхательного мониторирования достоверно не изменились.
- Прием левокарнитина (препарата Элькар®) оказывает значительное влияние на состояние сердечнососудистой системы. Динамика основных показателей реакции сердечнососудистой системы на нагрузочный тест свидетельствует о более адекватном ответе. Повышение ИХР и ИЭРС, снижение индексов ИИР, ΔСАД/ΔЧСС и ΔДАД/ΔЧСС отражают положительную перестройку гемодинамики у больных бронхиальной астмой и нарушенной адаптацией к физическим нагрузкам.
- Для профилактики постнагрузочного бронхоспазма у детей с бронхиальной астмой рекомендуется использование левокарнитина наряду с другими медикаментозными средствами.
На правах рекламы
Ознакомьтесь с инструкцией
Литература
- Баранов А. А, Хаитов Р. М. Аллергология и иммунология. М., 2011.
- Глобальная стратегия лечения и профилактики бронхиальной астмы. Пересмотр 2007. Под ред. Чучалина А. Г. М.: Издательский дом «Атмосфера», 2008. 108 с.
- Национальная программа «Бронхиальная астма у детей. Стратегия лечения и профилактика» (второе издание). М.: Издательский дом «Русский врач», 2006. 100 с.
- Новик Г. А. Бронхиальная астма у детей. СПб: ООО «Издательство Фолиант», 2009. 352 с.
- Савельев Б. П. Общая физическая работоспособность по тесту PWC-170 у здоровых детей и подростков. В кн.: Физиология роста и развития детей и подростков. Под ред. Баранова А.А., Щеплягиной Л.А., М., 2000, с. 397-402;
- Федосеев Г. Б., Трофимов В. И. Бронхиальная астма. СПб: Нордмед, 2006, с. 308.
- Anderson S. D. Exercise-induced asthma in children: a marker of airway inflammation // Med J. 2002; Aust, 177 Suppl: S61-63.
- O’Byrne P. M. Leukotriene bronchoconstriction induced by allergen and exercise // Am J Respir Crit Care Med. 2000; 161: S68-S72.
- Carlsen K. H, Anderson S. D., Bjermer L., Bonini S, Brusasco V., Canonica W., Cummiskey J., Delgado, Del GiaccoS. R., Drobnic F., Haahtela T., Larsson K., Palange P., Popov T., van Cauwenberge P. Treatment of exercise-induced asthma, respiratory and allergic disorders in sports and the relationship to doping: Part II of the report from the Joint Task Force of European Respiratory Society (ERS) and European Academy of Allergy and Clinical Immunology (EAACI) in cooperation with GA2LEN // Allergy. 2008: 63: 492-505.
- Terrence W. Carver Jr. Exercise-induced asthma: critical analysis of the protective role of montelukast // Journal of Asthma and Allergy. 2009: 2, 93-103.
- Clark С. J. Asthma and exercise: a suitable case for rehabilitation // Thorax. 1992, 47/10, 765-767.
- Cochrane L. M., Clark C. J. Benefits and problems of physical traininy programme for asthmatic patients // Thorax. 1990, 45, № 5, 345-351.
- MyLinh Duong, Padmaja Subbarao, Ellinor Adelroth, George Obminski, Tara Strinich, Mark Inman, Soren Pedersen, Paul M. O’Byrne. Sputum Eosinophils and the Response of Exercise-Induced Bronchoconstriction to Corticosteroid in Asthma // Chest. 2008, 2, 133.
- Enhorning G., Hohlfeld J., Krug N., Lema G., Welliver R.n C. Surfactant function affected by airway inflammation and cooling: possible impact on exercise-induced asthma // Eur. Respir. J. 2000, Mar; 15 (3): 532-528.
- Freed A. N., Davis M. S. Hyperventilation with dry air increases airway surface fluid osmolality in canine peripheral airways // Am. J. Respir. Crit. Care. Med. 1999, Apr; 159 (4 Pt 1): 1101-1107.
- Finnerty J. P., Wood-Baker R., Thomson H., Holgate S. Т. Role of lencotrienes in exercise-induced asthma // Am. Rev. Resp. Dis. 1992. Vol. 145. P. 746-749.
- Hendrickson C. D., Lynch J. M., Gleeson K. Exercise-induced asthma: a clinical perspective // Lung. 1994, 172, 1-14.
- Hilberg T. Etiology of Exercise-induced asthma: physical stress-induced transcription // Current Allergy and Asthma Reports. 2007, 7: 27-32.
- Hofstra W. B., Neijens H. J., Duiverman E. J. et al. Dose-response over time to inhaled fluticasone propionate treatment of exercise- and methacholine-induced bronchoconstriction in children with asthma // Pediatr Pulmonol. 2000; 29: 415-423.
- Kivity S., Onn A., Greif Y., Fireman E., Pomeranz S., Topilsky M. Nedocromil and exercise-induced asthma: acute and chronic effects // Isr. Med. Assoc. J. 1999, Oct; 1 (2): 92-94.
- Koh M. S., Tee A., Lasserson T. J., Irving L. B. Inhaled corticosteroids compared to placebo for prevention of exercise induced bronchoconstriction // Cochrane Database of Systematic Reviews. 2007.
- Kubota T., Koga K., Araki H. et al. The relationships of mononuclear leukocyte beta-adrenergic receptors to aerobic capacity and exercise-induced asthma in asthmatic children // Arerugi. 2000. Vol. 49. P. 40-51.
- Lopesa W. A., Radominskib R. B., Rosa’rioFilhoc N. A., Leited N. Exercise-induced bronchospasm in obese adolescents // Allergol Immunopathol. 2009; 37 (4): 175-179.
- Milgrom H., Taussig L. M. Keeping children with exercise-induced asthma active // Pediatrics. 1999, Sep; 104 (3): e38.
- Moloney E. D., Griffin S., Burke C. M. et al. Release of inflammatory mediators from eosinophils following a hyperosmolar stimulus // Respir Med. 2003; 97: 928-932.
- Neuman I., Nahum H., Ben Amotz A. Prevention of exercise-induced asthma by a natural isomer mixture of beta-carotene // Ann. Allergy. Asthma. Immunol. 1999, Jun; 82 (6): 549-553.
- I. Neuman, H. Nahum. Reduction of exercise-induced asthma oxidative stress by lycopene, a natural antioxidant // Allergy. 2000: 55: 1184-1189.
- Nizar J. W., Calhoun J. Exercise-induced asthma is not associated with mast all activition or airway inflamation // J. Allergy Clin Jmmunol. 1992, 89/1, 60-68.
- Petersen R., Agertoft L., Pedersen S. Treatment of exercise-induced asthma with beclomethasone dipropionate in children with asthma // Eur Respir J. 2004; 24: 932-937.
- Randolph C. Exercise-induced asthma: update on pathophysiology, clinical diagnosis, and treatment // Curr Probl Pediatr. 1997; 27 (2): 53-77.
- Scollo M., Zanconato S., Ongaro R., Zaramella C., Zacchello F., Baraldi E. Exhaled nitric oxide and exercise-induced bronchoconstriction in asthmatic children // Am. J. Respir. Crit. Care. Med. 2000, Mar; 161 (3 Pt 1): 1047-1050.
- Carol Spooner, Duncan SaundersL., Brian H. Rowe. Nedocromil sodium for preventing exercise-induced bronchoconstriction. The Cochrane Collaboration. Published by John Wiley & Sons, Ltd., 2009.
- Subbarao P., Duong M., Adelroth E. et al. Effect of ciclesonide dose and duration of therapy on exercise-induced bronchoconstriction in patients with asthma // J Allergy Clin Immunol. 2006; 117: 1008-1013.
- Tan W. C., Tan C. H., Teoh P. C. The role of climatic conditions and histamine release in exercise-induced bronchoconstriction // Ann Acad Med Singapore. 1985; 14 (3): 465-469.
- Vilozni D., Bentur L., Efrati O. Exercise challenge test in 3 to 6-year old asthmatic children // Chest. 2007, 132; 497-503.
- Wilkerson L. A. Exercise-induced asthma // J. Am. Osteopath. Assoc. 1998, Apr; 98 (4): 211-215.
- Zarqa Ali. How to Diagnose Exercise Induced Asthma? // Asian Journal of Sports Medicine. 2011, 2, 63-67.
- Консенсус по детской бронхиальной астме — PRACTALL (Practicall Allergology), 2008.











Комментировать