Основные причины БС. Клинические признаки основных причин боли в нижней части спины с иррадиацией в нижнюю конечность. Терапия.
Шостак Н.А., Правдюк Н.Г., ГБОУ ВПО «РНИМУ им. Н.И. Пирогова» Минздрава России
Установлено, что около 70% всех известных заболеваний сопровождаются болью. Каждый пятый человек трудоспособного возраста страдает от боли. Распространенность хронической боли (ХБ) в популяции колеблется от 2 до 40-49%. По данным ВОЗ, болевые синдромы являются одной из ведущих причин (от 11,3 до 40%) обращений к врачу. В 73,8% случаев пациенты приходят на прием к неврологу и терапевту.
В клинике боль рассматривается как неприятное чувство, причиняющее больному страдание различной интенсивности. Физиологическая боль — важнейшая реакция на повреждающие факторы, она обеспечивает выживаемость живого организма в окружающей среде. Чувство боли является сигналом опасности и разрушения, вызывает цепь рефлекторных реакций, направленных на устранение опасности. Боль мобилизует функциональные способности органов и их защитные механизмы, оказывая стимулирующий эффект на гуморальные и клеточные звенья иммунитета, усиливая антителообразование, миграционную способность лейкоцитов. Однако боль играет положительную роль только до того момента, пока она предупреждает о нарушении целостности организма.
Патологическая боль (термин, предложенный российским ученым-патофизиологом Г.Н. Крыжановским в 1975 г) утрачивает адаптивный характер и является причиной развития комплекса патологических нарушений в организме. Патологическая боль часто приобретает значение подлинной болезни. Она может возникать при различной соматической патологии и патологии самой нервной системы. Основой патогенеза развития патологической боли является дисбаланс ноци- и антиноцицептивной систем. В нервной системе образуются скопления гиперактивных нейронов, являющихся генераторами патологически усиленного возбуждения [1]. Различают следующие варианты боли (табл. 1).
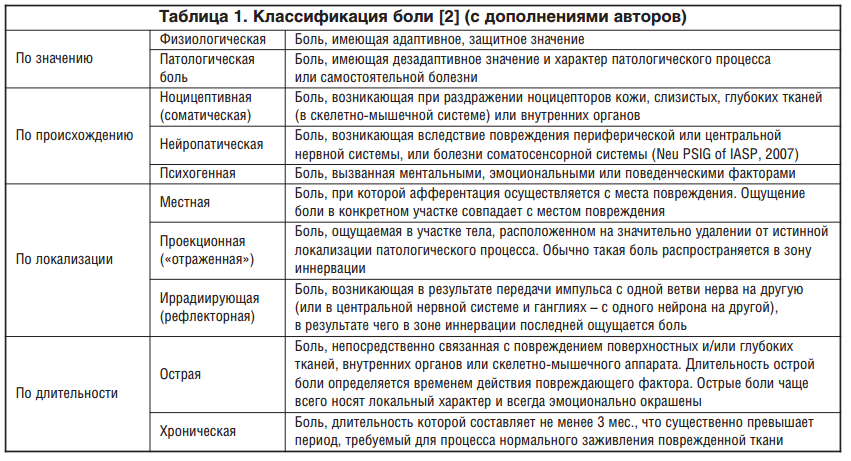
Ноцицептивные болевые синдромы возникают вследствие активации ноцицепторов при травме, воспалении, ишемии, отеке тканей. Возникающие при этом импульсы, следуя по восходящим ноцицептивным путям, достигают высших отделов нервной системы и отображаются сознанием, как следствие, формируется ощущение боли.
Патофизиологической основой нейропатических болевых синдромов является нарушение механизмов генерации и проведения ноцицептивного сигнала в нервных волокнах и процессов контроля возбудимости ноцицептивных нейронов в структурах спинного и головного мозга. Повреждение нервов приводит к структурно-функциональным преобразованиям в нервном волокне, в результате чего формируется неадекватная реакция нервного волокна на раздражение; паттерн передаваемого сигнала существенно меняется. Усиленная импульсация с периферии дезорганизует и работу центральных структур. В создавшихся условиях происходит формирование болевого симптомокомплекса, клинически проявляющегося в виде снижения и/или потери чувствительности в сочетании с аллодинией, гипералгезией, дизестезией, гиперпатией.
Психогенная боль возникает вне зависимости от соматических, висцеральных или нейрональных повреждений и в большей степени определяется психологическими и социальными факторами.
Выделяют также дисфункциональный тип боли, ведущую роль в формировании клинических симптомов при котором имеют центральные механизмы (дезингибиция и центральная сенситизация — повышение возбудимости ноцицептивных нейронов задних рогов спинного мозга) при наличии ноцицептивного или периферического нейропатического компонента [3].
В клинической практике чаще встречаются сочетанные формы болевых синдромов, которые можно классифицировать по временным характеристикам. Острая боль, как правило, обусловлена ноцицептивной афферентацией и гораздо реже имеет нейропатическую природу. Причинами хронической боли могут быть периферическое ноцицептивное воздействие и дисфункция периферической или центральной нервной системы. ХБ — это боль, продолжающаяся сверх нормального периода заживления и длящаяся в течение 3 мес. и более.
Примером сочетанной формы болевых синдромов является боль в спине (БС). Известно, что спина — многокомпонентная анатомическая структура и любой ее элемент может выступать источником боли. Основные причины БС представлены в таблице 2.
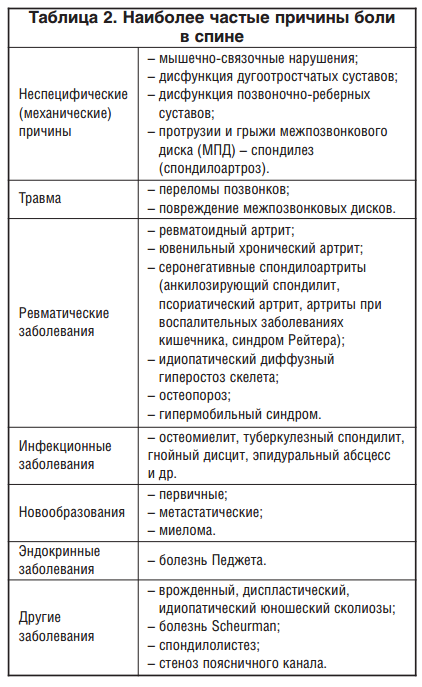
Хотя в подавляющем большинстве случаев болевой синдром в спине носит ноцицептивный характер и обусловлен мышечно-скелетными нарушениями, существует ряд причин (дискогенные болевые синдромы, спондилез и артроз фасеточных суставов, травмы позвоночника (в т. ч. при остеопорозе), стеноз позвоночного канала и т. д.), обусловливающих присоединение и невропатического компонента боли. Кроме того, изучается роль центральной сенситизации в происхождении и поддержании хронической БС. Ряд исследований свидетельствует о наличии преимущественно ноцицептивного, нейропатического или дисфункционального варианта хронической БС, что в последующем может влиять на выбор лечебной тактики [4].
Среди всех причин развития хронической БС ведущее место принадлежит дегенеративному поражению МПД. При дорсальном выпячивании МПД боль вначале появляется в результате раздражения болевых рецепторов наружных слоев фиброзного кольца и задней продольной связки, сопровождающегося спазмом сегментарных мышц (рефлекторная люмбоишиалгия). Смещаясь в сторону позвоночного канала или межпозвоночного отверстия, грыжа МПД может компримировать спинномозговой корешок, что ведет к возникновению корешкового синдрома (радикулопатии). Радикулопатия как осложнение грыжевого выпячивания диска встречается в 5-7% случаев [5]. Другими причинами радикулопатии могут выступать остеофит, сформированный на фоне спондилеза (спондилоартроза), гипертрофия желтой связки и стеноз межпозвонкового отверстия. Клинические признаки основных причин боли в нижней части спины с иррадиацией в нижнюю конечность представлены в таблице 3.
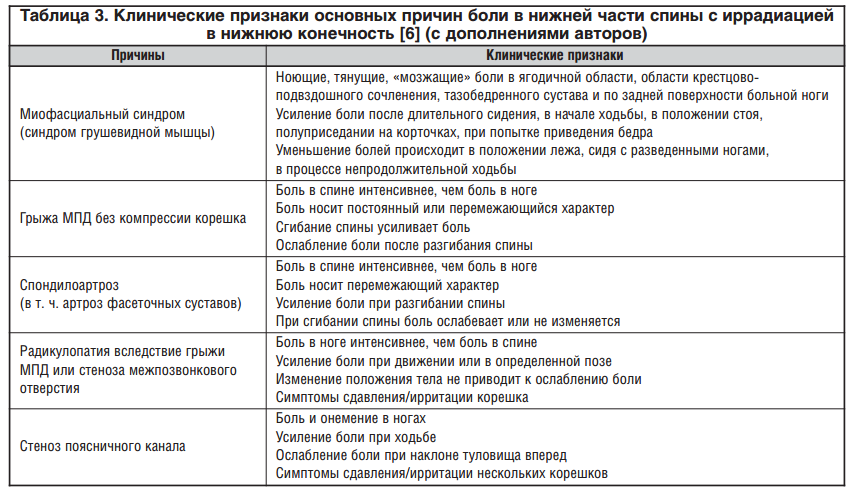
БС, ассоциированная с грыжей МПД, компримирующей нервный корешок, носит смешанный характер, имеет ноцицептивный и нейропатический компоненты. Ноцицептивный механизм связан с раздражением болевых рецепторов в наружных слоях поврежденного диска и окружающих его тканях, нейропатический — с повреждением волокон корешка, интерневральным отеком, ишемией и воспалением, приводящими на начальных этапах к фокальной демиелинизации, а в дальнейшем — и к аксональной дегенерации. Высказывается предположение, что хроническая БС приводит к ранним структурным нарушениям. В результате интенсивной и длительной болевой импульсации гибнут спинальные ингибиторные вставочные нейроны, ответственные за подавление болевой афферентации. Поэтому раннее купирование боли и нейропротекция могут предупреждать развитие хронической БС [7].
Подход к лечению БС формируется на основании современных представлений об этиопатогенетических механизмах ее развития, а также с учетом варианта течения болевого синдрома.
При остром болевом синдроме следует ожидать уменьшения боли в течение 2 нед. В ряде контролируемых исследований показано, что постельный режим не только не ускоряет восстановление, но, наоборот, может способствовать трансформации острого болевого синдрома в хронический. Поэтому при умеренной боли необходимости в постельном режиме нет, а при интенсивной боли его следует максимально ограничить (до 1-3 дней). Однако специальные физические упражнения в остром периоде заболевания не показаны (уровень доказательности А).
Учитывая, что при дегенеративных процессах в структурах позвоночника развивается асептическое воспаление, в программу лечения должны включаться нестероидные противовоспалительные препараты (НПВП) в первые 24-48 ч от начала заболевания (уровень доказательности А). Показано внутримышечное введение НПВП в течение 2-3 дней с последующим переходом на пероральный прием лекарственного препарата (10-14 дней). Воздействие на мышечный компонент предполагает использование миорелаксантов, устраняющих мышечный спазм, продолжительность применения которых составляет не более 2 нед. (уровень доказательности А). Важной составляющей является локальная терапия с использованием НПВП-содержащих гелей и мазей (непрерывным курсом — не более 2 нед.).
Мануальная терапия может приводить к кратковременному улучшению, однако не является альтернативой медикаментозному лечению (уровень доказательности В). Сформулированы абсолютные противопоказания к проведению мануальной терапии: опухоли и метастатические поражения позвоночника, спондилит, остеопороз. Относительными противопоказаниями являются грыжа МПД, гиперлордоз поясничного и шейного отдела позвоночника, отсутствие физиологического кифоза в грудном отделе позвоночника («плоская» спина), врожденная дисплазия костно-хрящевой части позвоночника и связочного аппарата. При отсутствии эффекта от стационарного курса комплексной консервативной терапии в течение 6 нед. (сохранение стойкого болевого синдрома и/или нарастание неврологического дефицита) показана консультация нейрохирурга.
Схему лечения хронического болевого синдрома (наряду с НПВП и миорелаксантами при обострении) дополняют применением антидепрессантов (уровень доказательности А), слабых опиоидов (трамадол) (уровень доказательности А), препаратами капсаицина (локально — 3 нед.) (уровень доказательности А). Из физиотерапевтических методов лечения активно используются чрескожная электронейростимуляция (уровень доказательности В) и нейрорефлексотерапия (уровень доказательности А). Особое место занимает использование обучающих поведенческих программ (уровень доказательности А) в сочетании с психосоциальной коррекцией (уровень доказательности А), комплекс специальных физических упражнений (уровень доказательности В). Хирургическая коррекция при хроническом болевом синдроме показана не ранее чем через 2 года после проведенной консервативной терапии (за исключением случаев появления неврологического дефицита и выраженного болевого синдрома) (уровень доказательности С) [8].
Основу нейропротективной терапии при радикулопатиях составляют витамины группы В. Доказано, что витамины группы В (тиамин (В1), пиридоксин (В6), цианокобаламин (В12)) обладают нейротропными регенераторными свойствами. Витамин B1 участвует в проведении нервных импульсов, обеспечивает аксональный транспорт, определяет регенерацию нервной ткани. Пиридоксин способствует нормализации белкового обмена, увеличивает запасы внутриклеточного магния, участвующего в энергетических процессах и нервной деятельности. Цианокобаламин (метилкобаламин — активный метаболит витамина В12) принимает участие в восстановлении структуры миелиновой оболочки. В экспериментальной модели акриламид-индуцированной нейропатии у животных было обнаружено, что сверхвысокая доза метилкобаламина стимулирует регенерацию нерва путем повышения транскрипции гена [9].
Наряду с описанными эффектами тиамину, пиридоксину и цианокобаламину свойственно антиноцицептивное действие. Возможными мишенями выступают болевые рецепторы и натриевые каналы поврежденных мембран чувствительных волокон. Учитывая наличие асептического воспаления при БС, применение витаминов группы В в комбинации с НПВП можно считать патогенетически обоснованным. Анальгетическое действие витамина В6 обусловлено его влиянием на обмен катехоламинов [10]. В экспериментах на животных доказано подавление ноцицептивной реакции нейронов заднего рога спинного мозга и активности нейронов в таламусе витаминами группы В. На самцах крыс было показано анальгезирующее действие смеси витаминов — пиридоксина, тиамина и цианокобаламина — в отношении боли, индуцированной нагревом, сдавлением и химическими агентами. Тиамин проявлял активность при адъювант-индуцированном артрите, цианокобаламин — при воспалении, индуцированном введением каррагенина; пиридоксин демонстрировал антиноцицептивное действие в моделях теплового болевого раздражения и подавлял ноцицептивную активность нейронов таламуса [11].
Наиболее целесообразным представляется комбинированное применение витаминов группы В, т. к. при совместном их введении возникает эффект синергизма, обеспечивающий усиление терапевтического действия тиамина, пиридоксина и цианокобаламина. Клинический опыт демонстрирует высокую эффективность и безопасность использования комбинации витаминов группы В при нейропатиях, невралгиях, а также при БС, обусловленной как мышечно-связочной дисфункцией, так и в сочетании с нейропатическим компонентом. R. Marcolongo и A. Fioravante наблюдали значительное уменьшение боли и повышение трудоспособности у пациентов с люмбоишиалгией, получавших комбинацию витаминов группы В [12]. По данным Destito et al. (1987), через 10 дней применения комплекса витаминов группы В наблюдалось статистически значимое уменьшение боли и улучшение функционального статуса у пациентов, страдающих БС, причем первые признаки улучшения наблюдались уже через 3 дня от начала лечения [13].
В качестве примера инъекционного нейротропного комплекса можно привести Нейробион, который содержит сбалансированную комбинацию нейротропных витаминов в адекватно высоких лечебных дозах. Парентеральное применение комплекса, в который входят тиамин, пиридоксин и цианокобаламин, эффективно купирует болевые ощущения, нормализует рефлекторные реакции, восстанавливает нарушенную чувствительность. В случаях выраженного болевого синдрома лечение целесообразно начинать с внутримышечного введения (глубокие инъекции в ягодичную мышцу) по 3 мл (1 ампула) 1 р./сут ежедневно. После уменьшения симптомов или в случае болевого синдрома умеренной интенсивности препарат вводят по 3 мл 2-3 раза в неделю в течение 2-3 нед. В качестве поддерживающей терапии и для профилактики рецидива рекомендуется прием препарата Нейробион в форме таблеток.
Таким образом, боль, являясь универсальной реакцией организма, приобретает различные клинические формы и варианты течения, требующие многокомпонентного и поэтапного подхода к лечению.
Литература
- Шостак НА. Алгология как междисциплинарная проблема современной медицины // Клиницист. 2008. № 1. С. 4-9.
- Allan I. Basbaum, Bushnell M.C. // Science of Pain. 2008. 11200 р.
- Woolf C.J. Pain: moving from symptom control toward mechanism specific pharmacologic management //Ann. Intern. Med. 2004. Vol. 140. P. 441-451.
- Nijs J., Apeldoorn A., Hallegraeff H, Clark J. et al. Low backpain: guidelines for the clinical classifcation of predominant neuropathic, nociceptive, or central sensitization pain // Pain Physcian. 2015. Vol. 18(3). P.E333-346.
- Waddell G. The back pain revolution. London: Churchill Livingstone, 2004. 475 p.
- Левин О. С. Современные подходы к диагностике и лечению болей в спине. М, 2006. 62 с.
- Вершинина С.В. Радикулопатия как фактор хронизации боли в спине // Медицинский вестник. Школа клинициста. 2009. № 31 (500). С. 11.
- Ревматология: учебное пособие/под ред. проф. Н.А. Шостак. М.: ГЭОТАР-Медиа, 2012.448 с.
- Kathleen A. Head. Периферическая нейропатия: патогенетические механизмы и альтернативные виды терапии.
- Abbas Z.G., Swa A.B. Evaluation of the efficacy of thiamine and pyridoxine in the treatment of symptomatic diabetic peripheral neuropathy// East. Afr. Med. J. 1997. Vol. 74, № 12. Р. 803-808.
- Bartoszyk G.D., Wild A Антиноцицептивное действие пиридоксина, тиамина и цианкобаламина у крыс.
- Marcolongo R., Fioravanti A. Vitamins B1, B6 and B12 for lumboischialgia. Bvitamins in Pain: Associated Symposium to the 5th World Congress on Pain, Hamburg, Germany, August 2, 1987. eds HU Gerbershagen, M. Zimmermann.
- Destito D., Canonico N., Tentori-Mondto T. Analgesic activity of vitamins B1, B6 and B12 in the painful vertebral syndrome. Associated Symposium to the 5th World Congress on Pain, Hamburg, Germany, August 2, 1987. eds HU Gerbershagen, M. Zimmermann.



Комментировать