Обзорный анализ современных анти-VEGF препаратов, способных блокировать сосудистый эндотелиальный фактор роста. Описание основных препаратов, которые входят в группу анти-VEGF препаратов.
Алпатов С.А.
Резюме
Важным прорывом в лечении целого ряда глазных заболеваний явилось применение лекарств, блокирующих ангиогенез. В настоящее время разработаны и применяются несколько препаратов, способные блокировать сосудистый эндотелиальный фактор роста (vascular endothelial growth fa
ctor — VEGF) на разных этапах. В обзоре проведен анализ современных анти-VEGF препаратов.Ключевые слова: анти-VEGF, ранибизумаб, афлиберцепт, конберцепт, блокаторы ангиогенеза, макулярная дегенерация.
В настоящее время существует группа анти-VEGF препаратов, способных блокировать сосудистый эндотелиальный фактор роста (vascular endothelial growth factor — VEGF): пегаптаниб, бевацизумаб, ранибизумаб, афлиберцепт и конберцепт, применяемых для лечения «влажной» формы возрастной макулярной дегенерации (ВМД) и целого ряда других патологических состояний. В статье приведен их сравнительный анализ. Все препараты как в исследованиях, так и в клинической практике показали близкую эффективность и безопасность, хотя при применении одних из них требуется большее количество инъекций, при применении других – меньшее, есть различия в частоте и типе побочных эффектов. Важным фактором выбора лекарств становится их доступность. Выбирать препарат следует, обсуждая с пациентами как положительные, так и отрицательные стороны каждого из лекарств. Знания о патогенезе многих глазных патологических состояний (например, ВМД диабетического макулярного отека и др.) остаются далеко не полными. Соответственно, возможности их полного излечения практически отсутствуют. Важным прорывом явилось применение в офтальмологии препаратов, блокирующих ангиогенез. Главной мишенью при этом считается фактор роста эндотелия сосудов — VEGF, молекула с ангиогенными свойствами, которая стимулирует митоз эндотелиальных клеток, а также способна повышать проницаемость через сосудистую стенку. В настоящее время разработаны и применяются в клинике несколько препаратов, способные блокировать VEGF на разных этапах, в том числе его продукцию, воздействие на рецепторы, а также на пострецепторный сигнальный путь.
Пегаптаниб (торговое название – Макуген) представляет собой пегилированный, модифицированный олигонуклеотид (аптамер), обладающий высоким сродством к внеклеточному изомеру VEGF165 и подавляющий его активность. Аптамеры – синтетические одноцепочечные рибо- или дезоксирибоолигонуклеотиды длиной 30–100 нуклеотидов, обладающие способностью распознавать и связывать определенные молекулы лиганда с высокой степенью сродства и специфичностью. Аптамеры получают с помощью селекции in vitro. Они являются функциональными аналогами моноклональных антител, но, в отличие от последних, более стабильны, имеют более широкий спектр действия, малоиммуногенны и менее дорогостоящи.
Пегаптаниб является селективным препаратом, воздействующим именно на изоформу VEGF165, которая считается наиболее ответственной за процесс глазной неоваскуляризации. Благодаря избирательному действию препарата планировалось минимизировать побочные эффекты анти-VEGF терапии, например, влияние на сосудистую стенку здоровых кровеносных сосудов.
Пегаптаниб натрия стал первым анти-VEGF препаратом, одобренным для лечения заболеваний глаз у человека в декабре 2004 г. Основным клиническим испытанием, на основании результатов которого пегаптаниб был рекомендован для клинического применения, стало исследование VISION. Это было рандомизированное двойное слепое клиническое исследование с участием 1208 пациентов, которые получали инъекции пегаптаниба натрия (0,3, 1,0 или 3,0 мг) или симуляцию инъекции (плацебо) каждые 6 нед. в течение 48 нед. [5]. В исследование включали пациентов в возрасте 50 лет и старше, имевших субфовеальную хориоидальную неоваскуляризацию (ХНВ) вследствие ВМД и остроту зрения исследуемого глаза от 20/40 до 20/320. Результаты исследования VISION позволили установить, что в группе пациентов с «влажной» формой ВМД, получавших пегаптаниб, у 6% было достоверное улучшение зрения по сравнению с 2% пациентов в группе плацебо. По окончании первого года исследование продлили еще на 48 нед. После этого острота зрения сохранялась на исходном уровне достоверно чаще при продолжении пациентами терапии пегаптанибом в дозе 0,3 мг по сравнению с группой пациентов, где лечение было прекращено. Таким образом, это исследование показало целесообразность продолжения терапии пегаптанибом у пациентов с неоваскулярной ВМД и после годичного курса лечения. Появление новых, более эффективных препаратов привело к тому, что Макуген почти перестал использоваться.
Бевацизумаб (Авастин) – гуманизированное рекомбинантное гиперхимерное моноклональное антитело, которое селективно связывает все изоформы VEGF и нейтрализует его. Препарат блокирует связывание фактора роста с его рецепторами 1 и 2 типа (VEGFR1 и VEGFR2) на поверхности эндотелиальных клеток. Бевацизумаб состоит из 214 аминокислот и имеет молекулярный вес около 149 000 дальтон.
Первоначально препарат был разработан и применяется до сих пор в онкологии в виде внутривенных инъекций. Введение бевацизумаба приводит к подавлению метастатического прогрессирования опухоли и снижению микрососудистой проницаемости при различных онкологических состояниях, включая рак ободочной кишки, молочной железы и т. д. В 2005 г. американские исследователи Rosenfeld и Puliafito сообщили о первом опыте применения бевацизумаба у пациентов с экссудативной формой ВМД и прогрессирующим ухудшением зрения, несмотря на предшествующую ФДТ или лечение Макугеном [11]. После 2—3-кратного внутривенного введения препарата были отмечены достоверное повышение остроты зрения и уменьшение толщины сетчатки в макуле. Однако при системном введении бевацизумаба существует риск побочных эффектов, описанных при применении этого препарата у онкологических больных: повышение артериального давления, носовые кровотечения, протеинурия и риск тромбоэмболии. Поэтому было предложено вводить бевацизумаб в стекловидное тело с целью минимизировать его системное действие и максимально приблизить лекарство к ткани-мишени — неоваскулярной мембране. Инъекция бевацизумаба в полость стекловидного тела сводит на нет риск системных побочных эффектов, поскольку вводимая доза 1,25 мг в 400—500 раз меньше той, что используется для внутривенного введения. Тем не менее этого вполне достаточно, чтобы обеспечить высокую концентрацию лекарственного препарата в месте его действия.
Некоторое время эффективность интравитреального введения бевацизумаба ставилась под сомнение. Поскольку молекулярная масса препарата примерно в 3 раза больше, чем масса пегаптаниба и ранибизумаба, считалось, что теоретически он не способен проходить сквозь сетчатку. Однако более поздние результаты исследований убедительно свидетельствуют о том, что бевацизумаб, введенный в полость стекловидного тела, также может проникать через все слои сетчатки. Согласно инструкции фирмы-производителя, препарат не предназначен для интравитреального введения. Тем не менее именно он на сегодняшний день является самым распространенным блокатором ангиогенеза и широко применяется во всем мире для лечения самых различных сосудистых и пролиферативных заболеваний глаза. По данным опроса, проведенного в 2013 г. Американским обществом ретинальных специалистов (ASRS), 61% практикующих в этой области врачей в США и 42% – в других странах применяют бевацизумаб в качестве основного препарата для лечения неоваскулярной формы ВМД (ASRS, 2014). Таким образом, его применение можно считать сложившимся стандартом лечения этого заболевания.
Ранибизумаб (Луцентис) является человеческим моноклональным фрагментом антител к эндотелиальному фактору роста А (VEGF-A) и экспрессируется рекомбинантным штаммом E. сoli.
Ранибизумаб, как и все применяемые в настоящее время блокаторы ангиогенеза, вводится в глаз в виде инъекции в стекловидное тело через pars plana. Препарат избирательно связывается с изоформами VEGF-А (VEGF110, VEGF121, VEGF165) и предотвращает взаимодействие фактора роста с его рецепторами на поверхности клеток эндотелия (VEGR1 и VEGR2), что приводит к подавлению неоваскуляризации и пролиферации сосудов, а также уменьшает опосредованную VEGF проницаемость сосудов [4].
В настоящее время ранибизумаб является, по сути, наиболее изученным анти-VEGF препаратом. Его эффективность и безопасность при ВМД первоначально проверены в 3 базовых двойных слепых рандомизированных контролируемых 2-годичных исследованиях MARINA, ANCHOR и PIER. Всего в эти 3 эксперимента были включены 1323 пациента. Ранибизумаб вводился в виде инъекций в стекловидное тело по 0,3 либо 0,5 мг 1 р./мес. на протяжении всего периода наблюдения. Препарат заметно улучшал зрение у пациентов с субфовеальными нарушениями при неоваскулярной ВМД. Достигнутое преимущество в остроте зрения по сравнению с аналогичным показателем в группе плацебо сохранялось и через 24 мес. лечения [1, 4].
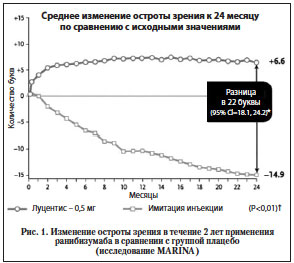
Ранибизумаб стал первым лекарственным препаратом из группы блокаторов ангиогенеза, лечение которым приводит не только к замедлению прогрессирующего снижения центрального зрения, но и к частичному восстановлению остроты зрения. Так, в исследовании MARINA повышение остроты зрения произошло в зависимости от дозы препарата у 25—40% пациентов, его стабилизация – у 95% (рис. 1). На протяжении периода наблюдения в этом исследовании (24 мес.) острота зрения в группе плацебо ухудшилась на 14 букв по таблице EDTRS, в то время как у пациентов, получавших ежемесячные интравитреальные инъекции ранибизумаба, острота зрения, напротив, улучшилась на 6 букв.
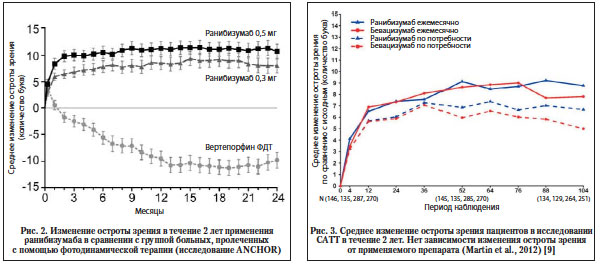
При сравнении эффективности применения ранибизумаба и другого, в то время популярного метода лечения ХНВ – фотодинамической терапии (ФДТ) были убедительно доказаны преимущества лекарственной терапии (рис. 2). Острота зрения у пациентов, получавших ранибизумаб, в зависимости от дозы улучшилась в среднем на 8,1 и 10,7 буквы и оставалась стабильной на протяжении периода лечения. При применении ФДТ с вертепорфином острота зрения за это время ухудшилась на 9,8 буквы [2]. Параллельно с улучшением зрения в группе больных, получавших ранибизумаб, происходило и уменьшение толщины макулы. Оба исследования (MARINA и ANCOR) показали хорошую переносимость и высокую степень безопасности препарата. Не было выявлено достоверной разницы в количестве как глазных, так и общесоматических нежелательных явлений между пациентами, получавшими ранибизумаб, и группами плацебо и ФДТ. Луцентис показал себя намного более эффективным препаратом, чем Макуген. На основании положительных результатов клинических исследований в июне 2006 г. ранибизумаб был утвержден в США как препарат для лечения ХНВ, связанной с ВМД. В 2008 г. он был сертифицирован и в Российской Федерации.
Для дальнейшего изучения воздействия ранибизумаба на структуры глаза и организм в целом пациенты, наблюдавшиеся в 24-месячных исследованиях MARINA, ANCHOR и FOKUS, были включены в следующее, продленное еще на 2 года (до 4 лет) исследование HORIZON [12]. Участники были разделены на 3 группы: в 1-ю группу вошли пациенты, получавшие ранибизумаб с самого начала на протяжении 2 лет (600 чел.), во 2-ю группу – пациенты, ранее получавшие ФДТ или фиктивные инъекции (190 чел.), и, наконец, в 3-ю группу – больные, ранее не поучавшие лечения (63 чел.). К удивлению, через 2 года было отмечено постепенное снижение высоких результатов, достигнутых в предыдущие 2 года. Зрение пациентов, несмотря на лечение, стало постепенно ухудшаться, и такая тенденция продолжилась и в дальнейшем, что было зафиксировано в следующем продленном исследовании SEVEN UP.
Для оценки долгосрочных результатов (от 7 до 8 лет) после начала интенсивной терапии ранибизумабом экссудативной формы ВМД использовали данные 75 пациентов, которые ранее принимали участие в программах MARINA, ANCНOR и HORIZON. Максимальная продолжительность наблюдения составила 7–8 лет (диапазон 6,3–8,5 года) после начала инъекций в исследованиях MARINA и ANCНOR [10]. Примерно через 7 лет после начала лечения ранибизумабом в начальных исследованиях MARINA и ANCНOR по сравнению с исходным состояние почти половины глаз было стабильным, в то время как у 1/3 пациентов потеря букв при определении остроты зрения составила 15 и более. Оценивая полученные данные, следует помнить, что без лечения ранибизумабом острота зрения ухудшается в среднем на 15 букв за 2 года. Таким образом, терапия ранибизумабом, хотя и не может привести к полному излечению, позволяет сохранять зрительные функции пациентов с «влажной» формой ВМД в течение длительного периода.
Согласно данным Национального института глаза (США), ежегодно более 250 тыс. американцев с возрастной макулодистрофией получают off-label Авастин.
Оценить, насколько эффективен и безопасен бевацизумаб, в том числе по отношению к его конкуренту ранибизумабу, были призваны сравнительные исследования Comparison of Age-related Macular Degeneration Treatments Trials (CATT) в США и Inhibition of VEGF in Age-related Choroidal Neovascularisation (IVAN) в Великобритании.
Дизайн обоих исследований был похож. В них были включены пациенты старше 50 лет с не леченной ранее «влажной» формой ВМД. Все больные были разделены на 4 группы в зависимости от вводимого препарата (ранибизумаб или бевацизумаб) и режима введения (ежемесячное или по потребности (pro renata (PRN)) с ежемесячным контролем). Следует отметить, что если исследование CATT в группе PRN начиналось с 3 ежемесячных инъекций, то в исследовании IVAN их не было.
Результаты обоих исследований показали похожие результаты динамики остроты зрения у больных с экссудативной ВМД, независимо от того, получали ли они интравитреально ранибизумаб или бевацизумаб. В исследовании CATT зафиксировано среднее увеличение остроты зрения по сравнению с исходным – на:
– 8,8 буквы – при применении ранибизумаба ежемесячно;
– 7,8 буквы – бевацизумаба ежемесячно;
– 6,7 буквы – ранибизумаба PRN;
– 5,0 буквы – бевацизумаба PRN.
Средняя острота зрения в конце исследования была сходной во всех 4 группах (рис. 3).
При анализе морфологических данных через 2 года исследования CATT элиминация интра- и субретинальной жидкости по данным оптической когерентной томографии (ОКТ) происходила по-разному в разных группах больных, и отличия были весьма существенными. Полное отсутствие жидкости наблюдалось у 45,5% пациентов в группе ежемесячных инъекций ранибизумаба (лучший результат) и всего у 13,9% в группе бевацизумаба PRN (худший результат). В то же время при ежемесячном режиме инъекций гораздо чаще развивалось такое серьезное осложнение, как географическая атрофия, и ее уровень был выше в случае применения ранибизумаба [9]. Пациентам, получавшим PRN бевацизумаб, потребовалось в среднем 14,1 инъекции против 12,6 инъекции ранибизумаба в аналогичном режиме (p=0,01).
В исследовании IVAN не было выявлено зависимости изменений морфологии макулы от вида применяемого препарата [3].
По оценке профиля безопасности препарата в течение 1-го года исследования САТТ было показано, что уровень смертности, инфарктов миокарда и инсультов среди пациентов, получавших бевацизумаб, был несколько выше, однако к концу 2-го года разница уменьшилась. Общий уровень смертности пациентов между 1-м и 2-м годом составил 1,5 и 2,8% при приеме Луцентиса, а при приеме Авастина – 2,6 и 2,9% (в 1-й и 2-й годы соответственно). Видно, что во 2-й год существенной разницы уже не было. Явления тромбоза встречались у пациентов, принимавших Луцентис на протяжении и 1-го, и 2-го года, в 2,2% случаев, у принимавших Авастин – в 2,4% в 1-й год и 1,7% – во 2-й. Инсульты отмечались у 0,8% пациентов, получавших Луцентис в 1-й год лечения, и у 1,2% – во 2-й год. При приеме Авастина – у 1,2% как в течение 1-го, так и 2-го года лечения.
После 1-го и 2-го года исследования IVAN не было выявлено статистически значимой зависимости между применяемыми препаратами и серьезными системными побочными эффектами, хотя такие явления были чаще у больных, леченных бевацизумабом. В то же время артериальные тромбозы и остановка сердца случались чаще при лечении ранибизумабом, и эта разница была статистически достоверна.
Таким образом, оба препарата: и бевацизумаб, и ранибизумаб показали примерно равную эффективность в отношении поддержания остроты зрения больных с «влажной» формой ВМД. Для бевацизумаба требуется немного больше инъекций в режиме pro renata, и несколько выше риск системных осложнений в течение 1-го года лечения. В то же время ранибизумаб чаще приводит к географической атрофии макулы.
Афлиберцепт (Эйлеа) – это гибридный белок, состоящий из частей внеклеточных доменов рецепторов VEGF человека 1-го и 2-го типов, слитых с Fc-фрагментом человеческого IgG1, производимый с помощью технологии рекомбинантной ДНК. Афлиберцепт действует как растворимый рецепторный «белок-ловушка», связывающийся не только с VEGF-A, но и с плацентарным фактором роста (PIGF) с более высокой степенью сродства, чем их естественные рецепторы, и, таким образом, ингибирующий связывание и активацию этих нативных рецепторов VEGF.
Безопасность и эффективность афлиберцепта были оценены в 2 рандомизированных многоцентровых двойных слепых исследованиях VIEW1 и VIEW2 на пациентах с «влажной» формой ВМД [6]. Все пациенты в них были разделены на следующие 4 группы:
1) афлиберцепт в дозе 2 мг каждые 8 нед. после 3 предварительных ежемесячных доз с ежемесячным контролем;
2) афлиберцепт в дозе 2 мг каждые 4 нед.;
3) афлиберцепт в дозе 0,5 мг каждые 4 нед.;
4) ранибизумаб в дозе 0,5 мг каждые 4 нед.
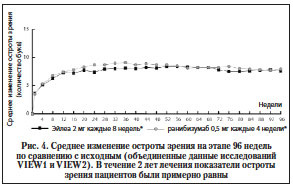
В конце исследований острота зрения сохранилась приблизительно у 95% пациентов, принимавших афлиберцепт 1 раз в 2 мес., и у 94% принимавших ежемесячно ранибизумаб. Было показано, что лечение афлиберцептом клинически эквивалентно лечению ранибизумабом (рис. 4).
Оба препарата показали достаточно высокий уровень безопасности в исследованиях. Возникновение серьезных глазных побочных эффектов было сбалансировано по всем 4 группам. Частота серьезных неблагоприятных реакций, связанных с процедурой инъекции, у афлиберцепта составила менее 1 на 1000 интравитреальных инъекций. Эти реакции включали в себя эндофтальмит, травматическую катаракту и кратковременное повышение внутриглазного давления (ВГД). Наиболее частыми неблагоприятными реакциями, отмечавшимися не менее чем у 5% пациентов, получавших препарат, были конъюнктивальное кровоизлияние (26,7%), боль в глазу (10,3%), отслойка стекловидного тела (8,4%), катаракта (7,9%), «мушки» перед глазами (7,6%) и повышение ВГД (7,2%).
В течение 2 лет пациенты, которым вводили 2 мг афлиберцепта каждые 4 нед., получили в среднем 16 инъекций, в том числе 4,2 в течение 2-го года, когда инъекции выполнялись в режиме PRN. В группе ранибизумаба пациенты получили 16,5 инъекции (4,7 в течение 2-го года).
В целом исследования показывают, что эффект афлиберцепта аналогичен действию ранибизумаба. Препарат достаточно эффективен в лечении «влажной» формы ВМД, он снижает накопление жидкости в сетчатке, улучшает остроту зрения и удерживает эти эффекты в течение достаточно долгого временного промежутка. Афлиберцепт хорошо переносится пациентами. Осложнения, возникающие в процессе лечения, аналогичны нежелательным явлениям, возникающим при лечении другими анти-VEGF препаратами. Преимуществом препарата является то, что для достижения стабильного эффекта требуется несколько меньшее количество его инъекций.
Конберцепт, подобно афлиберцепту, представляет собой рекомбинантный белок, состоящий из человеческих внеклеточных доменов VEGFR-1 и VEGFR-2 в сочетании с участком Fc человеческого иммуноглобулина G-1. В дополнение к высокой афинности ко всем изоформам VEGF-A он также связывается с плацентарным фактором роста и VEGF-B. Структурное различие между конберцептом и афлиберцептом заключается в том, что конберцепт содержит еще и 4-й связывающий домен, который повышает ассоциацию VEGF с рецептором.
Конберцепт хорошо переносился в клинических испытаниях, обеспечивая улучшение остроты зрения подобно другим анти-VEGF агентам. В то же время, согласно полученным данным, необходимо меньшее количество инъекций этого препарата по сравнению другими анти-VEGF препаратами. В декабре 2013 г. конберцепт был одобрен в Китае для использования в лечении «влажной» формы ВМД. О безопасности конберцепта можно судить по данным рандомизированного двойного слепого мультицентрового исследования AURORA, которое было проведено для изучения его эффективности. Препарат вводился в дозах 0,5 мг или 2,0 мг ежемесячно или в режиме PRN (после 3 «загрузочных» инъекций). Больных наблюдали в течение 12 мес. Кроме 3 «загрузочных» инъекций в группе лечения PRN до конца года пациентам потребовалось дополнительно только 2 или 3 инъекции. Изменение толщины сетчатки и динамика остроты зрения были аналогичны результатам применения других анти-VEGF препаратов. В конце 12-месячного периода в группе PRN в исследовании AURORA острота зрения улучшилась на 13,4 буквы, в группе ежемесячных инъекций – на 12,4 буквы.
Наиболее распространенные глазные нежелательные явления, отмечавшиеся во время лечения, были связаны с собственно инъекцией: например, транзиторное повышение ВГД, помутнение стекловидного тела, катаракта, конъюнктивальные кровоизлияния и кератит. Никаких системных нежелательных явлений отмечено не было [7].
Дизайн исследования PHOENIX был разработан по аналогии с исследованием эффективности ранибизумаба PIER – 3 ежемесячные инъекции с последующим переходом на ежеквартальный режим введения. Через 12 мес. лечения у пациентов отмечалось улучшение остроты зрения в среднем на 10 букв, что позволило авторам сделать вывод о более высокой эффективности конберцепта в сравнении с эффективностью ранибизумаба. Параллельно с функциональными отмечены и положительные анатомические изменения сетчатки в виде резорбции жидкости и нормализации состояния макулы по данным ОКТ и ФАГ. В настоящее время препарат не присутствует нa европейском и американском рынке.
Недавно стали появляться сообщения о применении еще одного анти-VEGF препарата как альтернативы афлиберцепту. Зив-афлиберцепт (Залтрап) имеет тот же механизм действия, что и афлиберцепт. Зив-афлиберцепт в настоящее время применяется для лечения колоректального рака. Одним из основных различий между этими препаратами является их осмолярность – у афлиберцепта она несколько меньше.
При оценке безопасности интравитреальных инъекций зив-афлиберцепта у кроликов никаких различий гистологических или электроретинографических показателей между группами пациентов, получавшими афлиберцепт или зив-aфлиберцепт, обнаружено не было, хотя зив-aфлиберцепт может оказывать определенное влияние на культуру клеток пигментного эпителия сетчатки in vitro в дозах, превышающих клинические [8]. Не выявлено токсического воздействия на сетчатку при введении этих 2-х препаратов в стекловидное тело лабораторных кроликов. Исследования не выявили какой-либо разницы в макро- и микропоказателях, включая ОКТ, состояние кровотока и гистологические показатели.
Первые сообщения о применении зив-афлиберцепта являются обнадеживающими, поскольку предполагается, что возможно применение другого, аналогичного афлиберцепту по эффективности, но гораздо менее дорогого анти-VEGF агента. Однако в настоящее время не существует достоверных данных об эффективности и безопасности препарата в условиях клинической практики.
В целом в настоящее время существует группа анти-VEGF препаратов, применяемых для лечения «влажной» формы ВМД и целого ряда других патологических состояний. Несмотря на некоторую разницу строения их молекул, а также определенные отличия физико-химических характеристик, все препараты как в исследованиях, так и в клинической практике показали сходные эффективность и безопасность. Все они приводят к улучшению зрения в краткосрочной перспективе, уменьшая активность неоваскулярной мембраны и снижая экссудацию. Кроме того, в настоящее время важным фактором выбора лекарств становится их доступность. Известно, что off-label препараты намного дешевле официально рекомендованных, и их использование позволяет лечить большее количество пациентов, проводя полный курс лечения.
В ближайшее время благодаря развитию новых технологий ожидается появление на рынке новых препаратов, возможно, еще более эффективных и безопасных, чем уже имеющиеся. Выбор препарата в настоящее время не столь очевиден. Компромисс следует искать и обсуждать с пациентами, взвешивая все «за» и «против».
Литература
- Bourla D.H., Young T.A. Age-Related Macular Degeneration: A Practical Approach to a Challenging Disease // The American Geriatrics Society. 2006. Vol. 54. P. 1130–1135.
- Brown D., Michels M., Kaiser P. et al. ANCHOR Study Group. Ranibizumab versus verteporfin photodynamic therapy for neovascular age-related macular degeneration: Two-year results of the ANCHOR study // Ophthalmology. 2009. Vol. 1. N 16. Р. 57–65.
- Chakravarthy U., Harding S., Rogers C. et al. Alternative treatments to inhibit VEGF in age-related choroidal neovascularisation: 2-year findings of the IVAN randomised controlled trial // Lancet. 2013. Vol. 382. P. 1258–1267.
- Ferrara N., Damico L., Shams N. et al. Development of Ranibizumab, An Anti-Vascular Endothelial Growth Factor Antigen Binding Fragment, As Therapy For Neovascular Age-Related Macular Degeneration // Retina. J. Retinal and Vitreous Diseases. 2006. Vol. 26. N 8. P. 859–870.
- Gragoudas E., Adamis A., Cunningham E.Jr., et al. Pegaptanib for neovascular age-related macular degeneration // N Engl J Med. 2004. Vol. 351. Р. 2805—2816.
- Heier J., Brown D., Chong V. et al. Intravitreal Aflibercept (VEGF Trap-Eye) in Wet Age-related Macular Degeneration // Ophthalmology. 2012. Vol. 119. P. 2537–2548.
- Li X., Gezhi Xu G, Wang Y. et al. Safety and Efficacy of Conbercept in Neovascular Age-Related Macular Degeneration. Results from a 12-Month Randomized Phase 2 Study: AURORA Study // Ophthalmology. 2014.
- Malik D., Tarek M., del Carpio J. et al. 2014 Safety profiles of anti-VEGF drugs: bevacizumab, ranibizumab, aflibercept and ziv-aflibercept on human retinal pigment epithelium cells in culture // Br J Ophthalmol. 2014. Vol. 98. Suppl 1. Р. 11–16.
- Martin D., Maguire М., Fine S. et al. Ranibizumab and Bevacizumab for Treatment of Neovascular Age-related Macular Degeneration Two-Year Results // Ophthalmology. 2012. Vol. 119. P. 1388–1398.
- Rofagha S., Bhisitkul R., Boyer D. et al. Seven-year outcomes in ranibizumab-treated patients in ANCHOR, MARINA and HORIZON: a multicenter cohort study (SEVEN-UP) // Ophthalmology. 2013. Vol. 120. P. 2292–2299.
- Rosenfeld P., Brown D., Heier J. et al. Ranibizumab for neovascular age-related macular degeneration // N Engl J Med. 2006. Vol. 355. P. 1419–1431.
- Singer M., Awh C., Sadda S. et al. HORIZON: An Open-Label Extension Trial of Ranibizumab for Choroidal Neovascularization Secondary to Age-Related Macular Degeneration // Ophthalmology. 2012. Vol. 119. P. 1175–1183.







Комментировать