Микроэкосистема влагалища. Вагинальная микрофлора. Результаты и анализ зарубежных исследований.
Е.Ф. Кира, Е.А. Душкина, Н.С. Бадикова, Кафедра женских болезней и репродуктивного здоровья ИУВ ФГБУ Национальный медико-хирургический центр им. Н.И. Пирогова Министерства здраво- охранения России, Москва
Роль молочной кислоты (МК) в поддержании гомеостаза вагинального биотопа весьма значима. В естественных условиях поддержание кислотности влагалища происходит благодаря функциональной активности влагалищных эпителиоцитов и МК-бактерий. В случаях нарушения стабильности рН среды коррекция кислотности влагалища может быть осуществлена с помощью местного применения препаратов МК, в связи с чем актуальность и перспективность исследований по изучению эффективности новых сов- ременных кислотосодержащих препаратов, их доз и схем лечения бактериального вагиноза не вызывают сомнения. Впервые разработанные в России суппозитории с МК в дозе 100 мг (фемилекс) становятся альтернативой традиционной антибактериальной тера- пии бактериального вагиноза. Возможно, что терапия МК при сниженной, но сохраненной лактофлоре сможет исключить второй этап применения пробиотиков.
Знания о микроэкологической системе влагалища, ее составляющих элементах, биологических свойствах, нормальной микрофлоре, изменчивости являются фундаментальной предпосылкой для понимания механизмов возникновения инфекционных болезней, создания адекватных диагности- ческих тестов и разработки оптимальных лечебных мероприятий [1]. В последние годы роль ваги- нальной микроэкосистемы все больше привлекает внимание многочисленных исследователей в связи с ее значительной ролью в обеспечении местной защиты против большинства патогенных бактерий и вирусов, колонизационной резистентности, а также для обеспечения адекватной ферти- льности женщин.
Микроэкосистема влагалища объединяет в себе анатомическое строение органа, гистологическую структуру его слизистой оболочки, биологические и биохимические свойства влагалищной жидкости и разнообразие микрофлоры, которая включает аэробные, микроаэрофильные, факультативные и облигатные анаэробные бактерии. Эти микроорганизмы могут существовать как комменсалы, либо находиться в отношениях синергизма или антагонизма друг с другом. Во времена альберта Дедерлейна бытовало представление о том, что микрофлора влагалища представляет собой однородный и постоянный пул лактобацилл. Но к настоящему времени благо- даря многочисленным исследованиям достоверно установлено видовое многообразие нормальной микрофлоры влагалища [1].
Вагинальная микрофлора, главным образом лактобактерии, играет важную роль в поддержании го- меостаза женских половых органов. На сегодняшний день идентифицировано более 150 видов этих микроорганизмов, из которых наибольшее клиническое значение имеют лактобактерии 4 видов: L. acidophilus, L. casei, L. fermentum и L. cellobiosum. Для поддержания их активной жизнедеятельности необходима кислая среда, анаэробные условия и достаточное содержание в эпителии влагалища гликогена – основного питательного субстрата для их роста. именно распад гликогена в десквами- рованном эпителии до моно- и дисахаров, которые в процессе метаболизма молочнокислых бакте- рий трансформируются в молочную кислоту (МК) и перекись водорода, способствует поддержанию соответствующего рН среды влагалища и препятствует размножению патогенных микроорганизмов. У здоровых женщин репродуктивного возраста доминируют лактобактерии, продуцирующие пере- кись водорода, доля которых достигает 95–98% от общей микробной массы влагалища. 2 Защитные свойства лактобактерий реализуются путем прямого антибактериального действия пере- киси водорода на условно-патогенные микроорганизмы (УПМ), а также посредством поддержания достаточной концентрации МК, что является критическим для жизнедеятельности кислотонеустой- чивых микроорганизмов влагалища. В условиях кислой среды лактобактерии активно конкурируют с другими микробами за возможность адгезии с клетками эпителия влагалища, а также стимулируют иммунную систему, выработку секреторного SIgA, лизоцима, комплемента и других факторов лока- льного иммунитета [1, 2].
Молочная, уксусная и летучие жирные кислоты с короткой углеродной цепочкой являются важными составляющими содержимого влагалища. Они образуются из углеводов, попадающих во влагалищ- ную жидкость из клеток эпителия. Лактобактерии ферментируют углеводы до алифатических жир- ных кислот, которые являются нормальной физиологической составляющей влагалищной жидкости и обеспечивают поддержание кислотности влагалищного содержимого. В норме рН соответствует кислому диапазону и находится в пределах 3,7–4,5.
Кислая среда во влагалище является одним из основных факторов, обеспечивающих нормальное состояние и функцию органа. Вагинальный уровень рН может подвергаться физиологическим из- менениям от рождения к менопаузе (с возрастом рН влагалища увеличивается) под действием сте- роидов яичников, в течение менструального цикла у одной и той же женщины, а также при бере- менности (в норме понижается) [1]. Кроме того, рН влагалища может меняться под действием дру- гих факторов: индекса массы тела (при его повышении рН влагалища увеличивается); заболеваний шейки матки и влагалища, инфекций (трихомоноз, бактериальный вагиноз); сексуальной активнос- ти, при попадании спермы во влагалище; оральных контрацептивов; системных заболеваний; сис- темной или местной антибактериальной терапии, погрешностей в личной гигиене и др. [2]. На кис- лотность влагалищной жидкости влияют многочисленные экзогенные и эндогенные факторы, в том числе температура и оксигенация. Отмечается даже зависимость рН от профессиональной деяте- льности (у работающих женщин рН ниже, чем у домохозяек).
Слаженность и гармоничность деятельности микроэкосистемы влагалища координируются и регу- лируются эндокринной, иммунной системами с учетом особенностей процессов обмена в организ- ме, некоторых факторов внешней среды и экзогенных влияний. МК образуется в результате молочнокислого брожения и является важным продуктом обмена ве- ществ животных, растений и микроорганизмов (рис. 1).
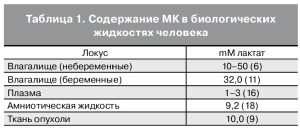
МК обнаруживается в различных биологических жидкостях и тканях человека (табл. 1) и играет очень важную роль в обмене веществ и поддержании гомеостаза. В норме у женщин репродуктив- ного возраста МК аккумулируется в просвете влагалища. Во влагалищной жидкости она образуется при взаимодействии между слизистой оболочкой влагалища и молочнокислыми бактериями [3, 4].
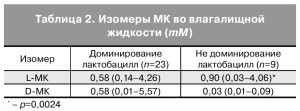
Сегодня доказано, что эпителиальные клетки способны вырабатывать МК. Именно в слое промежуточных вагина- льных эпителиоцитов под влиянием эстрогенов глюкоза метаболизируется в анаэробных условиях до пировиноградной и L-МК. L-МК диффузно проникает наружу и скапливается в просвете влагали- ща. Второй механизм образования МК влагалища – бактериального происхождения. Lactobacillus spp. во влагалище метаболизируют экстрацеллюлярный гликоген в МК посредством анаэробного глико- лиза. Другие бактерии (Atopobium, Megasphaera, Leptotrichia, Pediococcus, Leuconostoc, молочноки- слые стрептококки, бифидобактерии) также могут продуцировать МК во влагалище. Бактерии про- дуцируют два изомера L- и D-МК (табл. 2).
Главная биологическая роль МК влагалища – антибактериальная и противовирусная защита. МК влагалища не убивает лактобациллярную микрофлору, ее действие заключается в прямом разру- шении бактериальной мембраны. Установлена связь между концентрацией D- и L-МК и количественным доминированием различных микроорганизмов во влагалище. так, при L-МК доминируют L. iners и L. crispatus, но при этом также обнаруживаются гарднереллы и стрептококки. При обнаружении D-МК выделяют в основном L. crispatus, несколько меньше – L. iners, но не выделяются ни гарднереллы, ни стрептококки. Из этого следует вывод, что D-МК в большей степени губительна для УПМ.
Вторая очень важная функция МК – иммунологическая компетентность. В настоящее время доказа- но влияние бактерий и МК на выработку иммунных медиаторов в женских половых путях. При этом у МК обнаружен специфический эффект, которого нет у уксусной кислоты. 4 Кроме того, отмечается избирательная стимуляция интерлейкина-23 (IL-23)/IL-17, T- лимфоцитарного звена [5, 6], индукция провоспалительных цитокинов вагинальными эпителиаль- ными клетками в присутствии агонистов Toll-подобных рецепторов [7]; индукция опухолевого ангио- генеза [8, 9]; активация лимфоцитов [10, 11].
При бактериальном вагинозе (БВ) и трихомонозе изменяется кислотный состав содержимого влага- лища в щелочную сторону, в среднем 6,0–6,5. Это обусловлено значительным снижением уровня МК во влагалище [1, 12]. Вот почему определение рН во влагалище не менее важно, чем определе- ние кислотности в желудке для диагностики многих заболеваний.
Учитывая, что образование микробных биопленок во влагалище при различных инфекциях повы- шает устойчивость бактерий к антибактериальным средствам, изменяет рН среды в щелочную сто- рону и снижает активность иммунитета, становится оправданной и крайне необходимой разработка новых препаратов для окисления среды. ацидификация влагалища может быть надежно осуществ- лена с помощью местного применения МК.
В 2012 г. в россии зарегистрирован препарат фемилекс, содержащий в своем составе 100 мг мк в виде вагинальных суппозиториев. Теоретическое обоснование применения МК как наиболее физи- ологического компонента в качестве самостоятельного средства или в комплексном лечении БВ, нашло свое отражение в проведенном нами исследовании. Представленные результаты терапии БВ препаратами фемилекс и фемилекс+гексикон показали высокую эффективность и безопасность обеих схем терапии, сравнимую и даже превосходящую по эффективности стандартное лечение клиндамицином (рис. 2). аскорбиновая кислота (вагинорм-с) и клиндамицин (далацин) оказались менее эффективными в качестве самостоятельного способа лечения БВ по сравнению с фемилек- сом и фемилекс+гексикон [2]. Было доказано, что монотерапия мк по 100 мг однократно в сутки в виде вагинальных суппозитори- ев (фемилекс) является эффективным методом лечения БВ. частота положительных результатов составила 93,9%. Эффективность сочетания фемилекса и гексикона была наибольшей среди всех изученных групп – 96,4%. В результате такого лечения наблюдалось выраженное угнетение роста БВ-ассоциированных микроорганизмов. Напротив, количество лактобактерий не только не умень- шалось, но и достоверно увеличивалось сразу после окончания лечения (визит 2) и спустя 1 мес (визит 3), тогда как клиндамицин действовал на МК-бактерии более агрессивно.
МК является безопасным препаратом для клинического применения. Частота нежелательных явле- ний при ее использовании в монотерапии составила 3%; при сочетании фемилекса и гексикона не- желательных явлений при лечении БВ не зарегистрировано. Ни в одном из случаев не отмечено возникновения кандидозного вагинита на фоне приема фемилекса, тогда как после лечения ваги- нормом-с и далацином вульвовагинальный кандидоз развивался в 7,7 и 3,7% соответственно. Эти данные позволяют рекомендовать фемилекс как для монотерапии, так и в комбинации с гекси- коном для лечения БВ, а также различных инфекционно-воспалительных заболеваний влагалища. Таким образом, можно констатировать, что роль МК в поддержании гомеостаза вагинального био- топа весьма значима. В естественных условиях поддержание кислотности влагалища происходит благодаря функциональной активности влагалищных эпителиоцитов и МК-бактерий. В случаях на- рушения стабильности рН среды коррекция кислотности влагалища может происходить либо при применении непосредственно препаратов, содержащих слабые органические кислоты (молочную, борную), либо при воздействии на микроорганизмы, ассоциированные с БВ, например метронида- золом или клиндамицином. В последнем случае добиться восстановления кислотности удается, но этот процесс происходит значительно медленнее, чем при использовании непосредственно кислот- ных препаратов и не всегда в полной степени. L-МК обеспечивает механизм антимикробной защиты женских половых путей: убивает нелактоба- циллярную микрофлору, селективно активирует иммунокомпетентные клетки, стимулирует антиба- ктериальную активность клеток вагинального эпителия [13]. Мы предполагаем, что специфическая 5 продукция L- и D-МК не просто обеспечивает генерацию кислого рН, но и ответственна за поддер- жание необходимого пула лактобактерий и оптимума вагинальной микроэкосистемы в целом. Нами был обоснован один из основных принципов терапии БВ – восстановление нормальных био- физических и биохимических параметров микроэкосистемы влагалища, а именно – восстановление рН влагалищной среды. В связи с этим большое значение приобретают кислотосодержащие препа- раты.
Ацидификация влагалища может быть надежно осуществлена с помощью местного применения МК. Ранее нами установлено, что инстилляции влагалища МК являются наиболее приемлемым и физиологически оправданным способом. Благодаря их применению уменьшается рН содержимого влагалища (восстанавливается кислая среда), что создает неблагоприятные условия для размно- жения строгих анаэробов. Кроме того, слабые растворы МК обладают выраженным антисептичес- ким действием, а также обеспечивают оптимальные условия для восстановления лактофлоры. Помимо инстилляций в настоящее время наиболее часто используются различные кислотосодер- жащие средства, преимущественно гели.
М. Milani и соавт. (2003) в рандомизированном слепом контролируемом исследовании при лечении БВ показали бóльшую эффективность однократной оральной дозы тинидазола 2 г с последующей поддерживающей терапией в виде интравагинального введения буферного кислотного геля, чем стандартной 7-дневной схемы интравагинального использования клиндамицина [14]. M. Mucci и C. Benvenuti (2006) из Швейцарии и италии разработали и предложили использовать МК с мальтодек- стрином в виде геля (Intilac plus, Rottapharm) для лечения БВ в течении 1 нед. Было продемонстри- ровано, что полное выздоровление или улучшение наблюдалось у 88% женщин с острым БВ или дисмикробизмом на фоне терапевтической безопасности и клинической и микробиологической эф- фективности препарата [15] .
В 2006 г. M. Brandt и соавт. сообщили об оригинальном препарате вагизан (Vagisan,Wolff, Герма- ния), представляющем собой суппозитории с МК. В отличие от нашей методологии применения МК на начальном этапе лечения, цитируемые авторы использовали вагизан интравагинально после ку- рса терапии метронидазолом сначала ежедневно в течение 7 дней, а далее дважды в неделю еще в течение 13 нед.
Рецидивы составили 7,4% в группе с МК против 12,7% в группе контроля. Однако эти различия бы- ли статистически недостоверными, так как группы были неоднородными – 8 и 77 человек. по всей видимости, профилактическое использование МК после лечения БВ требует дополнительных исс- ледований [16].
A. Swidsinski и соавт. (2012) отметили положительный эффект при локальном интравагинальном применении лактат-геля у 11 из 20 пациенток, страдающих реккурентным циститом и бактериурией, обусловленными персистенцией кишечной палочки. авторы связывают положительный эффект с вероятной санацией влагалища, в котором Е. coli входила в состав микробных биопленок. В данном контексте влагалище – это резервуар УПМ, ассоциированной с бактериурией и циститом [17]. Резюмируя все перечисленное, актуальность и перспективность исследований по изучению эффек- тивности новых современных кислотосодержащих препаратов, их доз и схем лечения БВ, не вызы- вают сомнения. Впервые разработанные в россии суппозитории с мк в дозе 100 мг (фемилекс) ста- новятся альтернативой традиционной антибактериальной терапии БВ. Возможно, что терапия МК при сниженной, но сохраненной лактофлоре сможет исключить второй этап применения пробиоти- ков, что доказано высокой эффективностью сочетания фемилекса и гексикона [2].
Литература
1. Кира Е.Ф. Бактериальный вагиноз. м.: миа; 2012. 472 с. 2. Кира Е.Ф., Прилепская В.Н., Костава М.Н., Гамирова Е.В., Довлетханова Э.Р., Душкина Е.А. и др. современные подходы к выбору препа- рата локального действия в терапии бактериального вагиноза. акушерство и гинекология. 2012; 7: 60–7. 6 3. Gorodeski G.I., Hopfer U., Liu C.C., Margles E. Estrogen acidifies vaginal pH by up-regulation of proton secretion via the apical membrane of vaginal-ectocervical epithelial cells. Endocrinology. 2005; 146(2): 816–24. 4. Zhou X., Bent S.J., Schneider M.G., Davis C.C., Islam M.R., Forney L.J. Characterization of vaginal microbial communi-ties in adult healthy women using cultivation-independent methods. Microbiology. 2004; 150(8): 2565–73. 5. Shime H., Yabu M., Akazawa T., Kodama K., Matsumoto M., Seya T., Inoue N. Tumor-secreted lactic acid promotes IL-23/ IL-17 proinflammatory pathway. J. Immunol. 2008; 180(11): 7175–83. 6. Witkin S.S., Alvi S., Bongiovanni A.M., Linhares I.M., Ledger W.J. Lactic acid stimulates interleukin-23 production by peripheral blood mononuclear cells exposed to bacterial lipopolysaccharide. FEMS Immunol. Med. Microbiol. 2011; 61(2): 153–8. 7. Mossop H., Linhares I.M., Bongiovanni A.M., Ledger W.J., Witkin S.S. Influence of lactic acid on endogenous and viral RNA-induced immune mediator production by vaginal epi-thelial cells. Obstet. Gynecol. 2011; 118(4): 840–6. 8. Végran F., Boidot R., Michiels C., Sonveaux P., Feron O. Lactate influx through the endothelial cell monocarboxylate transporter MCT1 supports an NF-κB/IL-8 pathway that drives tumor angiogenesis. Cancer Res. 2011; 71(7): 2550–60. 9. Gottfried E., Kunz-Schughart L.A., Ebner S., Mueller-Klieser W., Hoves S., Andreesen R. et al. Tumorderived lactic acid modulates dendritic cell activation and antigen expres-sion. Blood. 2006; 107(5): 2013– 21. 10. Murray C.M., Hutchinson R., Bantick J.R. Monocarboxylate transporter MCT1 is a target for immunosuppression. Nat. Chem. Biol. 2005; 1(7): 371–6. 11. Roth S., Gmünder H., Dröge W. Regulation of intracellular glutathione levels and lymphocyte functions by lactate. Cell. Immunol. 1991; 136(1): 95–104. 12. Молчанов О.Л., Тимошенкова Ю.Л., Абашин В.Г. о роли модуляции кислотности влагалищной жидкости в терапии бактериального вагиноза. Гинекология. 2010; 12(1): 33–6. 13. Boskeye E.R., Cone R.A., Whaley K.J., Moench T.R. Origins of vaginal acidity: high D/L lactate ratio is consistent with bacteria being the primary source. Hum. Reprod. 2001; 16(9): 1809–13. 14. Milani M., Barcellona E., Agnello A. Efficacy of the combination of 2 g oral tinidazole and acidic buffering vaginal gel in comparison with vaginal clindamycin alone in bacte-rial vaginosis: a randomized, investigator-blinded, controlled trial. Eur. J. Obstet. Gynecol. Reprod. Biol. 2003; 109(1): 67–71. 15. Mucci M., Benvenuti C. Effect of lactic acid and maltodextrins in trins in vaginal dysmicrobism. In: Abstracts of the 11th World Congress of Gynecological Endocrinology. Florence, Italy, February 26-29, 2004; Gynecol. Endocrinol. 2004; 18(Suppl.1): 176–9. 16. Brandt M., Hoyme U.B., May T.W., Lohmann K. Metronidazole administrered intravaginally vs orally in treatment of bacterial vaginosis followed by prophylaxis of recurrence with lactic acid. A prospective randomized double blind placebo-controlled multicenter study. Abstracs Books, Monterey, 2006. 17. Swidsinski A., Loening-Baucke V., Mendling W., Swidsinski S. Positive effects of local therapy with a vaginal lactic acid gel on dysuria and E.colibacteriuria question our current news on recurrent cystitis. Arch. Gynecol. Obstet. 2012; 1: 2196.













Комментировать