Д.А. Напалков*,Первый Московский государственный медицинский университет им. И.М.Сеченова 119992, Москва, Б. Пироговская ул., 6
Введение
Количество исследований и публикаций относительно целесообразности применения статинов огромно. В настоящее время ни у кого не вызывает сомнений тот факт, что эффективность данного класса препаратов для первичной и вторичной профилактики сердечно-сосудистой событий чрезвычайно высока. Принципиальный вопрос, который решает для себя медицинская общественность как в нашей стране, так и за рубежом — не столько само назначение статинов тем пациентам, кому они показаны, сколько выбор их дозы. И в этой связи нельзя не коснуться темы побочных эффектов на фоне терапии статинами, поскольку боязнь их возникновения заставляет пациентов отказываться от долгосрочной терапии статинами и снижает приверженность лечению, а врачей — назначать существенно меньшие дозы препаратов.
Повышение уровня печеночных ферментов
В связи с часто назначающимся биохимическим исследованием крови повышение уровня печеночных ферментов, регистрирующееся на фоне терапии статинами, возникает достаточно часто. Поэтому, в первую очередь, необходимо понимание того факта, что повышение уровня трансаминаз далеко не всегда ассоциировано с нарушением функционирования печени. О реальной гепатотоксичности необходимо говорить в случае, если клиническая картина соответствует закону Хая (его вывел Хайман Циммерман еще в 1970-е годы) [1] и включает в себя позиции, указанные в табл. 1. Оказалось, из каждых 10 пациентов, отвечающих закону Хая, у одного развивается острая печеночная недостаточность, и, наоборот, у каждого 10-го пациента с повышением уровня аланиновой трансаминазы (АлТ) в 5-10 раз выше верхней границы нормы имеются и другие позиции закона Хая.

В то же время следует отметить, что изолированное повышение уровня трансаминаз без общего билирубина не является проявлением так называемого «поражения печени». Более точно о поражении печени свидетельствуют отклонения от нормы таких параметров, как уровень альбумина плазмы, протромбиновое время и уровень прямого билирубина. Изолированное повышение ферментов печени может происходить на фоне целого ряда других заболеваний, которые необходимо исключить у пациента, прежде чем принять решение о медикаментозно-ассоциированном отклонении лабораторных показателей от нормы.
Ключевым изменением в принципах ведения пациентов на фоне применения статинов является определение уровня печеночных ферментов до начала терапии статинами, а далее — лишь по клиническим показаниям в связи с тем, что серьезное поражение печени возникает крайне редко и практически непредсказуемо по лабораторным анализам. Отмечается также, что статины могут безопасно применяться у пациентов с неалкогольным стеатогепатозом. При сопутствующей терапии вирусных гепатитов противовирусными препаратами (интерферон-альфа, пегилированный интерферон-альфа, энтекавир, тенофовир, адефовир, ламивудин и телбивудин) необходимо взвешивать возможность межлекарственных взаимодействий и назначать статины с особой осторожностью. Допускается назначение статинов у пациентов, перенесших трансплантацию печени, а также при аутоиммунном гепатите [2].
Говоря о конкретных препаратах, можно привести в качестве примера крупный ретроспективный анализ 49 клинических исследований с аторвастатином (n=14 236), который показал сопоставимую частоту повышения уровня печеночных ферментов в группах плацебо (0,2%), аторвастатина 10 мг (0,1%) и аторвастатина 80 мг (0,6%), тем самым доказав высокий профиль безопасности аторвастатина [3].
Миопатии и рабдомиолиз
Миопатии признаются наиболее частым побочным эффектом, возникающим на фоне лечения статинами. Кроме того, в отличие от толерантного восприятия повышения уровня печеночных ферментов у большинства больных миопатии с исходом в острую почечную недостаточность, действительно, могут быть серьезным поводом для беспокойства и у пациентов, и у врачей. В этой связи необходимо указать, какие варианты миопатий описаны на фоне лечения статинами (табл. 2) [4].

Из числа указанных статин-индуцированных миопатий наиболее часто встречается миалгия (1-5% в клинических исследованиях и 11-29% в наблюдательных когортных исследованиях) [5-10]. Считается, что более низкая частота миопатий в клинических исследованиях связана, во-первых, с отсутствием специализированных опросников для выявления симптомов мышечного поражения, а также в связи с жесткими критериями включения и исключения из исследований.
Алгоритм диагностики статин-индуцированной миалгии был разработан в ходе двойного слепого клинического исследования STOMP [11]. В исследование были включены 202 пациента, рандомизированные в группы приема аторвастатина 80 мг и плацебо в течение 6 мес, в течение которых дважды в мес с пациентами активно устанавливался контакт по телефону и задавались вопросы об ощущениях в мышцах. В ходе анализа полученных данных была разработана диагностическая шкала статин-индуцированной миопатии, которая приведена в табл. 3.

Пациенты, у которых была выявлена непереносимость одного из статинов (например, вследствие развития миопатии), могут хорошо переносить другие статины. При наличии непереносимости различных статинов и необходимости снижения дозы в качестве дополнительных гиполипидемических препаратов может использоваться эзетимиб и (не зарегистрированные в России) секвестранты желчных кислот.
В уже упоминавшемся выше ретроспективном анализе 49 клинических исследований с аторвастатином (n=14 236) был продемонстрирован профиль безопасности аторвастатина в отношении риска развития рабдомиолиза, сопоставимый с плацебо [3]. Миалгия была зафиксирована в группах аторвастатина 10 мг в 1,4% случаев, в группах аторвастатина 80 мг — в 1,5% случаев, а в группах плацебо — в 0,7% случаев. При этом ни в одной из групп терапии не было отмечено ни одного случая рабдомиолиза [3].
Сахарный диабет
Впервые вопрос о возможной провокации клинической манифестации сахарного диабета 2 типа на фоне приема статинов возник после публикации данных исследования JUPITER с розувастатином. В нем было отмечено незначительное, но статистически значимое повышение числа выявленных новых случаев сахарного диабета в группе розувастатина в сравнении с плацебо [1 2]. После этого был проведен целый ряд мета-анализов, целью которых было ответить на 2 вопроса: 1) является ли данная ситуация уникальной для молекулы розувастатина и 2) перевешивает ли польза от применения статинов потенциальный риск ускорения клинической манифестации сахарного диабета.
В мета-анализ Sattar et al. было включено 13 исследований по статинам, в которых в общей сложности у 91140 пациентов в начале исследования отсутствовал диагноз «сахарный диабет» [13]. В течение 4-летнего периода наблюдения в группах терапии статинами было зафиксировано 2226 случаев развития сахарного диабета, а в группах плацебо — 2052 [отношение шансов (ОШ) 1,09; 95% доверительный интервал (ДИ) 1,02-1,17]. Существенных различий между исследованиями с различными статинами (аторвастатин, симвастатин, розувастатин, правастатин и ловастатин) выявлено не было. Число пациентов, которые необходимо было пролечить для того, чтобы у 1 больного «индуцировался» сахарный диабет, составило 255 человек. В то же время было отмечено, что подобная терапия у такого количества пациентов приводит к профилактике 5,5 сердечно-сосудистых событий (сердечно-сосудистая смерть или нефатальный инфаркт миокарда), поэтому польза от лечения статинами, вне всяких сомнений, перевешивает риск прогрессирования нарушений углеводного обмена на фоне подобной терапии.
В ряде других мета-анализов [14-15] были получены аналогичные результаты: при небольшой, но достоверной тенденции к развитию диабета на фоне приема статинов польза от снижения сердечно-сосудистого риска несопоставимо высока.
В то же время ответ на другой вопрос — ухудшает ли прием статинов гликемический контроль у пациентов с сахарным диабетом — оказался следующим: имеющиеся данные позволяют говорить лишь о недостоверном ухудшении гликемического контроля не более чем на 0,3%, в связи с чем нельзя говорить о подобном «побочном эффекте» терапии статинами [16].
В настоящее время доказательная база по применению статинов у пациентов с сахарным диабетом существует по симвастатину (исследование 4S и HPS), а также по аторвастатину (исследование CARDS) (табл. 4) [17-20]. С учетом более жестких требований к снижению уровня липидных фракций у большинства пациентов с сахарным диабетом [холестерин липопротеидов низкой плотности (ХС ЛНП) <1,8 ммоль/л], выбор аторвастатина в этой клинической ситуации (исследования проводились на оригинальном препарате Липримар, Pfizer) можно считать наиболее предпочтительным.
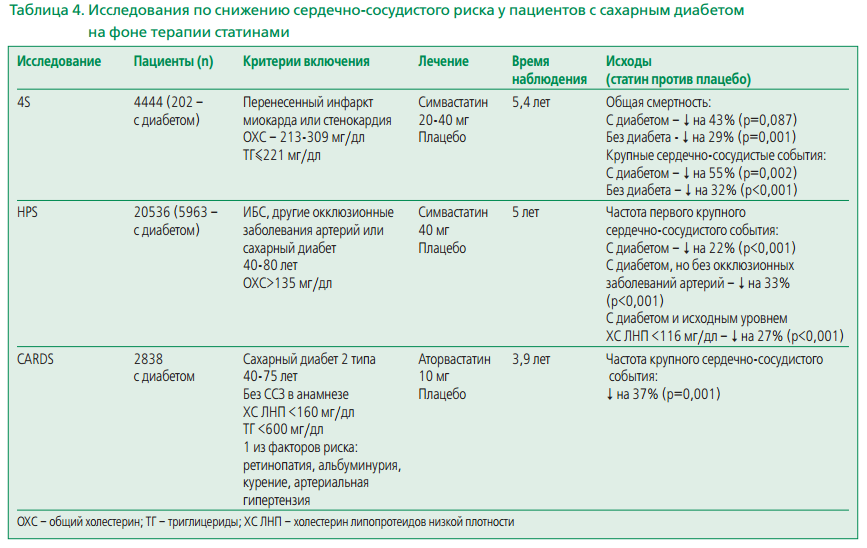
Большинство экспертов сходятся во мнении о том, что перед началом терапии высокими дозами статинов врачи должны предупреждать пациентов о необходимости уменьшения модифицируемых факторов риска развития сахарного диабета: борьбы с гиподинамией, снижении веса и гипогликемической диеты.
Когнитивная дисфункция
В первую очередь, перед началом терапии статинами нет необходимости проводить оценку на предмет выявления когнитивной дисфункции у пациентов. Во-вторых, терапия статинами не сопровождается риском развития когнитивной дисфункции по данным когортных и рандомизированных исследований. При развитии когнитивной дисфункции на фоне терапии статинами необходимо доказать ее наличие и исключить возможные факторы ее возникновения: другие лекарственные препараты, алкоголь, наличие депрессии, В12-дефицитной анемии, патологии щитовидной железы, ВИЧ-инфекции, опухоли ЦНС, болезни Паркинсона, болезни Альцгеймера и др. И только в том случае, если возникновение когнитивной дисфункции происходит на фоне более липофильных препаратов (симвастатин и аторвастатин), то это может быть поводом для замены их на более гидрофильные статины — правастатин или розувастатин [21].
Почечная функция
В одном из крупных мета-анализов, включавшем все ключевые исследования по аторвастатину и розувастатину, сравнивалось влияние проводимой гиполипидемической терапии на состояние функции почек [22]. При сравнении с плацебо терапия аторвастатином и розувастатином приводила к достоверному улучшению показателя скорости клубочковой фильтрации (СКФ): на 0,59 для аторвастатина (р=0,01) и на 0,04 для розувастатина (р=0,01). В исследованиях, сравнивавших аторвастатин и розувастатин, их влияние на СКФ было сопоставимым (р=0,89), однако влияние аторвастатина на уменьшение протеинурии было достоверно выше, чем таковое у розувастатина (р=0,009). В этой связи представляется целесообразным рассматривать аторвастатин как препарат выбора у пациентов с протеинурией различного генеза, поскольку он обладает большим нефропротективным действием, чем розувастатин. Особенно это представляет значимость в популяции возрастных пациентов, имеющих сопутствующую патологию, которая способствует прогрессирующему ухудшению почечной функции в сочетании с нарастанием протеинурии.
Заключение
Подводя итоги, в которых необходимо коснуться не только безопасности, но и эффективности терапии имеющимися на российском фармацевтическом рынке статинами (симвастатин, аторвастатин и розувастатин), можно свести их плюсы и минусы в одну приведенную ниже табл. 5.

Таким образом, если вопрос безопасности терапии статинами является не менее актуальным, чем вопрос ее эффективности, то в данном «балансе сил» предпочтение целесообразно отдавать терапии аторвастатином, при этом, по возможности, оригинальным препаратом (Липримар, Pfizer), на котором было проведено подавляющее большинство клинических исследований и получены соответствующие результаты, отражающие его безопасность и эффективность.
Конфликт интересов. Автор заявляет об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Литература
- US Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research (CDER) Center for Biologies Evaluation and Research (CBER). Guidance for Industry, Drug-Induced Liver Injury: Premarketing Clinical Evaluation 2009. Available at http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guid-ances/UCM174090.pdf. Accessed March 14, 2014.
- Bays H, Cohen DE, Chalasani N, Harrison SA. An Assessment by the Statin Liver Safety Task Force: 2014 Update. J Clin Lipidology 2014; 8: S47-S57.
- Newman C, Tsai J, Szarek M, Luo D, Gibson E. Comparative safety of atorvastatin 80 mg versus 10 mg derived from analysis of 49 completed trials in 14,236 patients. Am J Cardiol 2006; 97 (1): 61 -7
- Rosenson RS, Baker SK, Jacobson TA, et al. An Assessment by the Statin Muscle Safety Task Force: 2014 Update. J Clin Lipidology 2014; 8: S58-S71.
- Phillips PS, Haas RH, Bannykh S, et al, Scripps Mercy Clinical Research Center. Statin-associated myopathy with normal creatine kinase levels. Ann Intern Med 2002; 137: 581-5
- Phillips PS, Haas RH. Observations from a statin myopathy clinic. Arch Intern Med 2006; 166: 1 2321233.
- Bruckert E, Hayem G, Dejager S, et al. Mild to moderate muscular symptoms with high-dosage statin therapy in hyperlipidemic patients—the PRIMO study Cardiovasc Drugs Ther 2005; 1 9: 403-14
- Buettner C, Davis RB, Leveille SG, et al. Prevalence of musculoskeletal pain and statin use. J Gen Intern Med 2008; 23: 1 182-6.
- El-Salem K, Ababneh B, Rudnicki S, et al. Prevalence and risk factors of muscle complications secondary to statins. Muscle Nerve 2011; 44: 877-81.
- Cohen JD, Brinton EA, Ito MK, Jacobson TA. Understanding Statin Use in America and Gaps in Patient Education (USAGE): an internet-based survey of 10,138 current and former statin users. J Clin Jpidol 2012; 6: 208-1 5.
- Parker BA, Capizzi JA, Grimaldi AS, et al. Effect of statins on skeletal muscle function. Circulation 2013;127:96-103.
- Rajpathak SN, Kumbhani DJ, Crandall J, et al. Statin therapy and risk of developing type 2 diabetes a meta-analysis. Diabetes Care 2009; 32: 1924-9.
- Sattar N, Preiss D, Murray HM, et al. Statins and risk of incident diabetes: a collaborative meta-analysis of randomised statin trials. Lancet 2010; 375: 735-42
- Waters DD, Ho JE, Boekholdt SM, et al. Cardiovascular event reduction versus new-onset diabetes during atorvastatin therapy: effect of baseline risk factors for diabetes. J Am Coll Cardiol 2013; 61: 14852.
- Ridker PM, Pradhan A, MacFadyen JG, et al. Cardiovascular benefits and diabetes risks of statin therapy in primary prevention: an analysis from the JUPITER trial. Lancet 2012; 380: 565-71
- Maki KC, Ridker PM, Brown WV, et al. An Assessment by the Statin Diabetes Safety Task Force: 2014 Update. J Clin Lipidology 2014; 8: S17-S29.
- Colhoun HM, Betteridge DJ, Durrington PN, et al, CARDS investigators. Primary prevention of cardiovascular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS) multicentre randomised placebo-controlled trial. Lancet 2004; 364: 685-96
- Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lower-ng with simvastatin in 20,536 high-risk individuals: a randomised placebo-controlled trial. Lancet 2002;360:7-22.
- Collins R, Armitage J, Parish S, et al, Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol-lowering with simvastatin in 5963 people with diabetes: a randomised placebo-controlled trial. Lancet 2003; 361: 2005-16.
- Pyorala K, Pedersen TR, Kjekshus J, et al. Cholesterol lowering with simvastatin improves prognosis of diabetic patients with coronary heart disease. A subgroup analysis of the Scandinavian Simvastatin Survival Study (4S). Diabetes Care 1997; 20: 61 4-20.
- Rojas-Fernandez CH, Goldstein LB, Levey AI, et al. An Assessment by the Statin Cognitive Safety Task Force: 2014 Update. J Clin Lipidology 2014; 8: S5-S16.









Комментировать