Синдром раздраженного кишечника – общая характеристика. Новые рекомендации по диагностике и лечению синдрома раздраженного кишечника в первичной помощи, выпущенные Национальным институтом здравоохранения и клинического мастерства Великобритании (NICE). Преимущество спазмолитического эффекта Бускопана.
Профессор В.Б. Гриневич, профессор Е.И. Сас, к.м.н. Ю.А. Кравчук, к.м.н. Н.Н. Щербина, к.м.н. О.И. Ефимов, ФГКВОУ ВПО «ВМА им. С. М. Кирова» Минобороны России, Санкт-Петербург
Синдром раздраженного кишечника (СРК) — одно из наиболее распространенных желудочно-кишечных расстройств, которым страдают 10-15% населения в развитых странах [1, 2]. На всем земном шаре от проявлений СРК страдают около 1 млрд жителей. СРК — одно из самых частых заболеваний, с которыми сталкиваются терапевты и гастроэнтерологи в своей врачебной практике [3]. Кроме того, большая часть больных предпочитают не обращаться к врачу и справляться самостоятельно со своими проблемами. Например, в США только от 9 до 23% лиц с симптомами СРК ежегодно обращаются к врачу; от 38 до 46% посещали врача хотя бы один раз в жизни. Считается, что функциональное расстройство кишечника характеризуется болью или эквивалентным ей дискомфортом, связанным с дефекацией или изменением стула.
Согласно современным представлениям СРК является биопсихосоциальным заболеванием, в основе развития которого лежит взаимодействие 2-х основных патологических механизмов: повышенного (в некоторых случаях — негативного) психосоциального воздействия и рецепторно-двигательной дисфункции (нарушения висцеральной чувствительности и моторной активности кишечника). Следует отметить, что развитие висцеральной гиперчувствительности нужно рассматривать как основу формирования всей функциональной патологии ЖКТ. Еще недавно СРК относили к функциональным заболеваниям, при которых патогенез развития симптомов не может быть объяснен органическими причинами. В последние годы удалось установить, что в основе висцеральной чувствительности и аллодинии (снижение порога восприятия боли) лежит развитие воспалительной реакции в стенке кишечника больных СРК [3]. В этой связи становится понятно, что наличие только спазмолитического эффекта у препаратов, используемых при лечении больных СРК, способно оказывать необходимое позитивное воздействие на двигательную дисфункцию, но не влияет на восстановление висцеральной чувствительности. Отсюда закономерно следует вывод, что при сохраненной гиперчувствительности моторные нарушения будут существовать длительное время, а следовательно, необходимо и длительное использование спазмолитических препаратов. Таким образом, должны использоваться препараты с доказанной эффективностью и безопасностью.
Национальный институт здравоохранения и клинического мастерства Великобритании (NICE) выпустил новые рекомендации по диагностике и лечению СРК в первичной помощи. На основании тщательного анализа клинических данных были сделаны выводы о том, «… что спазмолитические средства, такие как Бускопан®, содержащий хорошо известную активную субстанцию гиосцина бутилбромида, являются препаратами первой линии в диагностике и управлении общих симптомов у пациентов с СРК. Испытания с использованием Бускопана® продемонстрировали эффективность в уменьшении симптомов боли, связанных с СРК, рекомендуемая продолжительность первичного курса лечения не менее 6-8 нед., базовая терапия — 1-3 мес.» [4].
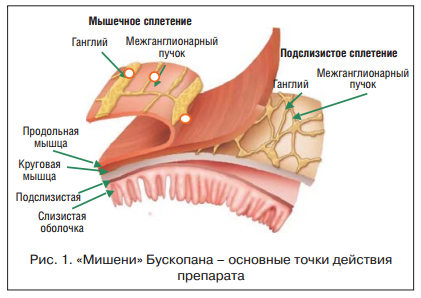
Следует отметить преимущество спазмолитического эффекта Бускопана® по сравнению с другими препаратами данной группы: препарат оказывает местное спазмолитическое действие, реализуя ганглиоблокирующий и антимускариновый эффекты на уровне межмышечного и подслизистого нервных сплетений (рис. 1).
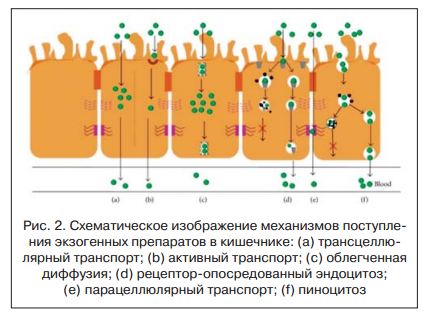
Другими словами, поступая в стенку кишечника путем парацеллюлярного транспорта (путь «е» показан на рисунке 2), Бускопан® сразу реализует свой спазмолитический эффект на уровне ЖКТ. Этот факт объясняет скорость наступления спазмолитического эффекта: при пероральном приеме препарата эффект наступает уже через 15 мин. В условиях спазма и развития местной воспалительной реакции увеличивается проницаемость кишечника. Поэтому будет более правильным говорить о том, что препарат легче проникает в кишечную стенку в зонах спазма, а уже потом о том, что его эффект более выражен в зоне спазма. С другой стороны, низкий уровень всасывания в кровь (!) (около 8%) и биодоступности препарата (вторичное, проникновение из крови в ткани) (менее 1%) определяет высокий уровень безопасность препарата.
Таким образом, после всасывания (8% от принятой дозы) только 1% может распределиться по другим органам и системам. Закономерно, что большая часть препарата элиминируется через кишечник (более 90%), эффективно «отработав» на уровне ЖКТ, и лишь 2-5% — через почки. Парацеллюлярный транспорт Бускопана® обеспечивает, с одной стороны, скорость и эффективность наступления эффекта, а с другой стороны — безопасность при использовании препарата. Так, согласно регулярно подаваемому отчету (Periodic Safety Update Report) с 1992 г. было зафиксировано 194 млн эпизодов приема таблетированного Бускопана, и только в 48 случаях было зафиксированы побочные эффекты антихолинергической природы, т. е. в 0,00000025% случаев [5].
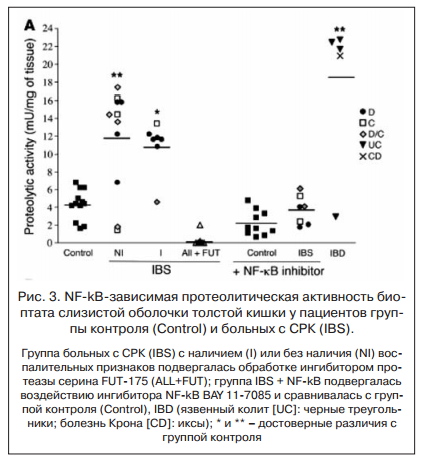
Попытка использовать ненаркотические анальгетики (производные пиразолона, пара-аминофенола, индолуксусной кислоты и др.), которые не влияют на тканевую воспалительную реакцию слизистой оболочки кишечника, а следовательно, и не изменяют висцеральной чувствительности, не имела успеха, поскольку оказывался только временный обезболивающий эффект. У пациентов с СРК было выявлено достоверное увеличение NF-kB-зависимой протеолитической активности биоптата слизистой оболочки толстой кишки по сравнению с пациентами группы контроля. Введение ингибитора NF-kB приводило к нормализации протеолитической активности (рис. 3). Введение супернатантов биопсии кишечника от больных СРК вызвало явления гипералгезии (повышенное болевое реагирование) и аллодинии у мышей, которые купировались применением ингибиторов сериновых протеаз и NF-kB [6]. С этим связана попытка (имевшая определенный положительный результат) использовать в лечении больных СРК кетотифен длительными курсами [7, 8]. Однако логичнее было устранить причину данной воспалительной реакции — дисбиоз кишечника [9] путем применения как комбинации рифаксимина с пребиотиками, так и только пребиотических препаратов [10, 11].
Однако в основу нормализации дисбиотических нарушений кишечника должен быть положен принцип нивелирования моторных и секреторных нарушений ЖКТ. Безусловно, в данном контексте будут представлять интерес препараты, обладающие комплексным воздействием на органы ЖКТ. Таким представителем можно считать гиосцина бутилбромид, обладающий помимо вышеописанного спазмолитического эффекта секретолитической активностью. Наличие MAP-киназной активности у М3-холиновых рецепторов обусловило необходимость изучения воздействия холинолитических препаратов на пролиферативную активность эпителия. Первоначально была выявлена повышенная экспрессия мускариновых М1 и М3 рецепторов на эпителиальных и гладкомышечных клетках дыхательных путей больных ХОБЛ [12, 13]. Активация М3-рецепторов не только приводила к констрикции бронхов, но и оказывала пролиферативное воздействие на эпителий бронхов. Эффект был опосредован Gq-белками М3-мускариновых рецепторов, которые активируют фосфатидилинозитол-3-киназу, и ингибирующим фосфорилированием гликогенсинтазы киназы-3. Холинергическая стимуляция мускариновых рецепторов усиливала экспрессию генов провоспалительных агентов (интерлейкина (ИЛ) -6, -8, циклооксигеназы (ЦОГ) -1, -2 и урокиназы активатора плазминогена) в гладких мышцах и клетках эпителия. В дальнейшем удалось установить протеинкиназа С-зависимое увеличение нуклеарного фактора NF-kB, оказывающего пролиферативный эффект. На фоне провоспалительного эффекта стимуляция мускариновых рецепторов приводила к митогенному эффекту, сопровождающемуся снижением дифференцировки клеток Закономерным следствием длительной блокады М3-рецепторов было не только достижение спазмолитического эффекта, но и предупреждение ремоделирования бронхиальных путей, противовоспалительный эффект [14].
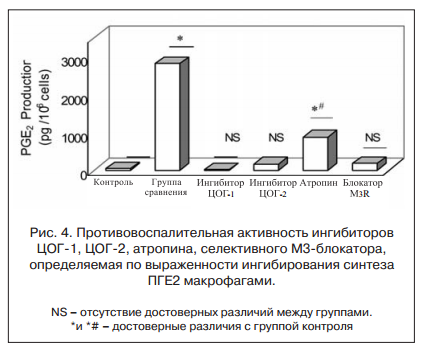
В случае, когда пациенты наблюдались с постинфекционной формой СРК, данные изменения рассматривались как остаточные воспалительные изменения. В то же время у группы пациентов в анамнезе отсутствовала связь с кишечной инфекцией. Для данной категории пациентов были установлены связь психотравмирующих факторов с провоспалительной активностью супернатантов, а также увеличение экспрессии М3-ацетилхолиновых рецепторов [15]. Использование селективных М3-холинолитиков позволяло не только устранять болевой синдром за счет спазмолитического эффекта, но и добиваться снижения провоспалительной активности, а также гиперчувствительности кишечной стенки [16]. При этом в эксперименте была подтверждена противовоспалительная активность селективных М3-блокаторов, сопоставимая для эпителиальных тканей с таковой селективных ингибиторов ЦОГ-2 (рис. 4) [17].
Ниже представлен анализ результатов собственных исследований, в основу которых положено наблюдение за 132 пациентами с СРК, средний возраст которых составил 34,9±4,6 года (32,1±4,1 года — у мужчин, 36,6±3,3 года — у женщин).
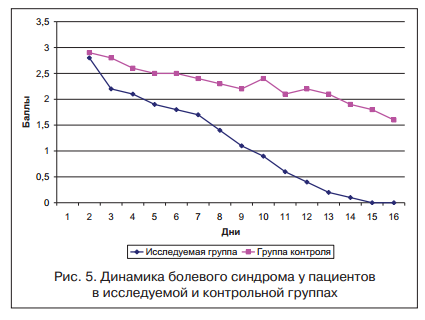
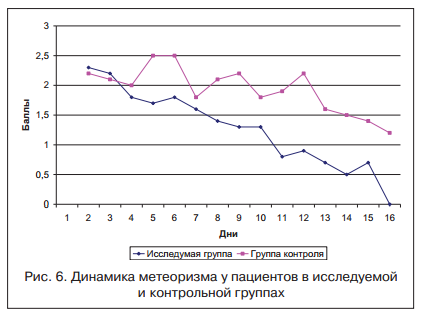
Больные были разделены на 2 группы в зависимости от проводимой терапии. Основная группа представлена 98 пациентами, в комплексной терапии которых использовался гиосцина бутилбромид (Бускопан®) 60 мг/сут, длительность терапии составила 6 нед. 34 пациента в контрольной группе получали дротаверин в дозировке 120 мг/сут. Все больные проходили стационарное обследование и лечение в клинике 2-й кафедры терапии (усовершенствования врачей) Военно-медицинской академии в г. Санкт-Петербурге. Использование гиосцина бутилбромида у пациентов основной группы позволило в течение 2-х нед. достичь купирования болевого абдоминального синдрома и метеоризма (рис. 5, 6).
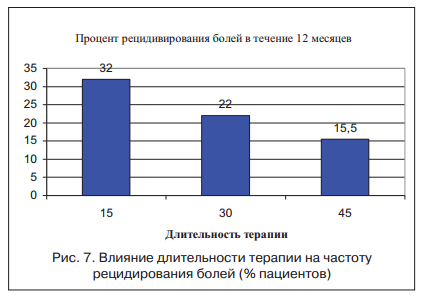
Следует отметить, что состояние гиперсенситивности у пациентов с СРК сохраняется еще в течение 3-4 нед. после купирования клинической симптоматики. Для дальнейшего исследования зависимости висцеральной гиперчувствительности от длительности лечения пациенты основной группы были разделены по срокам лечения на 3 подгруппы: 34 пациента со сроком лечения 2 нед. и по 32 пациента со сроками лечения 4 нед. и 6 нед. По результатам исследования удалось установить, что только к концу 6 нед. у пациентов на фоне использования гиосцина бутилбромида удалось значительно снизить гиперчувствительность. В клиническом эквиваленте это нашло отражение в частоте рецидивирования у пациентов исследуемых групп. Так, у пациентов со сроками лечения 2 нед. частота рецидивирования достигала 32%, со сроками лечения 4 нед. — снижалась до 22%, а при сроках лечения 6 нед. — составляла 15,5% (рис. 7).
Таким образом, использование гиосцина бутилбромида в течение 6 нед. позволило снизить частоту рецидивирования в течение 1 года в 2 раза по сравнению с группой, лечившейся 2 нед.
Вывод. Гиосцина бутилбромид (бускопан) обладает физиологическим воздействием на секреторную и моторную функции ЖКТ и способен эффективно устранять их нарушения. Благодаря обнаруженным ранее противовоспалительным и пролиферативным эффектам селективных М3-холиноблокаторов возможно длительное использование данной группы препаратов с целью восстановления процессов репарации и дифференцировки.
Длительное использование гиосцина бутилбромида в составе комплексной терапии больных СРК не только безопасно, но и прогностически оправданно для данной категории пациентов, поскольку способствует восстановлению висцеральной чувствительности и достоверно снижает частоту рецидивирования заболевания.
Литература
- Johanson J.F. Options for patients with irritable bowel syndrome: contrasting traditional and novel serotonergic therapies// Neurogastroenterol. Motil. 2004. Р. 701-711.
- Camilleri M. Mechanisms in IBS: something old, something new, something borrowed // Neurogastroenterol. Motil. 2005. Р. 311-316.
- Шептулин АА. Особенности диагностики и дифференциальной диагностики при синдроме раздраженного кишечника // Клиницисты о лабораторной диагностике. 2003. № 6. С. 3-7.
- Leslie A. Samuels Pharmacotherapy Update: Hyoscine Butylbromide in the Treatment of Abdominal Spasms Clinical Medicine: Therapeutics. 2009. Р. 647-655.
- Tytgat G.N. Hyoscine Butylbromide A Review of its Use in the Treatment of Abdominal Cramping and Pain // Drugs. 2007. Vol. 67 (9). Р. 1343-1357.
- Cenac N., Andrews C.N., Holzhausen M. et al. Role for protease activity in viscera pan in irritable bowel syndrome // J Clin Invest. 2007. № 117(3). Р. 636-647.
- Ford A.C., Talley N.J. Advances in pathophysiology, diagnosis and treatment Nat. Rev// Gastroenterol. Hepatol. 2010. № 10. Р. 216-234.
- DuPontA.W, DuPont H.L. The intestina microbiota and chronic disorders of the gut Nat. Rev// Gastroenterol. Hepatol. 2011. № 10. Р. 214-226.
- Natalie J. Wood Human gut microbiota can be readily cultured, manipulated and archived// Nature Reviews Gastroenterology & Hepatology. 2011. № 8. Р. 241- 260.
- Pimentel M. et al. Rifaximin therapy for patients with irritable bowel syndrome without constipation // N. Engl. J. Med. 2011. Vol. 364. Р. 22-32.
- Whelan K. Probiotics and prebiotics in the management of irritable bowel syndrome: a review of recent clinical trials and systematic reviews // Current Opinion in Clinical Nutrition & Metabolic Care. 2011. Vol. 14. Iss. 6. P. 581-587.
- Kummer W., Lips K. S., Pfeil U. The epithelial cholinergic system of the airways // Histochem Cell Biol. 2008. № 130 (2). Р. 219-234.
- Wessler I., Krkpatrick C.J. Acetylcholine beyond neurons: the non-neurona cholinergic system in humans // British Journal of Pharmacology. 2008. Vol. 154. №. 8. Р. 1558-1571.
- Saeed Kolahian, Reinoud Gosens. Cholinergic Regulation of Airway Inflammation and Remodeling // Journal of Allergy. 2012. Vol. 1. Р. 69-78.
- Lee K.J., Km Y.B., Kim J.H., Kwon H.C. The alteration of enterochromaffin cell, mast cell, and lamina propria T lymphocyte numbers in irritable bowel syndrome and its relationship with psychological factors // J Gastroenterol Hepatol. 2008. № 11. Р. 1689-1694.
- Wotta D.R., Wattenberg E.V., Langason R.B., el-Fakahany E.E. M1, M3 and M5 muscarinic receptors stimulate mitogen-activated protein kinase // Pharmacology. 2008. № 4. Р. 175-186.
- De la Torre E., Davel L. et al. Muscarinic receptors participation in angiogenic response induced by macrophages from mammary adenocarcinoma-bearing mice // Breast Cancer Research.













Комментировать