Больные артериальной гипертензией, страдающие сахарным диабетом, относятся к группе высокого риска развития сердечно-сосудистых осложнений. Рассматриваются современные возможности фармакотерапии больных АГ, страдающих сахарным диабетом. Приводятся данные доказательной базы по применению различных классов антигипертензивных лекарственных средств у больных данной группы для профилактики сердечно-сосудистых осложнений.
Морозова Т.Е.*, Андрущишина Т.Б.
Первый Московский государственный медицинский университет имени И.М. Сеченова
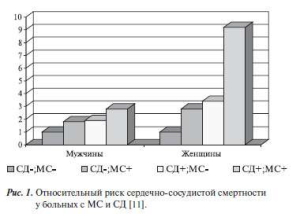
Распространенность сахарного диабета (СД) неуклонно растет как в развитых, так и в развивающихся странах, причем в первую очередь за счет диабета 2 типа, на долю которого приходится до 90% всех случаев болезни. По оценкам Всемирной организации здравоохранения, более 180 миллионов человек во всем мире страдает сахарным диабетом, а к 2025 году существует вероятность увеличения этих цифр вдвое. Большинство больных СД умирают или становятся инвалидами вследствие сердечно-сосудистых осложнений (ССО). Наличие различных вариантов нарушений углеводного обмена, таких как метаболический синдром (МС) и СД, увеличивает относительный риск сердечно-сосудистой смертности, которая существенно возрастает при сочетании МС и СД (рис.1) [9,11,20].
Ведущей причиной смерти больных СД 2 типа являются макрососудистые осложнения, в основе развития которых лежит атеросклеротическое поражение основных артериальных бассейнов, приводящее к развитию ишемической болезни сердца (ИБС) и её осложнений, цереброваскулярной болезни и поражению артерий нижних конечностей. Характерными для больных СД являются также микрососудистые осложнения (ретинопатия, нефропатия) вследствие специфического для СД поражения сосудов микроциркуляторного русла, связанного с утолщением базальных мембран капилляров. Важнейшими факторами, оказывающими влияние на риск сердечно-сосудистых осложнений у больных СД 2 типа являются уровень АД, состояние углеводного и липидного обмена [7,14,19,20]. Результаты крупного клинического исследования UKPDS (U.K. Prospective Diabetes Study) позволили выделить наиболее значимые факторы риска и расположить их в порядке убывания значимости – это повышение уровня холестерина липопротеинов низкой плотности (ХЛНП); повышение артериального давления (АД); курение; низкий уровень холестерина липопротеинов высокой плотности (ХЛВП); повышение уровня гликозилированного гемоглобина (HbA1c) [24].
Основные цели лечения больных СД заключаются в снижении сердечно-сосудистой смертности и риска развития макрои микрососудистых осложнений. Профилактика сердечно-сосудистых осложнений у больных СД должна быть направлена на весь комплекс факторов риска сердечнососудистых осложнений, включая изменение образа жизни (отказ от курения, регулярные физические упражнения, контроль веса, соблюдение рекомендаций по диете), контроль гликемии с минимальным риском гипогликемии (уровень гликозилированного гемоглобина < 6,5%, уровень глюкозы плазмы натощак менее 6,0 ммоль/л (108 мг/дл), постпрандиальный уровень глюкозы плазмы менее 7,5 ммоль/л (135 мг/дл)), контроль артериального давления и уровня липидов крови [1,16,21].
В связи с этим особую актуальность приобретают вопросы рационального выбора лекарственных средств, позволяющих не только улучшить клиническое состояние пациентов, но и снизить сердечно-сосудистый риск. Особенности АГ у больных СД. Риск развития сердечно-сосудистых осложнений увеличивается в 2 раза у больных СД, имеющих АГ, по сравнению с больными СД, имеющими нормальный уровень АД. У больных СД 1 типа развитие АГ непосредственно связано с прогрессированием нефропатии. При СД 2 типа развитие АГ в 80% случаев предшествует развитию заболевания. Наиболее часто у этих больных выявляется «эссенциальная» гипертония, которая является проявлением синдрома периферической инсулинорезистентности.
Повышенное АД ассоциируется с 2–3–кратным увеличением абсолютного риска сердечнососудистой смертности у больных с СД 2 типа по сравнению с лицами без диабета [7,14,19]. Об этом свидетельствуют результаты исследования MRFIT (Multiple Risk Factor Intervention Trial) [20]. По данным другого исследования сообщается, что от 35 до 75% сердечнососудистых и почечных осложнений у больных СД могут быть связаны с АГ [9]. Все это привело к тому, что больные СД, даже без клинических проявлений атеросклероза, по риску развития сердечно-сосудистых осложнений приравниваются к больным с установленным диагнозом ИБС [19].
Течение АГ у больных СД 2 типа имеет ряд отличительных признаков. У этих больных чаще выявляется увеличение пульсового давления, что ассоциируется с более высоким риском развития сердечно-сосудистых осложнений. Для них более характерна гипертония в ночное время. Отсутствие снижения АД ночью является феноменом, ассоциирующимся с более частым поражением органов– мишеней, в частности сердца и почек. Больные СД более склонны к ортостатической гипотонии, что осложняет проведение адекватного контроля уровня АД. У них чаще регистрируется неадекватный прирост АД во время физической нагрузки, нарушения ауторегуляции кровяного давления. Указанные отличия, в частности, во многом определяют более высокий риск развития сердечно– сосудистых осложнений у больных СД с АГ [7,14].
Поскольку наличие АГ увеличивает уже исходно повышенный риск развития сердечно–сосудистых осложнений при СД, то у этой категории больных требуется жесткий контроль уровня АД и достижение его целевых значений. В соответствии с рекомендациями Российского медицинского общества артериальной гипертонии и Всероссийского научного общества кардиологов (РМОАГ/ВНОК) для больных СД целевой уровень АД составляет < 130/80 мм рт.ст. [3].
Европейские рекомендации устанавливают более низкие значения АД – менее 125/75 мм рт.ст. для больных с признаками почечной недостаточности или с протеинурией более 1 г/сут [16]. Предполагаемая польза от снижения САД ниже 120 мм рт. ст. у больных СД не подтвердилась. По результатам клинического исследования ACCORD Blood Pressure Clinical Trial (Action to Control Cardiovascular Risk in Diabetes – 4733 больных, длительность наблюдения – 4,7 лет) интенсивный конт роль АД (целевое САД менее 120 мм рт.ст.) у больных СД 2 типа не имеет прогностического преимущества по сравнению с уровнем САД менее 140 мм рт.ст. [22].
Выбор антигипертензивных препаратов имеет особое значение, поскольку наличие у больного СД накладывает целый ряд ограничений к применению того или иного лекарственного средства. Необходимо учитывать спектр его побочных действий, возможные воздействия на углеводный и липидный обмен, а также наличие сопутствующих сосудистых осложнений у больного.
Поэтому антигипертензивные препараты при лечении больных СД должны отвечать повышенным требованиям, а именно:
обладать высокой антигипертензивной активностью при минимуме побочных эффектов;
не нарушать углеводный и липидный обмены;
обладать кардиопротективным и нефропротективным действием;
не ухудшать течение других (не сосудистых) осложнений СД.
В соответствии с рекомендациями РМОАГ/ВНОК в настоящее время для лечения больных АГ рекомендуются пять классов антигипетензивных ЛС с доказанным влиянием на степень сердечнососудистого риска и не имеющих существенных различий по выраженности антигипертензивного эффекта – это ингибиторы АПФ, антагонисты рецепторов ангиотензина ΙΙ (АРА), бетаадреноблокаторы (БАБ), антагонисты кальция (АК) и тиазидные диуретики (табл.1).
Каждый класс имеет свои особенности применения, преимущества и ограничения, связанные с возможностью развития нежелательных реакций [3].
Согласно современным международным рекомендациям, медикаментозная терапия больных СД и АГ должна включать ингибиторы ангиотензинпревращающего фермента (ИАПФ) или антагонисты рецепторов ангиотензина II (БРА) [6,9,13,16,21].
Ингибиторы ангиотензинпревращающего фермента и блокаторы рецепторов ангиотензина II.
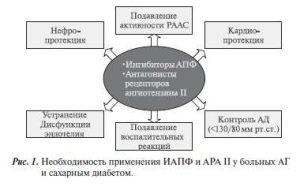
Целесообразность применения ИАПФ (каптоприл, эналаприл, лизиноприл, периндоприл, рамиприл и др.) или АРА (лосартан, валсартан, телмисартан и др.) при у больных СД с АГ не вызывает сомнений. Этому есть как теоретическое, так и практическое обоснование, так как блокада ренинангиотензин-альдостероновой системы (РААС) не только обеспечивает контроль уровня АД, но и объясняет целый спектр негемодинамических эффектов, присущих ИАПФ и АРА, в частности, их органопротективные свойства (рис.2) [20].
Доказательства органопротективных свойств и снижения смертности в результате лечения различными ИАПФ и АРА получены в целом ряде международных многоцентровых рандомизированных клинических исследований, таких как ALLHAT, ANBP2, CAPPP, EWPHE, HOPE, SCAT, STOP-2, UKPDS и многие другие (рис. 2) [20].
Противопоказанием для применения ИАПФ у больных СД является двусторонний стеноз почечных артерий. Это осложнение нужно иметь в виду у больных СД 2 типа с генерализованным атеросклерозом.
Антагонисты кальция не оказывают неблагоприятного воздействия на углеводный и липидный обмены и широко применяются у больных СД и АГ. Предпочтение следует отдавать АК группы верапамила и дилтиазема, которые обладают способностью уменьшать протеинурию. Можно назначать также дигидропиридиновые АГ пролонгированного действия (амлодипин, фелодипин, исрадипин и др.). Нифедипин короткого действия может оказывать неблагоприятное воздействие не сердце (синдром обкрадывания и аритмогенный эффект) и почки, усиливая протеинурию.
Препараты центрального действия. Центральные симпатолитики, вызывают гипотензивный эффект, главным образом, за счет снижения активности симпатической нервной системы. В настоящее время препараты первого (резерпин, метилдопа) и второго (клонидин, гуанфацин) поколений имеют ограниченное применение, что обусловлено развитием побочных реакций, таких как головокружение, сонливость, сухость во рту.
Необходимо обратить внимание, что метилдопа остается препаратом первого ряда для ле чения АГ у беременных женщин, поскольку его безопасность для эмбриона и плода доказана многолетними наблюдениями за детьми, матери которых получали препарат во время беременности [3,21].
Третье поколение препаратов центрального действия – селек тивные агонисты имидазолиновых рецепторов моксонидин (Моксогамма®) в таблетках по 0,2 мг; 0,3 мг; 0,4 мг и рилменидин в таблетках по 1 мг. В основе антигипертензивного действия моксонидина и рилменидина лежит специфичность в отношении имидазолиновых рецепторов нейронов, расположенных в вентролатеральных ядрах продолговатого мозга. Снижая активность симпатической нервной системы, агонисты имидазолиновых рецепторов снижают АД и уменьшают ЧСС. Антигипертензивное действие этих препаратов сопровождается также дополнительными эффектами, связанными со стимуляцией имидазолиновых рецепторов в тканях почек, надпочечников, поджелудоч ной железы, жировой ткани и каротидных клубочков.
Благоприятные фармакологические эффекты моксонидина и рилменидина делают их полезными как при монотерапии, так и в составе комбинированной терапии АГ у больных с метаболическим синдромом и са харным диабетом. Это обусловлено тем, что в основе действия этих препаратов лежит снижение активности симпатической нервной системы, играющей немаловажную роль в патогенезе АГ, особенно у больных СД 2 типа с выраженной инсулинрезистентностью, поскольку гиперинсулинемия сама по себе сопровождается симпатической активацией. С другой стороны, имеет значение благоприятный метаболический профиль агонистов имидазолиновых рецепторов, их способность положительно влиять на обмен глюкозы и липидов.
Важное клиническое значение имеет тот факт, что агонисты имидазолиновых рецепторов оказывают благоприятное влияние на метаболизм углеводов и липидов, ослабляют инсулинорезистентностъ и улучшают толерантность к глюкозе, а также снижают плазменные уровни триглицеридов и холестерина [4,15,18].
Моксонидин в суточной дозе от 0,2 до 0,6 мг и рилменидин в суточной дозе 1 мг обладают высокой антигипертензивной эффективностью и хорошей переносимостью. Антигипертензивное действие продолжается до 24 час., что позволяет назначать их 1 раз в день. Антигипертензивный эффект усиливается при сочетании с малыми дозами тиазидных диуретиков и блокаторами РААС [15].
Моксонидин и рилменидин в отличие от клонидина и других агонистов α2-адренергических рецепторов обладают хорошим спектром переносимости. Они обладают слабым сродством к α2 – адренорецепторам, стимуляция которых обусловливает такие побочные реакции, как седативный эффект и появление сухости в рту. В соответствии с рекомендациями РМОАГ/ВНОК агонисты имидазолиновых рецепторов рекомендуются как один из компонентов комбинированной терапии для длительного лечения АГ у больных ожирением, сахарным диабетом и метаболическим синдромом [3].
Тиазидные диуретики (гидрохлортиазид) обладают спектром нежелательных метаболических эффектов: нарушают толерантность к углеводам, повышают инсулинрезистентность, обладают гиперлипидемическим эффектом. Нарушение толерантности к углеводам появляется через 2-3 года от начала постоянного лечения этими препаратами. При назначении этих препаратов больным СД возможно потребуется коррекция дозы сахароснижающих средств. Кроме того, тиазидные диуретики ухудшают фильтрационную функцию почек, снижая скорость клубочковой фильтрации. Малые дозы гидрохлортиазида (6,25-25 мг) не влияют на углеводный, липидный и пуриновый обмен, что позволяет их безопасно комбинировать с другими антигипертензивными лекарственными средствами у больных СД, в том числе и в составе фиксированных комбинаций [15,21].
Тиазидоподобные диуретики (индапамид, индапамид ретард) не влияют на углеводный и липидный обмен, что делает безопасным их прием у больных СД. Индапамид в средней терапевтической дозе действует как гипотензивный препарат за счет сосудорасширяющего эффекта и не оказывает диуретического действия. Он при длительной терапии не влияет на углеводный и липидный обмен, не ухудшает функцию почек и даже способен снижать микроальбуминурию, что делает его безопасным для лечения АГ у больных СД.
Бета-адреноблокаторы (БАБ). Высокая эффективность применения данной группы у больных АГ для снижения риска сердечно-сосудистых заболеваний ограничена их неблагоприятным метаболическим действием на углеводный и липидный обмен.
Современные рекомендации по ведению больных АГ ограничивают использование БАБ в качестве препаратов 1-й линии у больных АГ с множественными метаболическими факторами риска, включая абдоминальное ожирение, нарушенную толерантность к глюкозе. Неблагоприятные метаболические эффекты связаны с блокадой β2-адренорецепторов. В связи с этим больным с СД могут назначаться только БАБ, обладающие высокой кардиоселективностью.
Теоретические предпосылки о потенциальных преимуществом кардиоселективных БАБ у больных с метаболическим синдромом, сделанные на основании экспериментальных данных, были подтверждены клиническими исследованиями [10,12]. В частности в крупнейшем исследовании UKPDS (U.K. Prospective Diabetes Study Group), включавшем 1148 больных сахарным диабетом, было показано, что у больных СД 2-го типа, страдающих АГ, кардиоселективный БАБ атенолол существенно улучшает прогноз жизни, не уступая в этом отношении ингибитору АПФ – каптоприлу [24].
БАБ представляют собой весьма неоднородную по своим фармакологическим эффектам группу лекарственных препаратов, внутри которой имеются значимые различия в фармакокинетике и фармакодинамике, касающиеся двух основных показателей – кардиоселективности и липофильности.
Общим свойством всех БАБ является конкурентный антагонизм в отношении β1-адренергических рецепторов. Наряду с блокадой β1-адренергических рецепторов БАБ мо гут блокировать и β2адренорецепторы.
Препараты, применяемые для длительной терапии АГ, удобно разделить на следующие группы в зависимости от β1-адреноселективности, а также наличия или отсутствия дополнительных вазодилатирующих свойств:
1. БАБ без вазодилатирующих свойств:
а) неселективные (пропранолол, надолол, окспренолол, соталол, тимолол и др.);
б) β1-селективные (атенолол, бетаксолол, бисопролол, метопролол и др.).
2. БАБ с вазодилатирующими свойствами:
а) неселективные (карведилол, буциндолол, пиндолол, лабетолол и др.);
б) β1-селективные (небиволол, целипролол и др.).
Особое место среди БАБ занимает бисопролол (Бисогамма®), который обладает высокой кардиоселективностью, превосходящей метопролол, что было показано в работе K. Brixius с соавторами. Если принять способность блокировать β1-рецепторы у карведилола за 1, то для метопролола этот показатель составит 6, для бисопролола – 21 [5]. Также, будучи амфофильным, то есть растворяющимся как в жирах, так и в воде, бисопролол имеет два пути элиминации – почечную экскрецию и печеночный метаболизм. Это обеспечивает большую безопасность применения у больных с сопутствующими поражениями печени и почек, пожилых больных, а также низкую вероятность лекарственного взаимодействия.
По антигипертензивному эффекту бисопролол не только не уступает другим БАБ, но по ряду показателей превосходит их. Так, в исследовании BISOMET было показано, что бисопролол сопоставим с метопрололом по степени снижения АД в покое, но значительно превосходит его по влиянию на уровень систолического АД и частоту сердечных сокращений при физической нагрузке [8]. Эффективность бисопролола по снижению сердечно-сосудистого риска в сочетании с отсутствием негативного воздействия на показатели углеводного обмена доказаны в крупных рандомизированных клинических исследованиях, в числе которых и такие известные как CIBIS-II (Cardiac Insufficiency Bisoprolol Study II), TIBBS (Total Ischemic Burden Bisoprolol Study), DECREASE-IV и др. [2,6,17,25].
Важно отметить, что бисопролол обладает хорошим профилем безопасности. Практически все исследователи отмечают хорошую переносимость бисопролола, в т.ч. при сочетании артериальной гипертензии с сахарным диабетом. Он практически не влияет на такие показатели, как уровень гликозилированного гемоглобина, уровень глюкозы натощак, не вызывает изменений липидного спектра крови у больных СД и при этом не требуется коррекции доз сахароснижающих средств [6].
Возможность принимать препарат один раз в сутки способствует более высокой приверженности пациентов к лечению. При АГ бисопролол может применяться не только в виде монотерапии, но и в сочетании с другими антигипертензивными препаратами.
В связи с важностью достижения быстрого и стойкого контроля АД большинству больных АГ в сочетании с СД для достижения целевого АД требуется комбинированная терапия и руководства, основывающиеся на подходах стратификации риска, рассматривают именно комбинированную терапию как вариант фармакологического лечения первой линии. У многих пациентов монотерапия показала свою неэффективность или более позднее достижение контроля АД, что значительно повышает частоту возникновения инфарктов, инсультов и смертельных исходов.
Учитывая два обстоятельства – высокую тканевую активность ренин-ангиотензиновой системы и высокую солечувствительность больных СД, наиболее эффективной антигипертензивной терапией является комбинация ИАПФ и тиазидоподобного диуретика. Результаты исследования ADVANCE показали, что дополнительное назначение комбинации периндоприла и индапамида больным СД 2 типа приводят к снижению общей смертности на 14%, сердечно-сосудистой смертности – на 18%, сердечно-сосудистых осложнений – на 14%, почечных осложнений – на 21% [23].
Наличие микроальбуминурии у больных СД 1 и 2 типов является показанием для антигипертензивной терапии, вызывающей блокаду РААС независимо от уровня АД, т. е. назначения АРА II или ИАПФ, в том числе в сочетании с тиазидоподобными диуретиками в малых дозах [21].
При недостаточной эффективности монотерапии ИАПФ (или АРА) к терапии следует добавить диуретик с учетом скорости клубочковой фильтрации (КФ):
при КФ более 30 мл/мин на 1,73 м2 – тиазидный, при КФ менее 30 мл/мин – петлевой.
Комбинированная антигипертензивная терапия больных СД, включающая ИАПФ или АРА и тиазидный/тиазидподобный диуретик, требует регулярного контроля КФ и уровня калия в сыворотке.
Заключение.
Таким образом, больные АГ, страдающие СД, относятся к группе высокого риска развития сердечно-сосудистых осложнений. Профилактика развития ССО у этой группы больных требует комплексной фармакотерапии, включающей лекарственные средства, доказавшие свою эффективность в отношении сердечно-сосудистого риска и не ухудшающие течение сахарного диабета. Важное место среди них занимают БАБ, одним из которых является бисопролол.
(Бисогамма®) – высокоселективный препарат, имеющий уникальные гидро–липофильные свойства, длительный период полувыведения и связанный с этим удобный однократный режим дозирования. Благоприятный профиль безопасности и отсутствие негативных метаболических воздействий позволяют использовать его в лечении больных АГ в сочетании с сахарным диабетом для снижения риска сердечно-сосудистых осложнений.
Литература
1. Алгоритмы специализированной медицинской помощи больным сахарным диабетом Под редакцией И.И. Дедова, М.В. Шестаковой (2-е издание) Москва 2006 г.
2. Мычка В.Б., Сергиенко В.Б., Горностаев В.В и др. Влияние терапии бисопрололом на перфузию головного мозга у больных с метаболическим синдромом // Артериальная гипертензия. Прил. к Consilium Medicum 2003 т. 09; №5.
3. Российское медицинское общество по артериальной гипертонии (РМОАГ), Всероссийское научное общество кардиологов (ВНОК). Диагностика и лечение артериальной гипертензии. Российские рекомендации (четвертый пересмотр), 2010.
4. Чазова И.Е., Мычка В.Б. Новые возможности в лечении больных с метаболическим синдромом (результаты исследования ALMAZ). Системные гипертензии 2006(8); 2.
5. Brixius K. et al. Nebivolol, bucindolol, metoprolol and carvedilol are devoid of intrinsic sympathomimetic activity in human myocardium // British Journal of Pharmacology 2001;133: 1330–1338
6. CIBIS-II Investigators and Committees. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomized trial // Lancet 1999; 353: 9-13.
7. Cooper M. The prevalence of hypertension in patients with diabetes. In: Hypertension and diabetes (Ed. Mogensen CE). Lippincott Williams & Wilkins, London, 2003, 3–9.
8. Haasis R, Bethge H Exercise blood pressure and heart rate reduction 24 and 3 hours after drug intake in hypertensive patients following 4 weeks of trearment with bisoprolol and metoprolol: a randomized multicentre double–blind study (BISOMET) // Eur Heart J 1987; 8: 103–113.
9. Haffner M., Lehto S., Ronnemaa T. et al. Mortality from coronary heart disease in subjects with 2 diabetes and in nondiabetic subjects with and without prior myocardial infaction // N. Engl. J. Med., 1999, 339, 229–234.
10. Heinemann I., Heise T., Ampudia J. et al. Four week administration of an ACE inhibitor and a cardioselective beta-blocker in healthy volunteers: no influence on insulin sensitivity // Europ. Heart J. 1995; 25: 595–600.
11. Hunt KJ, Resendez RG, Williams K et al. San Antonio Heart StudyNational Cholesterol Education Program versus World Health Organization metabolic syndrome in relation to all-cause and cardiovascular mortality in the San Antonio Heart Study // Circulation. 2004 Sep 7;110(10):1251-7.
12. Janka H.U., Ziegler A.G., Disselhoff G. et al. Influence of bisoprolol on blood glucose, glucosuria, and haemoglobin A1 in noninsulin-dependent diabetics // J Cardiovasc Pharmacol. 1986; 8: Suppl 11: S96–9.
13. Law MR, Morris JK, Wald NJ. Use of blood pressure lowering drugs in the prevention of cardiovascular disease: meta-analysis of 147 randomised trials in the context of expectations from prospective epidemiological studies // BMJ. May 23, 2009;338: b1665.
14. Parving H–H. Hypertension and diabetes: the scope of the problem// Blood pressure 2001; 10 (Suppl 2): 25–31.
15. Pater C, Bhatnagar D, Berrou J. P. et al. A novel approach to treatment of hypertension in diabetic patients – a multicenter, double-blind, randomized study comparing the efficacy of combination therapy of Eprosartan versus Ramipril with lowdose Hydrochlorothiazide and Moxonidine on blood pressure levels in patients with hypertension and associated diabetes mellitus type 2 – rationale and design [ISRCTN55725285] // Curr Control Trials Cardiovasc Med. 2004; 5(1): 9.
16. Rydén Lars, Standl Е. Guidelines on diabetes, pre-diabetes, and cardiovascular diseases. Eur Heart J 2007 Suppl 9 (suppl C): 30-74
17. Schouten O., Poldermans D., Visser L. et al. Fluvastatin and bisoprolol for the reduction of perioperative cardiac mortality and morbidity in high-risk patients undergoing non-cardiac surgery: rationale and design of the DECREASE-IV study // Am Heart J. 2004; Dec; 148: 6: 1047–52.
18. Sharma A M, Wagner T and Marsalek P. Moxonidine in the treatment of overweight and obese patients with the metabolic syndrome: a postmarketing surveillance study // J Human Hypertension 2004; 18: 669–675.
19. Sowers JR, Epstein M, Frohlich ED. Diabetes, hypertension, and cardiovascular disease // An Update Hypertension 2001; 37: 1053–1059.
20. Stamler J., Vaccaro O., Neaton JD, et al. for the Multiple Risk Factor Intervention Trial Research Group. Diabetes, other risk factors, and 12–year cardiovascular mortality for men screened in the Multiple Risk Factor Intervention Trial // Diabetes Care 1993; 16: 434–444.
21. Standards of Medical Care in Diabetes-2009. American Diabetes Association// Diabetes Care 2009: Vol.32, Suppl1, S13-60.
22. The ACCORD Study Group. Effects of intensive blood-pressure control in type 2 diabetes mellitus. N Engl J Med 2010; 362:1575-85
23. The ADVANCE Collaborative Group. Intensive Blood Glucose Control and Vascular Outcomes in Patients with Type 2 Diabetes // N Engl J Med. June 12, 2008;358:2560-72.
24. U.K. Prospective Diabetes Study Group. Efficacy of atenolol and captopril in reducing risk of macrovascular and microvascular complications in type II diabetes: UKPDS 39 // Br Med J 1998; 317: 713-720.
25. Von Arnim T Medical treatment to reduce total ischemic burden: Total Ischemic Burden Bisoprolol Study (TIBBS), a multicenter trial comparing bisoprolol and nifedipine// J Am Coll Cardiol 1995;25:231-8











Комментировать