Важное значение артериальной гипертензии как фактора риска сердечнососудистых осложнений, в том числе инсультов. Роль вариабельности артериального давления как независимого предиктора инсульта и коронарных событий. Способность антагонистов кальция, в частности амлодипина, снижать вариабельность артериального давления и частоту инсультов, а также других сердечно-сосудистых осложнений.
Коробко И.Ю.
РНПЦ «Кардиология», Минск
Резюме. Рассматривается важное значение артериальной гипертензии как фактора риска сердечнососудистых осложнений, в том числе инсультов. Обсуждается роль вариабельности артериального давления как независимого предиктора инсульта и коронарных событий. Подчеркивается способность антагонистов кальция, в частности амлодипина, снижать вариабельность артериального давления и частоту инсультов, а также других сердечно-сосудистых осложнений.
Ключевые слова: артериальная гипертензия, сердечно-сосудистые осложнения, инсульты, антагонисты кальция, амлодипин.
Артериальная гипертензия (АГ) – одно из самых распространенных заболеваний сердечно-сосудистой системы. Согласно проведенным исследованиям, распространенность АГ по всему миру в 2000 г. составляла около 26%, а по прогнозам к 2025 г. ожидается увеличение распространенности АГ до 29% (рис. 1). Причем наибольший прирост АГ ожидается за счет экономически развивающихся стран, так как почти 75% лиц с АГ к 2025 г. будут проживать в экономически развивающихся странах [6].
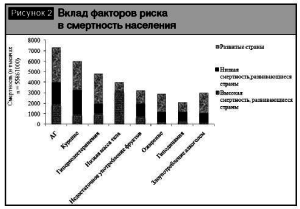
Значимость АГ обусловлена не только в ее высокой распространенностью, но и тем, что АГ является одним из самых главных факторов риска (ФР) сердечно-сосудистой заболеваемости и смертности (рис. 2 ). Например, в России среди семи ведущих ФР, вносящих значительный вклад в преждевременную смертность населения, первые три места занимают ФР развития сердечно-сосудистых заболеваний (ССЗ): АГ (35,5%), гиперхолестеринемия (23%) и курение (17,1%) [1].
Взаимосвязь между уровнем артериального давления (АД) и риском ССЗ непрерывна, постоянна и не зависит от других ФР, т.е. чем выше АД, тем выше риск сердечно-сосудистых осложнений (ССО) [2].
Доказана прямая взаимосвязь между АГ и ростом заболеваемости инсультами, ишемической болезнью сердца (ИБС) и смертностью от этих заболеваний. Показано, что примерно две трети всех инсультов и половина всех случаев ИБС обусловлены АГ, и это становится причиной 7 млн смертей и 64 млн случаев инвалидности ежегодно. Особенно сильная корреляция наблюдается между АГ и риском инсульта (как фатального, так и нефатального) [19].
В исследовании INTERSTROKE, которое было выполнено в 22 странах мира, было показано, что АГ – наиболее значимый ФР развития как ишемического, так и геморрагического инсульта (суммарный популяционный риск составил 90,3%) [17].
Инсульт является второй ведущей причиной смерти и первой причиной инвалидности в мире. Наряду с возрастом высокое АД является главным фактором риска инсульта. Кроме того, высокое АД после инсульта повышает риск повторного нарушения мозгового кровообращения [7].
Предполагается, что АГ способствует развитию инсульта путем вовлечения различных патофизиологических механизмов, таких как оксидативный стресс, эндотелиальная дисфункция, повышение жесткости артерий, болезнь малых сосудов и т.д. [7].
Механизмы, повышающие риск цереброваскулярных заболеваний:
- оксидативный стресс;
- субклиническое воспаление;
- повышение активности ренин-ангио-тензиновой системы;
- эндотелиальная дисфункция;
- ремоделирование резистивных артерий;
- повышение сосудистой проницаемости;
- спазм гладких мышц сосудистой стенки (снижение церебрального кровотока, повышение сосудистого сопротивления);
- болезнь малых сосудов;
- церебральная амилоидная ангиопатия;
- повышение жесткости артерий (синтез коллагена и фибронектина).
Результаты исследований показали, что относительно небольшое снижение АД (5–6 мм рт. ст. для диастолического АД и 10–12 мм рт. ст. для систолического АД в течение 3–5 лет) уменьшало риск инсульта более чем на одну треть. Снижение АД с использованием гипотензивной терапии способствует также снижению повторного инсульта и других сосудистых катастроф. Несмотря на то что связь между АД и риском инсульта установлена как для систолического, так и для диастолического АД, данные исследования MRFIT (Multiple Risk Factor Intervention Trial) свидетельствуют, что систолическое АД может оказывать более сильное негативное влияние на цереброваскулярные заболевания [7]. Кроме того, последние исследования показали, что наряду с уровнем АД еще одним сердечно-сосудистым ФР, который следует учитывать при лечении АГ, является вариабельность АД [21, 25].
Вариабельность как систолического, так и диастолического АД определятся по стандартному отклонению от среднего значения АД. Результаты исследований показали, что вариабельность АД – независимый ФР поражения органов-мишеней и сердечно-сосудистых осложнений, даже у лиц без АГ. Так, в исследовании PAMELA (Pressioni Arteriose Monitorate E Loro Associazioni), было проведено суточное мониторирование АД (СМАД) и эхокардиография у 1648 лиц, случайно выбранных из населения г. Монца (Италия). Лица, получавшие антигипертензивную терапию, из исследования исключались. Результаты исследования PAMELA показали, что существует тесная связь между индексом массы миокарда левого желудочка (ИММЛЖ ) и средним систолическим и диастолическим АД при СМАД (р < 0,001). Кроме того, впервые было показано, что существует положительная независимая связь между ИММЛЖ и вариабельностью систолического и диастолического АД (р < 0,05, р < 0,01 соответственно) [20].
Интересны данные по изучению вариабельности АД в детстве и связи ее с формированием АГ во взрослом возрасте. В исследовании [24] было показано, что уровни систолического и диастолического АД во взрослом возрасте были достоверно (р < 0,001) связаны с уровнем АД и вариабельностью систолического АД в детстве. Авторы пришли к выводу, что повышение вариабельности и уровня АД в детстве является предик-тором развития гипертензии во взрослом возрасте.
Кроме того, в недавних исследованиях было показано, что наряду с вариабельностью АД, определяемой при СМАД, еще большее значение в плане риска ССО имеют показатели вариабельности АД на визитах к врачам, так называемая вариабельность от визита к визиту. Установлено, что вариабельность АД от визита к визиту является сильным предиктором сердечно-сосудистых событий (ССС). Так, в исследовании [14] вариабельность систолического АД от визита к визиту была связана с субклиническим атеросклерозом сонных артерий. В исследовании [15] вариабельность систолического АД от визита к визиту была ассоциирована с повышением общей смертности. Еще в одном исследовании [23] вариабельность АД от визита к визиту значительно коррелировала с функцией почек и почечных артериосклеротических изменений. Более того, вариабельность систолического АД от визита к визиту является сильным предиктором инсульта, независимо от среднего АД [21]. Следовательно, влияние на вариабельность АД разных групп антигипертензивных препаратов, возможно, может объяснить различия между ними в эффективности предотвращения инсульта. С другой стороны, влияние на вариабельность АД, может способствовать оптимизации антигипертензивной терапии.
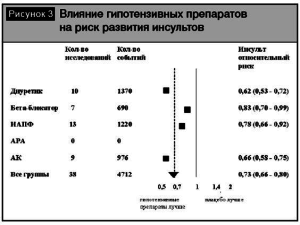
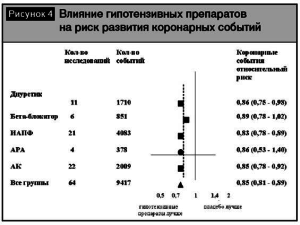
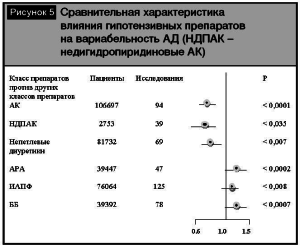
Различия групп гипотензивных препаратов в плане профилактики инсульта были представлены в метаанализе [13]. Результаты метаанализа показали, что при лечении антагонистами кальция (АК) суммарный относительный риск инсульта, рассчитанный в ходе выполнения анализа по сравнительной оценке эффективности препаратов, был достоверно ниже (р = 0, 01) по сравнению с препаратами других классов (рис. 3). Кроме того, АК не уступали другим классам антигипертензивных препаратов в снижении риска осложнений ИБС (рис. 4). Еще в одном метаанализе [18] по изучению влияния АК на сердечно-сосудистые исходы было доказано, что дигидропиридиновые АК снижали риск смерти от всех причин (р = 0,026 ) и предотвращали развитие сердечной недостаточности по сравнению с плацебо (р = 0, 001). Кроме того, АК достоверно снижали риск инсульта (р=0,0001), в том числе по сравнению с ингибиторами ангиотензинпревращающего фермента (иАПФ)(р = 0, 016). В то же время интересны данные метаанализа 389 исследований [3], где было показано, что в сравнении с другими классами антигипертензивных препаратов снижение вариабельности систолического АД было отмечено при лечении АК (р < 0,0001) и непетлевыми диуретиками (р < 0,007), а повышение вариабельности систолического АД наблюдалось при лечении иАПФ (р= 0,008), антагонистами рецепторов ангиотензина (АРА) (р = 0,0002), бета-блокаторами (ББ) (р =0,0007) (рис. 5). Во всех проанализированных исследованиях снижение вариабельности систолического АД способствовало снижению риска инсульта (р < 0,0001), независимо от уровня среднего АД. Таким образом, снижение вариабельности АД может играть существенную роль в профилактике острых нарушений мозгового кровообращения.
Наиболее часто используемый АК, доказавший свою эффективность в различных исследованиях, – амлодипин (Норваск). В клинических исследованиях также доказано положительное влияние амлодипина на вариабельность АД. В метаанализе 12 исследований с участием 94 338 пациентов анализировалась эффективность амлодипина в профилактике инсульта, инфаркта миокарда у пациентов с АГ, ИБС, диабетической нефропатией. Результаты анализа показали, что амлодипин обеспечивал значительно более выраженное протективное действие против инсульта, чем препараты из других классов антигипертензивных средств (препараты сравнения: хлорталидон, атенолол, лизиноприл, эналаприл, ирбесартан, валсартан, кандесартан, а также плацебо) [11]. Положительное влияние амлодипина (Норваск) на вариабельность АД было показано в исследовании X-CELLENT (The Natrilix SR Versus Candesartan and Amlodipine in the Reduction of Systolic Blood Pressure in Hypertensive Patients). В исследование были включены 1762 пациента с АГ в возрасте от 40 до 80 лет. Из всех включенных в исследование пациентов 577 было проведено СМАД. Результаты СМАД показали, что терапия амлодипином приводила к снижению вариабельности САД за день (р < 0,0008), ночь (р < 0,008) и сутки (р <0,008), в то время как кандесартан не снижал вариабельность систолического АД. Авторы сделали вывод, что терапия амлодипином в течение 3 мес. приводила к значительному снижению вариабельности АД, и механизмом этого снижения, возможно, является снижение АД и улучшение регуляции автономной нервной системы [25].
Интересны результаты исследования ASCOT-BPLA (Anglo-Scandinavian Cardiac Outcomes Trial Blood Pressure Lowering Arm) [5, 21, 22], в котором у 19 257 пациентов с АГ и другими ФР ССЗ проводилось сравнение двух режимов лечения – на основе амлодипина и на основе атенолола. В ходе исследования, а также при более позднем анализе определялась вариабельность систолического АД как при СМАД, так и от визита к визиту. Было установлено, что у пациентов, получавших лечение на основе амлодипина, отмечено снижение фатального и нефатального инсульта (р = 0,0003), частоты развития всех ССО и выполнения всех вмешательств (р < 0,0001), общей смертности (р =0,025), а также частоты развития новых случаев сахарного диабета (р < 0,0001). Результаты исследования доказали, что среднее АД было плохим предиктором развития инсульта и коронарныхосложнений. В то же время показатель вариабельности систолического АД от визита к визиту был мощным предиктором развития инсульта и коронарных событий (р < 0,0001). Более того, вариабельность систолического АД от визита к визиту на фоне лечения амлодипином была ниже, чем в группе атенолола (р < 0,0001). По сравнению с исходными данными на фоне лечения амлодипином вариабельность АД снижалась, в то время как на фоне лечения атенололом она увеличивалась. Необходимо отметить, что, повидимому, не все АК способны уменьшать вариабельность АД. Так, в исследовании ELSA (European Lacidipine Study on Atherosclerosis) было показано [9], что у пациентов с мягкой и умеренной АГ вариабельность АД от визита к визиту существенно не различалась при лечении лацидипином и атенололом.
Говоря об эффективности амлодипина в профилактике инсультов, его высокой антигипертензивной эффективности, способности снижать вариабельность АД, необходимо отметить, что препарат обладает широким спектром фармакологической эффективности. Клиническая эффективность амлодипина у пациентов с различными ССЗ хорошо доказана в различных исследованиях. Так, в исследовании CAMELOT (The Comparison Amlodipine vs Enalapril to Limit Occurrence of Thrombosis) проводилось сравнение влияния блокатора кальциевых каналов амлодипина и иАПФ эналаприла в сопоставлении с плацебо на развитие ССС у пациентов с ИБС. Под ССС подразумевались: смерть из-за ССС, фатальный и нефатальный инфаркт миокарда, вмешательство по коронарной реваскуляризации, госпитализация из-за стенокардии, застойной сердечной недостаточности, нефатальный инсульт или транзиторная ишемическая атака. Кроме того, в исследовании CAMELOT с использованием внутрисосудистого ультразвукового исследования (УЗИ) проводилась оценка прогрессирования коронарного атеросклероза под влиянием проводимой терапии. Результаты исследования показали отчетливый эффект терапии амлодипином на первичную конечную точку. Терапия амлодипином способствовала относительному снижению на 31% частоты развития ССС (первичная точка) (р = 0,003). Терапия эналаприлом привела к снижению ССС на 15,3%, что было статистически не значимо (р = 0,16). Кроме того, результаты внутрисосудистого УЗИ показали, что отмечался рост атеросклеротических бляшек в группе плацебо (р = 0,02 ), тенденция к прогрессированию атеросклероза в группе эналаприла (р = 0,08 ) и отсутствие прогрессирование атеросклероза в группе амлодипина (р = 0,31) [16].
Еще в одном исследовании PREVENT (The Prospective Randomized Evaluation of the Vascular Effects of Norvasc Trial) у 825 пациентов с ангиографически доказанной ИБС было показано, что после 36 мес. терапии амлодипином значительно (р = 0,007) снижалось прогрессирование атеросклероза сонных артерий. По данным УЗИ толщина комплекса интима-медиа сонных артерий к концу срока наблюдения в группе плацебо увеличилась на 0,033 мм, а в группе амлодипина уменьшилась на 0,013 мм (р = 0,007) [4].
В исследовании CAPE (The Circadian Anti-Ishemia Program in Europe) оценивался эффект амлодипина по влиянию на ишемию миокарда у больных со стабильной ИБС. Было показано, что прием амлодипина в дозе от 5 до 10 мг в сутки по сравнению с плацебо в дополнение к проводимому лечению значительно снижал частоту эпизодов болевой и безболевой ишемии миокарда (р =0,025) и приступов стенокардии (р = 0,0001) у пациентов со стабильной ИБС [12].
Амлодипин продемонстрировал свою эффективность и в рамках комбинированной терапии. Так, в исследовании ACCOMPLISH (Avoiding Cardiovascular Events through Combination Therapy in Patients Living with Systolic Hypertension) было показано, что у пациентов АГ с высоким риском ССО при лечении комбинацией амлодипина и иАПФ беназеприла частота неблагоприятных ССС была достоверно ниже, чем при назначении того же беназеприла в сочетании с гидрохлортиазидом (9,6% в группе амлодипина и беназеприла и 11,8% в группе беназеприла и гидрохлортиазида, р < 0,001) [10].
В 2012 г. вышли новые Европейские рекомендации по лечению хронической и острой сердечной недостаточности [8]. В рекомендациях указывается, что если у пациентов с хронической сердечной недостаточностью АД не контролируется на фоне приема иАПФ, ББ и диуретиков и необходимо назначение АК, то следует назначать амлодипин или фелодипин. Амлодипин (Норваск) характеризуется высокой клинической эффективностью, доказанной в крупных исследованиях и является эффективным препаратом, способным снизить риск ССО у пациентов с АГ и ИБС. Амлодипин положительно влияет на вариабельность АД, что может вносить существенный вклад в профилактику острых нарушений мозгового кровообращения и оптимизацию антигипертензивной терапии.
Таким образом, АГ является весомым, но потенциально корригируемым фактором риска ССО, в том числе инсульта. Стратегия профилактики цереброваскулярных заболеваний основана на выявлении и коррекции целого ряда факторов, которые предрасполагают к их развитию, среди которых одним из главных является повышенный уровень АД и, как показали исследования, вариабельность АД, в частности вариабельность от визита к визиту. Постоянная антигипертензивная терапия, направленная на достижение целевого уровня АД, снижение вариабельности АД, а также коррекция сопутствующих ФР, позволяют снизить суммарный риск ССО у пациентов с АГ. Все это свидетельствует о необходимости постоянной просветительской работы среди населения и больных АГ, а также выявления и регулярного лечения указанной категории пациентов [2].
ЛИТЕРАТУРА
1. Оганов Р.Г., Масленникова Г.Я. // Профилактическая медицина. – 2009. – № 6. – С. 3–7.
2. Шальнова С.А. // Артериальная гипертензия. – 2008. – № 2 (2). – С. 57–58.
3. Webb A.J.S., Mehta U.Z., Rothwell P.M. // Lancet. – 2010. – Vol. 375. – P. 906–915.
4. Pitt B., Byington R.P., Furberg C.D. et al. // Circulation. – 2000. – Vol. 102. – P. 1503–1510.
5. Dahlof B., Sever P., Poulter N.R. et al. // Lancet. – 2005. – Vol. 366. – P. 895–906.
6. Wiliams B. // J. Am. Coll. Cardiol. – 2006. – Vol. 48. – P. 1698–1711.
7. Sierra C., Coca A. // Eur. Society of Hypertension Scient. Newsletter. – 2011. – Vol. 12, N 39.
8. ESH Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012 // Eur. Heart Journal. –2012. – Vol. 33. – P. 1787–1847.
9. Mancia G., Parati G., Facchetti R., Zanchetti A. // Journal of Hypertension. – 2012. – Vol. 30, N 6. – P. 1241–1251.
10. Jamerson K., Weber M.A., Bakris G.L. et al. // N. Engl. J. Med. – 2008. – Vol. 359. – P. 2417–2428.
11. Wang J.-G., Li Y., Franklin S.S., Safar M. // Hypertension. – 2007. – Vol. 50. – P. 181–188.
12. Deanfield J., Detry J.-M.R.G., Lichtlen P.R. et al. // J. Am. Coll. Cardiol. – 1994. – Vol. 24. – P. 1460–1467.
13. Law M.R., Morris J.K., Wald N.J. // BMJ. – 2009. Vol. 338. – P. 1665.
14. Li Yan, Liu Jing, Wang Wei et al. // Heart. – 2011. – Vol. 97. – P. A95–A96.
15. Munther P., Shimbo D., Tonelli M. et al. // Hypertension. – 2011. – Vol. 57, N 2. – P. 160–166.
16. Nissen S.E., Tuzcu E.M., Libby P. et al. // Jama . – 2004. – Vol. 292. – P. 2217–2225.
17. O’Donnell M., Xavier D., Liu L. et al. // Lancet. – 2010. – Vol. 376, Is. 9735. – P. 112–123.
18. Costanzo P., Perrone-Filardi P., Petretta M. et al. // J. of Hypertension. – 2009. – Vol. 27, N 6. – P. 1136–1151.
19. Kearney P.M., Whelton M., Reynolds K. et al. // Lancet. – 2005. – Vol. 365, Is. 9455. – P. 217–223.
20. Sega R., Corrao G., Bombelli M. et al. // Hypertension. – 2002. –Vol. 39 (part 2). – P. 710–714.
21. Rothwell P.M., Howard S.C., Eamon D. et al. // Lancet. – 2010. – Vol. 375, Is. 9718. – P. 895–905.
22. Rothwell P.M., Howard S.C., Dolan E. et al. // Lancet Neurol. – 2010. – Vol. 9, N 5. – P. 469–480.
23. Kawai T., Ohishi M., Kamide K. et al. // Hypertens. Research. – 2012. – Vol. 35. – P. 239–243.
24. Chen W., Srinivasan S.R., Ruan L. et al. // Am. J. Hypertens. – 2011. – Vol. 24, N 1. – P. 77–82.
25. Zhang Y., Agnoletti D., Safar M.E. et al. // Hypertension. – 2011. – Vol. 58. – P. 155–160.
Медицинские новости. – 2012. – №10.










Комментировать