Антитромбоцитарная терапия как звено вторичной профилактики ишемического инсульта. Мозговой инсульт. Назначение антитромбоцитарных препаратов.
Т.С. Мищенко, Е.В. Песоцкая, А.В. Линская, Л.И. Аборнева,
Государственное учреждение «Институт неврологии, психиатрии и наркологии АМН Украины», г. Харьков
Газета «Новости медицины и фармации»
Неврология (339) 2010 (тематический номер) / Клинические исследования
Мозговой инсульт (МИ) по-прежнему остается актуальнейшей медико-социальной проблемой во всем мире, так как является третьей, а в некоторых странах второй по счету причиной смерти и утраты трудоспособности после ишемической болезни сердца (ИБС) и онкозаболеваний [1, 2]. В Украине, по данным официальной статистики, в 2009 г. заболеваемость МИ составила 280,2 на 100 тыс. населения, причем в 35 % случаев инсульт развивается у людей трудоспособного возраста [3]. Летальность в течение первого года после инсульта составляет 35-38 %, и только 20 % больных, перенесших МИ, возвращаются к работе [4].
Четвертую часть всех инсультов составляют повторные [5]. По данным эпидемиологических исследований, у пациентов, выживших после МИ, вероятность развития повторного нарушения мозгового кровообращения (НМК) достигает 30 %, что в 9 раз превышает таковую в общей популяции [5-7]. Доказано, что общий риск повторного НМК в первые два года после перенесенного инсульта составляет от 4 до 14 %, причем в течение первого месяца повторный ишемический инсульт (ИИ) развивается у 2-3 % выживших, в первый год — у 10-16 %, затем — у около 5 % ежегодно. Частота повторного инсульта в течение первого года различна для различных клинических вариантов инфаркта мозга: при тотальном инфаркте в каротидном бассейне она составляет 6 %, лакунарном — 9 %, частичном инфаркте в каротидном бассейне — 17 %; инфаркте в вертебробазилярном бассейне — 20 % [8-11].
Аналогичному риску подвержены и лица, перенесшие транзиторные ишемические атаки (ТИА) и острую ишемию, закончившуюся выздоровлением. Ранее эти нозологические формы считались легкими, не угрожающими жизни пациента. Однако на сегодняшний день эта точка зрения пересмотрена. И ТИА, и острая ишемия, заканчивающаяся выздоровлением, являются грозными факторами риска развития инфаркта мозга и смерти. После первой ТИА у 10-20 % пациентов инсульт развивается в течение последующих 90 дней, у 5 % этих пациентов — в первые 24-48 часов после ТИА [12, 13]. В обновленном руководстве Европейской инсультной организации (European Stroke Organisation, ESO) по ведению больных с ИИ и ТИА (2008) впервые упоминание о ТИА вынесено в заголовок наряду с инсультом. В этом документе ведению больных с ТИА уделяется особое внимание.
Риск повторного ИИ достоверно выше не только у пациентов, перенесших симптомные эпизоды церебральной ишемии, но и у больных с выявленными асимптомными постишемическими очагами по результатам магнитно-резонансной или компьютерной томографии («немые» инсульты) [14]. Эта категория пациентов также требует проведения активных мероприятий по предотвращению развития клинически проявляющегося инсульта.
Успех вторичной профилактики ИИ во многом зависит от распознания патогенетических механизмов первого сосудистого события и воздействия на них [3-5, 11, 15]. В связи с этим основными направлениями вторичной профилактики МИ являются: коррекция факторов риска путем изменения образа жизни, отказа от курения, снижения массы тела; лечение артериальной гипертензии, фибрилляции предсердий; нормализация гликемии. Поскольку атеросклероз магистральных артерий головы (МАГ) является причиной большинства ИИ [16] (в общей структуре ишемических НМК атеротромботический инсульт (АИ) составляет 30-50 % [3, 5, 7]), важным аспектом вторичной профилактики инсульта является липидомодифицирующая терапия (прием статинов, которые обладают не только гиполипидемическим, но и противовоспалительным действием). Пациентам со стенозами сонных артерий 70-99 %, а также с нестабильными бляшками рекомендована каротидная эндартерэктомия. Учитывая, что главной причиной острой ишемии при атеротромботическом варианте инсульта является тромбоз в области атеросклеротических бляшек (АСБ) и атерогенная эмболия [17-20], трудно переоценить также роль антитромбоцитарных препаратов в качестве средств вторичной профилактики ИИ [21-25]. Пациентам с перенесенным инсультом и ТИА кардиоэмболического генеза рекомендована терапия оральными антикоагулянтами, а при наличии противопоказаний к их применению — прием ацетилсалициловой кислоты (АСК) в дозе 325 мг.
Назначение антитромбоцитарных препаратов с целью вторичной профилактики ИИ следует начинать как можно раньше [3, 26], так как риск развития повторного ИИ особенно высок в ранние сроки после перенесенного эпизода острой церебральной ишемии.
Многочисленными клиническими исследованиями и систематизированным обзором Апйр^ее Trialists’ СоНаЬогаНоп [27, 28] было показано, что длительный прием антиагрегантных средств (в течение месяца и более) уменьшает риск серьезных сосудистых эпизодов (инфаркт миокарда, инсульт, сосудистая смерть) на 25 %.
Внедрению антиагрегантной терапии в клиническую ангионеврологию способствовало подтверждение ключевой роли тромбоцитов в тромбообразовании при ишемических НМК [29-32]. Тромбоциты являются жизненно необходимыми компонентами свертывания крови — физиологического процесса, обеспечивающего остановку кровотечения после повреждения тканей и сосудов. Адгезию и активацию тромбоцитов можно рассматривать как восстановительную реакцию в ответ на внезапное образование трещины или разрыва атероматозной бляшки. Однако неконтролируемое развитие такого процесса посредством серии самоподдерживающихся циклов усиления реакции может привести к формированию внутрипросветного тромба, закупорке сосуда и острой ишемии мозга. Рассматривая тромбоциты как ключевые факторы тромбогенеза, нельзя не отметить другую, не менее важную их функцию, опосредованно влияющую на этот процесс. Тромбоциты в настоящее время рассматриваются как источник воспалительных медиаторов, причем сам процесс воспаления может способствовать локальному тромбозу, который, в свою очередь, усугубляет воспаление. Как противовоспалительная терапия может замедлять и приостанавливать тромбообразование, так и антитромботическая терапия способна ослабить сосудистый воспалительный процесс, прерывая сформировавшийся порочный круг [33].
Это объясняет важность антитромбоцитарной терапии в стратегии вторичной профилактики некардиального мозгового инсульта.
В настоящее время доказана эффективность четырех антитромбоцитарных препаратов в профилактике МИ. Это ацетилсалициловая кислота (АСК), тиклопидина гидрохлорид, клопидогреля бисульфат, а также комбинация аспирин + дипиридамол длительного высвобождения. Перечисленные антиагрегантные препараты, различаясь по основным механизмам действия, являются антагонистами агрегации тромбоцитов в различных точках приложения и способствуют прекращению тромбообразования на стадии формирования тромбоцитарных агрегатов. Так, аспирин (ацетилсалициловая кислота — АСК) блокирует циклооксигеназу, предотвращая образование тромбоксана А^иЬ>2 <^иЬ> — мощного вазоконстриктора и индуктора агрегации тромбоцитов. Тиенопиридины, к которым относятся клопидогрель и тиклопидин, являются необратимыми и селективными ингибиторами АДФ-индуцированной агрегации тромбоцитов, блокирующими аденозиновые рецепторы тромбоцитов. Дипиридамол увеличивает концентрацию циклических нуклеотидов и влияет на концентрацию АДФ, тромбина, арахидоновой кислоты.
Большой интерес вызывает поиск новых путей повышения эффективности применения антиагрегантов, в частности АСК, с использованием комбинации препаратов [34]. Одним из таких лекарственных средств является дипиридамол. Разнообразие фармакологических эффектов этого препарата объясняет интерес к возможности его применения с целью профилактики ИИ. Была проведена серия клинических исследований, целью которых являлось сравнение эффективности дипиридамола и плацебо в качестве средства предупреждения повторной острой церебральной ишемии [35-38]. Одним из первых исследований, посвященных данной проблеме, явилось European Stroke Prevention Study (ESPS-1). В нем изучены возможности вторичной профилактики ИИ после перенесенных ИИ и/или ТИА комбинацией дипиридамола и АСК [39]. Полученные результаты свидетельствовали о достоверно большей эффективности комбинированного препарата по сравнению с плацебо, однако дизайн исследования не подразумевал прямого сравнения эффективности комбинированной терапии и применения АСК в качестве средства монотерапии. Ответу на этот вопрос, а также решению ряда других проблем было посвящено рандомизированное контролируемое многоцентровое исследование European Stroke Prevention Study-2 (ESPS-2), задачей которого было изучение эффективности комбинированной терапии с применением АСК и фармакологической формы дипиридамола с замедленным высвобождением (ДЗВ) [40, 41]. Согласно дизайну исследования в него были включены 6602 пациента, перенесшие ИИ или ТИА, которые на протяжении более 24 месяцев получали малые дозы АСК (50 мг в сутки), ДЗВ (400 мг в сутки) в виде как монотерапии, так и комбинированной терапии, группа сравнения получала плацебо. Оказалось, что применение АСК в качестве монотерапии привело к снижению частоты ИИ на 18 %, ИИ и/или летального исхода — на 13 %, применение ДМВ — к снижению частоты инсультов на 15 % и ИИ и/или летального исхода — на 15 %. Наиболее значимый эффект зарегистрирован в группе комбинированной терапии, в которой уменьшение числа ИИ составило 37 %, а ИИ и/или летального исхода — 24 %. Необходимо отметить, что ни один из режимов терапии не сопровождался снижением общей летальности, обусловленной различными причинами. Авторы отметили сопоставимую эффективность применения как АСК, так и ДМВ в указанных дозах, при том что комбинированная терапия обладала значительно большим эффектом. Оказалось, что применение антиагрегантов в различных режимах (монотерапия или комбинация) было значительно эффективнее отсутствия лечения (группы плацебо), причем эффект в большей степени заключался в предупреждении ИИ и в меньшей — инфаркта миокарда. В последующем основной интерес исследователей привлекала возможность и целесообразность проведения комбинированной терапии с применением АСК и ДМВ с целью вторичной профилактики ИИ. В клиническую практику был введен препарат агренокс (25 мг АСК и 200 мг ДЗВ) [42]. Оказалось, что в целом двукратный прием агренокса в течение суток сопровождается примерно вдвое большим снижением риска развития ИИ или ТИА по сравнению с терапией одним из препаратов, входящих в его состав [43, 44]. На рубеже 1990-2000 гг. агренокс начал широко использоваться в клинической практике в странах Западной Европы с целью вторичной профилактики эпизодов острой церебральной ишемии [42]. В 2008 г. были опубликованы результаты масштабного исследования PRoFESS, посвященного оценке эффективности различных стратегий вторичной профилактики ИИ, в котором приняли участие 20 332 пациента, находившиеся под наблюдением на протяжении в среднем 2,5 года [45]. При сравнении эффективности комбинации АСК (50 мг в сутки) и ДМВ (400 мг в сутки), с одной стороны, и клопидогреля (75 мг в сутки) — с другой, оказалось, что на фоне лечения ИИ развился в 9 и 8,8 % случаев соответственно. Также не было существенных отличий в частоте достижения прочих конечных точек исследования (острый инфаркт миокарда, смертность от заболеваний сердечнососудистой системы). Полученные данные свидетельствуют об аналогичной эффективности препаратов как средств вторичной профилактики ИИ. Сопоставимой оказалась и частота геморрагических осложнений в указанных группах пациентов, хотя в группе больных, получавших комбинированную терапию, она оказалась несколько большей — 4,1 и 3,6 % соответственно (относительный риск (ОР) — 1,42; 95% доверительный интервал (ДИ) — 1,00-1,32). Аналогичным образом это касалось и риска развития внутричерепных кровоизлияний (ОР = 1,42; 95% ДИ 1,11-1,83). Накопленный опыт клинического применения агренокса, результаты рандомизированных контролируемых исследований позволили провести метаанализ, результаты которого были опубликованы в 2008 г. [46]. Подтвердились имеющиеся данные о преимуществе комбинированной терапии с применением малых доз АСК и ДМВ — ОР развития ИИ уменьшался на 0,77 (95% ДИ 0,67-0,89). Положительный эффект оказался достоверно большим по сравнению с группой пациентов, принимавших только АСК, ДМВ, а также дипиридамол короткого действия как в виде монотерапии, так и в комбинации с АСК. Опубликованный практически одновременно другой метаанализ был проведен для сравнения эффективности комбинированного лечения с применением АСК у пациентов, перенесших ТИА или малый инсульт некардиоэмболического генеза [47]. Всего были проанализированы 7612 пациентов, из которых 3800 получали комбинированную терапию. Авторы установили несомненное преимущество сочетанного применения дипиридамола и АСК, которое не зависело от исходного риска развития цереброваскулярных поражений (наличие предыдущих эпизодов острой церебральной ишемии, сахарного диабета, артериальной гипертензии), от пола, возраста, типа поражения сосудистого русла — микроили макроангиопатии. Интересно, что авторы не установили существенных различий эффективности использования различных доз дипиридамола в комбинации с АСК по сравнению с монотерапией АСК. В целом же снижение ОР развития ИИ при комбинированной терапии по сравнению с монотерапией АСК было аналогично тому, что продемонстрировано в указанном ранее исследовании, и составило 0,78 (95% ДИ 0,68-0,90).
Антитромбоцитарные эффекты АСК реализуются за счет угнетения активности циклооксигеназы тромбоцитов, вследствие чего подавляется продукция тромбоксана А2. Основным активным метаболитом препарата является салициловая кислота, хорошо связывающаяся с белками плазмы крови, благодаря чему период полувыведения составляет 2-3 ч. Дипиридамол оказывает угнетающее действие на функцию тромбоцитов и эндотелиоцитов за счет ингибирования цАМФи цГМФ-фосфодиэстераз, аденозиндезаминазы, вследствие чего в клетках повышается концентрация цАМФ и цГМФ, замедляется обратное поступление аденозина, в связи с чем возрастает его концентрация в крови (с указанным механизмом, в частности, связан сосудорасширяющий эффект препарата). Находящийся вне клеток аденозин взаимодействует с А2-рецепторами тромбоцитов, стимулируя аденилатциклазу тромбоцитов, и таким образом увеличивает уровень цАМФ тромбоцитов. В итоге наблюдается подавление приклеивания тромбоцитов к сосудистой стенке и образования тромбоцитарных агрегатов. Кроме того, дипиридамол обладает способностью изменять баланс тромбоксана А2 и простагландина Е1, смещая его в сторону выработки последнего — мощного естественного антиагреганта. Считается также, что дипиридамол способствует увеличению продолжительности жизни тромбоцитов. Интересна возможность осуществления эффектов дипиридамола через воздействие на функцию эндотелия, в частности, вследствие влияния на тромбоцитарно-лейкоцитарные взаимодействия, взаимодействие тромбоцитов с клетками сосудистой стенки, течение реакции воспаления [48]. В условиях клинического применения важно, что дипиридамол не влияет непосредственно на деятельность системы циклооксигеназ, в связи с чем обладает минимальным риском ульцерогенного действия. После перорального приема дипиридамол быстро всасывается в кишечнике, степень его абсорбции в значительной степени определяется уровнем кислотности желудочного сока, в связи с чем биодоступность имеет значительные индивидуальные колебания (наличие в капсуле агренокса молекул винной кислоты обеспечивает стабильную локальную кислотность и постепенное высвобождение препарата). Имеются данные о том, что абсорбция ДМВ более пролонгирована по сравнению с короткоживущими формами препарата [49]. Максимальная концентрация в плазме крови отмечается приблизительно через 60 мин после перорального приема. Препарат хорошо связывается с белками плазмы крови (до 98 % принятого препарата), период полувыведения формы с замедленным высвобождением достигает 13 ч, что обеспечивает остаточную эффективность при двукратном приеме в сутки. Выведение препарата из организма происходит главным образом с желчью и калом. Таким образом, есть все основания полагать, что входящие в состав агренокса АСК и ДМВ имеют различные точки приложения и отличаются механизмами действия, хотя оба препарата в целом обладают мощным антитромбоцитарным эффектом, препятствуя процессам тромбообразования, что было установлено как в условиях эксперимента, так и в процессе клинических наблюдений. Необходимо отметить особенность состава агренокса — наличие быстродействующей АСК и лекарственной формы ДМВ, что обеспечивает стабильную эффективность препарата на протяжении суток. Интересные сведения о механизмах действия препарата были получены в результате небольшого по масштабам рандомизированного клинического исследования (40 больных, перенесших ИИ, получающих агренокс или АСК по 81 мг в сутки — Agrenox versus Aspirin Therapy Evaluation — AGATE) [50]. Агренокс достоверно в большей степени угнетал экспрессию целого ряда биологически активных веществ, участвующих в системе гемостаза — молекул клеточной адгезии 1 (PECAM-1), антигена к гликопротеину IIb/GPIIb, активность самого комплекса GPIIb/IIIa, а также ингибирование рецепторов, активируемых протеазой-1 (PAR-1). Полученные данные позволяют предполагать наличие у агренокса свойств, которыми не обладают его компоненты, вследствие чего наблюдается аддитивный клинический эффект. Несколько позже указанные авторы обнаружили интересный факт: предварительная обработка дипиридамолом крови больных, имеющих каротидный стеноз и перенесших ИИ, сопровождается уменьшением экспрессии протромбиназных комплексов, чем преодолевается резистентность к аспирину. Эти данные соответствуют результатам клинических исследований, в которых подтверждено усиление превентивного эффекта агренокса по сравнению с монотерапией. В целом выраженность антиагрегантного эффекта препарата, оцениваемая по интенсивности агрегации кровяных пластинок в ответ на различные индукторы, существенно не отличается у представителей различных рас (европейцы, афроамериканцы, японцы) [47, 48]. С учетом существенного вазодилатирующего эффекта дипиридамола при внутривенном введении препарата, в частности в отношении венечных артерий (кровоток возрастает до 6 раз, что может провоцировать острую коронарную ишемию), проведено исследование влияния агренокса на коронарный кровоток [51]. В указанном исследовании участвовали 24 пациента, перенесшие острый ИИ или ТИА, получавшие агренокс в стандартных дозировках. Оказалось, что применение препарата на протяжении 6,7 ±1,9 суток сопровождалось увеличением кровотока в среднем на 39 % при снижении сосудистого сопротивления на 32,7 %, при этом признаков ухудшения коронарного кровотока не зарегистрировано ни у одного больного. Необходимо подчеркнуть, что в литературе не описаны случаи клинически значимого обострения ИБС на фоне применения агренокса. Вместе с тем применение препарата нежелательно у пациентов с острой коронарной ишемией, тяжелым мультифокальным поражением венечных артерий.
С учетом данных о вазопротекторном и антиагрегантном эффекте фиксированной комбинации АСК и ДМВ целью нашего исследования явилось изучение влияния препарата агренокс на клиническое течение постинсультного периода, а также на частоту повторных сосудистых событий у больных, перенесших АИ.
Задачи исследования: 1. Оценить состояние неврологического статуса у больных в постинсультном периоде. 2. Изучить реологические свойства крови, тромбоцитарный и коагуляционный гемостаз у обследованных пациентов и влияние препарата агренокс на эти показатели. 3. Оценить влияние препарата агренокс на состояние стенки сонных артерий у больных, перенесших ИИ.
Материалы и методы
Было обследовано 46 пациентов, перенесших ИИ (основная группа), в возрасте от 37 до 78 лет (средний возраст 61,81 ± 1,58 года) и 43 пациента группы сравнения в возрасте от 45 до 76 лет (средний возраст 60,79 ± 2,15 года). Из числа обследованных в основной группе мужчины составляли 56,5 % (26 человек), женщины — 43,5 % (20 человек). У 22 больных (43,3 %) очаг поражения локализовался в системе правой внутренней сонной артерии (ВСА), у 15 пациентов (36,7 %) — в системе левой ВСА и у 9 больных (20,0 %) — в вертебробазилярном бассейне.
У обследованных пациентов отмечались такие факторы риска развития ИИ, как артериальная гипертензия (АГ) — 75,4 %, ИБС — 72,3 %, перенесенный инфаркт миокарда (ИМ) — 12,2 %, ТИА — 21,4 %, гиперхолестеринемия — 57,1 %, сахарный диабет (СД) II типа — 36,7 %.
Для решения поставленных задач в работе был применен клинико-неврологический метод с обследованием больных по специально разработанной карте. Для оценки функциональных возможностей больных использовалась шкала Рэнкина; динамика повседневной активности оценивалась по индексу Бартел. Всем пациентам проводилось дуплексное сканирование магистральных артерий головы (МАГ) и изучение реологических свойств крови, состояния тромбоцитарного, коагуляционного гемостаза и фибринолиза.
Были проанализированы следующие показатели лабораторных исследований: количество тромбоцитов в 1 мкл периферической крови (в норме — 150-400 тыс/мкл); показатель гематокрита; время свертывания крови (ВСК) по Ли — Уайту (8-12 мин) — самый доступный показатель, который дает представление о свертывающей способности крови; активированное частичное тромбопластиновое время (АЧТВ) — в норме 28-38 с; протромбиновое время (ПВ) — позволяет оценить внешний и общий пути свертывания крови (факторы VII, I, II, X); фибринолитическая активность.
Всем пациентам проводилось ультразвуковое исследование МАГ на аппарате Ultima РА («Радмир», Украина) широкополосным линейным датчиком с центральной частотой 7,5 мГц в дуплексном режиме с цветовым картированием кровотока. Исследование сонных артерий включало определение: толщины комплекса интима-медиа (КИМ) сонных артерий в стандартных точках по общепринятой методике, диаметров общих (ОСА) и внутренних (ВСА) сонных артерий, степень стенозирования просвета сосуда по критерию ECST [52], наличие нарушений сосудистой геометрии. Скоростные и спектральные параметры кровотока определялись в дуплексном режиме, с автоматической оценкой параметров кровотока в ОСА, ВСА и позвоночных артериях (ПА) на экстракраниальном уровне. Оценивали пиковую систолическую, конечную диастолическую скорости кровотока, усредненную по времени пиковую скорость кровотока и объемную скорость кровотока (Vvol) в каждом сосуде отдельно, а также оценивали суммарную объемную скорость кровотока в общих сонных артериях (IVvol ОСА), суммарную объемную скорость кровотока в позвоночных артериях (IVvol ПА) и суммарную объемную скорость кровотока в каротидном и позвоночном бассейнах (IVvol МК), индекс резистентности (RI) и пульсационный индекс (PI). Повторное исследование проводили через 6 и 12 месяцев.
Больным основной группы назначался препарат агренокс (капсулы с модифицированным высвобождением, которые вмещали 200 мг дипиридамола и 25 мг АСК производства Boehringer Ingelheim) по одной капсуле два раза в сутки в течение года. У пациентов группы сравнения с целью вторичной профилактики МИ применялся аспирин в дозе 100 мг в сутки.
Все исследуемые пациенты получали стандартную терапию, составляющую основу вторичной профилактики, а именно: антигипертензивные препараты, статины.
Исследование неврологического статуса, изучаемых параметров крови и сосудистой стенки проводилось перед началом приема антитромбоцитарных препаратов, через шесть месяцев лечения и через год.
Результаты и их обсуждение
До начала проводимой терапии у обследованных пациентов основными жалобами были: слабость в левых или правых конечностях — 87,5 %, нарушения чувствительности в них — 54,1 %, речевые расстройства — 25,8 %, снижение памяти — 83,3 %, затруднения при ходьбе — 37,5 %, головная боль — 86,7 %, шум и чувство тяжести в голове — 81,2 %, головокружение — 62,5 %, снижение фона настроения, потеря интереса к жизни — 45,8 %.
В неврологическом статусе у этих пациентов преобладали двигательные нарушения в виде гемипареза — 87,5 %, повышение мышечного тонуса в паретичных конечностях по спастическому типу — 74,2 %, нарушения чувствительности в виде гемигипестезии — 54,1 %, центральный парез мимической мускулатуры — у 29,2 %, элементы моторной афазии — у 8,3 %, сенсомоторной афазии — у 16,7 %. Подкорковый синдром встречался в 33,3 % случаев, псевдобульбарный — в 37,5 %. У 76,1 % пациентов отмечались когнитивные нарушения, в 17,4 % случаев была диагностирована сосудистая деменция (применялась шкала Mini-mental State Examination — MMSE), у 45,8 % пациентов — постинсультная депрессия.
Через 6 месяцев после начала лечения большинство больных отмечало уменьшение головной боли — 71,1 %, головокружения — 54,3 %, шума и чувства тяжести в голове — 64,1 %. Больные становились активнее и отмечали улучшение общего самочувствия. К концу исследования почти у всех больных наблюдалось уменьшение выраженности проявлений цефалгического, вестибулоатактического, астенического синдромов, снижение артериального давления по сравнению с исходными значениями.
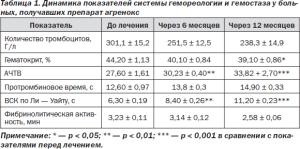
На момент включения пациентов в исследование у всех больных показатели количества тромбоцитов, гематокрита, ВСК по Ли — Уайту, уровень фибриногена, АЧТВ были повышены. В результате приема агренокса в течение года у обследованных больных улучшился ряд показателей реологических свойств крови, тромбоцитарного и коагуляционного гемостаза. Динамика показателей системы гемореологии и гемостаза представлена в табл. 1.
Таблица 1. Динамика показателей системы гемореологии и гемостаза у больных, получавших препарат агренокс
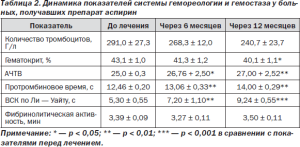
Показатели гемореологии и гемостаза до и после лечения в группе сравнения, где с целью вторичной профилактики применялся препарат аспирин, представлены в табл. 2.
Таблица 2. Динамика показателей системы гемореологии и гемостаза у больных. получавших препарат аспирин
При исследовании параметров мозговой гемодинамики и толщины комплекса интима-медиа перед началом лечения антитромбоцитарными препаратами достоверных различий между основной группой и группой сопоставления выявлено не было.
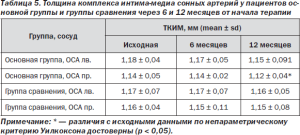
У всех пациентов основной группы и группы сравнения были выявлены признаки атеросклеротического поражения сонных артерий, проявляющиеся утолщением КИМ, структурной перестройкой КИМ с повышением эхогенности с полной или частичной утратой дифференцировки на слои. Достоверных отличий в исходной толщине КИМ между группами выявлено не было. В основной группе толщина левой ОСА составила 1,18 ± 0,16 мм, толщина правой ОСА — 1,14 ± 0,13 мм, в группе сравнения соответственно слева — 1,17 ± 0,14 мм, справа — 1,16 ± 0,19 мм.
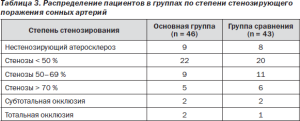
Также не было выявлено достоверных отличий в диаметрах ОСА и ВСА, в распределении по степени атеросклеротического поражения. Сужение просвета сосуда локальными атеросклеротическими бляшками (АСБ) менее 20 % относительно диаметра оценивалось как нестенозирующий атеросклероз. По степени стенозирования пациенты были разделены в соответствии с рекомендациями American Society of Echocardiography and the Society of Vascular Medicine and Biology 2006 г. [53] на 5 групп. Были выделены группы со стенозами менее 50 %, со стенозами 5069 %, со стенозами более 70 %, с субтотальной окклюзией (определялось выраженное снижение скоростных параметров кровотока) и тотальной окклюзией (кровоток в сосуде в режиме энергетического допплеровского картирования не определялся). Достоверных различий по степени стенозирующего поражения между группами выявлено не было (табл. 3).
Таблица 3. Распределение пациентов в группах по степени стенозирующего поражения сонных артерий
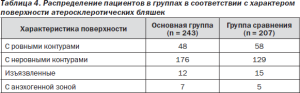
В основной группе было выявлено 243 АСБ, в группе сравнения — 207. Все выявленные АСБ имели гетерогенную структуру и были разделены на группы в соответствии с характеристикой поверхности. Были выявлены бляшки с ровными контурами, неровными контурами, изъязвленные (глубина дефекта > 2 мм) по классификации, предложенной Thiele с соавт. [54], и бляшки с анэхогенными зонами в покрышке, создающие в режиме цветового картирования «дефект прокрашивания». Изъязвленные бляшки и бляшки с гипоэхогенным компонентом расценивались как атеротромбогенные. Достоверных различий между группами в состоянии поверхности атеросклеротических бляшек (АСБ) выявлено не было (табл. 4).
Таблица 4. Распределение пациентов в группах в соответствии с характером поверхности атеросклеротических бляшек
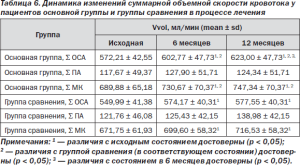
Также не было выявлено достоверных отличий в параметрах мозговой гемодинамики между группами. Скоростные и спектральные параметры кровотока в обеих группах достоверно не отличались. Не было достоверных отличий между основной группой и группой сравнения в показателях суммарной объемной скорости кровотока в каротидном и позвоночном бассейнах. В основной группе суммарный МК составил 689,88 ± 65,18 мл/мин, в группе сравнения — 671,75 ± 61,93 мл/мин.
При повторном исследовании через 6 месяцев достоверных различий в толщине КИМ как между группами, так и по сравнению с исходными данными в группах пациентов выявлено не было. Через 12 месяцев от начала исследования в обеих группах отмечалась тенденция к уменьшению толщины КИМ по сравнению с исходными данными, однако достоверное уменьшение толщины КИМ было выявлено только в основной группе (табл. 5).
Таблица 5. Толщина комплекса интима-медиа сонных артерий у пациентов основной группы и группы сравнения через 6 и 12 месяцев от начала терапии
В течение всего времени наблюдения не было выявлено достоверных изменений в степени стенозирования в основной и в группе сравнения. Однако через 6 месяцев после начала лечения у 5 из 7 (71,43 %) пациентов основной группы стабилизировались бляшки с анэхогенными зонами в покрышке, в то же время в группе сравнения стабилизация покрышки определялась только в 2 случаях из 5 (40 %). Через 12 месяцев существенной динамики в состоянии поверхности АСБ в обеих группах не отмечалось.
Через 6 месяцев после начала лечения суммарная объемная скорость кровотока в каротидном и позвоночном бассейнах достоверно увеличилась в обеих группах, преимущественно за счет суммарной объемной скорости кровотока в общих сонных артериях (табл. 6).
Таблица 6. Динамика изменений суммарной объемной скорости кровотока у пациентов основной группы и группы сравнения в процессе лечения
Через 12 месяцев лечения суммарная объемная скорость кровотока в каротидном и позвоночном бассейнах достоверно не отличалась от состояния на 6 месяцев, что можно расценивать как стабилизацию объемной скорости кровотока в процессе лечения.
Большинство обследованных нами больных хорошо переносили прием препарата, в 4 случаях отмечалась головная боль, которая самостоятельно регрессировала на 3-й день приема препарата. За время наблюдения у обследованных больных не было зафиксировано повторных сосудистых событий.
Выводы
- Проведенное исследование показало комплексное (антиагрегационное, вазоактивное, метаболическое) действие препарата агренокс у больных в восстановительном периоде АИ.
- У обследованных пациентов клинически отмечались улучшение и стабилизация состояния, за период наблюдения ни у одного из них не было зарегистрировано повторных острых сосудистых эпизодов.
- В результате лечения препаратом агренокс у обследованных больных отмечалось улучшение реологических свойств крови и показателей тромбоцитарного и коагуляционного гемостаза.
- Через 6 месяцев от начала терапии улучшилась и стабилизировалась мозговая гемодинамика. Кроме того, в течение 6 месяцев в 70 % случаев стабилизировались потенциально атеротромбогенные бляшки, через 12 месяцев от начала лечения зарегистрировано достоверное уменьшение толщины комплекса интима-медиа сонной артерии в месте максимального утолщения.
Таким образом, исследуемый препарат агренокс продемонстрировал антиагрегационный, вазоактивный и метаболический эффект у больных с перенесенным атеротромботическим инсультом и может быть использован с целью вторичной профилактики у больных в восстановительном периоде атеротромботического инсульта.
Литература
- Sacco R.L., Foulkes M.A., Mohr J. et al. Determinants of early recurrence of cerebral infarction. The Stroke Data Bank // Stroke. — 1989. — 20. — 983-9.
- Варакин Ю.Я. Эпидемиологические аспекты профилактики нарушений мозгового кровообращения // Атмосфера. Нервные болезни. — 2005. — № 2. — С. 4-10
- Мищенко Т.С. Вторичная профилактика мозгового инсульта (рекомендации для практических врачей). — Киев, 2003. — 20 с.
- Зозуля І.С., Боброва В.І. Вторинна профілактика ішемічного інсульту: оптимізація лікувальної тактики // Укр. вісник психоневрології. — 2002. — Т. 10, вип.1 (30) (додаток). — С. 54-55.
- Скворцова В.И., Чазова И.Е., Стаховская Л.В. Вторичная профилактика инсульта. — М.: ПАГРИ, 2002.— 365 с.
- Diener H.C., Ringleb P. Antithrombotic secondary prevention after stroke // Curr. Treat. Options Cardiovasc. Med. — 2002. — 4. — 429-440.
- Adams H. Secondary Prevention of Atherothrombotic Events After Ischemic Stroke // Mayo Clin. Proc. — 2009. — 84. — 43-51.
- Kent D., Thaler D. Stroke Prevention — Insights from Incoherence // N. Engl. J. Med. — 2008. — 10. — 1056.
- Lovett J., Coull A., Rothwell P. Early risk of recurrence by subtype of ischemic stroke in population-based incidence studies // Neurology. — 2004. — 62. — 56973.
- Инсульт. Диагностика, лечение и профилактика: Руководство для врачей / Под ред. З.А. Суслиной, М.А. Пирадова. — М., 2008.
- Alberts M.J. Secondary prevention of stroke and the expanding role of the neurologist // Cerebrovascular Diseases. — 2002. — 13 (Suppl. 1). — 12-16.
- Coull A., Lovett J., Rothwell P. Oxford Vascular Study. Population based study of early risk of stroke after transient ischemic attack or minor stroke: implications for public education and organization of services // BMJ. — 2004. — 328. — 326-8.
- Kennedy J. et al. Fast Assessment of Stroke and Transient Ischemic Attack to Prevent Early Recurrence Trial (FASTER): a randomized controlled pilot trial // Lancet Neurol. — 2007. — 6 (11). — 961-969.
- Vermeer S.E., Hollander M., Van Dijk E. et al. Silent brain infarcts and white matter lesions increase stroke risk in the general population: the Rotterdam Scan Study // Stroke. — 2003. — 34. — 1126-9.
- Очерки ангионеврологии / Под ред. З.А. Суслиной. — М., 2005.
- Atlas of Atherothrombosis / Ed. E.J. Topol. — UK: Science Press, 2004.
- Лутай М.И. Разрыв атеросклеротической бляшки и его клинические последствия. Можно ли предотвратить коронарную катастрофу? // Укр. кардіол. журн. — 2001. — Дод. 2. — С. 4-7.
- Волков В.И. Атеросклероз и атеротромбоз: патогенез, клинические проявления, лечение // Лікування та діагностика. — 2002. — № 3. — С. 13-22.
- Міщенко Т.С., Пісоцька О.В. Патогенетичні механізми атеротромботичного інсульту // Український вісник психоневрології. — 2007. — Т. 15, вип. 1 (50). — с. 25-27.
- Суслина З.А., Танашян М.М., Ионова В.Г. Ишемический инсульт: кровь, сосудистая стенка и антитромботическая терапия. — М., 2005.
- Мищенко Т.С. Антитромботическая терапия у больных с мозговым инсультом // Український медичний часопис. — 2000. — № 6 (20) — С. 38-41.
- Белоусов Ю.Б. Роль антитромбоцитарных препаратов во вторичной профилактике инсульта // Журнал невропатологии и психиатрии им. С.С. Корсакова. Инсульт (приложение). — 2003. — Вып. 9. — С. 87-88.
- Скворцова В.И., Стаховская Л.В., Пряникова Н.А. и др. Цереброваскулярные заболевания. Как правильно выбрать антиагрегант для вторичной профилактики ишемического инсульта // Consilium Medicum. Неврология. Цереброваскулярные заболевания. — 2007. — 9 (2). — 4-10.
- Antiplatelet Trialists’ Collaboration. Collaborative overview of randomised trials antiplatelet therapy: Prevention of death, myocardial infarction, and stroke by prolonged antiplatelet therapy in various categories of patients // BMJ. — 1994. — 308. — 98-106.
- Mateen F., Shuaib A. Progress in clinical neurosciences: The antiplatelet agents and the role of the endothelium // Can. J. Neurol. Sci. — 2007. — 34 (3). — 270-9.
- Morton J., Newton J., Gray C. Counting the true cost of antiplatelet therapy for stroke prevention // Age and Ageing. — 2005. — 34. — 212-4.
- Antithrombotic Trialists’ Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients // BMJ. — 2002. — 324. — 71-86.
- Lip G., Kamath S., Hart R. ABC of antithrombotic therapy: Antithrombotic therapy for cerebrovascular disorders // BMJ. — 2002. — 325. — 1161-3.
- Григорова І.А. Стан біоенергетичного гомеостазу і метаболізму у хворих на ішемічний інсульт // Український вісник психоневрології. — 2002. — Т. 10, вип. 1(30). — С. 41-42.
- Яворська В.О., Грицай Н.М., Мохамед А.М. Роль системи гемостазу при порушенні мозкового кровообігу. — Київ: Книга, 2004. — 191 с.
- Томах Н.В. Гемореологічні порушення та функціональний стан судинної стінки у хворих з ішемічними ураженнями головного мозку: Автореф. дис… к.м.н.: 14.01.15. — Київ, 2002. — 20 с.
- Танашян М.М. Ишемические инсульты и основные характеристики гемореологии, гемостаза и фибринолиза: Дис… д.м.н. — М., 1997.
- Комаров А.Л., Панченко Е.П. Роль воспаления в развитии атеротромбоза: «противовоспалительные» эффекты клопидогреля // Фарматека. — 2007. — 8/9. — 23-29.
- Caplain H. Enhanced antiplatelet effects of clopidogrel plus ASA compared with ASA alone or with extended release dipyridamole combined with low-dose ASA in healthy volunteers // Cerebrovasc. Dis. — 2001.— 11 (Suppl. 4). — 85.
- Sacco R.L. et al. Guidelenes for prevention of stroke in patients with ischemic stroke or transient ischemic attack // Stroke. — 2006. — 37. — 577-617.
- Marissal J., Selke B. Economic assessment of the secondary prevention of ischaemic stroke with dipyridamole plus aspirin (Aggrenox/Asasantin) in France // Pharmacoeconomics. — 2004. — 22 (10). — 661-70.
- Schaefer W., Koch K., Nowak B. et al. Dipyridamole/aspirin combination in secondary stroke prevention: effects on absolute myocardial blood flow and coronary vascular resistance // Int. J. Clin. Pharmacol. Ther. — 2006. — 44(7). — 319-28.
- Forbes C. Secondary stroke prevention with lowdose aspirin, sustained release dipyridamole alone and in combination. ESPS Investigators. European Stroke Prevention Study // Thromb. Res. — 1998. — 92 (1, Suppl. 1). — S1-6.
- Diener H.C., Cunha L., Forbes C., Sivenius J., Smets P., Lowenthal A. European Stroke Prevention Study 2: dipyridamole and acetylsalicylic acid in the secondary prevention of stroke // J. Neurol. Sci. — 1996.— 143. — 1-13.
- Diener H., Cunha L., Forbes C. et al. European Stroke Prevention Study 2. Dipyridamole and acetylsalicylic acid in the secondary prevention of stroke // J. Nerol. Sci. — 1996. — 143. — 5-13.
- Lenz T., Hilleman D. Aggrenox: a fixed-dose combination of aspirin and dipyridamole // Ann Pharmacother. — 2000. — 34(11). — 1283-90.
- Scheen A. Pharma-clinics. The drug of the month. Dipyridamole-acetylsalicylic acid combination (Aggrenox) // Rev. Med. Liege. — 2000. — 55(10). — 957-9.
- Halkes P., Gray L., Bath P. et al. Dipyridamole plus aspirin versus aspirin alone in secondary prevention after TIA or stroke: a meta-analysis by risk // J. Neurol. Neurosurg. Psychiat. — 2008. — 79. — 1218-23.
- 17th European Stroke Conference, Nice, France // Cerebrovascular Diseases. — 2008. — 25, Suppl. 2.
- Verro P., Gorelick P., Nguyen D. Aspirin plus dipyridamole versus aspirin for prevention of vascular events after stroke or TIA: a meta-analysis // Stroke. — 2008. — 39(4). — 1358-63.
- Thijs V., Lemmens R., Fieuws S. Network metaanalysis: simultaneous meta-analysis of common antiplatelet regimens after transient ischaemic attack or stroke // Eur. Heart J. — 2008. — 29. — 1086-92.
- Serebruany V., Malinin A., Ziai W. et al. Dipyridamole decreases protease-activated receptor and annexin-v binding on platelets of post stroke patients with aspirin nonresponsiveness // Cerebrovasc Dis. — 2006. — 21(1-2). — 98-105.
- Sacco R., Diener H.-C., Yusuf S. et al. Aspirin and Extended-Release Dipyridamole versus Clopidogrel for Recurrent Stroke // N. Engl. J. Med. — 2008. — 359. — 67-74.
- Serebruany V., Malinin A., Hanley D. Magnitude and time course of platelet inhibition with extended release dipyridamole with or without aspirin in healthy Japanese volunteers. The AGgrenox versus Aspirin Therapy Evaluation (AGATE-Japan // Thromb Haemost. — 2008.— 99(1). — 116-20.
- Schaefer W., Koch K., Nowak B. et al. Dipyridamole/aspirin combination in secondary stroke prevention: effects on absolute myocardial blood flow and coronary vascular resistance // Int. J. Clin. Pharmacol. Ther. — 2006. — 44(7). — 319-25.
- European Carotid Surgery Trialists’ (ECST) Collaborative Group. MRC European Carotid Surgery Trial: interim results for symptomatic patients with severe (70-99 %) or with mild (0-29 %) carotid stenosis // Lancet. — 1991. —337. — 1235-1243.
- Gerhard-Herman M., Gardin J., Jaff M., Mohler E., Roman M., Naqvi T. Guidelines for Noninvasive Vascular Laboratory Testing: A Report from the American Society of Echocardiography and the Society of Vascular Medicine and Biology // J. Am. Soc. Echocardiogr. — 2006. — 19. — 955-972.
- Thiele B.L., Jones A.M., Hobson et al. Standards in non-invasive cerebrovascular testing // J. Vasc. Surg. — 1992. — 15. — 495-503.
едпросвита» необходимый элемент для профессионального роста
[1] У обследованных пациентов клинически отмечались улучшение и стабилизация состояния, за период наблюдения ни у одного из них не было зарегистрировано повторных острых сосудистых эпизодов.




Комментировать