Результати клінічних випробувань ефективності антиоксидантної терапії у пацієнтів із критичними станами. Припущення щодо можливих причин негативних результатів цих досліджень та сформульовано можливі майбутні тенденції вивчення та впровадження антиоксидантної терапії у цій групі пацієнтів
Хижняк А.А., Ступницький М.А., Харківський національний медичний університет
Резюме У статті проаналізовано останні результати клінічних випробувань ефективності антиоксидантної терапії у пацієнтів із критичними станами. Висловлено припущення щодо можливих причин негативних результатів цих досліджень та сформульовано можливі майбутні тенденції вивчення та впровадження антиоксидантної терапії у цій групі пацієнтів
Вступ
Антиоксидантна терапія в медицині критичних станів (огляд літератури)
Хижняк А.А., Ступницький М.А., Харківський національний медичний університет
Резюме У статті проаналізовано останні результати клінічних випробувань ефективності антиоксидантної терапії у пацієнтів із критичними станами. Висловлено припущення щодо можливих причин негативних результатів цих досліджень та сформульовано можливі майбутні тенденції вивчення та впровадження антиоксидантної терапії у цій групі пацієнтів.
Вступ
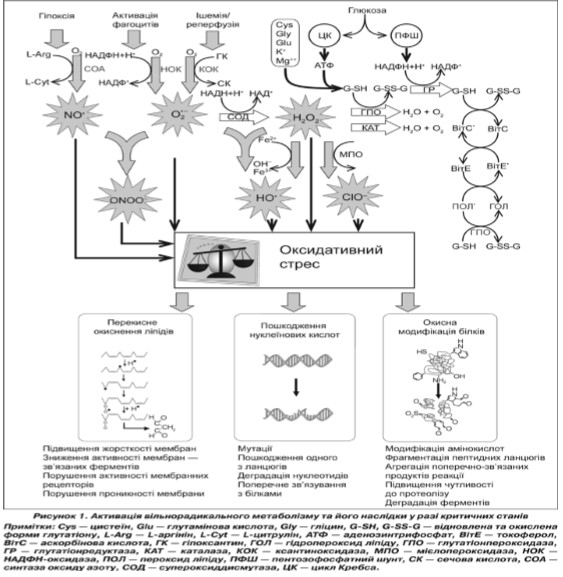
(рис. 1). У нормі за відсутності іонів металів змінної валентності супероксидні радикали перетворюються на пероксид водню (H2O2) супероксиддисмутазою (СОД). Клітиниагоцити використовують пероксид водню, перетворюючи його на гіпохлорит, що руйнує стінки бактеріальних клітин, за допомогою мієлопероксидази. Надлишок пероксиду водню вилучається під дією глутатіонпероксидази (ГП) або каталази (КАТ).
В умовах патології можуть відбуватися системні порушення активності захисних ферментних систем, що зв’язують іони заліза у плазмі крові (церулоплазмін і трансферин) і в клітинах (феритин). Масивні зростання швидкості генерації АФК та інших радикалів призводять до розвитку оксидативного стресу (ОС), спричинюючи пошкодження клітини та її смерть [5]. У цьому випадку O2•– та H2O2 вступають в альтернативні реакції, а саме — перетворення тривалентного заліза на двовалентне та утворення радикалів гідроксилу (HO•). Останні мають високу хімічну активність [6] і здатні викликати розрив ниток ДНК, володіючи мутагенним, канцерогенним або цитостатичним ефектом. Реагуючи з ненасиченими жирними кислотами, ініціюють ланцюгову реакцію їх пероксидації. У випадку атаки білків виникають модифікації окремих амінокислот, що призводить до зміни конформації білкової молекули. Такі білки втрачають свої функції та піддаються протеолітичним процесам, що призводить до утворення низькомолекулярних пептидів (молекул середньої маси) та вивільнення іонів металів з металопротеїдів. Більшість автооксидантних реакцій стимулюються невеликою кількістю металічних іонів змінної валентності.
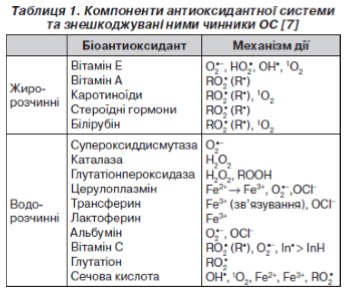
Антиоксидант — екзогенна (природна чи синтетична) або ендогенна сполука, що проявляє захисний вплив шляхом видалення вільного кисню (табл. 1), перехоплення АФК або їх попередників, інгібування формування АФК та зв’язування металічних іонів,необхідних для їх формування [7, 8].
Оксидативний стрес у патогенезі критичних станів
Під час критичного стану організму ОС може бути пов’язаний з активацією фагоцитів (нейтрофілів, моноцитів, макрофагів, еозинофілів), продукцією оксиду азоту (NO•) і вивільненням іонів заліза та міді, як і самих металопротеїнів [9]. Крім того, доведено, що активація ксантиноксидази є основним джерелом АФК після опікової травми [10]. Одразу ж після ішемії супероксид продукується протягом фази реперфузії ксантиоксидазою і швидко реагує з NO•, формуючи ONOO–. Більшість NO•, що виробляється макрофагами, також перетворюється на ONOO– [11]. Відомо, що продукція реактивних сполук, як, наприклад, O2•–, H2O2, і NO•, відбувається у точках розвитку запалення і сприяє пошкодженню тканин [12]. Підтверджено наявність тяжкого ОС у хворих із синдромом сиcтемної запальної відповіді (ССЗВ), зменшеними значеннями загальної антиоксидантної здатності (ЗАОЗ) плазми та її компонентів [13]; підвищеними рівнями активних продуктів тіобарбітурової кислоти (АПТБК), особливо у пацієнтів, у яких розвивався синдром поліорганної недостатності (ПОН) [14]; збільшеними рівнями малонового діальдегіду та 4- гідроксинонеалю [15]. Активація ксантиноксидази під час сепсису підтверджує відмову мікроциркуляторного контролю, що призводить до погіршення перфузії та ішемії. Galley et al. (1996) продемонстрували, що пацієнти з сепсисом, які загинули, мали нижчі рівні ксантиноксидази, збільшену продукцію вільних радикалів та вищі рівні лактату, ніж ті, які мали сепсис та вижили. У пацієнтів із найвищими рівнями ксантиноксидази спостерігались кращі результати виживання [16]. Досліджено, що у пацієнтів із розлитим гнійним перитонітом та деструктивним панкреатитом у першу чергу розвивається оксидативне пошкодження білкових молекул плазми крові, а тоді вже ліпідів. Крім того, ступінь вираженості ПОН корелює з рівнем оксидативного пошкодження білків [17]. Підвищені концентрації ізопростанів [18] і вираженість ПОЛ in vivo визначались у видихуваному конденсаті повітря хворих на гострий респіраторний дистрес—синдром/синдром гострого пошкодження легень (ГРДС/СГПЛ). У цій же групі хворих спостерігалось істотне зменшення α— токоферолу, аскорбінової кислоти, β—каротину і селену та підвищені рівні продуктів ПОЛ у плазмі крові [19].
Незважаючи на глибокі знання перебігу вільнорадикальних процесів, що лежать в основі патогенезу критичних станів, досі не існує однозначної думки щодо ефективності антиоксидантної терапії у складі лікувальних схем пацієнтів у критичних станах.
Антиоксиданти та ГРДС/СГПЛ
Дослідження підтвердили здатність парентерально введеного N-ацетилцистеїну (NAЦ) до збільшення рівня відновленого глутатіону в бронхоальвеолярній промивній рідині й в середині легеневих гранулоцитів [20]. Проте клінічні випробування ефективності мали двозначні результати. Jepsen et al. (1992) у проспективному випробуванні NAЦ у хворих із доведеним ГРДС були не в змозі довести будь—яку перевагу від терапії за співвідношенням PaO2/FiO2 та виживанням [21]. Domenighetti et al. (1997) також не змогли продемонструвати будь—які зміни результатів захворювання від терапії NAЦ у пацієнтів із доведеним ГРДС [22]. Проте Suter et al. (1994) у подібній групі пацієнтів продемонстрували покращення оксигенації та зменшення потреби апаратної дихальної підтримки в групі пацієнтів, які лікувалися NAЦ [23]. Bernard et al. (1997) у проспективному рандомізованому подвійному сліпому випробуванні NAЦ змогли показати зростання рівня відновленого глутатіону в еритроцитах та підтвердити активність ліків на основі істотного зменшення числа днів тривалості СГПЛ [24]. Не було жодної різниці за результатами виживання в будь—якому з цих досліджень, проте всі мали відносно малий об’єм вибірки. Потрібні подальші випробування для того, щоб визначити, чи пацієнти в більш ранній стадії захворювання або, краще, ті, які знаходяться в групі ризику розвитку ГРДС, отримають покращення від введення NAЦ.
В одному дослідженні було залучено додаткове ентеральне введення вітаміну E як доповнення до лікування ГРДС [25]. Рівні сироваткового α—токоферолу не зростали до рівня групи контролю. Проте неясно, чи це був наслідок надмірного використання вітаміну E, чи мальабсорбції за рахунок тяжкості захворювання.
Було оцінено ефективність перорального прийому вітамінів E і C та α—каротину у хворих на ГРДС [26]. Пацієнти, які отримували цю дієту, потребували меншої вентиляційної підтримки, мали більш короткий період перебування у відділеннях інтенсивної терапії (ВІТ) і мали меншу частоту виникнення органної дисфункції порівняно з контрольними хворими. Проте ця модифікована дієта також мала зміни вмісту ліпідів із зростанням ω-3 жирних кислот. Тому точно невідомо, чи переваги, отримані в цьому вивченні, є наслідком зростання антиоксидантної активності або ефекту зміненого метаболізму ліпідів клітин запалення.
Сепсис, ССЗВ
Досліджувалось додаткове введення селену хворим на ССЗВ у пацієнтів із його низькими сироватковими рівнями [27]. Автори продемонстрували більш низьку частоту ниркової недостатності, більш швидке усунення дисфункції органів і тенденцію до зменшення рівня летальності пацієнтів, які отримували селен. Необхідні подальші вивчення, щоб повністю висвітлити механізми переваг і клінічної користі цього підходу лікування.
Результати введення СОД у моделях сепсису у тварин були варіабельні. Загалом СОД ефективна, коли вводиться перед початком розвитку сепсису, але встановлено, що в разі введення після сепсису можливий і шкідливий її вплив [28, 29].
У плацебо—контрольованому клінічному випробуванні внутрішньовенного введення «коктейлю антиоксидантів» (NАЦ, селен, вітамін С) оцінили ефект у хворих на тяжкий гострий панкреатит [30]. Автори зазначають, що незважаючи на підвищення відносних значень антиоксидантів у сироватці крові та зниження маркерів ОС, не спостерігалось статистично вірогідної різниці частоти розвитку дисфункції органів на 7-й день терапії. Смертьвиникала у пацієнтів із більш тяжким захворюванням. Необхідні подальші дослідження з рандомізацією пацієнтів відповідно до факторів ризику розвитку ускладнень.
Peake et al. (1996) продемонстрували істотну депресію серцево—судинних порушень після 24 год введення NAЦ пацієнтам із септичним шоком [31]. Інші дослідження продемонстрували, що введення NAЦ покращує дихальну функцію та скорочує перебування у ВІТ без істотних гемодинамічних ефектів [32] і, що цікаво, зменшує продукцію IL-8 (важливого медіатора септичного пошкодження легень) [33], сприяючи поповненню пулу та активації нейтрофілів [34]. Введення високих доз NAЦ знижує пероксидативний стрес і покращує клінічні результати у пацієнтів із септичним шоком [35]. Внутрішньовенна інфузія NAЦ збільшувала печінковий кровотік і покращувала функцію печінки через 24 год після початку розвитку септичного шоку [36]. Hein et al. (2004) повідомили, що введення NAЦ зменшує продукцію молочної кислоти печінки, збільшує її перфузію і покращує її функцію у хворих із септичним шоком [37]. Високі дози NАЦ підвищують фагоцитарну активність зі зменшеною оксидативною діяльністю нейтрофілів у пацієнтів із ССЗВ/сепсис [38].
Тривала інфузія селену у вигляді натрію селеніту (4000 мкг у 1-й день, 1000 мкг/день у наступні 9 днів) не проявила жодних токсичних властивостей, але й не покращувала клінічних результатів у пацієнтів із септичним шоком [39].
В одному клінічному випробуванні досліджувався підхід використання «коктейлю антиоксидантів» у пацієнтів із сепсисом. Galley et al. (1997) вводили комбінацію NAЦ, вітаміну C та α— токоферолу хворим на септичний шок [40]. Автори продемонстрували швидкоплинну позитивну відповідь гемодинаміки, але не отримали ефекту щодо виживання пацієнтів.
Шок
Застосування церулоплазміну (ЦП) у хворих із явищами травматичного, геморагічного або інфекційно—токсичного шоку призводило до швидкого збільшення активності ЦП плазми в першу ж добу після початку лікування. Зменшувався вміст малонового діальдегіду. Серед клінічних ефектів відмічалось зниження частоти легеневих ускладнень, проте автори не наводять результатів виживання пацієнтів [41].
Ад’ювантне введення високих доз аскорбінової кислоти (66 мг/кг маси тіла на годину) протягом перших 24 годин після опікової травми значно знижує потрібний об’єм інфузійної рідини, навколорановий набряк та редукує респіраторну дисфункцію [42].
Tossios et al. (2003) у рандомізованому подвійному сліпому плацебоrонтрольованому клінічному дослідженні виявили, що введення 100 мг/кг NАЦ із наступною інфузією 20 мг/кг/год значнознижує концентрацію 8-ізопростагландину-F2α та нітротирозину у біоптатах міокарда лівого шлуночка пацієнтів, яким проводилась кардіоплегія зі штучним кровообігом із приводу кардіохірургічного втручання [43].
40 пацієнтів кардіохірургічного профілю, яким проводилась коронарна ангіопластика та хірургічна корекція клапанного апарату серця, були включені у плацебо—контрольоване випробування емульсії all-rac-α—токоферил ацетату (синтетична форма α—ізомеру токоферолу) [44]. Інфузія препарату спричинювала нормалізацію концентрації вітаміну Е в плазмі під час та після хірургічного втручання, але не спостерігалось впливу на феномен раннього підвищення малонового діальдегіду, зниження ЗАОЗ плазми та вітаміну С. Біохімічні маркери пошкодження міокарда та показники клінічного видужання пацієнтів не змінювались після проведеного кардіохірургічного втручання.
Алопуринол у дослідженнях на людях у разі передопераційного введення пацієнтам, які потребували коронарного шунтування, довів свої вигідні ефекти у вигляді пом’якшення кардіальної ішемії та реперфузійного пошкодження [45]. У рандомізованому випробуванні алопуринол істотно знижував ранню післяопераційну летальність після коронарного шунтування й покращував серцеву роботу [46]. В іншому дослідженні алопуринол знижував частоту аритмій, потребу в інотропних засобах та імовірність періопераційного інфаркту міокарда [47]. У подібній групі пацієнтів препарат знижував ферментативну активність ксантиноксидази, проте не мав жодного впливу на рівень молочної кислоти, пірувату, креатинкінази та її МB- фракції. [48]. Також було виявлено, що алопуринол знижує рівень процесів ПОЛ у разі шунтування коронарних артерій [49] і покращує відновлення серцевого викиду та ударну роботу лівого шлуночка з одночасним зниженням концентрації сечової кислоти в плазмі крові [50].
Проте в подвійному сліпому рандомізованому дослідженні терапії ішемічної хвороби серця (140 хворих) алопуринол збільшував частоту поширення інфаркту міокарда, це свідчить, що він фактично може бути протипоказаний хворим на ішемічну хворобу серця [51].
Церебральна ішемія
Відомо, що збільшення споживання з їжею вітамінів—антиоксидантів призводить до зменшення ризику інсульту [52]. Проте два рандомізованих випробування показали, що доповнення β— каротину до терапії [53] та споживання інших вітамінів—антиоксидантів [54] не були пов’язані зі зменшенням ризику інсульту.
Терапевтичний досвід використання алопуринолу в терапії церебральної ішемії обмежений вивченням, проведеним на 22 немовлятах із тяжкою асфіксією [55]. Спостерігалась тенденція до покращення показників виживання, інгібування продукції вільних радикалів, покращення кровопостачання головного мозку та його електричної активності.
Передішемічне введення рекомбінантної людської СОД пом’якшує ішемічне пошкодження, індуковане в полівок двосторонньою закупоркою сонної артерії на 5 хвилин [56]. У багатоцентровому випробуванні терапія поліетиленгліколькон’югованою СОД (пегорготеїн) була не в змозі покращити результати видужання хворих із тяжкою черепно—мозковою травмою у разі введення в межах 8 годин після пошкодження [57]. Це відносно довге терапевтичне вікно може пояснити негативні результати.
Основні обмеження щодо застосування ферментативних антиоксидантів: їх великий розмір, що обмежує клітинну проникність, короткий період напівжиття, антигенність і висока вартість. Низькомолекулярні імітатори ендогенних ферментів були розроблені для подолання деяких із цих обмежень.
Ебселен (2-феніл-1,2-бензизоселеназол— 3(2Н)-он) — низькомолекулярна селенорганічна сполука, що знешкоджує H2O2 глутатіонпероксидазоподібною активністю та інгібує процеси ПОЛ [58]. На основі багатообіцяючих фактів нейропротекторної ролі ебселену, отриманих на тваринних моделях, у 300 хворих на гострий ішемічний інсульт проведено дослідження ефективності лікування в межах 48 год після атаки інсульту. Через 1 місяць спостерігались позитивні результати [59]. Покращення продовжувалося 3 місяці, але дослідження провалилося, не досягнувши статистичної значимості. Ogawa et al. (1999) провели рандомiзоване випробування ебселену на 99 хворих із повною оклюзією середньої мозкової артерії [60]. Спостерігалось істотне зниження об’єму мозкового інфаркту і поліпшення результатів видужання хворих, які починали лікування в межах 6 год після ішемічної атаки. Зараз препарат знаходиться на 3- й фазі клінічних випробувань терапії інсульту.
Розробляються серії з 21-аміностероїдів з антиоксидантною активністю (лазароїди). Один із них — U74006F (мезилат тирилазаду). Після демонстрації своєї церебропротективної ефективності на тваринних моделях [61, 62] тирилазад був клінічно оцінений при гострих неврологічних порушеннях у людей. У двох дуже подібних багатоцентрових випробуваннях у разі субарахноїдального крововиливу (САК) були повідомлені суперечливі результати. Flaishaker et al. (1995) показали зменшення летальності хворих і покращення неврологічних результатів на третій місяць [63]. Проте Haley et al. (1997) не знайшли жодних відмінностей між тирилазаду і групами плацебо [64]. Два великих багатоцентрових дослідження тирилазаду в разі черепно—мозкової травми помірного й тяжкого ступеня також були не в змозі показати будь—які чіткі відмінності результатів виживання між лікованими пацієнтами та групою плацебо [65, 66]. Ці суперечливі результати можуть пояснюватися особливостями відмінностей госпіталізації хворих, стандартів догляду або використання ліків, що зменшують біоефективність тирилазаду.
Змішані групи пацієнтів відділень інтенсивної терапії
Випробування NAЦ для інших популяцій хворих у критичних станах також мають змішані результати. Не спостерігалось переваг у результатах захворювання пацієнтів відділень інтенсивної терапії. Preiser et al. (2000) провели дослідження на 51 пацієнті, у якому довели, що ентеральне введення суміші вітамінів—антиоксидантів (А, С, Е) підвищує концентрацію цих вітамінів у крові, нормалізує вміст ліпопротеїнів низької щільності та стійкість до оксидативних процесів, проте не покращує клінічних результатів [67]. Випробування інфузії NAЦ не виявило покращення загального антиоксидантного потенціалу та будь—якої істотної різниці кінцевих клінічних результатів, як, наприклад, тривалість інотропної підтримки, механічної вентиляції легень та кількість днів, проведених у ВІТ [68]. Проте друге дослідження виявило переваги від застосування суміші вітамінів С та Е у такій групі пацієнтів. Nathens et al. (2002) продемонстрували, що під впливом внутрішньовенного та ентерального введення вищезгаданих вітамінів пацієнтам хірургічного профілю знижується рівень маніфестації синдрому ПОН та тривалість перебування у ВІТ [69]. Crimi et al. (2004) на основі результатів плацебо—контрольованого дослідження показали, що ентеральне введення суміші вітамінів С та Е знижує рівень ізопростанів та АПТБК у крові, а також покращує показники 28-денного виживання пацієнтів із різною патологією, що потребували перебування у ВІТ [70].
Патофізіологічні основи невдачі деяких клінічних випробувань антиоксидантів
ОС може являти собою загальний шлях для життєво небезпечних критичних захворювань, збільшуючи ймовірність розвитку синдрому ПОН та смерті [71]. Хоча додаткове введення антиоксидантів має бути логічною відповіддю на зменшені рівні антиоксидантів, користь цієї терапії не була дoсі чітко продемонстрована.
Оксидативно—антиоксидантний дисбаланс уражає різні метаболічні шляхи, і немає «ідеальних» ліків, здатних впливати на всі з них. Теоретично комбінація антиоксидантів із різними властивостями могла би бути кращим вибором, ніж монотерапія. Крім того, критичні захворювання, як, наприклад, сепсис і ГРОС, індукуються не тільки вільними радикалами, а демонструють комплексну патофізіологію з багатьма заплутаними запальними й незапальними метаболічними шляхами. Було б наївно думати про терапію цих захворювань тільки антиоксидантами.
Слід також пам’ятати, що оксидативні пошкодження часто відбуваються без істотного ПОЛ, і,таким чином, інгібітори пероксидації ліпідів можуть бути (а часто так і є) терапевтично неефективними навіть в умовах, коли вільні радикали відіграють важливу роль в індукції пошкодження тканин [17]. Деякі антиоксиданти, що розривають ланцюгові реакції, здатні до відновлення Fe3+ до Fe2+ і можуть поглиблювати залізозалежні радикальні реакції, у тому числі неліпідні. Наприклад, флавоноїди— могутні інгібітори ПОЛ, можуть посилювати залізозалежне іоннорадикальне пошкодження, призводячи до пошкодження вуглеводів та ДНК [72].
Інша важлива проблема — правильна доза. Немає жодних остаточних директив ні для внутрішньовенного, ні для ентерального введення антиоксидантів і, що найважливіше, жодні фармакокінетичні дослідження не були проведені у критично хворих пацієнтів. Наприклад: тоді як болюсне введення NAЦ із короткою безперервною інфузією низьких доз покращує оксигенацію і гемодинамічні показники, тривала безперервна інфузія високих доз індукує кардіодепресію і підвищує летальність. Таким чином, лікування дуже високими дозами антиоксидантів потрібно застосовувати обережно через ризик токсичності і, особливо, у разі ентерального введення [73].
Окрім того, не проводились дослідження ефективності антиоксидантів залежно від рівня доставки кисню та порушення кисневого гомеостазу, адже логічно припустити, що рівень напруження кисню, а точніше його різкі зміни (що відбуваються в разі ішемії/реперфузії) визначають активність оксидативних процесів.
Час початку терапії — важливе питання, оскільки антиоксиданти не мають переваг у разі необоротного пошкодження тканини [26]. Тоді як терапія антиоксидантами у разі встановленого остаточного діагнозу не показувала жодної клінічної різниці [21, 22], комбінація раннього введення високих доз мала очевидні позитивні результати [74]. В ідеальному випадку найкращий вибір — профілактичне введення антиоксидантів, але це не завжди можливо.
Несумісні результати ефективності антиоксидантів можуть пояснюватися фактом, що вітаміни C та E можуть окиснюватися з формуванням аскорбілового радикалу й радикалу α—токоферолу, що можуть діяти як отруйні прооксиданти та потребують відновлення [1, 2, 6, 7]. Це вимагає енергетичних та пластичних затрат, а отже — відповідного рівня глюкози та інших ключових нутрієнтів у крові. Продукція АТФ, що підтримує систему глутатіону, вимагає вітамінів групи В, магнію, ліпоєвої кислоти, коензиму Q10 та ацетил-L-карнітину, що можуть бути важливими препаратами вибору. Вітамін D впливає на активність пентозофосфатного шунта, і таким чином, може проявляти антиоксидантний ефект, стимулюючи продукцію НАДФН + Н+ [75]. Таким чином, харчування з відповідною кількістю калорій — основний шлях зниження продукції вільних радикалів.
Висновки та майбутні напрямки досліджень
Багато очевидних фактів свідчать, що ОС важливий або в первинних, або у вторинних патофізіологічних механізмах, що лежать в основі патофізіології розвитку критичних станів. Антиоксиданти різної хімічної будови були досліджені як терапевтичні агенти. Хоча деякі з антиоксидантів показали ефективність у тваринних моделях, більшість їх не показала корисного ефекту в клінічних випробуваннях, що виконувались до сьогодні. Таким чином, пошук, відкриття і розробка нових могутніх антиоксидантних агентів із заданими властивостями — багатообіцяючий підхід для терапії в медицині критичних станів.
Литература
Gutteridge J.M., Mitchell J. Redox imbalance in the critically ill // Br. Med. Bull. — 1999.— V. 55. — P. 49-75.
Frei B. Reactive oxygen species and antioxidant vitamins: mechanisms of action // Am. J. Med. — 1994. — V. 97. — P. 5-23.
Nathan C. Specificity of a third kind: reactive oxygen and nitrogen intermediates in cell signaling // J. Clin. Invest. — 2003. — V. 111. — P. 769-778.
Macdonald J., Galley H.F., Webster N.R. Oxidative stress and gene expression in sepsis // Br. J. Anaesth. — 2003. — V. 90. — P. 221-232.
Marnett L.J., Riggins J.N., West J.D. Endogenous generation of reactive oxidants and electrophiles and their reactions with DNA and protein// J. Clin. Invest. — 2003. — V. 111. — P. 583-593.
Владимиров Ю.А. Свободные радикалы в биологических системах // Соросовский Образовательный Журнал. — 2000. — Т. 6, № 12. — С. 13-19.
Halliwell B. Free radical, antioxidants, and human disease: curiosity, cause, or consequence? // Lancet. — 1994. — V. 344. — P. 721-724.
GilgunSherki Y., Rosenbaum Z., MelamedE. et al. Antioxidant Therapy in Acute Central Nervous System Injury: Current State // Pharmacol. Rev. — 2002. — V. 54. — P. 271-284.
Oldham K.M., Bowen E.P. Oxidative stress in critical care: is antioxidant supplementation beneficial? // J. Am. Diet. Assoc. — 1998. — V. 98. — P. 1001-1008.
Horton J.W. Free radicals and lipid peroxidation mediated injury in burn trauma: the role of antioxidant therapy // Toxicology. — 2003. — V. 189. — P. 75-88.
Ischiropoulos H., Zhu L., Chen J. et al. Peroxynitritemediated tyrosine nitration catalyzed by superoxide dismutase // Arch. Biochem. Biophys. — 1992. — V. 298. — P. 431.
Сuzzocrea S., Zingarelli B., Costantino G. et al. Beneficial effects of 3-aminobenzamide, an inhibitor of poly(ADP-ribose) synthetase in a rat model of splanchnic artery occlusion and reperfusion // Br. J. Pharmacol. — 1997. — V. 121. — P. 1065-1074.
Alonso de Vega J.M., Diaz J., Serrano E. et al. Oxidative stress in critically ill patients with systemic inflammatory response syndrome // Crit. Care Med. — 2002. — V. 30. — P. 1782-1786.
Motoyama T., Okamoto K., Kukita I. et al. Possible role of increased oxidant stress in multiple organ failure after systemic inflammatory response syndrome // Crit. Care Med. — 2003. — V. 31. — P. 1048-1052.
Ogilvie A.C., Groeneveld A.B., Straub J.P. et al. Plasma lipid peroxides and antioxidants in human septic shock // Intens. Care Med. — 1991. — V. 17. — P. 40-44.
Galley H.F., Davies M.J., Webster N.R. Xanthine oxidase activity and free radical generation in patients with sepsis syndrome // Crit. Care Med. — 1996. — V. 24. — P. 1649-1653.
Пасечник И.Н. Окислительный стресс и критические состояния у хирургических больных // Вестник интенсивной терапии. — 2004. — № 3. — С. 27-31.
Carpenter C.T., Price P.V., ChristmanB.W. Exhaled breath condensate isoprostanes are elevated in patients with acute lung injury or ARDS // Chest. — 1998. — V. 114. — P. 1653-1659.
Metnitz P.G., Bartens C., Fischer M. et al. Antioxidant status in patients with acute respiratory distress syndrome // Intens. Care Med. — 1999. — V. 25. — P. 180-518.
Ortolani O., Conti A., De Gaudio A.R. et al. Protective effects of N-acetylcysteine and rutin on the lipid peroxidation of the lung epithelium during the adult respiratory distress syndrome // Shock. — 2000.— V. 13. — P. 14-18.
Jepsen S., Herlevsen P., Knudsen P. et al. Antioxidant treatment with N-acetylcysteine during adult respiratory distress syndrome. a prospective, randomized, placebo-controlled study // Crit. Care Med. — 1992. — V. 20. — P. 918-923.
Domenighetti G., Suter P.M., SchallerM.D. et al. Treatment with N-acetylcysteine during acute respiratory distress syndrome: a randomized, doubleblind, placebo-controlled clinical study // J. Crit. Care. — 1997. — V. 12. — P. 177-182.
Suter P.M., Domenighetti G., SchallerM.D. et al. Nacetylcysteine enhances recovery from acute lung injury in man: a randomized, double-blind, placebo-controlled clinical study // Chest. — 1994. — V. 105. — P. 190-194.
Bernard G.R., Wheeler A.P., Arons M.M. et al. A trial of antioxidants N-acetylcysteine andprocysteine in ARDS: the Antioxidant in ARDS Study Group // Chest. — 1997. — V. 112. — P. 164-172.
Seeger W., Ziegler A., Wolf H. Serum alpha-tocopherol levels after high-dose enteral vitamin E administration in patients with acute respiratory failure // Intens. Care Med. — 1987. — V. 13. — P. 395-400.
Gadek J., DeMichele S.J., Karlstad M.D. et al. Effect of enteral feeding with eicosapentaenoic acid, gamma-linolenic acid, and antioxidants in patients with acute respiratory distress syndrome: Enteral Nutrition in ARDS Study Group // Crit. Care Med. — 1999. — V. 27. — P. 1409-1420.
Angstwurm M.W., Schottdorf J., SchopohlJ. et al. Selenium replacement in patients with severe systemic inflammatory response syndrome improves clinical outcome // Crit. Care Med. — 1999. — 27. — P. 1807-1813.
Hoffman H., Siebeck M., Welter H.F. et al. High dose superoxide dismutase potentiates respiratory failure in septicemia // Am. Rev. Respir. Dis. — 1987. — V. 135. — P. 78.
Traber D.L., Adams T.Jr., Sziebert L. et al. Potentiation of lung vascular response to endotoxin by superoxide dismutase // J. Appl. Physiol. — 1985. — V. 58. — P. 1005-1009.
Siriwardena A.K., Mason J.M., Balachandra S. et al. Randomized, double-blind, placebo-controlled trial of Intravenous (N- acetylcysteine, selenium, vitamin c) Antioxidant therapy in severe acute pancreatitis // Gut. — 2006.— V. 1. — P. 115873-115885.
Peake S.L., Moran J.L., Leppard P.I. N- Acetyl-L-cysteine depresses cardiac performance in patients with septic shock // Crit. Care Med. — 1996.— V. 24. — P. 1302-1310.
Spapen H., Zhang H., Demanet C. et al. Does N-acetyl-L-cysteine influence cytokine response during early human septic shock? // Chest. — 1998.— V. 113. — P. 1616-1624.
Endo S., Inada K., Ceska M. et al. Plasma interleukin-8 and polymorphonuclear leukocyte elastase concentrations in patients with septic shock // J. Inflammation. — 1995. — V. 45. — P. 136-142.
Hack C.E., Hart M., van Schijndel R.J. et al. Interleukin-8 in sepsis: relation to shock and inflammatory mediators // Infect. Immun. — 1992. — V. 60. — P. 2835-2842.
Ortolani O., Cont A., Gaudio De A.R. et al. The effect of glutathione and N-acetylcysteine on lipoperoxidative damage in patients with early septic shock // Am. J. Respir. Crit. Care Med. — 2000. — V. 161. — P. 1907-1911.
Rank N., Michel C., Haertel C. et al. N- acetylcysteine increases liver blood flow and improves liver function in septic shock patients: results of aprospective, randomized, double-blind study // Crit. Care Med. — 2000. — V. 28. — P. 3799-3807.
Hein O.V., Ohring R., Schilling A. et al. N- acetylcysteine decreases lactate signal intensities in liver tissue and improves liver function in septic shock patients, as shown by magnetic resonance spectroscopy: extended case report // Crit. Care. — 2004. — V. 8. — R66-R71.
Heller A.R., Groth G., Heller S.C. et al. N- acetylcysteine reduces respiratory burst but augments neutrophil phagocytosis in intensive care unit patients// Crit. Care Med. — 2001. — V. 29. — P. 272-276.
Forceville X., Laviolle B., Annane D. et al. Effects of high doses of selenium, as sodium selenite, in septic shock: a placebo-controlled, randomized, double-blind, phase II study // Crit. Care. — 2007. — V. 11. — R73.
Galley H.F., Howdle P.D., Walker B.E. et al. The effects of intravenous antioxidants in patients with septic shock // Free Radic. Biol. Med. — 1997. — V. 23. — P. 768-774.
Альседерова А.Ш. Иммунопротектив- ный эффект церулоплазмина в остром периоде у больных, перенесших критические состояния раз- личного генеза // Анестезиол. и реаниматол. — 1992. — № 2. — C. 43-45.
Tanaka H., Matsuda T., Miyagantani Y. et al. Reduction of Resuscitation Fluid Volumes in Severely Burned Patients Using Ascorbic Acid Administration A Randomized, Prospective Study // Arch. Surg. — 2000. — V. 135. — P. 326-331.
Tossios P., Bloch W., Huebner A. et al. N acetylcysteine prevents reactive oxygen species — mediated myocardial stress in patients undergoing cardiac surgery: Results of a randomized, doubleblind, placebocontrolled clinical trial // J. Thorac. Cardiovasc. Surg. — 2003. — V. 126. — P. 1513- 1520.
Lassnigg A., Punz A., Barker R. et al. Influence of intravenous vitamin E supplementation in cardiac surgery on oxidative stress: a doubleblinded, randomized, controlled study // Br. J. Anaesth. — 2003. — V. 90. — P. 148-154.
Movahed A., Nair K.G., Ashavaid T.F. et al. Free radical generation and the role of allopurinol as a cardioprotective agent during coronary artery bypass grafting surgery // Can. J. Cardiol. — 1996. — V. 12. — P. 138-144.
Johnson W.D., Kayser K.L., BrenowitzJ.B. et al. A randomized controlled trial of allopurinol in coronary bypass surgery // Am. Heart. J. — 1991.— V. 121. — P. 20-24.
Rashid M.A., William-Olsson G. Influence of allopurinol on cardiac complications in open heart operations // Ann. Thorac. Surg. — 1991. — V. 52. — P. 127-130.
Yamazaki I., Soma T., Ichikawa Y. et al. Usefulness of allopurinol for prevention of myocardial reperfusion injury in open heart surgery // Nippon Kyobu Geka Gakkai Zasshi. — 1995. — V. 43. — P. 26-31.
Coghlan J.G., Flitter W.D., Clutton S.M. et al. Allopurinol pretreatment improves postoperative recovery and reduces lipid peroxidation in patients undergoing coronary artery bypass grafting // J. Thorac. Cardiovasc. Surg. — 1994. — V107. — P. 248-256.
Castelli P., Condemi A.M., BrambillascaC. et al. Improvement of cardiac function by allopurinol in patients undergoing cardiac surgery // J. Cardiovasc. Pharmacol. — 1995. — V. 125. — P. 119-125.
Parmley L.F., Mufti A.G., Downey J.M. Allopurinol therapy of ischemic heart disease with infarct extension // Can. J. Cardiol. — 1992. — V. 8.— P. 280-286.
Daviglus M.L., Orencia A.J., Dyer A.R. et al. Dietary vitamin C, beta-carotene and 30-year risk of stroke: results from the western electric study // Neuroepidemiology. — 1997. — V. 16. — P. 69-77.
Hennekens C.H., Buring J.E., MansonJ.E. et al. Lack of effect of long-term supplementation with beta-carotene on the incidence of malignant neoplasms and cardiovascular disease // N. Engl. J. Med. — 1996. — V. 334. — P. 1145-1155.
Blot W.J., Li J., Taylor P. et al. Nutrition intervention trials in Linxian China: supplementation with specific vitamin/mineral combination, cancer incidence, and diseasespecific mortality in the general population // J. Natl. Cancer Inst. — 1993. — V. 85. — P. 1483-1493.
Van Bel F., Shadid M., Moison R.M. et al. Effect of allopurinol on postasphyxial free radical formation, cerebral hemodynamics and electrical brain activity // Pediatrics. — 1998. — V. 101. — P. 185- 193.
Tagaya M., Mastsumoto M., Kitagawa K. et al. Recombinant human superoxide dismutase can attenuate ischemic neuronal damage in gerbils // Life Sci. — 1992. — V. 51. — P. 253-259.
Young B., Runge J.W., Waxman K.S. et al. Effects of pegorgotein on neurologic outcome of patients with severe head injury: a multicenter, randomized controlled trial // JAMA. — 1996. — V. 276. — P. 538-543.
Muller A., Cadenas R., Graf P. et al. A novel biologically active selenoorganic compound. I. Glutathione peroxidase activity in vitro and antioxidant capacity of PZ5 1 (Ebselen) // Biocliem. Pharmacol. — 1984. — V. 33. — P. 3235-3240.
Yamaguchi T., Sano K., Takakura K. et al. Ebselen in acute ischemic stroke: a placebocontrolled double-blind clinical trial. Ebselen study group // Stroke. — 1998. — V. 29. — P. 12-17.
Ogawa A., Yoshimoto T., Kikuchi H. et al. Ebselen in acute middle cerebral artery occlusion: a placebocontrolled doubleblind clinical trial // Cerebrovas. Dis. — 1999. — V. 9. — P. 112-118.
Perkins W.J., Milde L.N., Milde J.H. et al. Pretreatment with U74006F improves neurologic outcome following complete cerebral ischemia in dogs// Stroke. — 1991. — V. 22. — P. 902-909.
Hall E.D., Pazara K.E., Braughler J.M. et al. Non-steroidal lazaroid U78517F in models of focal and global ischemia // Stroke. — 1990. — V. 21 (Suppl. III). — P. 83-87.
Fleishaker J.C., Hulst-Pearson L.K., Peters G.R. Effect of gender and menopausal status on the pharmacokinetics of tirilazad mesylate in healthy subjects // Am. J. Ther. — 1995. — V. 2. — P. 553-560.
Haley E.C. Jr, Kassel N.F., Apperson- Hansen C. et al. A randomized, double blind, vehicle- controlled trial of tirilazad mesylate in patients with aneurysmal subarachnoid hemorrhage: a cooperative study in North America // J. Neurosurg. — 1997. — V. 86. — P. 467-474.
Maas A.I., Steyerberg E.W., Murray G.D. et al. Why have recent trials of neuroprotective agents in head injury failed to show convincing efficacy. A pragmatic analysis and theoretical considerations // Neurosurgery. — 1999. — V. 44. — P. 1286-1298.
Marshall L.F., Maas A.I., Marshall S.B. et al. A multicentral on the efficacy of using tirilazad mesylate in cases of head injury // J. Neurosurg. — 1998. — V. 89. — P. 519-525.
Preiser J.C., Van Gossum A., Berre J. et al. Enteral feeding with a solution enriched with antioxidant vitamins A, C and E enhances the resistance to oxidative stress // Crit. Care Med. — 2000. — V. 28. — P. 3828-3832.
Molnar Z., MacKinnon K.L., Shearer E. et al. The effect of N-acetylcysteine on total serum antioxidant potential and urinary albumin excretion in critically ill patients // Intens. Care Med. — 1998. — V. 24. — P. 230-235.
Nathens A.B., Neff M.J., Jurkovich G.J. et al. Randomized, prospective trial of antioxidant supplementation in critically ill surgical patients // Ann. Surg. — 2002. — V. 236. — P. 814-822.
Crimi E., Liguori A., Condorelli M. et al. Beneficial effects of antioxidant supplementation in enteral feeding in critically ill patients: a prospective, randomized, double-blind, placebo-controlled trial // Anesth. Analg. — 2004. — V. 99. — P. 857-863.
Knaus W.A., Draper E.A., Wagner D.P. et al. Prognosis in acute organsystem failure // Ann. Surg. — 1985. — V. 202. — P. 685-693.
Laughton M.J., Halliwell B., Evans P.J. et al. Antioxidant and prooxidant actions of the plant phenolics quercetin, gossypol and myricetin. Effects on lipid peroxidation, hydroxyl radical generation and bleomycindependent damage to DNA // Biochem. Pharrnacol. — 1989. — V. 38. — P. 2859-2865.
Jackson N.C., Carroll P.V., Russell-JonesD.L. et al. Umpleby A.M. The metabolic consequences of critical illness: acute effect on glutamine and protein metabolism // Am. J. Physiol. — 1999. — V. 276. — E163-E170.
Nathens A.B., Neff M.J., Jurkovich G.J. et al. Randomized, prospective trial of antioxidant supplementation in critically ill surgical patients // Ann. Surg. — 2002. — V. 236. — P. 814-822.
Bao B.Y., Ting H.J., Hsu J.W. et al. Protective role of 1-alpha, 25-dihydroxyvitamin D3 against oxidative stress in nonmalignant human prostate epithelial cells // Int. J. Cancer. — 2008. — V. 122 (12). — P. 2699-2706.
.









Комментировать