Антифосфолипидный синдром: общие тенденции. Этиология, патогенез, клиническая картина, диагностика и лечение.
Т.С. Оспанова, д—р мед. наук, Т.Ю. Химич, канд. мед. наук, Т.В. Бездетко, д—р мед. наук, Харьковский национальный медицинский университет
Еще в 50-х годах прошлого столетия была выявлена группа антител, вырабатываемых против определенных фосфолипидов. Впервые их обнаружили C.L. Conley и R.C. Harman [16] у больных с системной красной волчанкой (СКВ), у которых наблюдали также удлинение времени свертывания крови при активации тромбопластина (активированное тромбопластиновое время), однако без геморрагических осложнений.
В дальнейшем, напротив, была выявлена весьма тесная ассоциация антифосфолипидных антител (АФЛА) с артериальными и венозными тромбозами [5, 11, 15], в связи с чем АФЛА были названы волчаночным антикоагулянтом [11, 23, 24]. В 80-х годах прошлого столетия по мере усовершенствования теста для определения антикардиолипиновых антител (АКЛА) было установлено, что симптомокомплекс, сопровождающий развитие (или возникающий с появлением) АФЛА, выявляют не только при СКВ. Их нередко обнаруживают при других аутоиммунных заболеваниях, после вирусых инфекций, на фоне декомпенсированного хронического тонзил лита, у больных со спонтанным приобретенным иммунодефицитом (СПИД), а также в связи с приемом некоторых лекарственных средств (хлорпромазина, прокаинамида, дилантина, квинидина, гормонсодержащих препаратов) [11, 24, 26]. Перечень патологических состояний, при которых выявляют АФЛА, с течением времени увеличился, что способствовало формированию представлений о своеобразном в патогенетическом отношении первичном антифосфолипидном синдроме (АФС), основой которого является развитие аутоиммунной реакции c фосфолипидными детерминантами на мембранах тромбоцитов, клеток эндотелия сосудов, а также клеток нервной системы с теми или иными клиническими проявлениями. Развитие последних предопределяет гено- и фенотипическая предрасположенность (наличие locus minoris resistaencia). При выборочных скрининговых исследованиях донорской крови обнаружено, что примерно в 8% случаев она содержит АФЛА в низких титрах [5, 6, 8, 20, 27, 36]. В основном это кровь женщин молодого возраста, что, возможно, связано с приемом ими гормональных контрацептивов [3, 14, 25, 31].
АФЛА — это гетерогенная популяция анти тел, реагирующих с отрицательно заряженными, реже — нейтральными фосфолипидами.
К АФЛА относят следующие разновидности антител:
- волчаночный антикоагулянт — популяция АФЛА класса IgG или IgM, способных in vitro подавлять фосфолипидзависимые коагуляционные реакции путем взаимодействия с фосфолипидным компонентом протромбиназы активаторного комплекса. Волчаночный антикоагулянт был обнаружен сначала в сыворотке крови больных с СКВ. При СКВ продукция волчаночного антикоагулянта ассоциируется, в отличие от результатов in vitro, не с кровоточивостью, а с парадоксальным повышением частоты тромбозов;
антитела к кардиолипину — иммунологически гетерогенная популяция антител, реагирующих с илиимзмоованным отрицательно заряженным фосфолипидом — кардиолипином, являющимся основным антигеном реакции Вассермана; антитела к кардиолипину могут относиться к различным изотипам иммуноглобулинов (IgG, IgM и IgA);
антитела, реагирующие со смесью кардиолипина, холестерола (ХС) и фосфатидилхолина, определяемые с помощью реакции агглютинации (ложноположительная реакция Вассермана);
бета2-гликопротеин-1-кофакторзависимые АФЛА (бета2-ГП1-кофакторзависимые АФЛА)— подавляющие естественную антикоагулянтную активность бета2-ГП1. При АФС взаимодействие АФЛА с фосфолипидами зависит от кофактора бета2-ГП1. Он имеет молекулярную массу 50 000 000 ЕД и активно связывается с фосфолипидами, дезоксирибонуклеиновой кислотой (ДНК), компонентами мембран тромбоцитов и митохондрий, гепарином. Бета2-ГП1 является важным естественным антикоагулянтом, подавляет внутреннюю активацию антикоагуляционного каскада и агрегацию тромбоцитов. Подавление бета2-ГП1- кофакторзависимых АФЛА сопровождается возникновением тромбозов [33, 34].
Частота обнаружения АФЛА в сыворотке крови здоровых людей колеблется от 1 до 12% и может повышаться у лиц пожилого воз раста. В сыворотке крови здоровых людей уровень АФЛА низкий, а биологические мембраны защищены от их воздействия [1, 8, 10, 12, 13, 31, 36]. При заболеваниях, связанных с активацией В—лимфоцитов, концентрация АФЛА резко повышается. Наиболее часто и в высоком титре их обнаруживают в сыворотке крови больных с СКВ (до 70% случаев), реже при других ревматических заболеваниях, включая ревматоидный артрит, системную склеродермию, синдром Шегрена. Избыточное образование АФЛА выявляют также при злокачественных новообразованиях, лимфопролиферативных заболеваниях, аутоиммунной тромбоцитопенической пурпуре, на фоне острых и хронических вирусных, бактериальных и паразитарных инфекций инфекционный мононуклеоз, СПИД и др.), при ряде заболеваний центральной нервной системы (ЦНС), некоторых формах акушерской патологии, вследствие приема некоторых широко распространенных лекарственных препаратово(рпаелрьные контрацептивы, психотропные средства и др.). Как правило, гиперпродукция АФЛА приводит к развитию АФС [8, 10, 13, 17, 20, 27, 30, 34].
Этиология и патогенез. АФС чаще встречается у женщин. Причины заболевания неизвестны. Повышение уровня (как правило, транзиторное) АФЛА наблюдают на фоне широкого спектра бактериальных и вирусных инфекций, но тромботические осложнения у больных с инфекциями развиваются редко, что обусловлено различиями в иммунологических свойствах АФЛА у пациентов с АФС и инфекционными заболеваниями. Тем не менее предполагают, что развитие тромботических осложнений в рамках АФС может быть связано с латентной инфекцией. АФС может быть первичным, не связанным с какой—либо предшествующей патологией, но наиболее часто развивается при заболеваниях, сопровождающихся продукцией АФЛА. Существует генетическая предрасположенность к гиперпродукции АФЛА, которая связана с носительством антигенов HLA DR7, DQBj, DR4, а также нулевого аллеля Сф [1, 3, 6, 7, 25, 29, 35, 37]. Выделяют следующие основные формы и варианты течения АФС [24–26, 30, 31]:
Первичный АФС, при котором клинические проявления СКВ отсутствуют.
АФС у больных с достовернымодмиагноз СКВ (вторичный АФС).
АФС у больных с волчаночноподобными проявлениями.
«Катастрофический» АФС (острая диссеминированная коагулопатия и вазопатия), характеризующийся острым мультиорганным тромбозом, имитирующий синдром диссеминированного внутрисосудистого свертывания (ДВС) или гемолитикоуремический синдром.
АФС без АФЛА, то есть АФС, при котором отсутствуют серологические маркеры — антитела к кардиолипину и волчаночный антикоагулянт (АФЛА-негативный подтип АФС).
Другие микроангиопатические синдромы: тромботическая тромбоцитопеническая пурпура/гемолитикоуремический синдром; HELLP- синдром (гемолиз, повышение активности печеночных ферментов, снижение содержания тромбоцитов, беременность); ДВС-синдром; гипопротромбинемический синдром.
Течение АФС, тяжесть и распространенность тромботических осложнений непредсказуемы и в большинстве случаев не коррелируют с изменением титров АФЛА и активностью СКВ (при вторичном АФС). АФС проявляется преимущественно венозным тромбозом, инсультом, акушерской патологией или тромбоцитопенией [21, 22, 24, 37]. Полагают, что примерно у половины пациентов с АФС заболевание является первичным, однако вопрос о нозологической самостоятельности первичного АФС до конца не ясен. Имеются данные о том, что первичный АФС иногда может быть вариантом манифестации СКВ. Наоборот, у некоторых пациентов с классической СКВ в дебюте в дальнейшем на первый план могут выходить признаки АФС [1, 3, 9, 12, 27].
Основным патогенетическим механизмом АФС является влияние АФЛА на сосудистые, клеточные и гуморальные компоненты системы коагуляции, что приводит к нарушению равновесия между протромботическими и антитромботическими процессами и развитию тромбозов. АФЛА оказывают следующие патогенетические влияния [7, 10, 17–20, 28, 32, 37]:
на эндотелиальную клетку:
снижение синтеза простациклина — простагландина, оказывающего антиагрегационный и вазодилатирующий эффект;
нарушение функциональной активности тромбомодулина — белка, содержащегося на поверхности эндотелия, прямо тормозящего прокоагулянтную активность тромбина и ускоряющего активацию протеина С тромбином;
снижение активности гепаранульфата; индуцирование образования фактора активации тромбоцитов; нарушение фибринолитической активности;
снижение высвобождения тканевого активатора плазминогена; увеличение высвобождения ингибитора активатора плазминогена 1;
увеличение синтеза фактора Виллебранда, необходимого для нормальной агрегации тромбоцитов и обладающего способностью удлинять период полувыведения фактора VIII;
на тромбоциты:
увеличение продукции тромбоксана Аг, концентрации цитозольного кальция, что приводит к увеличению агрегации тромбоцитов;
за счет связывания с мембраной активированных тромбоцитов вызывают более быстрое разрушение их фагоцитирующими мононуклеарами, в результате чего развивается тромбоцитопения;
на гуморальные компоненты коагуляции:
уменьшение активации белка С и снижение уровня свободного белка S. В норме активированный протеин С в присутствии своего кофактора белка S избирательно разрушает факторы Va и VIIIa, что обусловливает угнетение свертывания крови;
ослабление активности гепарина и гепаринопосредованного образования комплекса антитромбин III — гепарин;
снижение синтеза и функциональной активности плацентарного антикоагулянта;
нарушение функциональной активности естественного антикоагулянта бета2-ГП1.
Клинические проявления. Поскольку в основе сосудистой патологии при АФС лежит невоспалительная тромботическая васкулопатия, затрагивающая сосуды любого калибра и локализации, от капилляров до крупных сосудов, включая аорту, спектр клинических проявлений чрезвычайно разнообразен. В рамках АФС описаны патология ЦНС, сердечноосудистой системы, нарушение функции почек, печени, ндокринных органов и пищеварительного тракта [7, 18].
Венозный и артериальный тромбоз. Наиболее характерен рецидивирующий венозный тромбоз [21]. Тромбы обычно локализуются в глубоких венах нижних конечностей, нередко в почечных и печеночных венах, приводя к развитию нефротического синдрома и синдрома Бадда – Киари. Часто наблюдают эмболию из глубоких вен нижних конечностей в легочную артерию и капиллярит, что приводит к развитию легочной гипертензии и легочной геморрагии. Описан тромбоз подключичной вены и вены сетчатки. Возможно развитие синдрома верхней или нижней полой вены при тромбозе соответствующей локализации. Тромбоз центральной вены надпочечников с последующей геморрагией и некрозом приводит к развитию хронической надпочечниковой недостаточности. Артериальный тромбоз клинически проявляется ишемией и гангреной нижних конечностей, синдромом дуги аорты, асептическим некрозом головки бедренной кости. Тромбоз обусловлен взаимодействием АФЛА с эндотелиальными клетками и снижением антитромботической активности эндотелия, подавлением продукции простациклина и повышением агрегации тромбоцитов, снижением активности циркулирующих антикоагулянтных факторов (антитромбина III, белка С и S, бе— та2-ГП1 и др.).
Поражение ЦНС. Тромбоз артерий головного мозга приводит к транзиторной ишемической атаке, рецидивирующему инсульту, которые могут проявиться не только парезами и параличами, но и судорожным синдромом, прогрессирующим слабоумием, психическими нарушениями. Возможны и другие неврологические нарушения: мигренеподобная головная боль, хорея, поперечный миелит. Не исключено, что синдром Снеддона (сочетание сетчатого ливедо, рецидивирующего тромбоза церебральных артерий и артериальной гипертензии)
Поражение сердца. Кардиальная патология может иметь серьезное прогностическое значение [7, 26] и клинически проявляется:
тромбозом коронарных артерий и развитием инфаркта миокарда;
острым или хроническим тромбозом мелких интрамуральных ветвей коронарных артерий, что приводит к нарушению сократительной способности миокарда;
поражением клапанов сердца (недостаточность митральногоакплана или сужение левого атриовентрикулярного отверстия, реже — недостаточность аортального или трикуспидального клапана). У некоторых больных возможно развитие тромботических наслоений на клапанах (вегетации), трудно отличимых от инфекционного эндокардита;
формированием внутрипредсердных тромбов, что напоминает клинические проявления миксомы сердца;
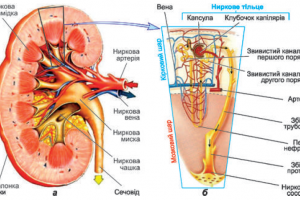
частым развитием артериальной гипертензии (лабильной или стабильной), которая обусловлена тромбозом почечных сосудов, инфарктом почек, тромбозом брюшного отдела аорты, интраглоерулярным тромбозом почек, развитием фибромышечной дисплазии почечных артерий. Поражение почек. При АФС нередко возникают тромбоз почечной артерии, инфаркт почки, а также внутриклубочковый микротромбоз («почечная тромботическая микроангиопатия») с последующим развитием гломерулосклероза и нарушением функции почек [2, 24].
Поражение печени. Возможны тромбоз печеночных вен (синдром Бадда – Киари), поражение артерий с развитием инфаркта печени и развитие узловой регенераторной гиперплазии.
Поражение легких. Описаны случаи тромбоэмболии легочной артерии и реже — тромботическая легочная гипертензия, обусловленная тромбозом легочных сосудов.
Поражение кожи. Кожными проявлениями АФС являются сетчатое ливедо (сосудистая сеточка в виде синеватых пятен на голенях, ступнях, бедрах, кистях, особенно хорошо заметная при охлаждении); поверхностная сыпь в виде точечных геморрагий, напоминающих васкулит; некроз кожи дистальных отделов нижних конечностей; хронические язвы нижних конечностей; кровоизлияния в подногтевое ложе (симптом «занозы»).
Акушерская патология является наиболее характерным проявлением АФС. Возможны следующие виды акушерской патологии: привычное невынашивание беременности, рецидивирующие спонтанные аборты (риск выкидышей увеличивается с повышением концентрации антикардиолипина класса IgG), внутриутробная гибель плода, поздний токсикоз беременных, преэклампсия, эклампсия, хорея, задержка внутриутробного развития плода, преждевременные роды. Основными механизмами акушерской патологии являются тромбоз сосудов плаценты, развитие инфаркта и недостаточности плаценты, угнетение синтеза простациклина, дефицит которого обусловливает гипертонус матки и выкидыш [22, 24, 26].
Дифференциальную диагностику АФС проводят с широким кругом заболеваний, протекающих с сосудистыми нарушениями, в первую очередь с системным васкулитом. Необходимо подчеркнуть, что при АФС наблюдается большое количество клинических проявлений («псевдосиндромов»), которые могут имитировать васкулит, инфекционный эндокардит, опухоль сердца, рассеянный склероз, гепатит, нефрит и др. АФС может сочетаться с различными заболеваниями, например c системным васкулитом. АФС следует заподозрить в случаях развития тромботических нарушений (особенно множественных, рецидивирующих, с необычной локализацией), тромбоцитопении и акушерской патологии у лиц молодого и сред него возраста, а также при необъяснимом тромбозе у новорожденных, в случае некроза кожи на фоне лечения непрямыми антикоагулянтами и у больных с удлиненным активированным частичным тромболастиновым временем (АЧТВ) при скрининговом исследовании.
Изменения показателей лабораторных исследований у больных с АФС:
В общем анализе крови: – увеличение СОЭ; – умеренная тромбоцитопения (количество тромбоцитов 70–120·109/л), не требующая специального лечения; – возможен лейкоцитоз;
редко — гемолитическая анемия.
При биохимическом исследовании крови:
гипергаммаглобулинемия; – удлинение фосфолипидзависимых коагуляционных реакций, увеличение АЧТВ и тромбинового времени;
повышение уровня креатинина и мочевины (при поражении почек);
гипербилирубинемия, повышение содержания аминотрансфераз, щелочной фосфатазы (при поражении печени).
При иммунологическом исследовании крови: – антитела к кардиолипину, причем наибольшее диагностическое
значение имеют антитела класса IgG, особенно в высокой концентрации;
волчаночный антикоагулянт. К недостаткам его определения относится невозможность применения у больных, получающих гепарин, вероятность ложноположительных и ложноотрицательных результатов;
ложноположительная реакция Вассермана
положительная реакция Кумбса при развитии гемолитической анемии;
антинуклеарный фактор и антитела к ДНК (реже);
ревматоидный фактор;
криоглобулины;
количество и активность Т-лимфоцитов- хелперов и В-лимфоцитов.
Представленные данные свидетельствуют о весьма широком спектре патологических состояний, при которых диагностируют АФС, что связано с многообразием проявлений аутоиммуной агрессии. Поэтому специфичность (патогномоничность) определения АФЛА невысока. Следует также учесть, что аутоиммунные реакции, обусловленные этими антителами, происходят на фосфолипидах мембран, главным образом клеток эндотелия сосудов, тромбоцитов, нервной системы, и, следовательно, локализация поражений может быть различной и многообразной.
Остается открытым вопрос: почему в одном случае «плацдармом» для агрессии АФЛА становятся сосуды или клапаны сердца, а в другом сосуды легких, кишечника, глаз, почек, надпочечников и др.? Требует также объяснения частое поражение соединительной ткани, которая в значительной степени лишена клеточных элементов. Ясно одно, что обнаружение АФЛА является неблагоприятным в прогностическом отношении лабораторным признаком, требующим систематического наблюдения за пациентами не только в фазе острых клинических проявлений заболевания, но и в фазе ремиссии.
В качестве иллюстрации представляем случай АФС, диагностированного в нашей клинике.
Больная К., 19 лет, впервые обратилась в клинику в связи с изменениями в клиническом анализе мочи (протеинурия до 4 г/л).
Из анамнеза известно, что у пациентки с 17 лет отмечены нарушения менструального цикла по типу метроррагии, по поводу чего она постоянно лечилась в гинекологическом отделении и принимала гормональные препараты. В этот период впервые выявлена ложноположительная реакция микропреципитации Вассермана. Кроме того, обнаружены изменения в моче (уровень белка в моче колебался от 1 до 3,7 г/л, выявлены микрогематурия и цилиндрурия), однако к терапевтам и нефрологам пациентка не обращалась.
При обследовании в клинике состояние больной относительно удовлетворительное. Кожные покровы бледные, чистые. По данным физикального обследования.
Таблица 1. Критерии АФС [4]
Критерии | Клинические проявления |
Клинические | Сосудистый тромбоз артерий и/или вен любой локализации в тканях или от дельных органах (допплерили морфологически подтвержденный) Патология беременности (внутриутробная смерть плода после 10 нед с нор мальными морфологическими признаками, преждевременные роды до 34-й недели с выраженной плацентарной недостаточностью или преэклампсией, три самопроизвольных аборта и более до 10 нед без гормональных нарушений, дефекты матки или хромосомные нарушения) Livedo reticulares (сетчатое ливедо) Геморрагический синдром |
Лабораторные | Антикардиолипиновые антитела классов IgG и IgM (повышенный уровень) в трех исследованиях в течение 1 мес Наличие волчаночного антикоагулянта в плазме крови Тромбоцитопения Ложноположительная реакция Вассермана |
АФС считают достоверно подтвержденным при наличии одного клинического и двух лабораторных критери- ев. | |
В общем анализе крови: анемия (гемоглобин 95 г/л, эритроциты 3,2·109/л, цветной показатель 0,89), тромбоциты 175·109/л, показатели белой крови — без отклонений от нормы. СОЭ 25 мм/ч.
В общем анализе мочи: протеинурия (до 2,8 г/л), цилиндрурия, 25–30 эритроцитов в поле зрения. При повторных исследованиях протеинурия не превышала 1 г/сут.
Величины показателей белкового обмена, азотистых шлаков и печеночных проб находились в пределах нормальных величин.
Приолраабторном обследовании выявлена ложноположительная реакция Вассермана.
Обнаружены изменения показателей свертывающей системы крови: международное нормализованное отношение (МНО) 1,69 ед. (нормальное значение до 1,3 ед.), уровень протромбина по Квику 52,6% (нормальное значение 70– 130%), протромбиновое время 25 с (нормальное значение 14–20 с), фибринолитическая активность крови более 260 с (нормальное значение не более 200 с).
Показатели липидного обмена: уровень общего ХС 6,03 ммоль/л, ХС липопротеинов высокой плотности 1,63 ммоль/л, ХС липопротеиов низкой плотности 3,64 ммоль/л.
Проведена дифференциальная диагностика с хроническим гломерулонефритом, СКВ и АФС.
Результаты дополнительного обследования:
повышение уровня IgG к фосфолипидам более 100 Ед/мл (нормальное значение до 10 Ед/мл);
индекс антинуклеарных антител 7,5 усл. ед. (нормальное значение до 1,5 усл. ед.);
снижение уровня С4-2 компонентов комплемента менее 0,02 г/л (нормальное значение 0,1–0,4 г/л);
LE-клетки при трехкратном исследовании не обнаружены. При проведении фиброгастродуоденоскопии выявлены геморрагии на слизистой оболочке желудка. По данным ультразвуко вого исследования органов брюшной полости патологии не выявлено. Почкиспроаложены в типичном месте, размеры правой почки 10×5×4 см, левой — 11×5×4,5 см, паренхима не истончена (20 мм в обеих почках), структура почечной ткани не изменена.
Полученные показатели клинико— лабораторных исследований соответствовали существующим критериям АФС (табл. 1). Установлен диагноз:
Первичный АФС с преимущественным поражением почек.
Хроническая болезнь почек I стадии: хронический гломерулоенфрит .
Эрозивный гастрит. Метроррагия. Анемия, легкое течение.
Основанием для установления диагноза у больной было наличие геморрагического синдрома (частые и обильные метроррагии, приведшие к анемии, геморрагии на слизистой оболочке желудка), а также ложноположительная реакция Васермана, повышение титров антител IgG к фосфолипидам более чем в 10 раз и уровня антинуклеарных антител более чем в 5 раз в сравнении с верхней границей нормы. На этом этапе другие клинические критерии данного синдрома (невынашивание беременности, венозный тромб, артериальная окклюзия, сетчатое ливедо, тромбоцитопения и др.) не обнаружены. Однако дальнейшее наблюдение подтвердило правильность установленного диагноза.
Пациентка была обследована в Харьковском специализированном медико-генетическом центре:
уровень гомоцистеина в крови 13,2 мкмоль/л (нормальное значение 10–11 мкмоль/л), что свидетельствовало о склонности кюразвити тромбофилитического состояния;
при анализе свободных аминокислот крови отмечено снижение уровня пролина до 0,077 ммоль/л (нормальное значение 0,120– 0,336 ммоль/л), повышение уровня метионина до 0,054 ммоль/л (нормальное значение 0,006–0,04 ммоль/л), повышение уровня цистеина до 0,071 ммоль/л (нормальное значение 0,016– 0,056 ммоль/л). Выявленные изменения в сочетании с гипергомоцистеинемией указывали на генетически обусловленную склонность к развитию тромбофилитических состояний аутоиммунного генеза. У женщин они являются критерием развития тяжелых гестозов с риском невынашивания беременности [1, 17, 18, 22, 26];
при исследовании полиморфизма системы генов фолатного цикла выявлен полиморфизм гена МТRR (метионинсинтетазы редуктазы) А66G в гомозиготном состоянии, свидетельствующий о генетически обусловленном нарушении фолатного обмена с развитием дефицита фолиевой кислоты.
Учитывая тот факт, что в клинической картине АФС ведущим является развитие рецидивирующих тромбозов, выявленные изменения в обмене аминокислот могли привести к более тяжелому течению заболевания, а при наступлении беременности — к очень высокому риску развития гестоза и невынашивания беременности [1, 6, 17,22, 27].
По результатам исследования TORCH- комплекса выявлено повышение титра IgG к вирусу Эпштейна – Барр (3,3 МЕ/мл при нормальном значении 0,9–1,1 ммоль/л). С помощью метода полимеразной цепной реакции ДНК цитомегаловируса, вируса герпеса, хламидии и токсоплазмы не выявлено.
Лечебные мероприятия при АФС зависят от варианта течения заболевания (табл. 2).
Учитывая наличие геморрагического синдрома, антикоагулянты больной не назначали, оснований для проведения терапии глюкокортикостероидами и иммуноглобулинами в момент наблюдения не было.
Сложный случай
Таблица 2. Лечебная тактика при АФС [4]
Вариант течения | Лечебная тактика | ||
Первичный АФС без клинических проявлений | Наблюдение, профилактика тромбоза | ||
Первичный тромбозом | АФС | с | Назначение низкомолекулярных гепаринов или гепарина |
Вторичный АФС | Лечение основной патологии, профилактика тромбоза | ||
Вторичный тромбозом | АФС | с | Лечение основной патологии, низкомолекулярные гепарины или гепарин |
Беременность на фоне АФС | Назначение с момента установления беременности ацетилсалициловой кислоты, низкомолекулярных гепаринов курсами с 10-й по 34-ю неделю беременности один раз в месяц | ||
АФС с тромбоцитопенией (>50 Г/л) | Назначение системных глюкокортикостероидов, внутривенно иммуноглобулин | ||
В последующий период в клинической картине сохранялась гинекологическая патология — частые метроррагии, по поводу которыхбольная продолжала неоднократные курсы гормональной терапии под наблюдением гинекологов. При амбулаторном наблюдении сохранялись протеинурия (уровень белка в моче — в пределах 1,4– 2,3 г/л) и микрогематурия (до 10 эритроцитов в поле зрения), периферических отеков не было.
Через 6 мес после установления диагноза АФС, со слов родственников, у больной отмечено быстрое развитиегирепсрсоирование нефротического синдрома, на фоне которого появилась выраженная боль в поясничной области. Больная в экстренном порядке госпитализирована в хирургическую клинику с предполагаемым диагнозом тромбоза вен селезенки и левой почки. В ургентном порядке проведена спленэктомия и нефрэктомия слева. В ходе операции подтвержден диагноз тромбоза селезеночной и почечной вен.
В настоящее время самочувствие пациентки средней тяжести. Отеков нет, протеинурия не превышает 2,5 г/л. Функциональное состояние единственной почки достаточное (скорость клубочковой фильтрации 90 мл/мин).
Особенностью случая является развитие тромбоза селезеночной и почечной вен у больной с АФС. Существует точка зрения, что нефротиченований для проведения терапии глюкоский синдром может быть следствием тромбоза почечных вен, поскольку в эксперименте на животных доказано, что длительная окклюзия почечной вены может привести к развитию протеинурии.Клиническая картина при тромбозе почечной вены определяется продолжительностью и выраженностью венозной окклюзии, а также наличием одно— или двустороннего процесса. Однако даже внеапная полная окклюзия одной почечной вены довольно часто протекает бессимптомно. Клинически манифестный тромбоз почечной вены проявляется болью разной интенсивности в поясничной области и боковых отделах живота вследствие перерастяжения почечной капсулы. До настоящего времени диагноз тромбоза почечных вен вызывает определенные трудности, учитывая зачастую бессимптомное течение этого осложнения, а также неоднозначность трактовки некоторых его клиниколабораторных проявлений у больных с нефротическим синдромом. Поэтому наше наблюдение должно напомнить врачу как о существовании АФС, так и возможности развития нефротического синдрома у больных с тромбозом почечной вены.
Литература.
Современные взгляды на иммунологию гестационного процесса / Т.Н. Демина [и др.] // Ре- прод. здоровье женщины. – 2003. – № 13. – С. 43–48.58 Therapia № 10 (51) 2010
Тромбоз почечных вен при мембранозной нефропатии / Н.Л. Козловская [и др.] // Терапевт. арх. – 2000. – № 6. – С. 71–73.
Коваленко, Д.Е. Антифосфолипидный синдром и его клинические последствия / Д.Е. Коваленко, В.В. Афанасьев, А.Н. Талько // Новые медицинские технологии. – 2004. – № 5. – С. 15– 19.
Наказ МОЗ України № 626 від 08.10.2007 Про затвердження клінічних протоколів надання медичної допомоги хворим з імунними захво— рюваннями. http://www.med- job.com.ua/index.php?go=Pages&in=view&id=335
Антифосфолипидный синдром (синдром Hughes): 10 лет изучения в России / Е.Л. Насонов [и др.] // Клин. медицина. – 1998. – № 2. – С. 411.
Патология сосудов при антифосфолипидном синдроме / Е.Л. Насонов [и др.] //– М: Ярославль, 1995. – 162 с.
Антифосфолипидный синдром: кардиологические аспекты / Е.Л. Насонов [и др.] // Терапевт. арх. – 1993. – № 11. – С. 80–85.
Насонов, Е.Л. Антифосфолипидный синдром: клиническая и иммунологическая характеристика / Е.Л. Насонов // Клин. медицина. – 1989. –№ 1. – С. 5–13.
Антитела к 2-β-гликопротеину1 при СКВ/ Т.М. Решетняк [и др.] // Клин. медицина. – 1998. –№ 3. – С. 36–40.
Антифосфолипидный синдром. Этиология, патогенез, диагностика, лечение и профилактика / В.И. Черний [и др.] // Медицина неотложных состояний. – 2007. – № 3. – С. 3–10.
Asherson R.A., Cervera R., Piette J.C., Shoenfeld Y. The antiphospholipid syndrome: history, definition, classification, and differential diagnosis: inAsherson R.A., Cervera R., Piette J.C., Shoenfeld Y. The antiphospholipid syndrome, Boca Raton, p.3-12. Florida, CRC, 1996.
Avivi I., Lanir N., Hoffman R., Brenner B. Hyperhomocysteinemia is common in patients with antiphospholipid syndrome and may contribute to expression of major thrombotic events. Blood Coagul. Fibrinolysis. 2002; № 13 (2):169–172.
Bazyka D.A., Belyayeva N.V., ChumakA.A. et al. Neuroimmune interaction. Health effects of Chornobyl accident. Kyiv: DIA, 2003; 193–202.
Berman J., Girardi G., Salmon J.E. TNF- alpha is a critical effector and a target for therapy in antiphospholipid antibodyinduced pregnancy loss. J. Immunol. 2005; № 174 (1): Р. 485–490.
Bowie E.V.M., Thompson J.H., JacuzziC.A. Thrombosis systemic lupus erythematosus de- spite circulating anticoagulants. J.Lab.Clin.Med. 1963; Vol. 62:p. 416–430.
Conley C.L., Harman R.C. A haemorrhagic disorder caused be circulating anticoagulant in pa tients with disseminaeol lupus erytematosus. J. Clin.Invest. 1952; Vol. 31: P. 621–622.
Couto E., Barini R., Nomura M.L., Annichino-Bizzacchi J.M. Methylene tetrahydrofolate reductase gene mutation together with anticardiolipin antibody duing pregnancy: a case report. San Paulo Med. J. 2002; № 120 (5): 152–153.
De Carolis C., Greco E., Guarino M.D. et al. Antithyroid antibodies and antiphospholipid syndrome: evidence of reduced fecundity and of poor pregnancy outcome in recurrent spontaneous aborters. Am. J. Reprod. Immunol. 2004; № 52 (4): 263–236.
Di Nisio M., Peters L., Middeldorp S. Anticoagulants for the treatment of recurrent pregnancy loss in women without antiphospholipid syndrome.Cochrane Database Syst. Rev. 2005; № 18 (2): CD004734.
Drife J. Thromboembolism: Reducing maternal death and disability during pregnancy // Br. Med. Bull. 2003; № 67 (1): 177–190.
Erkan D., Lockshin M.D. How much warfarin is enough in APS related thrombosis? // Thromb. Res. 2004; № 114 (5–6): Р. 435–442.
Farquharson R.G., Quenby S., Greaves. Antiphospholipid Syndrome in Pregnancy: A Randomized, Controlled Trial of Treatment. Obstet. Gyne- col. 2002; № 100: Р. 408–413.
Fenstein D.I., Rapapert S.I. Acquired inhibitors of blood coagulation. Prig.Hemostasis Thromb. 1972; Vol.1: p.75–95.
Galli M., Barbui T. Antiphospholipid syndrome: clinical and diagnostic utility of laboratory tests. Semin. Thromb. Hemost. 2005; № 31 (1): 17– 24.
Hughes GRV. The antiphospholipid syndrome: ten years on. Lancet 1993; 324: 341–4.
Kdous M., Hachicha R., Lombroso R., Gallardo G. Antiphospholipid antibodies and pregnancy .Tunis Med. 2005; V. 83 (1): P. 1–5.
Lee R.M., Brown M.A., Ward K. et al. Homocysteine levels in women with antiphospholipid syndrome and normal fertile controls J. Reprod. Immunol. 2004; V. 63 (1): 23–30.
Marai I., Tincani A., Balestrieri G., Shoenfeld Y. Anticardiolipin and anti-beta-2-glycoprotein I antibodies. Autoimmunity. 2005; V. 38 (1): 38.
Marai I., Zandman-Goddard G., ShoenfeldY. The systemic nature of the antiphospholipid syn- drome. Scand. J. Rheumatol. 2004; V. 33 (6): 365– 372.
Miesbach W., Scharrer I. The antiphospholipid syndrome. Dtsch. Med. Wochenschr. 2004; V. 129 (47): 2547–2552.
Nishiguchi T., Kobayashi T. Antiphospholipid syndrome: characteristics and obstetrical management. Curr. Drug Targets. 2005; V. 6 (5): 593– 605.
Ozturk O., Saridogan E., Jauniaux E. Drug intervention in early pregnancy after assisted reproductive technology Reprod. Biomed. Online. 2004; V. 9 (4): 452–465.
Reber G., de Moerloose P. Anti-beta2- glycoprotein I antibodies – when and how should they be measured? Thromb. Res. 2004; V. 114 (5–6): 527– 531.
Ronin-Walknowska E., Sipak-Szmigiel O. Immunological aspects of premature termination of pregnancies. Med. Wieku Rozwoj. 2003; V. 7 (3) (Suppl 1): 65–78.
Soltesz P. , Veres K., Lacos G. et al. Antiphospholipid antibodies in acute coronary syndrome. Orv. Hetil., 2003; 144(10): 461–466.
Soluble thrombomodulin levels among women with a history of recurrent pregnancy loss, with or without antiphospholipid antibodies / De Larranaga G.F., Remondino G., Alonso B.S., Voto L. Blood Coagul. Fibrinolysis. 2005; № 16 (1): 31–35.
Verspyck E., Marpeau L. Thrombophilias and vascular placental pathology. A survey of the literature. Rev. Med. Int. 2005; V. 26 (2): 103–108.





Комментировать