Результати діагностичної сцинтиграфії: ефекти тиреоїдного станінгу та селфстанінгу, які впливають на кінетику лікувальної активності І, прискорюючи його виведення з пухлинного вогнища. Використання методу регресивного аналізу параметрів розподілу радіойоду в залишковій тканині щитовидної залози.
Солодянникова О.І., Джужа Д.О., Саган Д.Л., Трацевський В.В., Войт Н.Ю., Сукач Г.Г., Турицина В.Л., Національний інститут раку, Київ
За допомогою діагностичної сцинтиграфії (обстежено 592 пацієнти) виявлено ефекти тиреоїдного станінгу та селфстанінгу, які впливають на кінетику лікувальної активності 131І, прискорюючи його виведення з пухлинного вогнища. Використання методу регресивного аналізу параметрів розподілу радіойоду в залишковій тканині щитовидної залози підтвердило, що радіойодотерапію слід проводити якомога швидше після діагностичної сцинтиграфії. Ретроспективний аналіз ефективності радіойодотерапії у хворих на диференційований рак щитовидної залози свідчить про високу ефективність першого курсу лікування у 88,6-76,0% хворих незалежно від періоду, який минув після операції або діагностичної сцинтиграфії. Однак питання про термін проведення радіойодотерапії необхідно вирішувати в кожному конкретному випадку з урахуванням факторів ризику.
Вступ
На сьогодні загальновизнаним лікуванням диференційованого раку щитовидної залози (ДРЩЗ) є тотальна тиреоїдектомія (ТТЕ) в комбінації з радіойодотерапією (РЙТ) та супресивною гормонотерапією (ГТ). Незважаючи на досягнуті успіхи в лікуванні тиреоїдного раку, й досі дебатується ряд питань проведення РЙТ з метою підвищення її ефективності [1].
Існують різнорідні точки зору щодо необхідності використання активності 131І для абляції залишкової тканини щитовидної залози (ЗТЩЗ) [3, 4], методів визначення обсягу ЗТЩЗ, впливу розмірів діагностичної активності на подальшу дію лікувальних доз 131І в зв’язку з розвитком тиреоїдного станінгу.
Згідно з даними літератури та результатами власних досліджень основними чинниками, що визначають ефективність РЙТ, є осередкові поглинуті дози (ОПД) в ЗТЩЗ, індивідуальна радіочутливість тиреоїдної тканини та явища тиреоїдного станінгу (оглушення) [1, 4, 5].
Однією з найефективніших методик РЙТ для абляції постхірургічної ЗТЩЗ у хворих на ДРЩЗ є використання розрахункової лікувальної активності 131І, що визначається на основі показників кінетики діагностичної активності. Однак часто ОПД в ЗТЩЗ є меншими, ніж очікувані розрахункові. Частково ці розбіжності можна пояснити ефектом тиреоїдного станінгу — зниженням функціональної активності тиреоїдної тканини під дією ОПД від діагностичної активності при проведенні сцинтиграфії, що призводить до зміни кінетики лікувальної активності і, як наслідок, до зниження терапевтичних ОПД [6].
T. Hadjieva [7, 8] пояснює зниження терапевтичних ОПД скороченням періоду напіввиведення терапевтичної активності за рахунок високої потужності дози в перші години після введення радіофармацевтичних препаратів. A. Bolster і співавтори [9], порівнюючи ефект ТС у хворих двох груп, у яких діагностичну сцинтиграфію проводили з 131I і 123I, відмічають вірогідне зниження ефекту тиреоїдного станінгу в останній групі. Тим не менше, зниження відносного накопичення лікувального радіойоду виявлено у 13 з 15 хворих 2-ї групи, яке в середньому становило 67,0±33,8% відносного накопичення при діагностичній сцинтиграфії. Автори пояснюють це явище тиреоїдним селфстанінгом (самооглушенням), тобто дією ОПД, які створюються у перші години та дні після введення лікувальної активності на подальшу кінетику 131I, що призводить до зниження очікуваних ОПД за весь курс РЙТ. Дані про величини ОПД або потужність дози в ділянках тиреоїдної тканини у перші кілька діб після введення радіопрепаратів, а також про ступінь змін параметрів кінетики 131I в літературі різнорідні [9]. Єдиного погляду на тиреоїдний селфстанінг як на певне реальне явище також немає.
Розподіл 131I в ЗТЩЗ під час РЙТ ДРЩЗ та діагностичного дослідження після введення низької активності радіойоду суттєво відрізняються. Діагностична сцинтиграфія, як правило, має бути проведена після введення 74 МБк радіойоду, тоді як терапевтична активність 131I сягає 1000-5000 МБк і 131 вище. Незважаючи на те що різниця в розподілі I в ЗТЩЗ на низькій та високій активності 131I широко дискутується в літературі [10, 11], не було спроб оцінити параметри кінетики виведення та накопичення радіойоду під час РЙТ на підставі даних діагностичного дослідження та визначити факти, які впливають на цю відмінність. Вирішення цього питання може допомогти визначити поглинуту дозу та скоригувати лікувальну активність 131I для успішної абляції ЗТЩЗ.
Важливість перерви між діагностичною сцинтиграфією та РЙТ є предметом уваги через реакцію клітин паренхіми на опромінення низькою активністю радіойоду перед лікуванням (так званий станінг-ефект). Деякі автори вважають, що довга перерва сприятливо впливає на репарацію клітин паренхіми [12]. В той же час, не було виявлено різниці між поглинутою в ЗТЩЗ дозою у хворих, які лікувались одразу ж після діагностичного дослідження та 131 через 7 діб після введення низької активності I [11].
Таким чином, метою даного дослідження було оцінити вплив таких факторів, як осередкова поглинута доза радіойоду, вплив тиреоїдного станінгу і селфстанінгу на ефективність курсів РЙТ.
Об’єкт і методи дослідження
З метою підвищення ефективності РЙТ при лікуванні хворих на ДРЩЗ шляхом розробки методів розрахунків порогової аблятивної активності 131І та кількісної оцінки тиреоїдного станінгу та селфстанінгу обстежено 592 пацієнти.
В роботі розглянуті ОПД і параметри кінетики 131І після прийому лікувальної активності у 32 хворих на ДРЩЗ віком 25-74 роки (6 чоловіків, 26 жінок).
Всі види сцинтиграфії виконували на дводетекторній гамма-камері та, у разі необхідності, на однофотонному емісійному комп’ютерному томографі.
Через 4-6 тиж після хірургічного лікування проводили діагностичну сцинтиграфію з 70-80 МБк йодиду натрію, міченого 1 1І. Дослідження виконували через 24-48 год після введення радіопрепаратів. РЙТ здійснювали емпіричною або розрахунковою активністю у межах 1,8-4,7 ГБк. Інтервал між діагностичною сцинтиграфією і РЙТ становив від 1 до 161 доби, в середньому 67,7±7,8 днів. На 4-ту добу після прийому лікувальної активності призначали супресивну ГТ Ь-тироксином із розрахунку 2,5 мкг/кг маси тіла. Контрольну сцинтиграфію проводили через 4-6 міс після РЙТ та припинення ГТ на 4-му тижні. Абляція вважалася повною, якщо при двох послідовних контрольних сцинтиграфіях не визначали осередки гіперфіксації радіопрепаратів. За необхідності призначали повторні курси РЙТ.
Поглинуті дози в ділянках ЗТЩЗ визначали згідно з рекомендаціями Комітету з медичних внутрішніх радіаційних доз за формулою [11]:
Dther = (0,1187∫A(t) dt) : m, (1)
де Dther — поглинута доза в ділянці ЗТЩЗ після РЙТ, Гр;
A(t) dt – інтеграл активності в ділянці ЗТЩЗ, МБк* год;
m – маса тканини ділянки ЗТЩЗ, г.
Для розрахунків поглинутих доз вимірювання активності в осередку гіперфіксації радіопрепаратів проводили через 1 добу після їх прийому і протягом 6 днів щоденно. При розрахунку загальної ОПД проводили екстраполяцію відрізку кривої між вимірюваннями через 3 і 6 діб. Масу ділянки ЗТЩЗ визначали з урахуванням обсягу розподілу радіойоду, при цьому питома маса тканини вважалася рівною 1 г/см. Обсяг ділянок розраховували за даними сцинтиграфії та з використанням еліпсоїдної моделі. Для обробки отриманих даних використовували пакети програми «Curve Expert 1.34», «SPSS 10.0».
Для регресійного аналізу параметрів кінетики розподілу 11I у 32 хворих з ДРЩЗ проводили РЙТ після діагностичної сцинтиграфії.
Визначали такі параметри кінетики:
Tdt ефективний період напіввиведення радіойоду із ЗТЩЗ після введення діагностичної та терапевтичної активності відповідно;
σ – відношення накопичення радіойоду в ЗТЩЗ до його вмісту в крові;
Δ — перерва між діагностичним дослідженням та РЙТ.

Було зроблено припущення, що вищеозначені параметри під час РЙТ визначаються як лінійна функція таких самих параметрів після введення низької активності, а також функції f (Δn):
Коефіцієнти α, β, γ, δ визначали методом регресійного аналізу.
Результати та їх обговорення
На основі створеної бази даних хворих на ДРЩЗ проаналізовані фактори, що впливають на ефективність РЙТ. Серед них, в першу чергу, було проведено вивчення ефекту тиреоїдного станінгу, значення якого практично не висвітлено в науковій літературі. Дослідження ефекту селфстанінгу проведено у виділеній групі хворих з ОПД в ЗТЩЗ при діагностичній сцинтиграфії <10 Гр. Це було зроблено з метою виключення впливу ефекту тиреоїдного станінгу, оскільки його значне збільшення відмічають при більш високих значеннях ОПД. У дослідженні взяли участь 32 пацієнти із ЗТЩЗ. Середня ОПД після діагностичної сцинтиграфії у них становила 4,14±0,35 Гр.
При проведенні РЙТ середня ОПД за 1 добу була на рівні 9,74±0,35 Гр, за 2 доби — 26,9±4,0 Гр і за 3 доби — 39,8±5,6 Гр. За весь курс РЙТ ОПД за 1-шу добу становила 13,45±0,8%, за 2-гу добу — 36,9±2,0%, за 3-тю добу — 53,75±2,4%. Таким чином, вже за перші кілька діб ОПД могла перевищувати 10 Гр і впливати на кінетику I, змінюючи функціональну активність тиреоцитів. Рівень накопичення 131I в ділянках ЗТЩЗ при РЙТ становив у середньому 47,4±5,4% від відповідного показника при діагностичній сцинтиграфії, ОПД на одиницю введеної активності (показник D/A) — 44,6±5,1%. Відмічено слабку вірогідну кореляцію між діагностичними ОПД та зниженням терапевтичного показника D/A відносно діагностичного r=0,264, p<0,05. Вірогідної кореляції між діагностичними ОПД і зниженням рівня накопичення 131I в ЗТЩЗ через 24 год після прийому лікувальної активності не було виявлено, що свідчить про незначущість впливу тиреоїдного станінгу на застосовану діагностичну активність в даній групі хворих.
При визначенні залежності показників кінетики лікувальної активності I від ОПД, що створюються в перші кілька діб, встановлено вірогідну позитивну кореляцію r=0,845, p<0,01 між ОПД та рівнем накопичення 131I через 24 год, а також терапевтичним показником D/A r=0,631, p<0,01.
Висловлене припущення [12], що зниження рівня накопичення 131I через 24 год після введення лікувальної активності відносно діагностичних показників може бути зумовлене пригнічувальною дією ОПД або потужністю доз, що створюються в перші кілька діб або навіть годин після прийому радіофармацевтичних препаратів, потребує більш поглибленого дослідження. Для вивчення цього питання необхідна дозиметрія з більш точним визначенням періоду максимального накопичення. Відносне зниження рівня накопичення I через 24 год пояснюється здатністю тиреоцитів поглинати за певний проміжок часу тільки обмежену кількість йоду, незалежно від його концентрації в крові. Другим чинником, що визначає відносне зниження накопичення радіофармацевтичного препарату, може бути співвідношення стабільного й радіоактивного йоду в крові. При достатній та надмірній концентрації стабільного йоду поглинання радіоізотопу може бути обмежено, незважаючи на високу активність, що вводиться.
Поряд з цим, не можна виключити впливу на показники кінетики лікувальної активності 131I і ОПД за 1-шу-2-гу добу, так як за величиною вони можуть перевищувати діагностичні ОПД, що спричиняють тиреоїдний станінг. Період напіввиведення лікувальної активності в цій групі хворих був у середньому в 1,62±0,15 раза нижчим, ніж період напіввиведення діагностичної активності.
Зіставлення кумулятивної ОПД за 1, 2 та 3 доби при РЙТ з абсолютними значеннями періоду напіввиведення лікувальної активності продемонструвало існування вірогідної негативної кореляції між цією величиною і ОПД за 1-шу добу, r=-0,316; p<0,05.
При цьому виведення I з ЗТЩЗ, як правило, характеризувалося більш повільною складовою протягом 2-3-ї доби і більш швидкою, починаючи з 4-ї доби. Період напіввиведення, що визначали через 24-72 год після прийому радіофармацевтичного препарату, в середньому становив 3,66±0,83 доби, а в інтервалі 72-144 год — 2,39±0,58 доби. Співвідношення між ними в середньому становило 1,93±0,3. Виявлено вірогідну негативну кореляцію між періодом напіввиведення, що визначений через 3-6 діб після прийому лікувальної активності 131І, і ОПД за 1-шу добу, г=-0,543; р<0,05, за 2-гу добу — г=-0,543; р<0,05 і за 3-тю добу — г=0,540; р<0,05.
Таким чином, наявність негативної кореляційної залежності між кумулятивними ОПД в ЗТЩЗ, отриманими протягом перших трьох діб РЙТ і періодом напіввиведення лікувальної активності 131І дозволяє припустити виведення радіойоду, що наступає, як правило, через 3 доби після прийому лікувальної активності. Прояв селфстанінгу, очевидно, зумовлений загибеллю частини клітин ЗТЩЗ або пригніченням їх функціональної активності кумулятивними дозами за перші кілька діб РЙТ. Ефект селфстанінгу слід брати до уваги при розрахунках лікувальної активності 131І на основі параметрів кінетики діагностичної активності.
Необхідність проведення РЙТ після тиреоїдектомії у хворих з ДРЩЗ на сьогодні не викликає сумнівів. Зазвичай РЙТ прийнято проводити через 4-6 тиж після хірургічного втручання. Проте іноді виникають ситуації, внаслідок яких проводять відстрочену РЙТ з суб’єктивних, ятрогенних причин, а також через недостатню кількість спеціалізованих ліжок. Останнє призводить до постійного зростання черги хворих, які потребують РЙТ, а значить — до збільшення періоду між операцією та РЙТ. У зв’язку з цим виникає питання про вплив відстроченого застосування радіойоду (понад 2 міс) на ефективність лікування.
На сьогодні у відділенні ядерної медицини Національного інституту раку перебуває 376 пацієнтів з позитивним ефектом після РЙТ, яким вона була проведена у різні строки після операції. Термін нагляду за пацієнтами коливався від 4 до 60 міс у середньому 13,2 міс.
Залежно від строків проведення РЙТ після операції всі пацієнти були розподілені на 3 групи. Початковим періодом вважали дату видалення первинної пухлини.
До 1-ї групи увійшли 97 хворих (76 жінок і 21 чоловік) віком 32-76 років (середній вік 54 роки), які одержали РЙТ через 30-60 днів після операції. Гістологічно у 62 виявили папілярний рак, у 15 фолікулярний, у 20 змішані форми ДРЩЗ.
У 2-гу групу було включено 192 пацієнти (147 жінок і 45 чоловіків) віком 19-68 років (середній вік 43,5 року), які одержали 131І через 61 день 6 міс після тиреоїдектомії. Гістологічно у 126 діагностовано папілярний рак, у 76 фолікулярний, у 40 змішані форми.
До 3-ї групи увійшли 87 осіб (70 жінок і 17 чоловіків) віком 18-67 років (середній вік 42,5 року), яким РЙТ було проведено в термін понад 6 міс після хірургічного втручання. Папілярний рак діагностовано у 52, фолікулярний у 20, змішані форвизначали у 63,8% хворих, фолікулярний у 16,2%, ми у 15.
Загалом папілярний рак щитовидної залози визначали у 63,8% хворих, фолікулярний – у 16,2%, змішані форми – у 20,0%.
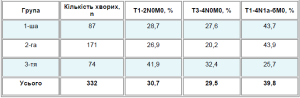
Розподіл хворих за класифікацією ТИМ наведено у табл. 1.
Таблиця 1. Розподіл хворих за показниками ТNМ
* До таблиці внесені лише ті хворі, для яких були вказані дані класифікації у післяопераційному діагнозі.
Одержані дані свідчать про те, що кількість хворих з T1-2N0M0 у 1-й та 2-й групах достовірно (p<0,05) менша, ніж у 3-й групі, тоді як частота метастазування в лімфатичні вузли достовірно вища (p<0,05).
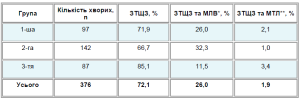
В табл. 2 наведені результати післяопераційної сцинтиграфії, проведеної після РЙТ.
Таблиця 2. Дані сцинтиграфії хворих на ДРЩЗ в різні строки після хірургічного лікування
*МЛВ — метастази в лімфатичні вузли; **МТЛ — метастази в легені.
За даними сцинтиграфії, у більшості обстежених хворих (72,1%) виявляли ЗТЩЗ. Із 105 (27,9%) хворих з реґіонарними та відділеними метастазами 25,7% отримали РЙТ в термін до 2 міс після операції, у 67,0% РЙТ була проведена через 2-6 міс, у 13,6% — через 6 міс і більше. Хворим 3-ї групи проводили РЙТ в середньому через 15,1 міс після хірургічного лікування, а до того перебували під наглядом лікаря за місцем проживання. Характеризуючи 3-тю групу пацієнтів, важко визначити причину відстроченого обстеження та лікування. Незважаючи на те що у більшості хворих цієї групи при сцинтиграфії визначали тільки ЗТЩЗ, у 11,5% було виявленометастази в реґіонарні лімфатичні вузли, а у 3,4% — метастази в легені. Оскільки ці пацієнти поступали з різних регіонів України та 25,3% з них після операції отримали дистанційну променеву терапію, не виключено, що у спеціалістів, які спостерігали їх, була впевненість в ефективності проведеного лікування. Адекватного післяопераційного спостереження, що включало б сцинтиграфію з 131І та визначення рівня сироваткового тиреоїдного гормону у хворих цієї групи не відмічено.
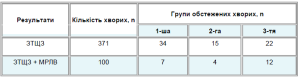
В табл. 3 наведена кількість курсів РЙТ, проведення яких дало позитивні результати залежно від часу, який минув після операції.
Таблиця 3. Дані сцинтиграфії хворих на ДРЩЗ через 4–6 тиж після операції
У пацієнтів 1-ї групи позитивний ефект після першого курсу РЙТ одержано у 81 з 97 хворих (83,5%). Абляція у хворих, які мали тільки ЗТЩЗ, досягнута після 1 курсу в 62 спостереженнях з 70 (88,6%) при введенні в середньому 3,3±0,2 ГБк та після 2 курсів у 8 випадках (11,4%) при введенні середньої сумарної активності 5,3±0,4 ГБк. Позитивний ефект у хворих з ЗТЩЗ та метастазами в реґіонарні лімфовузли після першого курсу одержано в 10 з 25 випадків (76,0%) при введенні 3,8±0,2 ГБк, після 2 курсів — в 6 випадках (24,0%) при прийомі 6,2±0,8 ГБк. У 2 хворих з метастазами в легені позитивний ефект РЙТ одержано в 1 випадку після 2 курсів при сумарній активності 9,4 ГБк, у другому — після 3 курсів при сумарній активності 12,6 ГБк.
В 2-й групі позитивний результат РЙТ після одночасного прийому радіофармацевтичних препаратів відмічали у 89,6% хворих. Абляція у пацієнтів лише з ЗТЩЗ після 1-го курсу одержана у 123 зі 128 хворих (96,1%) від введення 3,5±0,1 ГБк, після 2-го курсу — у 3,9% пацієнтів від середньої сумарної активності 4,9±0,8 ГБк. Девіталізація ЗТЩЗ та реґіонарних метастазів у лімфовузли після 1-го курсу зафіксована у 49 з 62 хворих (79,0%) від введення 4,1±0,8 ГБк, після 2-го курсу у 1 (17,7%) від 5,9±0,5 ГБк. Двом пацієнтам з таким розповсюдженням процесу було проведено більше 2 курсів РЙТ: у одного хворого з метастазами в реґіонарні лімфовузли позитивний ефект був одержаний після 4 курсів (8,4 ГБк), у другого після 5 курсів (7,4 ГБк). З 2 хворих з метастазами в легені позитивний результат зареєстровано в 1-му випадку після 2 курсів (9,1 ГБк), в 2-му — після 10 курсів (35,9 ГБк).
В 3-й групі позитивний ефект після 1-го курсу РЙТ досягнуто у 72 з 87 хворих (83,5%). Абляцію ЗТЩЗ після 1-го курсу виявляли у 64 з 73 пацієнтів (87,7%) від введення 3,4±0,3 ГБк, після 2-го курсу у 8 (10,9%) від введення 4,7±0,5 ГБк. У одного хворого позитивний ефект одержано після 3 курсів (4,9 ГБк). Девіталізація ЗТЩЗ і реґіонарних метастазів після 1-го курсу визначали у 8 з 11 хворих (72,7%) від введення 3,9±0,5 ГБк, після 2 курсів — у 1 (9,1%) від 6,0 ГБк, після 3 — у 1 від 7,0 ГБк. Позитивний результат РЙТ метастазів у легені було зареєстровано у 3 пацієнтів після 4 (28,2 ГБк), 5 (28,6 ГБк) і 10 (44,6 ГБк) курсів відповідно.
У цілому ефективність 1-го курсу РЙТ становила 86,4%. При цьому у хворих тільки з ЗТЩЗ повну абляцію після одноразового введення радіойоду залежно від строків лікування після операції визначали у 88,6; 96,1 і 87,7% випадків відповідно. Достовірної різниці між показниками ефективності 1-го курсу РЙТ у 3 групах не було. Одержані дані можна порівняти з даними, які наведено в роботі [7], де саме в такі періоди позитивні результати становили 45,0; 71,8 і 74,3%. На відміну від наших досліджень, автори не наводять показники ефективності РЙТ у хворих з більш розповсюдженими формами захворювань.
Згідно з нашими даними, девіталізація ЗТЩЗ і реґіонарних метастазів була досягнута в 3 групах після 1-го курсу відповідно в 76,0; 81,6 і 72,7% випадків. Хворих, які одержали 3 і більше курсів РЙТ як з приводу абляції ЗТЩЗ, так і лікування реґіонарних метастазів, у 1-й групі не було, в 2-й вони становили 1,0%, в 3-й — 3,4%. Хворі з метастазами в легені у групах 1-3 становили 2,1; 1,0 та 3,4%, середня кількість курсів РЙТ — 2,5; 6 та 6,3; середня активність на одного хворого — 11,0; 22,3 та 33,8 ГБк відповідно.
Таким чином, навіть при невеликій кількості хворих з віддаленими і реґіонарними метастазами, відзначається тенденція до збільшення кількості курсів і сумарної активності у пацієнтів 2-ї та 3-ї групи, що, можливо, зумовлено збільшенням маси пухлинної тканини при пролонгації періоду між тиреоїдектомією та РЙТ.
Незважаючи на досить високі показники ефективності 1-го курсу РЙТ незалежно від часу, що минув після операції, ми не рекомендуємо відстрочення застосування лікувальної активності радіойоду, оскільки будь-яке збільшення інтервалу між хірургічним лікуванням і РЙТ може призвести до підвищення вірогідності реґіонарного і віддаленого метастазування, збільшення маси прихованих метастазів. Після проведення діагностичної сцинтиграфії необхідно в кожному конкретному випадку вирішувати питання про термін проведення РЙТ з урахуванням факторів ризику.
Хворим віком старше 40 років з агресивними гістологічними варіантами раку (фолікулярний, слабо чи низько диференційований, інсулярний, папілярний з хвостиковими, оксифільними і циліндричними клітинами), мультифокальним ростом, інвазією в лімфатичні і кровоносні судини, екстратиреоїдні тканини, з реґіонарним і віддаленим метастазуванням показана невідкладна РЙТ.
Враховуючи зарубіжний і власний досвід проведення РЙТ та післяопераційного моніторингу, ми не рекомендуємо термінової абляції ЗТЩЗ у хворих з пухлинами <1-1,5 см при слабкому накопиченні радіойоду [1, 3]. З метою пригнічення росту тиреоїдної тканини цим хворим слід проводити супресивну ГТ Ь-тироксином в дозах, що дозволяють забезпечити зниження рівня тиреотропного гормону до 0,1 МОД/л [4].
Висновки
Використані клініко-радіонуклідні показники при обстеженні хворих на ДРЩЗ були спрямовані на посилення діагностичних можливостей радіонуклідних методів, оцінки ефективності РЙТ, визначення факторів, які впливають на результати лікування, кінетику радіойоду в процесі призначення різної активності 131І.
При проведенні РЙТ хворих з ДРЩЗ нарівні з ефектом тиреоїдного станінгу від діагностичної активності може проявитися й ефект тиреоїдного селфстанінгу зміна кінетики лікувальної активності 11І під дією кумулятивних ОПД за перші кілька діб проведення РЙТ.
Вивчення параметрів розподілу І в ЗТЩЗ під час РЙТ проводили на підставі даних діагностичних досліджень. Встановлено, що накопичення радіойоду в ЗТЩЗ щодо його вмісту в крові зменшується зі збільшенням перерви між РЙТ та діагностичним дослідженням.
Незважаючи на досить високі показники ефективності 1-го курсу РЙТ у хворих (88,6-76,0 %), незалежно від часу, який минув після операції або після діагностичної сцинтиграфії, питання про терміновість проведення РЙТ необхідно вирішувати в кожному конкретному випадку з урахуванням факторів ризику.
В найближчий період РЙТ необхідно призначати пацієнтам з Т3-4Ы1-2М1 рецидивами захворювання, багатофокусним та інвазивним ростом пухлини, що супроводжується високим ОПД після діагностичної активності.
Література
1. Солодянникова О.І., Сукач Г.Г., Войт Н.Ю. та ін. (2010) Європейський консенсус щодо ведення хворих із диференційованою карциномою щитоподібної залози. Онкологія, Т. 12, 2(44): 199-205.
3. Джужа Д.А., Синюта Б.Ф. (2002) Влияние эффекта тиреоидного «оглушения» на показатели кинетики 131-йода при радиойодтерапии дифференцированных форм рака щитовидной железы. Променева діагностика, променева терапія: Зб. наукових робіт Асоциації радіологів України, Вип. 11: 16-23.
12. Синюта Б.Ф., Чеботарьова Е.Д., Шишкіна В.В. та ін. (2002) Шляхи підвищення ефективності радіойодотерапії диференційованого раку щитоподібної залози // Зб. наукових праць співр. КМАПО ім. П.Л. Шупика, Вип. 11, кн. 2: 355-362.
24. Шишкина В.В., Чеботарева Э.Д., Джужа Д.А. и др. (2002) Эффективность радиойодтерапии больных дифференцированным раком щитовидной железы в разные сроки после выполнения тиреоидэктомии.Клінічна хірургія, 9: 47-50.
38. Брежнєв М.В., Баранов І.В., Солодянникова О.І. (2010) Досвід комплексного лікування диференційованого раку щитоподібної залози із застосуванням нових технологій. Український радіологічний журнал, 3: 276-278.
47. Medvedec M., Grosev D., Lincaris Z. et al. (2001) Thyroid “stunning”: full-quantitative explanation based on radiation absorbed dose analysis. Eur. J. Nucl. Med., 28(8): 1042.
51. Hadjieva T. (1985) Quantitative approach to radioiodine ablation pf thyroid remmants following surgery for thyroid cancer. Radiobiol. Radiother., Bd. 26, 6: 819-823.
53. Hadjieva D.T. (2000) Quantitative evidence of thyroid stunning in 131I cancer treatment. Nucl. Med. Review, 3(1): 47-51.
56. Bolster A.A., Dempsery M.F., Hilditch T.A. et al. (2001) Self-stunning in thyroid ablation-evidence from a comporative study of I and I as diagnostic agents. Eur. J. Nucl. Med., 28(8): 1005.
67. Muratet J.P., Daver A., Minier J.F. et al. (1998) Influence of scanning doses of iodine-131 on subsequent first ablative treatment outcome in patients operatedon for differntiated thyroid carcinoma. J. Nucl. Med., 39(9): 1546-1550.
75. Tautz M. (1976) Dosisberechnung bei der strahlentherapie der Schilddruse nash den MIBI Empfehlungen. Radiobiol. Radiother., Bd. 17(1): 7175.
81. Kozak O.V., Chebotareva E.D., Shishkina V.V. et al. (2002) Probability function of thyroid remnants ablation after first course of radioiodine treatment of thyroid cancer patients. Eur. J. Nucl. Med., 29(Suppl. 1): 667.



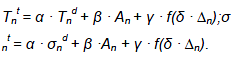






Комментировать